Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.49 no.4 Ciudad de la Habana oct.-dic. 2015
PRODUCTOS NATURALES
Caracterização química e avaliação da atividade antioxidante, antifúngica e moduladora do extrato etanólico de Anadenanthera macrocarpa (BERTH) BRENAN
Chemical characterization and antioxidant, antifungal and modulating activity of the alcohol extract from Anadenantera macrocarpa (Berth) Brenan
Caracterización química y actividad antioxidante, antifúngica y moduladora del extracto alcohólico de Anadenantera macrocarpa (Berth) Brenan
Vivianne Inácio Leite,I Cícera Datiane de Morais Oliveira,II Jakson Gomes Figueredo,III Pablo Antônio Maia de Farias,III Saulo Relison,II Edinardo Fagner Ferreira Matias,I Pedro Everson Alexandre de Aquino, I Henrique Douglas Melo Coutinho,II João Victor de Alencar Ferreira,II Luciene Ferreira de Lima,II Fernando Gomes FigueredoI,III
I Faculdade Leão Sampaio-FLS, CE, Brasil.
II Universidade Regional do Cariri- URCA, CE, Brasil.
III Faculdade de Medicina Estácio Juazeiro do Norte- FMJ, CE, Brasil.
RESUMO
Introdução: o estudo com plantas medicinais tem sido usado para assistência médica e farmacêutica, mais principalmente utilizadas como forma alternativa ou complementar ao tratamento terapêutico.
Objetivo: este trabalho teve como objetivo elucidar os principais metabólitos secundários e atividade antioxidante, bem como avaliar a atividade antifúngica e moduladora do extrato etanólico de folhas de Anadenanthera macrocarpa frente às linhagens do gênero Candida.
Métodos: na elucidação dos constituintes químicos foi utilizado o método de Cromatografia Líquida de Alta Eficiência, sendo que a verificação da atividade antioxidante foi realizada por método de FRAP. A atividade antifúngica do extrato foi mensurada através da determinação da Concentração Inibitória Mínima, sendo a modulação realizada por ensaio de microdiluição, realizado para verificar as interações entre o produto natural e o antifúngico utilizando a amostra em uma concentração subinibitória.
Resultados: demonstrou-se pela análise do Cromatografia Líquida de Alta Eficiência a presença de metabólitos secundários, como a: quercitrina, quercetina, isoquercitrina, apigenina, ácido gálico e ácido caféico. No ensaio FRAP, a redução ocorreu em uma equivalência de 2,72 mg de FeSO4 por g de extrato. Na avaliação da concentração inibitória mínima foram obtidos resultados ≥512 µg/mL e na avaliação dos ensaios para efeito modulador, o extrato etanólico não potencializou o efeito do antifúngico, não havendo nem sinergismo nem antagonismo.
Conclusão: através dos resultados podemos concluir que o presente extrato pode ser uma alternativa terapêutica uma vez que possui constituintes químicos com reconhecidas atividades biológicas e antioxidantes com baixo potencial tóxico.
Palavras-chave: fungos, Anadenanthera macrocarpa, antioxidantes.
ABSTRACT
Introduction: the study of medicinal plants has been used for medical and pharmaceutical services, but mainly used as an alternative or in addition to therapeutic treatment.
Objective: this study aimed to elucidate the main secondary metabolites and antioxidant activity and to evaluate the antifungal and modulating activity of the ethanol extract from Anadenanthera macrocarpa leaves against genus Candida strains.
Methods: the chemical component clearance was made by using high-performance liquid chromatography, and checking of the antioxidant activity was performed by FRAP method. The antifungal activity of the extract was measured by determining the minimum inhibitory concentration, the modulation performed by microdilution test, carried out to verify the interactions between the natural product and the antifungal product using the sample at a subinhibitory concentration.
Results: high-performance liquid chromatography showed the presence of secondary metabolites, such as: quercitrin, quercetin, isoquercitrin, apigenin, caffeic acid and gallic acid. In the FRAP assay, the reduction was 2,72 mg per equivalence grams of FeSO4 extract. The results of the assessment of minimum inhibitory concentration were ?512 µg/mL and in the evaluation of tests for modulating effect, the extract ethanol did not potentiate the antifungal effect, with neither synergism nor antagonism.
Conclusions: from the results we can conclude that this extract can be an alternative since it has chemical constituents with known biological activities and antioxidants with low toxic potential.
Keywords: fungi, Anadenanthera macrocarpa, antioxidant
RESUMEN
Introducción: el estudio de las plantas medicinales se han utilizado para la asistencia médica y farmacéutica, la mayoría utiliza principalmente como una alternativa o complemento al tratamiento terapéutico.
Objetivo: el objetivo del estudio para dilucidar los principales metabolitos secundarios y la actividad antioxidante, así como evaluar la actividad antifúngica modulando el extracto de etanol de Anadenanthera macrocarpa frente las cepas del género Candida.
Métodos: el esclarecimiento de los componentes químicos se utilizó cromatografía líquida de alta eficiencia y la comprobación de la actividad antioxidante se realizó por el método FRAP. La actividad antifúngica del extracto se midió mediante la determinación de la concentración mínima inhibitoria, y la modulación realizó por la prueba de microdilución, llevado a cabo para comprobar las interacciones entre el producto natural y el antifúngico utilizando la muestra a una concentración subinibitória.
Resultados: se demostró mediante análisis por cromatografía líquida de alta eficiencia, de la presencia de metabolitos secundarios, tales como: quercitrina, quercetina, isoquercitrina, apigenina, ácido gálico y ácido cafeico. El ensayo FRAP, la reducción fue de 2,72 mg por equivalencia g de FeSO4 extrato. Na evaluación de la concentración inhibitoria mínima se obtuvieron resultados ≥512 µg/mL y la evaluación de las pruebas para el efecto de modulación, el extracto etanol no potenció el efecto de antifúngico, ni con sinergismo o antagonismo.
Conclusión: de los resultados se puede concluir que el extracto puede ser una terapia alternativa, ya que tiene componentes químicos con actividades biológicas reconocidas y antioxidantes con bajo potencial tóxico.
Palabras clave: hongos, Anadenanthera macrocarpa, antioxidantes.
INTRODUÇÃO
A origem do conhecimento do homem sobre as propriedades medicinais das plantas confunde-se com sua própria história. Há milênios os vegetais têm sido utilizados pelos seres humanos no tratamento de doenças,1 e continuam tendo o seu valor não apenas nas comunidades tradicionais como também são objetos de estudos interdisciplinares na busca de novos fármacos.2
Muitas plantas medicinais apresentam atividade biológica devidoos constituintes presentes em sua composição. A realização de estudos sobre a composição química com espécies vegetais de interesse popular, identificando grupos de metabólitos secundários relevantes, contribuem na elucidação de mecanismos de diversos estudos que visam comprovar essas atividades.3,4 Além disso, esses compostos estão relacionados com a ação antioxidante de diversos fitoterápicos, ação esta que pode contribuir de forma significativa na potencialização de seus efeitos biológicos.5
Diversas espécies de plantas apresentam atividade antifúngica um exemplo é o extrato da malva, da aroeira-do-sertão e da goiabeira.6 A pesquisa pela atividade antifúngica tem por função a determinação do espectro antifúngico de um novo fármaco ou também na investigação da resistência ou sensibilidade de um fungo a um ou vários fármacos.7
O gênero Candida apresenta-se como principal responsável por infecções que ocorrem em ambiente hospitalar, principalmente em setores críticos, como as unidades de terapia intensiva passando a ter importância como agentes potencialmente patogênicos responsáveis por altos índices de mortalidade.8 Essas infecções têm conduzido a procura contínua por novos fármacos com efeito biocida em potencial e que não ofereçam efeitos colaterais. O que torna um grande desafio já que os fungos possuem semelhanças com nossas células.9
Dentre as várias espécies pertencentes a subfamília Mimosoideae destaca-se a Anadenanthera macrocarpa, popularmente conhecida como angico, sendo muito usada na medicina popular no combate de diversas doenças desde infecções a processos inflamatórios.10 Dentre as atividades biológicas comprovadas estão a antimicrobiana,11 propriedades antinociceptiva, anti-inflamatória e ainda atividade antioxidante.12
Portanto, esse estudo teve como objetivo identificar os constituintes químicos e analisar o potencial redutor de ferro do extrato etanólico deA. macrocarpa, bem como avaliar atividade antifúngica e moduladora deste produto natural frente a espécies de fungos do gênero Candida. Essas pesquisas podem estimular o desenvolvimento de novas drogas com qualidade e segurança para contribuição importante no campo da saúde em nível mundial, que sejam substâncias menos tóxicas aos seres humanos.13
MÉTODOS
SELEÇÃO, COLETA DO MATERIAL BOTÂNICO E LOCAL DE REALIZAÇÃO DA PESQUISA
Folhas de Anadenanthera macrocarpa foram coletadas em uma área de Caatinga, no sitio Canafisula no município de Penaforte, Ceará, Brasil, localizado nas coordenadas: x – 492 184,12 e y – 35505,56. O material vegetal foi submetido a identificação e uma exsicata do espécime foi depositada no Herbário Caririense Dárdano de Andrade e Lima, sob o número 6490, no município de Crato-CE.
OBTENÇÃO DO EXTRATO ETANÓLICO
A obtenção do extrato etanólico e frações foi realizada no Laboratório de Pesquisa em Produtos Naturais (LPPN) da Universidade Regional do Cariri (URCA). Para preparação do extrato etanólico, foram utilizadas folhas frescas de Anadenanthera macrocarpa as quais tiveram a superfície de contato aumentada, onde em um recipiente permaneceu submerso em etanol puro por 72 h, sendo após esse período, filtrado e concentrado em hidrodestilador rotativo a vácuo.14
QUANTIFICAÇÃO DE COMPOSTOS POR HPLC
Análises cromatográficas de fase reversa foram realizadas sob condições de gradiente usando coluna C18 (4,6 x 150 mm) embalaro de 5 µm; a fase móvel foi a água que contém 1 % de ácido fórmico (A) e acetonitrila (B), eda com partículas de diâmet o gradiente de composição foi:13 % de B until 10 min e mudou-se para obter 20 %, 30 %, 50 %, 60 %, 70 %, 20 % e 10 % B no min 20, 30, 40, 50, 60, 70 e 80, respectivamente, seguindo o método descrito por Silva et al15 com pequenas modificações.
O extrato etanólico de angico e fase móvel foram filtradas através do filtro de membrana de 0,45 µm (Millipore) e então desgaseificados por usar antes do banho ultra-sônico, o extrato foi analisado em uma concentração de 20 mg/mL. A taxa de fluxo foi 0,7 mL/min, injeção volume 50 µL e o comprimento de onda foram 270 para ácido gálico; 280 nm para catequina; 327 nm para clorogênico e os ácidos cafeico; e 365 nm para quercitrina, isoquercitrina, quercetina, luteolina, apigenina e rutina. Todas as amostras e fase móvel foram filtradas através do filtro de membrana de 0,45 µm (Millipore) e então desgaseificados por banho ultra-sônico antes de utilizar.
As soluções de referências de padrões foram preparadas em fase móvel para HPLC em um intervalo de concentração de 0,030-0,250 mg/mL para a catequina, quercitrina, quercetina, isoquercitrina, luteolina, apigenina e rutina; e 0.020–0,300 mg/mL para o gaulês, caféico e ácidos clorogênicos. Picos de cromatografia foram confirmados, comparando o seu tempo de retenção dos padrões de referência e por espectros de pai (200 a 500 nm). Curva de calibração para catequina: Y=13 057 x +1261,9 (r=0,9997); o ácido clorogénico: Y=11 952 x +1 283,9 (r=0,9999); ácido caféico: Y=11 856 x + 1197,6 (r=0,9998); ácido gálico: Y=12 518 x +1163,7 (r=0,9999); rutina: Y=13 260 x +12459 (r=0,9996); isoquercitrina: Y=11 754 x+1 296,4 (r=0,9995); quercitrina: Y=12 309 x +
1 348,9 (r=0,9993); luteolina: Y=12 725 x+1187,5 (r=0,9998); apigenina: Y=11 856 x +1 189,3 (r=0,9998) e quercetina: Y=13 084 x+132,1 (r=0,9999). Todas as operações de cromatografia foram realizadas à temperatura ambiente e em triplicata.
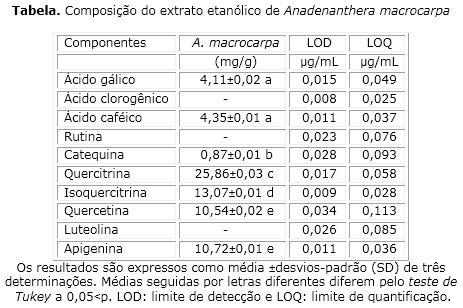
O limite de detecção (LOD) e limite de quantificação (LOQ) foram calculados com base no desvio-padrão de respostas e na inclinação usando três curvas analíticas independentes. LOD e LOQ foram calculados como 3,3 e 10 σ/S, respectivamente, onde σ é o desvio-padrão da resposta e S é o declive da curva de calibração.16
ENSAIO FRAP
Para realização do ensaio de ferric reducing ability of plasma (FRAP), utilizou-se o método de Benzie e Strain.17 As soluções estoque incluem um tampão acetato 300 mM de pH 3,6, TPTZ (2,4,6 –tripyridyls- Triazina) 10 mM em 40 mM HCl e FeCl3.6H2O 20 Mm na proporção de 10:01:01 no momento da utilização. As amostras (0,15 mL) foram misturadas para reagir com 2,85 mL de solução de FRAP durante 30 minutos no escuro em temperatura ambiente, após isso, as amostras foram mensuradas em espectrofotômetro com comprimento de onda 593 nm. Os resultados foram expressos em mg equivalentes de FeSO4/g de amostras, interpolando este valor na curva de calibração construída com os padrões de FeSO4, em diferentes concentrações (125 a 1 000 µg/mL).
PREPARO DA SOLUÇÃO INICIAL E DE TESTE
O preparo da solução inicial das amostras foi efetuado pesando-se 10 mg do extrato e diluindo-o em 1 mL de dimetilsulfóxido ( DMSO‒Merck, Darmstadt, Alemanha), para obter uma concentração inicial. A partir desta concentração, foi feito uma diluição em água destilada estéril para atingir a concentração de 1 024 µg/mL (solução teste).
LINHAGENS UTILIZADAS
As linhagens ensaiadas nos testes de sensibilidade ao produto natural foram leveduras (isolados clínicos) de Candida albicans 62, Candida krusei 01 e Candida tropicalis18 (CA LM 62, CK LMBM 01, e CT LM 18) obtidas do Laboratório de Micologia (LM) da Universidade Federal da Paraíba‒UFPB e do Laboratório de Microbiologia e Biologia Molecular (LMBM) da Universidade Regional do Cariri-URCA.
DROGAS E REAGENTES
Etanol absoluto (álcool etilico; PA; MMERCK) foi utilizado como solvente para obtenção do extrato e o dimetilsulfóxido (Synth; P.A.-A.C.S.-DMSO) foi usado na primeira diluição do extrato. Fluconazol (150 mg c/ 2 Cápsulas-Medley–Genérico) foi a droga de referência no teste de modulação dos fármacos comerciais.MEIOS DE CULTURA
As leveduras foram inicialmente cultivadas em meio sólido Agar Sabouraud Dextrose (ASD) e depois transferidas para tubos de ensaio contendo 5 mL de solução salina estéril. A concentração dos inóculos foi padronizada, comparando-se a turbidez dos tubos com o padrão 0,5 da escala de nefelométrica de McFarland. Esse procedimento forneceu uma suspensãopadrão de levedura contendo 1 x 105 células por mL.18 Nos testes de microdiluição o meio utilizado foi o Caldo Sabouraud Dextrose (CSD).
TESTE DE CONCENTRAÇÃO INIBITÓRIA MÍNIMA (CIM)
Foram preparados tubos eppendorf ® para distribuição na placa de microdiluição, contendo cada um deles com 1,5 mL de solução contendo 1 350 µL de CSD e 150 µL da suspensão fúngica. A placa foi preenchida adicionando-se 100 µL desta solução em cada poço (placa de 96 poços) e em seguida procedendo-se a microdiluição seriada com uma solução de 100 µL do produto natural (extrato), variando nas concentrações de 512 a 8 µg/mL, ficando o último poço para controle de crescimento. As placas foram levadas à incubadora por 24 horas a 37 ºC.18 A revelação da CIM foi feita observando-se a turbidez dos poços. A CIM foi definida como a menor concentração na qual nenhum crescimento foi observado.
TESTE DE MODULAÇÃO DA AÇÃO DE ANTIFÚNGICOS
Para verificar se o extrato exerce efeito modulador da ação dos antifúngicos frente às leveduras testadas, utilizou-se o método proposto por Coutinho et al,19 onde a solução do extrato foi testada em concentração sub-inibitória (CIM/8). Foram preparados tubos eppendorf® contendo cada um deles 1,5 mL de solução contendo meio de cultura CSD, 150 µL da suspensão fúngica e o produto natural na concentração CIM/8. Para o controle foram preparados tubos eppendorf® com 1,5 mL de solução contendo 1 350 µL de CSD e 150 µL de suspensão dos micro-organismos. A placa foi preenchida adicionando-se 100 μL desta solução em cada poço. Em seguida, 100 µL de droga (antifúngico) foram misturados ao primeiro poço, procedendo-se a microdiluição em série, até a penúltima cavidade. As concentrações de antifúngicos variavam a partir de 1 024 a 1 µg/mL.
ANÁLISE ESTATÍSTICA
Todas as determinações foram realizadas em triplicata e os resultados de testes normalizados através do cálculo das médias geométricas, erro padrão da média geométrica e desvio padrão geométricos. Os resultados foram comparados através de análise de variância (ANOVA) e a comparação entre as médias geométricas foi realizada de acordo com teste de Bonferroni sendo considerado significativo quando p<0,05.20.
RESULTADOS
Através da análise do HPLC de frações do extrato etanólico do angico o qual revelou a presença de ácido gálico (tempo de retenção - tR=11,85 min; 1 de pico), catequina (tR =15,07 min; 2 de pico), ácido clorogênico (tR=min 21,98; 3 de pico), ácido caféico (tR= 25,03 min; 4 de pico), rutina (tR=min 37,69; 5 de pico), quercitrina (tR=41,27 min; 6 de pico), isoquercitrina (tR=44,81 min; 7 de pico), quercetina (tR=min 48,19; 8 de pico), luteolina (tR=51,46 min; 9 de pico) e apigenina (tR=59,92 min; 10 de pico). Evidenciando assim que o componente majoritário foi a quercitrina (figura 1).
A análise cromatográfica revelada pelo HPLC-DAD mostrou que a composição do extrato etanólico de Anadenanthera macrocarpa apresenta os seguintes flavonóides: quercitrina, isoquercitrina, quercetina e apigenina. E também compostos fenólicos: ácido gálico e ácido caféico. Sendo os flavonóides os compostos detectados em maior quantificação (tabela).
A capacidade do extrato em reduzir o Fe3+ em Fe2+,foi de uma equivalência 2,72 mg de FeSO4 por g de extrato.
O extrato etanólico de Anadenanthera macrocarpa foi testado frente a três linhagens do gênero cândida: Candida albicans (CA LM 62), Candida krusei(CK LMBM 01) e Candida tropicalis (CT LM 18) demonstrando que não houve atividade clinicamente relevante para tais leveduras, com CIM de≥512 µg/mL. Na avaliação dos ensaios para efeito modulador da atividade antifúngica, foi verificado que a CIM do Fluconazol na presença do extrato etanólico de Anadenanthera macrocarpa não ocorreu nem sinergismo nem antagonismo. Sendo assim, não houve interferência do produto natural sobre a ação do fármaco (figura 2).
DISCURSÃO
Dados da literatura mostram que o componente majoritário, a quercitrina apresenta atividade antimicrobiana,21 antioxidante,22 atividade hipotensiva,23 sedativa em ratos,24 antiinflamatória,25 atividade esta que Comalada et al,26 afirma ser devido a clivagem do glicosídeo e liberação de sua genina, a quercetina. A quercitrina, ainda apresenta atividade antiviral contra a herpes27 mostrando uma grande atividade analgésica frente ao teste de ácido acético, sendo esta ação dose-dependente.28
O composto quercetina apresenta substâncias sugeridas como antioxidante, por apresentarem propriedade seqüestradora de radicais livres.29 No estudo realizado por Veras et al,30 a quercetina, não demonstrou atividade antifúngica quando testada contra as linhagens padrão de C. albicans ATCC 40227 e C. krusei ATCC 6538.
Ao passo que a isoquercitrina como a maioria dos flavonóides, também demonstrou atividade antioxidante.31 Evidenciando também atividade antidiabética,32 atividade contra o protozoário Entamoeba hystolitica33 e ainda foi retratado sua atividade antinociceptiva frente aos testes de ácido acético e formalina.34,35
A apigenina possui características anti-inflamatória, anticarcinogênica, antiviral, e antimutagênica.36-39 Enquanto os ácidos fenólicos caféico e clorogênico também apresentam potencial antioxidante conhecido.40 Essa atividade ocorre em sistemas lipídicos e na inibição da peroxidação celular.41 E ainda, o ácido gálico mostra uma propriedade de indução de morte celular (apoptose) em células cancerosas com grande seletividade.42,43
Segundo o estudo realizado por Figueredoet al,44 foi avaliado a prospecção fitoquímica do extrato etanólico de Anadenanthera macrocarpa indicando a presença de compostos potencialmente bioativos, sendo estes: taninos pirogálicos, antocianinas, antocianidinas, flavonas, flavonóis, xantonas, chalconas, auronas, flavononóis, catequinas, e flavononas. Muitos destes metabólitos secundários são responsáveis por atividades antimicrobianas. Os flavonóides por exemplo impedem o crescimento ou matam muitas cepas bacterianas, inibem enzimas específicas, seqüestram radicais livres, estimulam alguns hormônios e neurotransmissores.45
Ainda considerando as propriedades biológicas também pode ser atribuído atividades antiinflamatória, antioxidante, antiviral, antialergênica, antihepatotóxica, antiulcerosa, antineoplásica, antihipertensiva, antienvelhecimento, antidiabética, inibição da agregação plaquetária e anticelulítica.46-51 Devido a suas atividades já comprovadas, o uso de flavonoides na clínica é estimulado para o tratamento de diversas doenças.45
Os radicais livres são responsáveis por muitos danos oxidativos irreversíveis que podem levar ao desenvolvimento de várias doenças com características degenerativas, por exemplo, a aterosclerose, Doença de Parkinson, Mal de Alzheimer, distúrbios cardiovasculares, câncer e diabetes.52
A superprodução de espécies reativas ou um declínio das defesas antioxidantes naturais podem produzir o stress oxidativo celular, caracterizando o que ocorre nas doenças inflamatórias crônicas, tais como artrite e aterosclerose, além de desencadear diversas doenças associadas com o envelhecimento.53,54
Dessa forma, muitos são os estudos que investem na descoberta de novas substâncias que apresentem atividades antioxidantes, protegendo o organismo dos radicais livres retardando e prevenindo o desenvolvimento dessas doenças.55
Estudos têm demonstrado que polifenóis naturais como os identificados no presente estudo, apresentam ação na redução do câncer, além de que o consumo de alimentos fonte de substâncias fenólicas demonstrou redução do desenvolvimento de doenças cardiovasculares.56
O teste antioxidante pelo método FRAP, um composto é considerado um antioxidante quando apresenta potencial capacidade de reduzir o Fe 3+ em Fe2+.57,58 Neste ensaio, o extrato apresentou capacidade de redução de ferro. Este dado pode estar relacionado a sua constituição predominante de flavonoides,um polifenol que apresentam uma capacidade antioxidante comprovada sendo seu produto relativamente estável, devido à ressonância do anel aromático em sua estrutura.59,60 Logo, a atividade antioxidante de um composto pode estarrelacionada à sua quantidade de compostos fenólicos totais. Quanto maior a quantidade decompostos fenólicos, maior a atividade antioxidante.61
Neste contexto, estudos realizados por Silva,12 evidencio u-se queos extratos etanólicosda casca, galho e folhas de Anadenanthera macrocarpa apresenta atividade antioxidante através dastécnicas de autoxidação do sistema β‒caroteno/ácido linoléico e atividade sequestrante do radical DPPH, sendo bons sequestradores de radicais livres.
Além disso, Desmarchelieret al62 evidenciou a atividade antioxidante dos extratos aquoso e metanólico das cascas desta espécie através dos modelos de avaliação dopotencial antioxidante reativo total (TRAP), reatividade antioxidante total (TAR) e inibição da peroxidação lipídica, apresentando resultados positivos para ação antioxidante.
No grande grupo dos compostos fenólicos, os flavonóides e os ácidos fenólicos são osque mais se destacam e, são considerados os antioxidantes fenólicos mais comuns de fontesnaturais.63 Portanto este polifenol pode ser apontado como um dos fatores que influenciam na atividade redutora apresentada no presente estudo.
Osresultados da atividade antifúngica e moduladora corroboram com os resultados de Costa et al,64 ao verificar que o extrato etanólico de Anadenanthera macrocarpanão apresentou resultados positivos para a ação antifúgica contra Candida albicans, Candida tropicalis e C. glabrata.
Entretanto vale destacar alguns estudos que comprovam a ação antifúngica do extrato de Anadenanthera colubrina comprovando a ação do extrato bruto e fração acetato de etila da espécie contra Candida albicans,65 o extrato hidroalcoólico das cascas desta espécie contra Candida albicans, C. krusei, C. gillermond e C. parapsilosis66 e do extrato hidroalcoólico das cascas e frações ciclo-hexanica e acetato de etila contra Cândida albicans.67
O presente estudo mostra que o extrato etanólico de Anadenanthera macrocarpa apresenta atividade antioxidante, possuindo a presença de flavonóides e compostos fenólicos que apresentam as mais diversas atividades biológicas. Embora, não apresentou efeito antifúngico ou modulador da atividade do Fluconazol sobre as linhagens de Candida.
REFERÊNCIAS
1. Novais TS, Costa JFO, David JPL, David JM, Queiroz LP, França F, et al. Atividade antibacteriana em alguns extratos de vegetais do semi-árido brasileiro. Rev Bras Farmacog. 2003;13:5-8.
2. Macedo M, Carvalho JMK, Nogueira FL. Plantas medicinais e ornamentais da área de aproveitamento múltiplo de Manso, Chapada dos Guimarães, Mato Grosso. Cuiabá: Editora da UFMT; 2002. p.188.
3. Simões CMO, Schenkel EP, Gosmann G, Mello JCP de, Mentz LA, Petrovick PR. Farmacognosia: da planta ao medicamento. 5. ed. Porto Alegre/Florianópolis: Editora da UFSC; 2004. 1102p.
4. Albuquerque U, Hanazaki N. As pesquisas etnodirigidas na descoberta de novos fármacos de interesse médico e farmacêutico: fragilidades e perspectivas. Rev Bras Farmacog. 2006;16:678-689.
5. Pereira RJ & Cardoso MC. Metabólitos secundários vegetais e benefícios antioxidantes Vegetable secondary metabolites andantioxidants benefits. J Biotec Biodivers. 2012;3(4):146-152.
6. Alves PM, Queiroz LMG, Pereira JV, Pereira MSV. Atividade antimicrobiana, antiaderente e antifúngica in vitro de plantas medicinais brasileiras sobre microrganismos do biofilme dental e cepas do gênero Candida. Rev Soc Bras Med Trop. 2009;42:222-224.
7. Volpato AMM. Avaliação do potencial antibacteriano de Calendula officinalis (Astearaceae) para seu emprego como fitoterápico. [Dissertação de doutorado]. Paraná: Universidade Estadual de Ponta Grossa; 2005. P.58-67.
8. Kauffman CA. Fungal infections: Proceedings of the American. Thoracic Society.2006;3:35-40.
9. Rossi T, Lozovoy MAB, Silva RV, Fernandes EV, Geraldino TH, Costa IC. Interações entre Candida albicanse hospedeiro. Semina: Ciências Biológicas e da Saúde. 2011;32:15-28.
10. Matos FJA. Introdução a fitoquímica experimental. Fortaleza: UFC Edições; 1997. p. 141.
11. Dantas JP, Benvindo FS, Sousa JH, Almeida JM, Figueiredo MC, Pequeno AS, et al. Avaliação da atividade antimicrobiana in vitro e determinação da concentração inibitória mínima (CIM) de extratos hidroalcoolico de angico sobre cepas de Staphylococcusaureu. RevBras Anal Clin. 2010;42:33-37.
12. Silva OK. Avaliação das atividades antimicrobiana, aderência, antioxidante, antiinflamatória e antinociceptiva de Anadenantheramacrocarpa (Benth) Brenan. [Dissertação Mestrado]. Bahia: Universidade Federal da Bahia; 2011. p.67-74.
13. Barbosa-Filho JM, Nascimento Júnior FA, Tomaz ACA, Athayde-Filho PF, Silva MS, Cunha EVL, et al. Natural products with antileprotic activity. Rev Bras Farmacog. 2007;17:141-8.
14. Brasileiro BG, Pizziolo VR, Raslan DS, Jamal CM, Silveira D. Antimicrobial and cytotoxic activities screening of some Brazilian medicinal plants used in Governador Valadares district, Rev Bras Cienc Farm. 2006;19:195-202.
15. Silva ARH, Moreira LR, Brum ES, Freitas ML, Boligon AA, Athayde ML, et al. Biochemical and hematological effects of acute and sub-acute administration to ethyl acetate fraction from the stem bark Scutia buxifolia Reissek in mice. J Ethnopharmacol. 2014;53:908-916.
16. Boligon AA, Kubiça TF, Mario DN, Brum TF, Piana M, Weiblen R, et al. Antimicrobial and antiviral activity-guided fractionation from Scutiabuxi folia Reissek extracts. Acta Physiol Plant. 2013;35:2229-2239.
17. Benzie IEF & Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of-antioxidant power: the FRAP assay. Anal Biochemistry. 1999;239:0-76.
18. ClinicalandLaboratory Standards Institute-CLSI. Os padrões de desempenho para testes de susceptibilidade antimicrobiana; 22. Suplemento informativo. M100-S22 documento. ClinicalLaboratory Standards Institute, Wayne, PA; 2012.
19. Coutinho HDM, Costa JG, Lima EO, Falcão-Silva VS, Siqueira-Júnior JP. Enhancement of the antibiotic activity against a multiresistant Escherichia coli by Menthaarvensis L. and chlorpromazine.Chemotherapy. 2008;54:328-330.
20. Matias EFF, Alves EF, Santos BS, Souza CES, Ferreira JVA, Lavor AKLS, et al. Biological Activities and Chemical Characterization of Cordiaverbenacea DC. as Tool to Validate the Ethnobiological Usage. J Evid Based Complementary Altern Med. 2013:1-7.
21. Penna C, Marino S, Vivot E, Cruanes MC, Munoz JD, Cruanes J, et al. Antimicrobial activity of Argentine plants used in the treatment of infectious diseases. Isolation of active compounds from Sebastiania brasiliensis. J Ethnopharmacol. 2000;77:37-40.
22. Peng ZF, Strack D, Baumert A, Subramaniam R, Goh KN, Chia TF, et al. Antioxidant flavonoids from leaves of PolygonumhydropiperL. Phytochemistry. 2003;62:219-228.
23. Novoa BE, Céspedes AC, De Garcia LA, Olarte CJE. Quercitrin, a flavonoid with hypotensive activity obtained from Croton glabellus. Rev Colomb Cienc Quim Farm.1985; 4:4-17.
24. Kang TH, Jeong SJ, Kim NY, Higuchi R, Kim YC. Sedative activity of two flavonol glycosides isolated from the flowers of Albizzia julibrissin Durazz. J Ethnopharmacol. 2000;71:321-323.
25. Fermin SMLH, Galvez J, Romero JA, Zarnuelo A. Effect of quercitrin on acute and chronic experimental. J PharmacolExpTher. 1996;278:771-779.
26. Comalada M, Camuesco D, Sierra A, Balleste I, Xaus J, Galvez J, et al. In vivoquercitrin anti-inflammatory effect involves release of quercetin, which inhibits inflammation through down-regulation of the NF-jB pathway. Eur J Immunol. 2005;35:584-592.
27. Musci I, Gyulai Z, Beladi I. Combined effects of flavonoids and acyclovir against herpes viruses in cell cultures. Acta Microbiol Immunol Hung. 1992;39:137-147.
28. Silva MC, Yunes RA, DelleMonache F, Santos ARS, Schmeling LO, Gadotti VM, et al. Phytochemical and pharmacological analysis ofBauhinia microstachya (Raddi) Macbr. (Leguminosae). Z N aturforsch C. 2001;56:939-942.
29. Czinner E, Hagymas IK, Blazovics A, Kery A, Szoke E, Lemberkovics E. The in vitro effect of Helichrysiflos on microsomal lipid peroxidation. J Ethnopharmacol. 2001;77:31-35.
30. Veras HNH, Santos IJM, Santos ACB, Fernandes CN, Matias EFF, Leite GO, et al. Comparative evaluation of antibiotic and antibiotic modifying activity of quercetin and isoquercetin in vitro. Curr Top Nutraceut R. 2011;9:25-29.
31. Vitor RF, Mota-Felipe H, Teixeira G, Borges C, Rodrigues AI, Teixeira AP. Flavonoids of an extract of Pterospartumtridentatum showing endothelial protection against oxidative injury. J Ethnopharmacol. 2004;93:363-370.
32. Kim HY, Moon BH, Lee HJ, Choi DH. Flavonol glycosides from the leaves of Eucommiaulmoides glycation anhibitory activity. J Ethnopharmacol. 2004; 93:227-230.
33. Calzada F, Cedillo-Rivera R, Mata R. Antiprotozoal activity of the constituents of Conyzafilaginoides. J Nat Products. 2001;65(5):671-673.
34. Krogh R, Kroth R, Berti C, Madeira AO, Souza MM, Cechinel-Filho V, et al. Isolation and identification of compounds with antinociceptive action from Ipomoea pes-caprae (L.) R. Br. Pharmazie. 1999;54:464-466.
35. Silva MC. Análise fitoquímica e farmacológica de plantas medicinais selecionadas da flora catarinense: Aleuritesmoluccana, Bauhiniamicrostachya, e Marrubiumvulgare. [Tese de Doutorado]. Santa Catarina: Universidade Federal de Santa Catarina; 2003. p. 128-138.
36. Wan L, Guo C, Yu Q, Li Y, Wang X, Wang X, et al. Quantitative determination of apigenin and its metabolism in rat plasma after intravenous bolus administration by HPLC coupled with tandem mass spectrometry. J Chromatogr B. 2007;855:286-289.
37. Svehlíková V, Bennett RN, Mellon FA, Needs PW, Piacente S, Kroon PA, et al. Isolation, identification and stability of acylatedderivates of apigenin 7-O-glucoside from chamomile (Chamomillarecutita L. Rauschert.). Phytochemistry, 2004;65:2323-2332.
38. Schulz V, Hansel R, Tyler VE. Fitoterapia Racional: Um guia de Fitoterapia para as Ciências da Saúde. 4. ed. Barueri: Editora Manole; 2002. p. 307-311.
39. Zekovic Z, Pekic B, Lepojevic Z, Petrovic L. Chromatography in our investigations of Camomile (Matricariachamomilla L.). J Chromatogr B. 1994;39:9-10.
40. Soares SE. Ácidos fenólicos como antioxidantes. Rev Nutr. 2002;15:71-81.
41. Morais-Braga MFB. Prospecção química do extrato etanólico das folhas de lygodiumvenustumsw (Lygodiaceae) e avaliação das bioatividades antioxidante, antiepimastigota, antipromastigota, citotóxica e antimicrobiana de extrato e frações ( in vitro). [Dissertação de Mestrado]. Ceará: Universidade Regional do Cariri; 2012. p. 165-170.
42. Krogh R, Tunes RA, Andricopulo AD. Structure-activity relationships for the analgesic activity of gallic acid derivates. Il Farmaco. 2001;55(11-12):730-735.
43. Inoue M, Suzuki R, Koide T, Sakaguchi N, Ogihara Y, Yabu Y. Antioxidant, gallic acid, induces apoptosis in HL-60RG cells. BiochemBiophys Res Commun. 1994;204:898-904.
44. Figueredo FG, Ferreira EO, Lucena BFF, Torres CMG, Lucetti DL, Lucetti ECP, et al. Modulation of the Antibiotic Activity by Extracts from Amburanacearensis A. C. Smith and Anadenan theramacrocarpa (Benth.) Brenan. Biomed Res Int. 2013;1:1-5.
45. Havsteen BH. The biochemistry and medical significance of the flavonoids. Pharmacology & Therapeutics. 2002;96:67-202.
46. Walle T. Flavonoids and isoflavones (phytoestrogens): absorption, metabolism and bioactivity.Free Radical Bio Med. 2004;36:829-837.
47. Guardia T, Rotelli AE, Juarez AO, Pelzer LE. Anti-inflammatory properties of plant flavonoids: effects of rutin, quercetin and hesperedin on adjuvant arthritis in rat. Fármaco. 2001;56:683-687.
48. Narayana KR, Reddy MS, Chaluvadi MR, Krishna DR. Bioflavonoids classification, pharmacological, biochemical effects and therapeutic potencial. Indian J Pharmacol. 2001;33:2-16.
49. Harborne JB & Williams CA. Advances in flavonoids research since 1992. Phytochemistry. 2000;55:481-504.
50. Di Carlo G, Mascolo N, Izzo AA, Capasso F. Flavonoids: old and new aspects of a class of natural therapeutic drugs. Life Sci. 1999;65:337-353.
51. Formica LV, Regelson W. Review of the biology of quercetin and related bioflavonoids. Food Chem Toxicol. 1995;33:1061-1080.
52. Uchôa VT, Carvalho AA, Sousa CMM, Chaves MH, Sant’ana AEG. Evaluation of the antioxidizing activity of isolated Ximeniaamericana L. extracts and compounds. In: 1ST Brazilian Conference on Narural Products and XXVII Annual Meeting on Micromolecular Evolution, Systematics and Ecology [RESEM]; São Pedro, SP; 2007.
53. Jomova K, Vondrakova D, Lawson M, Valko M. Metals, oxidative stress and neurodegenerative disorders. Mol Cell Biochem. 2010;345:91-104.
54. Jomova K, Jenisova Z, Feszterova M, Baros S, Liska J, Hudecova D, et al. Arsenic: Toxicity, oxidative stress and human disease. J Appl Toxicol. 2011;31:95-107.
55. Andrade CA, Costa CK, Bora K, Miguel MD, Miguel OG, Kerber VA. Determinação do conteúdo fenólico e avaliação da atividade antioxidante de Acaciapodalyriifolia A. Cunn. ex G. Don, Leguminosae-mimosoideae. Rev Bras Farmacogn. 2007;17:231-235.
56. Ajaikumar KB, Asheef M, Babu BH, Padikkala J. The inhibition of gastric mucosal injury by Punicagranatum L. (pomegranate) methanolic extract. J Ethnopharmacol. 2005;96(1):171-176.
57. Stratil P, Klejdus B, Kuban V. Determination of total content of phenolic compounds and their antioxidant activity in vegetables evaluation of spectrophotometric methods. J Agr Food Chem. 2006;54(3):607-616.
58. Hukkanen AT, Pölönen SS, Kärenlampi SO, Kokko HI. Antioxidant capacity and phenolic content of sweet rowanberries. J AgrFoodChem. 2006;54(1):112-119.
59. Sousa CMM, Silva HR, Vieira-Junior GM, Ayres MCC, Costa CLS, Araújo DS, et al. Fenóis totais e atividade antioxidante de cinco plantas medicinais. Quim Nova. 2007;30(2):351-355.
60. Saxena R, Venkaiah K, Anitha P, Venu L, Raghunath M. Antioxidant activity of commonly consumed plant foods of India: contribution of their phenolic content. Int J Food SciNutri. 2007;58(4):250-260.
61. Singh RP, Chidambara Murthy KN, Jayaprakasha GK. Studies on the Antioxidant Activity of Pomegranate (Punicagranatum) Peel and Seed Extracts Using in vitro Models.J Agr Food Chem. 2002;50:81-86.
62. DesmarchelierC, Lisboa Romão R, Coussio J, Ciccia G. Atividades de eliminação de radicais livres em antioxidantes e extratos de plantas medicinais utilizadas na região de caatinga no Nordeste do Brasil.J Etnofarmacol. 1999;67(1):69-77.
63. Karakaya S. Bioavailability of phenolic compounds. Crit Rev Food Sci Nutr. 2004;44(6):453-464.
64. Costa EMMB, Barbosa AS, Florentino VGB, Silva JDF, Trovão DMBM, Medeiros ACD. In vitro antimicrobial activity of plant extracts of semi-arid region of Paraíba, PB, Brazil. Rev Odonto Cienc. 2013;28(4):101-104.
65. Lima RF, Alves EP, Rosalen PL, Ruiz ALTG, Duarte MCT, Góes VFF, et al. Antimicrobial and Antiproliferative Potential of Anadenantheracolubrina(Vell.) Brenan. J Evid Based Complementary Altern Med.2014;2014:1-7.
66. Carvalho AVOR. Atividade antimicrobiana in vitro de plantas do semiárido paraibano sobre espécies de Streptococcus e Cândida TCC. [Dissertação de Mestrado]. Paraíba: Universidade Estadual da Paraíba; 2012. p. 36-41.
67. Weber-sobrinho CR. Determinação da atividade antimicrobiana e citotóxica de extratos e da casca do caule de anadenanthera colubrina (Vell.) Brenan var. Cebil(Griseb.) Von Reis Alt. (Angico de Caroço). [Dissertação de Mestrado]. Pernambuco: Universidade Federal de Pernambuco; 2010. p. 154-160.
Recibido:30 de marzo de 2015
Aprobado: 2 de junio de 2015