Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.42 n.4 Ciudad de la Habana jul.-ago. 2003

Hospital Oncológico "Conrado Benítez"
Departamento de Anatomía Patológica
Alteraciones inducidas en el fibrosarcoma Sa-37 por la acción citotóxica de la corriente eléctrica directa
Dra. Catalina Suárez Quevedo,1 Lic. Rodolfo Pérez Bruzón,2 Lic. Luis Bergues Cabrales,3 Lic. Héctor Camué Ciria4 y Dr. Demetrio Segura López5
Resumen
La corriente eléctrica directa (CED) ha sido utilizada en el tratamiento de tumores sólidos. Se realizó este estudio para demostrar el efecto antitumoral de ésta en un fibrosarcoma Sa-37 mediante hallazgos tumorales y peritumorales. Se le aplicaron 5 mA durante 30 min a un grupo de tumores, a través de electrodos de platino insertados en ellos. A otro grupo no se les suministró CED. Se observó una respuesta inflamatoria aguda y un retardo en los crecimientos en los tumores tratados con respecto a los no tratados. Se concluyó que la CED tiene una acción retardadora en el crecimiento de los tumores tratados por los altos porcentajes de necrosis inducidos en éstos y la estimulación del sistema inmune.
DeCS: FIBROSARCOMA/terapia; TERAPIA POR ESTIMULACION ELECTRICA; RATONES CONSANGUINEOS C57BL; ANIMALES DE LABORATORIO.
La corriente eléctrica directa de baja intensidad (CED) es una modalidad terapéutica efectiva en el tratamiento de diferentes tumores sólidos que se caracteriza por su bajo costo e invasividad mínima. La efectividad antitumoral de la CED ha sido demostrada en diferentes estudios in vitro e in vivo, mediante el empleo de diferentes esquemas terapéuticos (intensidad y tiempo de exposición de la CED, número de electrodos, tipo de terapia, etc.) y tipos de tumores (experimentales y humanos).1-11
El objetivo de este trabajo es evaluar los efectos de la CED en el tumor experimental fibrosarcoma Sa-37 mediante la medición del volumen del tumor, porcentaje de necrosis y hallazgos tumorales y peritumorales, insertando los electrodos en el tumor.
Métodos
Animales y tumores
En el estudio se utilizaron ratones machos C57BL/6 con edades entre 7 y 8 sem y pesos entre 18 y 22 g, los cuales se mantuvieron en cajas plásticas, dentro de un local, en un rango de temperatura 21 ± 2 °C y humedad relativa del 63 %.
Los tumores sólidos fibrosarcoma Sa-37 fueron iniciados en la región subcutánea y dorsolateral por inoculación de 1 × 105 células viables. La viabilidad celular fue de 95 %. El conteo celular se realizó utilizando un hematocitómetro. Los volúmenes de los tumores se calcularon aplicando la fórmula del volumen de un elipsoide, para lo cual se realizaron mediciones diarias de los 3 diámetros perpendiculares del tumor, con un pie de rey de 0,05 mm de precisión.
Corriente eléctrica directa
La CED fue suministrada a los tumores a través de 4 electrodos de platino de 0,7 mm de diámetro y 20 mm de longitud, los cuales se insertaron dentro del tumor. La terapia comenzó cuando los tumores alcanzaron un volumen de 40,0 mm3 aproximadamente (día cero). Se formaron 2 grupos experimentales: uno control (GC) y uno tratado, denominado GT, de 25 animales cada uno. Al GT se le suministraron 5 mA durante 30 min. Para evaluar el crecimiento de los tumores no tratados y los tratados con CED se utilizaron por cada grupo experimental 10 animales. El estudio de necrosis en ambos grupos se realizó a las 24, 48, 72, 96 y 120 h después de suministrada la CED, en cada estudio se utilizaron 3 animales por grupo. Los animales del GC se mantuvieron bajo las mismas condiciones experimentales que los del GT, pero no se les suministró CED.
Análisis anatomopatológico del tumor
Los cortes histológicos de cada tumor se efectuaron según el diámetro mayor, se fijaron en formol al 10 % y se procesaron por el método de la parafina. La coloración empleada fue la de hematoxilina y eosina. Cada corte se dividió en 4 campos microscópicos para calcular el porcentaje de necrosis mediante lentes panorámicas; este porcentaje se determinó por medio de la relación existente entre el área necrosada y el área total del tumor, multiplicada por 100 %.
Análisis estadístico
Para comparar los volúmenes de los tumores y el porcentaje de necrosis del GT con respecto a los del GC se usó el criterio estadístico no paramétrico de suma de rango de Wilcoxon-Mann-Whitney de una cola. El nivel de significación fue a = 0,05.
Resultados
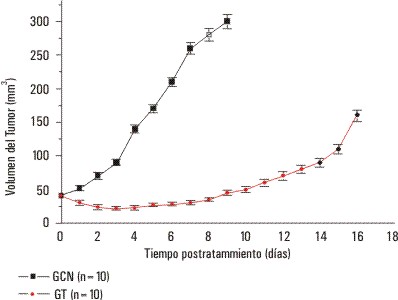
Se observó que después de aplicada la CED, los tumores del GT mostraron una disminución significativa de sus volúmenes con respecto a los del GC (p = 0,002). De las curvas de crecimiento correspondientes a los tumores del GC y GT se obtuvieron los valores medios del tiempo de doblaje del volumen (TD), que resultaron 2,6 y 13,0 d, respectivamente (fig. 1). El TD de los tumores tratados con CED resultó ser 5 veces mayor que el de los no tratados.
FIG. 1. Cinética de crecimiento de los tumores no tratados (GC) y los tratados con CED (GT). Cada punto experimental representa el promedio con su correspondiente error de la media (representado por la barra); n: representa el número de muestras por grupo experimental.
Los estudios de necrosis revelaron que los porcentajes de necrosis de los tumores del GT fueron significativamente mayores (p = 0,002) que los de los tumores del GC (tabla), a las 24, 48, 72, 96 y 120 h después de suministrada la CED. En todos los tumores del GT se observó una respuesta inflamatoria aguda, la cual no fue observada en ninguno de los tumores del GC.
Tabla. Porcentaje de necrosis del tumor fibrosarcoma SA-37, de los grupos control y tratado
| Tiempo postratamiento(h) | Grupo control | Grupo tratado |
| 24 | 23,5 ± 2,48(n = 3) | 80 ± 7,00(n = 3) |
| 48 | 25,5 ± 3,2(n = 3) | 87 ± 6,35(n = 3) |
| 72 | 27,6 ± 4,16(n = 3) | 90 ± 6,14(n = 3) |
| 96 | 29,3 ± 5,3(n = 3) | 93 ± 5,70(n = 3) |
| 120 | 30,7 ± 6,3(n = 3) | 96 ± 4,10(n = 3) |
n representa el número de muestra por grupo experimental
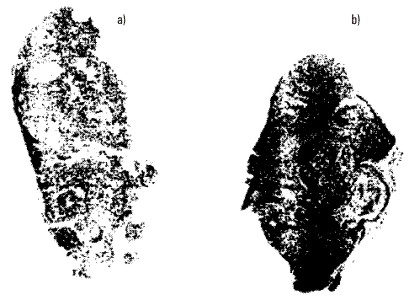
En los tumores del GC se observó que la necrosis era aleatoria por todo el tumor. Esto se pone en evidencia en la figura 2 donde se muestra la necrosis (zona negra) de un tumor no tratado (figura 2a) y la de uno tratado (figura 2b) a las 96 h postratamiento.
FIG. 2. Patrón de necrosis de los tumores del GC (a) y del GT (b) a las 96 h después de aplicada la electroterapia con CED de bajo nivel.
En todos los tumores del GC y GT se observó infiltración peritumoral de linfocitos y células plasmáticas, sin embargo, las diferencias no fueron significativas (p > 0,05). El grado de intensidad de este hallazgo peritumoral, en ambos grupos experimentales, fue moderado (++) a las 24, 48, 72, 96 y 120 h postratamiento. En todos los tumores del GT se observó congestión vascular e infiltración neutrofílica, sin embargo, estos hallazgos peritumorales no se observaron en ninguno de los tumores del GC. Los grados de intensidad de estos hallazgos fueron severos (+++) en las 24, 48, 72 y 96 h después de aplicada la CED, sin embargo, después de las 120 h postratamiento, el grado de intensidad de estos 2 hallazgos peritumorales fue moderado (++). Se encontraron diferencias significativas de estos hallazgos entre los grupos control y tratado (p = 0,02).
Discusión
Los resultados obtenidos en este estudio evidencian que la electroterapia con CED de bajo nivel tiene un marcado efecto inhibidor del crecimiento tumoral, el cual es evidenciado por la disminución significativa del volumen y el aumento significativo del TD de los tumores tratados con CED, con respecto a los tumores no tratados (fig. 1). Este marcado efecto antitumoral de la CED puede deberse a los altos porcentajes de necrosis encontrados en los tumores del GT con respecto a los tumores del GC (tabla). Los altos porcentajes de necrosis inducidos en los tumores del GT demuestran que la acción de la CED es citotóxica. El aumento significativo del TD de los tumores del GT, con respecto al de los tumores del GC, fue explicado por el retardo significativo del crecimiento de los tumores en este grupo.
Los estudios de necrosis revelaron un conjunto de hallazgos en los tumores del GT característicos de la necrosis, como: tumefacción o hinchazón celular, cariolisis nuclear, cariopicnosis, acidofilia citoplasmática y la presencia de una respuesta inflamatoria aguda. Estos hallazgos han sido reportados en otros estudios12 y explican que la necrosis es el proceso fundamental involucrado en la destrucción de los tumores cuando son sometidos a la acción de la CED. Los patrones de necrosis de los otros tumores del GC y GT fueron similares a los mostrados en la figura 2. La presencia de zonas blancas en los tumores tratados con CED pudiera estar relacionada con la parte del tumor que sobrevivió a la acción citotóxica de la CED (figura 2b). La presencia de esta parte viva del tumor explica el recrecimiento observado en los tumores del GT después de la regresión de éstos (figura 1).
Es probable que la apoptosis esté presente tanto en los tumores del GT como en los del GC, sin embargo no tiene el papel predominante en la destrucción de los tumores porque no induce respuesta inflamatoria, lo que hace más fácil su detección histológica, y por lo general aparece en células aisladas o pequeños grupos de células, situación que no fue observada en ninguno de los tumores del GT.
La presencia de linfocitos y de células plasmáticas en el GT y el GC fueron explicadas por la presencia del tumor en el organismo de los animales, el cual provoca una estimulación de los elementos celulares y humorales del sistema inmune. Este hecho puede ser soportado por el grado de intensidad moderado de este hallazgo peritumoral. La congestión vascular e infiltración neutrofílica sólo observados en los tumores del GT y en ninguno de los tumores del GC pudiera deberse a la estimulación de la respuesta inflamatoria aguda por la acción citotóxica de la CED. Esto puede ser sustentado por la marcada presencia del neutrófilo en los primeros momentos de aplicada la CED a los tumores y luego, por la moderada presencia de éstos después de las 96 h postratamiento. Serša y otros10 observaron a los 7 y 14 d después de suministrada la CED, una estimulación de los macrófagos y linfocitos T, respectivamente, pero la presencia de neutrófilos y el nivel de macrófagos era normal. La ausencia de los neutrófilos a los 7 d postratamiento pudiera explicar que el grado de infiltración de éstos disminuye con el tiempo, como se ha observado en este estudio después de las 96 h postratamiento. Estos resultados sugieren que la estimulación del sistema inmune está involucrado desde los primeros momentos de aplicada la CED.
Los resultados obtenidos en este estudio sugieren que el proceso de necrosis es consecuencia de procesos antitumorales involucrados en la destrucción de los tumores cuando son sometidos a la acción de la CED. Estos procesos pudieran ser la acción simultánea de las reacciones electroquímicas, fundamentalmente las que involucran las especies reactivas del oxígeno, y la estimulación de los componentes celulares del sistema inmune, el cual fue propuesto en un trabajo previo.11
Agradecimientos
Los autores quieren agradecer a Yarmila Mojena Melgares, Kenia Caballero Bordelois y Yarindra Mesa Mariño por su asistencia técnica.
Summary
Direct electric current (DEC) has been used in the treatment of the solid tumors. The aim of this study is demonstrate the antitumoral effect of it on a fibrosarcome Sa-37 through tumor and peritumoral findings. 5 mA during 30 minutes to a tumors group was applied through platinum electrodes inserted into it. Another group of tumors it not was applied DEC. It was observed in the treated tumors with respect to the untreated an acute inflammatory response and a growth delay of it. It was concluded that DEC has a delay action in the treated tumors growth due to the necrosis percentage high induced into the tumor and the stimulation of the immune system.
Subject headings: FIBROSARCOMA/therapy; ELECTRIC STIMULATION THERAPY; MICE, INBRED C57BL; ANIMALS, LABORATORY.
Referencias bibliográficas
- Dodd NJF, Moore JV, Taylor TV, Zhoo S. Preliminary evaluation of low level direct current therapy using magnetic resonance imaging and spectroscopy. Phys Med 1993;4:2-8.
- Serša G, Miklavcic D. The feasibility of low-level direct electric current electrotherapy for regional cancer treatment. Reg Cancer Treat 1993;1:31-5.
- Habal MB. Effects of applied DC currents on experimental tumor growth in rats. J Biomed Mater Res 1980;14:789-801.
- Nordeström BEW. Electrochemical treatment of cancer. I: Variable response on cathodic fields. Am J Clin Oncol (CCT) 1989;12:530-6.
- Zhun F, Tan S, Lin J. Effects of direct pulse on tissues of tumors in mice. Conference Proceedings. IEEE Engineering in Medicine and Biology 18th Annual International Conference Amsterdam, 1996.
- Plesnicar A, Serša G, Vodovnik L, Jancar J, Zaletel-Kragelj L, Plesnicar S. Electric treatment of human melanoma skin lesion with low level direct electric current: an assessment of clinical experience following a preliminary study in five patients. Eur J Surg 1994;574:45-9.
- Bergues LC, Hinojosa RH, Pérez RB. Direct electric current effects on the Ehrlich subcutaneous murine tumor. I: Necrosis and volume of tumor studies in advanced stages. Rev Bras Canc 1998;44:203-10.
- Xin YL, Xue FZ, Ge BS, Zhao FR, Shi B, Zhang W. Electrochemical Treatment of Lung Cancer. Bioelectromagnetics 1997;18:8-13.
- Chou CK, McDougall JA, Ahn C, Vora N. Electrochemical treatment of mouse and rat fibrosarcomas with direct current. Bioelectromagnetics 1997;18:18-24.
- Serša G, Kotnik V, Cemazar M, Miklavcic D, Kotnik A. Electrochemotherapy with bleomycin in Sa-1 tumor bearing mice-natural resistance and immune responsive-ness. Anti-cancer Drugs 1996;7:785-91.
- Bergues LC, Camué HC, Pérez RB, Suárez CQ, Hinojosa RA, Monte de Oca LG et al. Electrochemical treatment of mouse Ehrlich tumor with direct electric current. Bioelectromagnetics 2001;22:316-22.
- Mcsween R, Whaley K. Textbook of Pathology. 13 ed. Educational low-Priced Books Scheme (ELBS); 1992.
Recibido: 16 de julio de 2002. Aprobado: 13 de marzo de 2003.
Dr. Luis Bergues Cabrales. Centro Nacional de Electromagnetismo Aplicado (CNEA). Universidad de Oriente CP. 90 400, GP. 4078. Santiago de Cuba, Cuba. bergues@cnea.uo.edu.cu
1 Especialista de I Grado en Anatomía Patológica. Profesora Auxiliar. Hospital Oncológico "Conrado Benítez." Departamento de Anatomía Patológica.
2 Licenciado en Física. Instructor. División de Bioingeniería y Equipos. Centro Nacional de Electromagnetismo Aplicado.
3 Licenciado en Física. Profesor Asistente. Hospital Oncológico "Conrado Benítez". Departamento de Quimioterapia.
4 Licenciado en Biología. Instructor.
5 Especialista de I Grado en Oncología. Instructor.