Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.42 n.6 Ciudad de la Habana nov.-dic. 2003
Hospital Clinicoquirúrgico "Hermanos Ameijeiras"
Anticuerpos anticitoplasma del neutrófilo en la clasificación de las vasculitis sistémicas
Dra. Elena Kokuina,1 Dr. Milton Sánchez Basulto,2 Dra. Ana María Arias Prieto3 y Dra. Ana María Guerreiro Hernández4
Resumen
La detección de los anticuerpos anticitoplasma del neutrófilo (ANCA) constituye el diagnóstico inmunológico de las vasculitis sistémicas. Este trabajo estuvo dirigido a probar la utilidad clínica del método de inmunofluorescencia indirecta (IFI) sobre extensiones de células lavadas de sangre periférica para la detección de ANCA. Se analizaron por IFI, sobre extensiones de células periféricas lavadas, 103 muestras de suero clasificadas como negativas o positivas de ANCA por el método de IFI sobre neutrófilos aislados con dextrán. Se determinó la reactividad de estos autoanticuerpos en pacientes con vasculitis de pequeños vasos asociadas a ANCA (VPVA, n = 19), en vasculitis de pequeños vasos no asociadas a ANCA (VPVnoA, n = 59), en vasculitis secundarias a enfermedades reumáticas (VR, n = 21) y en individuos sanos (IS, n = 131). Se encontró que la sensibilidad y la especificidad de las extensiones de células periféricas lavadas para detectar ANCA fue del 96 % (ambas). Los ANCA se encontraron en el 79 % de los pacientes con VPVA y en el 19 % de los pacientes con VR, mientras que aquellos con VPVnoA y los IS no presentaron ANCA. En conclusión, el método de IFI sobre extensiones de células periféricas lavadas ha demostrado elevada sensibilidad y especificidad para detectar ANCA, lo que permite aplicarlo en la clínica médica para el estudio de las vasculitis sistémicas.
DeCS: ANTICUERPOS CITOPLASMATICOS ANTINEUTROFILO; VASCULITIS/diagnóstico; TECNICA DEL ANTICUERPO FLUORESCENTE INDIRECTA.
La ausencia de una clasificación universalmente aceptada de las vasculitis sistémicas ha sido compensada en la práctica clínica por la consideración según el calibre de los vasos afectados como vasculitis de grandes, medianos y pequeños vasos. Las vasculitis de pequeños vasos (VPV) lesionan fundamentalmente las arteriolas, capilares y vénulas poscapilares y son las más comunes en adultos.1 Recientemente, las VPV se han podido subdividir, sobre la base de sus características inmunológicas, en 3 categorías: las asociadas a la presencia de: 1. anticuerpos anticitoplasma del neutrófilo (ANCA); 2. inmunocomplejos y 3. anticuerpos antimembrana basal glomerular.2 Las vasculitis de pequeños vasos asociadas a los ANCA (VPVA) incluyen la poliangiitis microscópica (PAM), la granulomatosis de Wegener (GW), la glomerulonefritis crescéntica pauci-inmune (GNCPI), y el síndrome de Churg-Strauss (SCS). Los ANCA constituyen marcadores serológicos de gran valor clínico que orientan el diagnóstico diferencial hacia este estrecho grupo de procesos clinicopatológicos vasculares, y la detección oportuna de estos autoanticuerpos permite la rápida instauración de tratamientos inmunosupresivos para prevenir el daño terminal de los órganos.3
Aunque los ANCA fueron demostrados inicialmente en las VPVA, se han encontrado también en pacientes con vasculitis secundarias, entre estas, las enfermedades reumáticas como lupus eritematoso sistémico (LES) y artritis reumatoidea (AR).4
Actualmente está muy extendido el uso de láminas comerciales con neutrófilos humanos aislados para detectar los ANCA, lo que resulta inconveniente en nuestro medio por el elevado precio de las preparaciones comerciales. En este trabajo nos propusimos desarrollar un método de inmunofluorescencia indirecta para la detección precoz de los ANCA, el cual utiliza como sustrato antigénico extensiones de células lavadas de sangre periférica, y está dirigido a aportar un importante criterio diagnóstico para clasificar a los pacientes con vasculitis sistémicas.
Métodos
Población de estudio
Se coleccionaron muestras de suero pertenecientes a 99 pacientes consecutivos de los servicios clínicos del Hospital Clinicoquirúrgico "Hermanos Ameijeiras" que padecían enfermedades vasculares sistémicas diagnosticadas según criterios clínicos, histopatológicos y angiográficos5 como vasculitis sistémicas de pequeños vasos asociadas a ANCA (VPVA), n = 19; VPV no asociadas a ANCA (VPVnoA), n = 59 y vasculitis secundarias a enfermedades autoinmunes reumáticas (VR), n=21). Entre los pacientes con VPVA se halló: poliangiitis microscópica (PAM), n = 6; granulomatosis de Wegener (GW), n = 4; glomerulonefritis crescéntica pauci-inmune (GNCPI), n = 7 y síndrome de Churg-Strauss (SCS), n =2. De ellos, 11 fueron hombres y 8 mujeres, con edad promedio de 44 años (rango: 22 - 60 años). Entre los pacientes con VPVnoA se determinó púrpura de Schöenlein Henoch, n = 8; crioglobulinemia esencial mixta, n = 9; angiitis cutánea leucocitoclástica, n = 13 y otras no clasificadas, n = 29. De ellos, 29 fueron hombres y 30 mujeres, con edad promedio de 34 años (rango: 19 - 51 años). Entre los pacientes con VR fueron clasificadas como secundarias a la artritis reumatoidea (AR), n = 10 y al lupus eritematoso sistémico (LES), n = 11. De ellos, 5 fueron hombres y 16 mujeres, con edad promedio de 37 años (rango: 22 - 55 años).
Se recogieron además 131 muestras de suero de individuos sanos (IS) donantes voluntarios del banco de sangre del Hospital "Hermanos Ameijeiras" sin evidencia clínica ni antecedentes de enfermedades vasculares ni reumáticas. De ellos, 91 fueron hombres y 40 mujeres, con edad promedio de 29 años (rango: 18 - 52 años). Todas las muestras de suero fueron fraccionadas y conservadas a -20 °C hasta la fecha de su análisis.
Método de IFI para detectar ANCA
Se aplicó el método de IFI sobre células lavadas de sangre periférica.6 Una muestra de 2 mL de sangre venosa periférica con EDTA de un individuo donante de sangre se centrifugó a 1 500 xg a temperatura ambiental 6 min. Se eliminó la mayor cantidad posible de plasma y se sustituyó con solución salina tamponada fosfatada (PBS, pH = 7,2-7,4). Se realizaron extensiones de las células lavadas sobre láminas portaobjeto y se fijaron en etanol 100 % a -20 ºC por 5 min. Se marcó un círculo en el área más fina de la extensión para colocar la muestra problema. Las láminas preparadas de esta forma se conservaron a -20 º durante un tiempo máximo de 2 sem.
Los sueros controles negativos y positivos fueron donados por el Laboratorio de Inmunoquímica del Instituto de Hematología e Inmunología (IHI), Ciudad de La Habana.
Las muestras de suero problemas y controles se diluyeron 1:10 en PBS y se incubaron sobre el sustrato a temperatura ambiental durante 15 min en cámara húmeda. Las láminas se lavaron con 5 recambios de PBS, 7 min cada vez, y luego se incubaron durante 15 min con antisuero antiinmunoglobulinas (IgA, IgG, IgM) humanas conjugado con FITC (Sigma, Saint Louis) en la dilución de 1:200 en PBS. Las láminas fueron lavadas nuevamente y examinadas en un microscopio fluorescente con epiiluminación (Diaplan Leitz, Wetzlar).
Los resultados se interpretaron como negativos cuando la intensidad de fluorescencia de los neutrófilos y monocitos de la muestra problema fue igual o menor que la del suero control negativo; o como positivos cuando se observó una fluorescencia citoplasmática o perinuclear selectiva de los neutrófilos y monocitos, a diferencia de los linfocitos.
Para determinar la sensibilidad y especificdad del método desarrollado se compararon los resultados de 103 muestras de suero de pacientes con indicación clínica de ANCA con las del método de IFI del laboratorio de inmunoquímica del IHI. Este método utilizó como sustrato neutrófilos de sangre periférica de individuos sanos, donantes de banco de sangre, aislados por gradiente de dextrán 500 - metriozoato.7
Análisis de los resultados
La sensibilidad y especificidad del método de IFI sobre células de sangre periférica lavada para determinar ANCA se calcularon sobre la base de la comparación de los resultados clasificados como positivos y negativos entre el método desarrollado en nuestro laboratorio y el del laboratorio del Instituto de Hematología e Inmunología y se expresaron en porcentajes, según las fórmulas convencionales.8 La concordancia entre los resultados clasificados como positivos y negativos de los 2 laboratorios se evaluó mediante el cálculo del coeficiente de concordancia Kappa (k), con el estadígrafo del paquete estadístico SPSS-PC versión 10.1. Los valores de k pueden oscilar desde 0 (concordancia nula) hasta 1 (concordancia máxima).
Resultados
La comparación de los resultados de ANCA obtenidos por el método de IFI sobre extensiones de células lavadas de sangre periférica, desarrollado por el laboratorio del Hospital "Hermanos Ameijeiras," con los de la IFI sobre neutrófilos aislados por gradiente de dextrán 500 - metriozoato, del Instituto de Hematología, en 103 muestras de suero de pacientes con indicación clínica de ANCA, demostró que éstos concordaron en el 96 % (99/103, 22 muestras positivas y 77 negativas por ambos métodos) lo que se correspondió con un coeficiente de concordancia Kappa de 0,9 (p< 0,0001) (tabla 1). El método del HHA detectó ANCA en 22 de las 23 muestras clasificadas como positivas de ANCA por el laboratorio de referencia, lo que se correspondió con una sensibilidad de 96 %; y reconoció como negativas a 77 de las 80 muestras clasificadas como negativas de ANCA por el laboratorio de IHI, lo que representó una especificidad de 96 %.
Tabla 1. Distribución de los resultados de ANCA clasificados en negativos y positivos del método de IFI del Laboratorio del Hospital "Hermanos Ameijeiras" respecto a los del Laboratorio del Instituto de Hematología e Inmunología
| Total | + HHA/+IHI | -HHA/-IHI | +HHA/-IHI | -HHA/+IHI | |
| n | 103 | 22 | 77 | 3 | 1 |
| (%) | (100) | (21) | (75) | (3) | (1) |
k=0;9; P>0,001
n: 103 muestras de suero de pacientes con indicación clínica de ANCA.
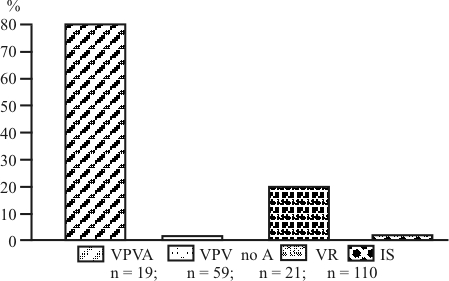
La IFI sobre extensiones de células lavadas de sangre periférica detectó ANCA en 19 de los 99 (19 %) pacientes con enfermedades vasculares, pero en ninguno de los 131 IS estudiados (0/131, 0 %). La distribución de los ANCA respecto al diagnóstico clínico mostró que estos autoanticuerpos se presentaron en 15 de los 19 (79 %) pacientes con VPVA; en ninguno de los 59 (0 %) con VPVnoA; y en 4 de los 21 (19 %) con VR (fig.). Dentro de las VPVA los ANCA se detectaron en 4 de los 6 pacientes con PAM (67 %), en 3 de los 4 con GW (75 %), en 6 de los 7 con GNCPI (86 %) y en los 2 con SCS (100 %) (tabla 2).
Fig. Frecuencia de ANCA en pacientes con vasculitis sistémicas e individuos sanos.
VPVA: Vasculitis de pequeños vasos asociadas a ANCA. VPVnoA: Vasculitis de pequeños vasos no asociadas a ANCA. VR: Vasculitis secundarias a enfermedades reumáticas. IS:Individuos sanos.
Tabla 2. Frecuencia de ANCA en la subclasificación clínica de las vasculitis de pequeños vasos asociadas a ANCA
| PAM | GW | GNCPI | SCS | |
| n = 6 | n = 4 | n = 7 | N = 2 | |
| ANCA+ n | 4 | 3 | 6 | 2 |
| ANCA+ % | 67 | 75 | 86 | 100 |
n = 19.
PAM: Poliangiitis microscópica. GW: Granulomatosis de Wegener. GENCPI: Glomerulonefriris crescéntica pauci-inmune. SCS: Síndrome de Churg-Strauss.
n = 19; n = 59; n = 21; n = 110
Discusión
Las normativas establecidas por el Consenso Internacional sobre los Métodos y Referencias de los ANCA exigen que todas las muestras de suero de pacientes con sospecha diagnóstica de VPV sean analizadas por una técnica de IFI estandarizada.9 El concepto básico que justifica la función primaria de la IFI para detectar ANCA es que el sustrato de este método, que son los neutrófilos intactos, provee todos los epitopos para la reactividad con estos autoanticuerpos.10 La mayor parte de los laboratorios clínicos utilizan para la detección de ANCA la IFI sobre láminas comerciales de neutrófilos, lo que resulta poco económico aún en países desarrollados.11 Nosotros describimos aquí un método para detectar la fluorescencia de los ANCA sobre extensiones de células lavadas de sangre periférica y comparamos nuestros resultados con los del método de IFI sobre neutrófilos aislados.7 La detección de los ANCA por IFI sobre extensiones de células lavadas de sangre periférica fue desarrollada en el año 1985 en el mismo laboratorio en el que se describieron por primera vez los ANCA, como una modificación del método originalmente descrito por Davies.12 En la actualidad, este método es utilizado en los laboratorios clínicos en Australia como prueba de primera línea para la detección precoz o cribado de ANCA.6 La IFI sobre extensiones de células lavadas de sangre periférica para determinar ANCA ha demostrado ser una metodología eficiente y de bajo costo, porque permite el análisis de un número considerable de muestras en corto período. Este método presenta ventajas adicionales en cuanto a la preparación y calidad del sustrato respecto a otras variantes de IFI. En las extensiones de sangre periférica, los neutrófilos aparecen de un tamaño mayor que en las láminas comerciales, lo que los hace fácilmente visibles al microscopio, además, las extensiones contienen también linfocitos, lo que permite demostrar la presencia simultánea de anticuerpos antinucleares, en caso de que la fluorescencia nuclear ilumine tanto los neutrófilos como los linfocitos.10,13 Las extensiones de células periféricas resultan también convenientes pues permiten realizar las determinaciones de ANCA de carácter urgente en muestras individuales, sin incurrir en el gasto adicional que supone la subutilización de láminas comerciales destinadas a probar múltiples muestras.
Los resultados del método de IFI sobre extensiones de células periféricas para detectar ANCA fueron semejantes en el 96 % de las muestras estudiadas a los del método de IFI sobre neutrófilos aislados con dextrán del IHI, lo que se reflejó en el alto coeficiente de concordancia Kappa entre los 2 métodos (k = 0,9; p < 0,0001).
Las extensiones de células periféricas lavadas detectaron ANCA en 22 de las 23 muestras de suero positivas por el método de IFI del IHI, lo que equivale a una sensibilidad de 96 %. Nuestro método identificó como positivas 3 de las 80 muestras negativas por el método de IFI del IHI, lo que corresponde a una especificidad de 96 % (tabla 1).
El mayor número de muestras clasificadas como positivas por el método de las extensiones de células periféricas respecto a las del método del IHI (+/+ = 25/23) puede obedecer a que nuestra preparación de sustrato prescinde del aislamiento de los neutrófilos y por tanto, es más rápida, con lo que se evita al máximo la desgranulación de estas células. La metodología establecida para la detección de ANCA por IFI advierte que el aislamiento y los lavados celulares son los pasos más vulnerables para provocar la activación y desgranulación de los neutrófilos y producir falsos negativos en la técnica.10 Para eliminar las dudas sobre los falsos negativos y positivos de nuestro método de IFI sería conveniente probar las muestras discordantes con una tecnología de mayor sensibilidad para identificar las distintas especificidades de los ANCA, como es el ensayo inmunoenzimático.
El método de IFI sobre extensiones de células periféricas no permitió distinguir los 2 patrones de fluorescencia clásicamente descritos de ANCA como son el citoplasmático (C-ANCA) y el perinuclear (P-ANCA). Hemos atribuido esta limitación a 2 factores técnicos: el primero de ellos es la característica del antisuero conjugado, que estaba dirigido frente a las inmunoglobulinas humanas polivalentes, con una elevada proporción FITC/proteína (F/P = 4,0); mientras que en la metodología estándar se recomienda la utilización de antisueros conjugados específicos para IgG (cadenas Fc?), con una proporción FITC/proteína baja (F/P < 2,3), pues el uso de antisueros poliespecíficos que detectan ANCA de clase IgA e IgM, así como una elevada proporción de fluorocromo/proteína pueden interferir con la discriminación de los patrones de fluorescencia.9,10,14 El otro factor que garantiza la calidad de las imágenes de fluorescencia es el ajuste preciso del microscopio de luz ultravioleta, sobre la base de la combinación adecuada de filtros de interferencia primarios y secundarios que permitan la emisión de luz de una longitud de onda de 515 nm.10,15
La prueba de ANCA forma parte integral del estudio diagnóstico de primera línea de pacientes con vasculitis sistémicas porque identifica serológicamente las vasculitis de pequeños vasos asociadas a ANCA (VPVA) como PAM, GW , SCS y GNCPI.3 A pesar del entusiasmo inicial, la utilización diagnóstica de estos autoanticuerpos ha revelado que su sensibilidad y especificidad varía apreciablemente en estas entidades clínicas, así como su presencia se extiende a otras condiciones clínicas de origen reumático, inflamatorio e infeccioso.3,16 Las variaciones en los resultados de ANCA entre los diferentes laboratorios se deben tanto a la falta de métodos estandarizados, como a la falta de consenso en los criterios de definición clínica de estas entidades.17Además, la sensibilidad depende también del grado de extensión (forma clínica generalizada versus limitada), de la gravedad, y de la actividad de la enfermedad (activa versus inactiva).18,19 No obstante, la introducción de métodos para la detección de los ANCA que puedan enriquecer el diagnóstico no invasivo de entidades clínicas tan complejas como las vasculiltis, debe considerarse como un desarrollo positivo dirigido al objetivo final de perfeccionar la atención clínica de los pacientes afectados.
Nuestro método identificó a la mayoría de los pacientes (79 %, 15/19) con VPVA, en contraste, ningún paciente con VPVnoA presentó ANCA en su circulación (0 %, 0/59) (fig.). La presencia de los ANCA es la característica inmunológica más relevante de los pacientes con VPVA aunque, como apuntamos arriba, se han comunicado frecuencias muy desiguales por los diferentes laboratorios. Los ANCA se han encontrado desde el 40 al 80 % en los pacientes con PAM;20,21 desde el 34 al 92 % en la GW;22 desde el 90 al 95 % en la GNCPI18,23 y desde el 33 al 75 % en el SCS.24,25 En este laboratorio, con el método de las extensiones de células periféricas hemos encontrado ANCA en el 67 % (4/6) de los pacientes con PAM; en el 75 % (3/4) de los pacientes con GW y en el 86 % (6/8) de los pacientes con GNCPI (tabla 2). Estos resultados deben ser confirmados con un número mayor de pacientes. La presencia de los ANCA en la mayoría de los pacientes con VPVA pudiera reflejar la contribución de estos autoanticuerpos a la patogénesis de la vasculitis necrotizante y glomerulonefritis crescéntica que da lugar a las VPVA como la GW, PAM, SCS y GNCPI. Aunque el papel patogénico de los ANCA ha sido demostrado en numerosos estudios experimentales,26 las asociaciones clínicas imperfectas con las vasculitis y con su actividad, no permiten suponer que la presencia de estos autoanticuerpos represente un requerimiento absoluto para el desarrollo de estas entidades.27
Hemos encontrado ANCA en una pequeña proporción (19 %, 4/21) de pacientes con enfermedades reumáticas como AR y LES (fig.). El rango de frecuencia de los ANCA en estas entidades oscila entre 20 y 70 %,28,29 aunque la mayoría de los autores han encontrado valores bajos, cercanos al 20 %.30 La determinación de ANCA en las vasculitis secundarias tiene un significado clínico limitado, pues aún no están definidas las correlaciones clínicas con la gravedad y extensión de la enfermedad, ni con el daño de órganos.25,27
El estudio clínico de la detección de ANCA sobre extensiones de láminas periféricas en las vasculitis primarias y secundarias permitió concluir que estos autoanticuerpos tienen un importante valor diagnóstico en las VPVA, pero se presentan también en otras enfermedades sistémicas inflamatorias. Por otra parte, un número considerable de pacientes con VPVA tuvo resultados negativos para los ANCA. Es necesario subrayar que el valor clínico de un método para detectar ANCA depende no solo de sus características operacionales como sensibilidad y especificidad, sino también de la situación clínica a la cual se aplica, por lo que solo el uso prudente del estudio de los ANCA en el marco de procesos clínicos propios de las vasculitis de pequeños vasos podrá conducir al diagnóstico acertado. La optimización continuada del método para la detección de ANCA conjuntamente con diseños adecuados de su aplicación clínica es lo que permitirá esclarecer la aún controvertida utilidad clínica de los ANCA.
Summary
The detection of the antineutrophil cytoplasmic antibodies (ANCA) is the immunological diagnosis of the systematic vasculitis. This paper was aimed at proving the clinical usefulness of the indirect immunofluorescence method (IIF) on extensions of washed peripheral blood cells for the detection of ANCA. 103 serum samples over extensions of washed peripheral blood cells were classified as negative or positive for ANCA by the IIF method on neutrophils isolated with dextran. The reactivity of these autoantibodies was determined in patients with vasculitis of small vessels associated with ANCA (ASVV, n = 19), in vasculitis of small vessels non associated with ANCA (noASVV, n = 59), in vasculitis secondary to rheumatic diseases (RV, n = 21) and in sound individuals (SI, n = 131). It was found that the sensitivity and specificity of the extensions of washed peripheral blood cells to detect ANCA was 96 % (for both). ANCA were observed in 79 % of the patients with ASVV and in 19 % of the patients with RV, whereas those with noASVV and the SI did not present ANCA. To conclude, the IIF method on extensions of washed peripheral blood cells has shown an elevated sensitivity and specificity to detect ANCA, which allows its application to medical clinic for studying systemic vasculitis.
.
Subject headings: ANTIBODIES, ANTINEUTROPHIL CYTOPLASMIC; VASCULITIS/diagnosis; FLUORESCENT ANTIBODY TECHNIQUE, INDIRECT.
Referencias bibliográficas
- Lie JT. Nomenclature and classification of vasculitis: Plus Va change, plus c'est la même chose. Arthritis Rheum 1994;37:181-9.
- Niles JL. Antineutrophil cytoplasmic antibodies in the classification of vasculitis. Annu Rev Med 1996;47:303 -13.
- Savige J, Davies D, Falk R, Jeannet J C, Wiik A. Antineutrophil cytoplasmic antibodies and associated diseases: A review of the clinical and laboratory features. Kidney Int 2000;57:846-62.
- Hauschild S, Schmitt WH, Csernok E, Flesch BK, Rautmann A, Gross WL. ANCA in systemic vasculitides, collagen vascular diseases, rheumatic disorders and inflammatory bowel diseases. Adv Exp Med Biol 1993;336:245-51.
- Bloch DA, Michel BA, Hunder GG. The American College of Rheumatology 1990 criteria for the classification of vasculitis: patients and methods. Arthritis Rheum 1990; 33:1068-73.
- Paspaliaris B, Pamio M, Savige J. Indirect immunofluorescence (IIF) of normal washed peripheral blood cells to demostrate antineutrophil cytoplasmic antibodies (ANCA). J Clin Pathol 2000;53:774-7.
- Guerreiro Hernández AM, Villaescusa Blanco R, Arce Hernández A, Merlín Linares J, Morera Barrios L, Pavón Morán V et al. Estudio longitudinal de anticuerpos anticitoplasma de neutrófilos en pacientes con anemia drepanocítica. Rev Cubana Hematol Inmunol Hemoter 2000;16(2):122-4.
- Galen RS. Use of predictive value theory in clinical immunology. En: Rose NR, Friedman H, Fahey JL (eds.). Manual of Clinical Laboratory Immunology. 3ra. ed. Washington D.C: Academic Society for Microbiology;1986. p. 966.
- Savige J, Gillis D, Benson E, Davies D, Esnault V, Falk RJ et al. International consensus statement on testing and reporting of antineutrophil cytoplasmic antibodies (ANCA). Am J Clin 1999;111:507-13.
- Wiik A. Methods for the detection of antineutrophil cytoplasmic antibodies. Recommendations for clinical use of ANCA serology and laboratory efforts to optimize the informative value of ANCA test results. Springer Semin Immunopathol 2001;23:217-29.
- Wiik A. Anti-neutrophil cytoplasmic antibodies tests: Which tests should be used in practice? Internal Medicine 2001;40:466-70.
- Davies DJ, Moran JE, Niall JF, Ryan GB. Segmental necrotizing glomerulonephritis with antineutrophil antibody: Possible arbovirus aetiology? Br Med J 1982;285:606-7.
- Savige J. Testing for antineutrophil cytoplasmic antibodies. Expert Rev Mol Diagn 2001;1:281-9.
- Pollock W, Clarke K, Gallagher K, Hall J, Luckhurst E, McEvoy R et al. Immunofluorescent patterns produced by antineutrophil cytoplasmic antibodies (ANCA) vary depending on neutrophil substrate and conjugate. J Clin Pathol 2002;55: 680-3.
- Wiik A, Rassmusen N, Wieslander J. Methods to detect autoantibodies to neutrophilic granulocytes. En: Venrooij WJ van, Maini RN (eds.). Manual of biological markers of disease. The Netherlands: Kluwer Academic Publishers; 1993. p. 1.
- McLaren JS, Stimson RH, McRorie ER, Coia JE, Luqmani RA. The diagnostic value of anti-neutrophil cytoplasmic antibody testing in a routine clinical setting. Q J Med 2001;94:615-21.
- Russell KA, Wiegert E, Schroeder DR, Homburger HA, Specks U. Detection of anti-neutrophil cytoplasmic antibodies under actual clinical testing conditions. Clin Immunol 2002;103:196-203.
- Rus V, Handwerger BS. Clinical value of antineutrophil cytoplasmic antibodies. Current Rheumathology Reports 2000;2:383-9.
- Hagen EC, Daha MR, Hermans J, Andrassy K, Csernok E, Gaskin G et al. Diagnostic value of standardized assays for anti-neutrophil cytoplasmic antibodies in idiopathic systemic vasculitis. EC/BCR Project for ANCA Assay Standardization. Kidney Int 1998;53:743-53.
- Guillevin L, Durand-Gasselin B, Cevallos R, Gayraud M, Lhote F, Callard P et al. Microscopic polyangiitis. Clinical and laboratory findings in eighty-five patients. Arthritis Rheum. 1999;42:421-30.
- Jennette JC, Falk RJ, Wilkman AS. Anti-neutrophil cytoplasmic autoantibodies - A serologic marker for vasculitides. Ann Acad Med Singapore 1995;24:248-53.
- Langford CA. The diagnostic utility of c-ANCA in Wegener's granulomatosis. Cleve Clin J Med 1998;65:135-40.
- Sinico RA, Radice A, Pozzi C. Diagnostic significance and antigen specificity of antineutrophil cytoplasmic antibodies in renal diseases: a prospective multicentric study. Italian Group of Renal Immunopathology. Nephrol Dial Trasplant 1994;9:505-10.
- Guillevin L, Cohen P, Gayraud M, Lhote F, Jarrousse B, Casassus P. Churg-Strauss syndrome. Clinical study and long-term follow-up of 96 patients. Medicine (Baltimore) 1999;78:26-37.
- Wiik AS. Clinical use of serological tests for antineutrophil cytoplasmic antibodies. What do the studies say? Rheum Dis Clin North Am 2001;27:799-813.
- Jennette JC, Falk RJ. Pathogenic potential of antineutrophil cytoplasmic autoantibodies. Lab Invest 1994;70:135 - 7.
- Vassilopoulos D, Hoffman GS. Clinical utility of testing for antineutrophil cytoplasmic antibodies. Clin Diagn Lab Immunol 1999;6:645-51.
- Merkel PA, Pollisson RP, Chang Y. Prevalence of antineutrophil cytoplasmic antibodies in a large inception cohort of patients with connective tissue disease. Ann Intern Med 1997;126:866-73.
- Schnabel A, Csernok E, Isenberg DA. Antineutrophil cytoplasmic antibodies in systemic lupus erythematosus: prevalence, specificities, and clinical significance. Arthritis Rheum 1995;38:633-7.
- Galeazzi M, Morozzi G, Sebastiani GD, Bellisai F, Marcolongo R, Cervera R et al. Anti-neutrophil cytoplasmic antibodies in 566 European patients with systemic lupus erythematosus: prevalence, clinical associations and correlation with other
autoantibodies. European Concerted Action on the Immunogenetics of SLE. Clin Exp Rheumatol 1998;16:541-6.
Recibido: 1 de diciembre de 2003. Aprobado: 6 de enero de 2004.
Dra. Elena Kokuina. Hospital Clínico Quirúrgico "Hermanos Ameijeiras" San Lázaro No.701 entre Belascoaín y Marqués González, Centro Habana, Ciudad de La Habana, Cuba.
1 Especialista de II Grado en Inmunología. Profesora Asistente. Hospital Clinicoquirúrgico "Hermanos Ameijeiras."
2 Residente de 3er Año de Inmunología. Instituto Superior de Ciencias Médicas de La Habana.
3 Licenciada en Química. Hospital Clinicoquirúrgico "Hermanos Ameijeiras."
4 Licenciada en Bioquímica. Investigadora Auxiliar. Instituto de Hematología e Inmunología.