Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.43 n.1 Ciudad de la Habana ene.-feb. 2004
Instituto Nacional de Oncología y Radiobiología
El precursor del factor de crecimiento epidérmico. Perspectivas de su utilización como marcador tumoral
Lic. Celia María Pereda Meira,1 Lic. Isbel García Figueredo2 y Lic. Astary Domínguez Ayerbe3
Resumen
Los factores de crecimiento comprenden una familia de moléculas que estimulan la proliferación celular. Por lo general estos factores son sintetizados en forma de largas moléculas precursoras que posteriormente son procesadas por enzimas para dar lugar a la molécula madura. Entre ellos se encuentra el factor de crecimiento epidérmico. En la mayoría de las secreciones y fluidos biológicos humanos se ha encontrado, además de la molécula madura de 6,2 kDa, una gran heterogeneidad de tamaño.
En orina de pacientes con cáncer de mama se encontró sobreexpresión de moléculas de bajo y alto peso molecular con respecto a la orina de mujeres sanas, lo que constituye una nueva vía de investigación en el campo de los marcadores tumorales. En otras especies animales también se han aislado formas de alto y bajo peso molecular y se ha definido que el procesamiento ocurre por serinoproteasas, denominadas calicreínas.
Palabras clave: Factor de crecimiento epidérmico, precursor del factor de crecimiento epidérmico, bajo y alto peso molecular, fluidos biológicos, calicreínas, cáncer.
Los factores de crecimiento comprenden una amplia familia de moléculas que estimulan la proliferación celular mediante su interacción con un receptor específico de membrana, no son nutrientes ni se emplean como metabolito o cofactor en ningún paso del metabolismo intermediario. Se trata, por tanto, de moléculas con una función de regulación.1
Los factores de crecimiento están presentes en una gran variedad de tejidos, tanto embrionarios como adultos y se piensa que son liberados por todas las células en cultivo.2 Se diferencian en cuanto a su especificidad; algunos como la interleucina-2 (IL-2), estimulan uno o sólo unos pocos tipos de células, mientras que otros, como el factor de crecimiento epidérmico (EGF), estimulan una amplia variedad de tipos celulares. Hasta hoy se ha descrito un grupo de factores de crecimiento que han sido caracterizados y sus genes clonados. Por lo general, son sintetizados en forma de largas moléculas precursoras que posteriormente son procesadas para dar lugar a la molécula madura. Entre estos tenemos, EGF,3-6 TGF a (factor de crecimiento transformante a),7-9 CSF-1 (factor estimulador de colonias),10 TNF (factor de necrosis tumoral),11,12 IL-1a (interleucina 1a),13 MCGF (factor de crecimiento de colonias de macrófagos).14
El estudio de los factores de crecimiento ha ocupado un lugar importante en la oncología experimental en los últimos años. Actualmente surgen cada día en la literatura más datos clínicos que tratan de avalar la importancia de estas moléculas biorreguladoras en el diagnóstico, seguimiento y tratamiento de las neoplasias malignas.
- Estructura del precursor del factor de crecimiento epidérmico
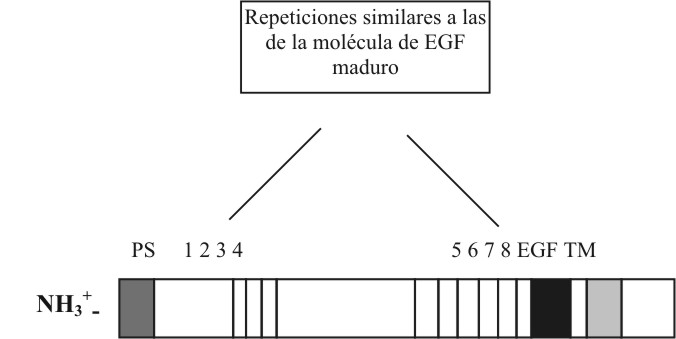
El EGF humano es sintetizado como una gran molécula precursora3-6 por la traducción de un ARNm de 4 800 bases que codifica para un polipéptido de aproximadamente 1 207 aminoácidos (aa). El dominio extracelular es grande, tiene 8 regiones de secuencia parcialmente homólogas al EGF maduro (fig.). Cada uno tiene, aproximadamente, 40 aminoácidos, incluyendo 6 cisteínas (Cys) espaciadas como en el EGF. El EGF maduro constituye solamente el 5 % de la molécula precursora y está ubicado en el dominio extracelular. Es un polipéptido de 53 aa y su peso molecular es 6,2 kDa. El dominio transmembrana está formado por 25 aa, en su mayoría hidrofóbicos, dispuestos en a-hélice. El dominio intracelular es pequeño y en él está ubicada la actividad tirosinaquinasa. La disposición que adopta la molécula del precursor en la membrana es Nout - Cin.3-6
Fig. Representación esquemática del precursor del factor de crecimiento epidérmico (EGF). Las 2 regiones hidrofóbicas, en el NH2-terminal y cerca del COOH-terminal, corresponden al péptido señal (PS) y al dominio de transmembrana (TM). Las 8 repeticiones similares EGF-like (ricas en Cys) al igual que el EGF maduro están localizadas en el dominio extracelular del precursor.
En el ratón, el EGF se sintetiza, al igual que en seres humanos, por medio de una larga molécula precursora de 1 217 aa y su estructura es comparable con la del EGF humano,15 mientras que en el caballo aparece como un polipéptido de 53 aa, que presenta de un 60-70 % de homología con el de las otras especies ya descritas. El precursor está formado por un transcripto de 4,9 kb, en el cual el EGF maduro tiene un tamaño similar al de otras especies de mamíferos.16
- Heterogeneidad de tamaño y distribución del precursor
El EGF está ampliamente distribuido en casi todos los fluidos y secreciones corporales,17 se encuentran altos niveles del mismo en orina, fluidos y secreciones mamarias, fluidos prostáticos y seminales, saliva, lágrimas, líquido amniótico, sudor de la mama, sudor de la axila y jugo gástrico. En todos, excepto en el jugo gástrico y en el sudor de la axila, donde sólo había EGF de 6,2 kDa, se encontraron otras moléculas de EGF inmunorreactivo de ³ 300, 170, 150, 70 y 20 kDa. Los fluidos que presentan mayor heterogeneidad son: orina, leche y plasma seminal.18, 19
En la sangre, los niveles de EGF maduro son bajos, aunque también están presentes formas de alto y bajo peso molecular. Las formas de alto peso molecular constituyen el 40 % del total de EGF en sangre. Se unen al receptor con una menor constante de afinidad aparente que el EGF maduro. El EGF es liberado durante la coagulación y las plaquetas son necesarias para la liberación del mismo; aunque existe poca correlación entre el contenido de plaquetas y el EGF.20
En el riñón y en la glándula mamaria es el precursor de EGF el que se acumula y no la forma madura, esto sugiere que el precursor por sí mismo tiene funciones fisiológicas adicionales.18 Este precursor secretado es capaz de unirse al receptor y activar la actividad intrínseca tirosina-quinasa del mismo; lo cual indica que no se requiere el procesamiento proteolítico completo del precursor para que se pueda llevar a cabo la función biológica.21, 22
En otras especies animales, además del EGF maduro de 6,2 kDa, también se han aislado formas de alto peso molecular; por ejemplo en el ratón se ha encontrado en la glándula submaxilar, en las células tubulares del riñón y en la orina, bajo condiciones que limitan la digestión enzimática. Esto sugiere que la orina contiene enzimas capaces de liberar el EGF maduro de 6,2 kDa de su precursor de alto peso molécular.15 Otra fuente de obtención de precursor de EGF en el ratón son las células alveolares de la glándula mamaria durante la lactancia, período en el cual la síntesis del mismo aumenta.23, 24
- Regulación de la expresión y la actividad del precursor
No se conoce con exactitud los factores que regulan la expresión del gen del precursor de EGF. Algunos autores han descrito varios mecanismos que pudieran estar implicados en este proceso. 21, 25, 26 Uno de estos mecanismos podría ser la unión a otras moléculas, tanto de la forma secretada (bajo peso molecular) como la asociada a la membrana (alto peso molecular), por ejemplo la unión al glicosaminoglicano heparina. Un segundo mecanismo sería que las especies solubles de 160-170 kDa del precursor existan en forma latente formando complejos con proteínas transportadoras. Esta forma latente puede ser activada por proteasas extracelulares que liberarían una forma más activa de este factor de crecimiento.21
En cuanto a los factores hormonales involucrados en la regulación de la expresión, estos no están bien determinados; sin embargo, patrones temporales de expresión del precursor indican que las mismas hormonas lactogénicas, como prolactina y glucocorticoides, que influyen en la expresión de caseína, probablemente influyan en la expresión del gen del precursor de EGF.23, 27
Se ha observado que los niveles de expresión de EGF aumentan en el epitelio glandular del endometrio de yegua durante el embarazo; esto puede proporcionar un estímulo mitogénico para el endometrio y/o trofoblastos y facilitar la diferenciación placentaria. Alternativamente, el precursor podría estar involucrado en el proceso secretor de las glándulas del endometrio el cual es necesario para producir la leche uterina para el sustento fetal.16
En las ratas adultas se ha definido el papel de las hormonas tiroideas y la hormona del crecimiento (GH) en la regulación de la producción del EGF renal.28, 29 En este modelo se ha encontrado que los niveles de EGF maduro, precursor de EGF y ARNm del EGF, disminuyen significativamente en el riñón de ratas a las que se les ha practicado la hipofisectomía, comparados con los niveles en las ratas normales. Estos niveles aumentan después de la administración de la hormona tiroidea (T3) y de la GH. De esta forma, la sola reposición de estas hormonas es suficiente para potenciar la expresión de EGF. La inducción de un estado de hipertiroidismo en ratas normales por la inyección de T3 aumenta los niveles de EGF maduro y su precursor presente en las membranas de las células renales.28 Por el contrario, la inducción de hipersomatotropismo en ratas normales por inyección de GH no afecta los niveles de EGF maduro excretable o ARNm de EGF.29
- Procesamiento del precursor
En la glándula submaxilar de ratón han sido identificadas múltiples calicreínas.30 La más caracterizada en esta glándula es una proteína que se une al precursor de EGF, la que probablemente sea responsable del procesamiento proteolítico del mismo. En el ratón, las calicreínas son una subfamilia multigénica de serino-proteasas que pueden encontrarse en una gran variedad de tejidos31 y presentan un alto porcentaje de homología.30 El sitio específico de ruptura es en los enlaces peptídicos que siguen a los residuos de arginina (Arg), histidina (His), leucina (Leu), lisina (Lys). Algunas de estas enzimas participan en el procesamiento postraduccional de hormonas polipeptídicas y factores de crecimiento.32 La formación de la molécula de EGF requiere la ruptura de 2 enlaces peptídicos: Arg977 - Asn978 (N-terminal) y Arg1029 - His1030 (C-terminal). Se ha considerado que una o más calicreínas puedan hidrolizar el precursor de EGF para dar lugar a la molécula madura.3,33
Entre las evidencias fundamentales que apuntan a definir que el precursor de EGF pudiera ser hidrolizado por estas enzimas, tenemos que en la glándula mamaria de ratones durante el período de lactancia se encontraron transcriptos de mGK-6 (calicreína) y la inmunorreactividad de este tipo de enzima fue encontrada en el borde luminal de las células alveolares con un patrón de distribución similar al precursor de EGF.34 De igual forma, aparecen calicreínas (rK1, rK7, rK10) en la glándula submaxilar de ratas, donde son abundantes y están colocalizadas con el EGF, sugiriendo que tales enzimas pueden estar involucradas en el procesamiento del precursor.35
- El precursor de EGF en cáncer
El conocimiento acerca de los factores de crecimiento y su papel regulador en la proliferación celular, específicamente el EGF, permiten suponer que su cuantificación en suero pudiera resultar interesante, no solo para monitorear la respuesta al tratamiento oncoespecífico de los pacientes, sino también para el diagnóstico precoz del cáncer. En estudios previos realizados en nuestro laboratorio (Fernández Minerva. Tesis de Diploma, INOR, 1994) se obtuvo que los valores de EGF sérico de pacientes con cáncer de mama no diferían significativamente de los del grupo normal; lo que muestra el pobre valor de tales determinaciones, tanto para el diagnóstico precoz como para el estadiamiento del cáncer mamario. No obstante, sería interesante estudiar el valor de esta determinación como posible marcador tumoral en el monitoreo o seguimiento de la respuesta al tratamiento lo que permitirá comprobar resultados encontrados en trabajos previos (Badía T. Tesis de Diploma, INOR 1991; González J. Tesis de Diploma, INOR 1992); así como evaluar la utilidad de esta molécula en el diagnóstico precoz de las recaídas de los pacientes, que es una de las principales funciones de los marcadores tumorales ya utilizada en la práctica clínica. Sin embargo, en orina de pacientes con una variedad de tumores malignos fue encontrado EGF de bajo y alto peso molecular.36, 37
Específicamente, en la orina de pacientes con cáncer de mama fue detectada una molécula de EGF de 43 kDa, esta molécula pudiera ser una forma parcialmente hidrolizada del precursor de EGF secretada por el tumor, transportada por la sangre y excretada por el riñón o alternativamente sintetizada en el riñón en respuesta a estímulos provenientes del tumor. Los valores más altos son detectados en pacientes que presentan ganglios linfáticos positivos y un tamaño tumoral que excede los 3 cm.38
En tumores primarios de mama, se ha demostrado una relación inversa del receptor del crecimiento epidérmico (EGF) y el receptor de estradiol (RE), conocido marcador de buen pronóstico y hormonodependencia tumoral, el mismo también muestra una expresión más frecuente en carcinomas mamarios menos diferenciados y se ha visto que, en las metástasis, la concentración de este marcador puede estar más elevada que en los tumores primarios.
En estudios preliminares llevados a cabo en nuestro laboratorio (datos no publicados) en los cuales se emplearon técnicas de inmunohistoquímica y Western Blotting en tejido maligno y benigno de la mama, se usó un anticuerpo monoclonal anti-EGF humano se encontró marcaje específico al nivel de membrana y la presencia de una molécula de alto peso molecular. Sin embargo, en las muestras provenientes de alguna patología mamaria (entiéndase tejido tumoral o condición displásica) utilizando el Western Blotting, se observó en mayor o en menor grado un bandeo difuso que, en algunas ocasiones, podría ser delimitado como 3 bandas situadas entre la región de aplicación de la muestra y 116 400 Da. Estas bandas pueden corresponder a la forma precursora del EGF anclada a la membrana, reportada en membrana de células transfectadas con esta molécula;22 sin ser igual el comportamiento en tejido normal de mama o en alguna afección de cabeza y cuello. Estos datos obtenidos en nuestro laboratorio junto con los resultados de Rall y otros39 demuestran la posible presencia del precursor de EGF en la membrana de células de riñón y de mama, lo cual sugiere que este por sí mismo pudiera desempeñar alguna función fisiológica importante. Por ello se piensa que si se demuestra la localización precisa de este precursor, al igual que ha sido demostrada previamente la presencia del receptor de EGF y su asociación con el cáncer de mama, pudiera tener un impacto en la localización in vivo de tumores de mama o sus metástasis con el empleo de anticuerpos monoclonales marcados con radioisótopos como 99 mTc.40
Al ser encontrado en el cáncer de mama fundamentalmente, podemos plantear que el papel del precursor del EGF, puede estar relacionado con estados proliferativos y servir, por tanto, como un posible marcador tumoral asociado a estos procesos en la mama.
En la actualidad se ha venido observando que el número de casos de cáncer de próstata ha ido aumentando con el tiempo, por tanto la búsqueda de nuevas variantes diagnósticas y tratamientos más adecuados va dirigido a investigar las interacciones de diferentes proteínas entre ellas los precursores de EGF y otras moléculas relacionadas con las rutas metabólicas que intervienen en esta afección. De esta forma se ha estudiado el papel de 2 proteínas, el factor de crecimiento similar al factor de crecimiento de unión a heparina ( HB-factor EGF) y anfiregulina (ARP), ambas moléculas ligandos del receptor de factor de crecimiento epidérmico y que son derivadas de los precursores unidos a membrana pro-HB-EGF y pro-ARP y su capacidad potencial para controlar el crecimiento celular de estas células de cáncer de próstata. Está cobrando particular interés estudiar las proteínas que pueden interactuar con los dominios citoplasmáticos de los precursores antes mencionados en diferentes localizaciones tumorales señaladas anteriormente.41
Summary
The growth factors are a family of molecules that stimulate cellular proliferation. Generally, these factors are synthetized as large precursor molecules that are later processed by enzymes to give rise to the mature molecule. The epidermal growth factors is among them. In most of the secretions and human biological fluids, it has been found a great size heterogeneity in addition to the mature molecule of 6.2 kDa. In urine from patients with breast cancer, it was found an overexposure of low and high molecular weight compared with the urine of sound women, which is a new way of research in the field of tumoral markers. In other animal species, other forms of low and high molecular weight have been isolated, too, and it has been defined that the processing occurs by serine proteasas, called callicreins.
Key words: Epidermal growth factor, precursor of the epidermal growth factor, low and high molecular weight, biological fluids, callicreins, cancer.
Referencias bibliográficas
- Pérez R, Lage A. Los factores de crecimiento y sus relaciones con la transformación maligna. Interf y Biotecn 1986;l3 (3):179-209.
- Shields R. Growth factors for tumors. Nature 1978;267:670-1.
- Scott J, Urdea M, Quiroga M, Sánchez-Pescador R, Fong N, Selby M et al. Structure of a mouse submaxillary messenger RNA encoding epidermal growth factor and seven related proteins. Science 1983;221:236-40.
- Gray A, Dull TJ, Urich A. Nucleotide sequence of EGF cDNA predicts a 128 000-molecular wieght protein precursor. Nature 1983; (Lond) 303:722-5.
- Bell GI, Fong NM, Wornstead MA, Coput DF, Ku L, Urden MS et al. Human epidermal growth factor precursor: cDNA sequence, expression in vitro and gene organization. Nucleic Acid Res 1986;14:8427-46.
- Mroczkowski B, Ball R. EGF: biology and properties of its gene and protein precursor. En: Habenicht A (ed). Growth Factors, Differentiation Factors and Cytokine. New York: Springer-Verlag; 1990.p.18-30.
- Bringman TS, Linndquist PB, Derynck R. Different TGF-a species are derived from a glycosylated and palmitoylated transmembrane precursor. Cell 1987;48:429-40.
- Barchman R, Lindquist PB, Nagashima M, Kohr W, Lipan T, Napier M et al. Transmembrane TGF-a precursors activate EGF/TGF-a receptors. Cells 1989;56:691-700.
- Anklesaria P, Teixido J, Laiho M, Pierce JH, Greenberger JS, Massague J. Cell-Cell adhesion mediated by binding membrane- anchored transforming growth factor a to EGF redeptors promotes cell proliferation. Proc Nalt Acad Sci USA 1990;87:3289-93.
- Rettenmier CW. Biosynthesis of macrophage colony-stimulating factor (CSF-1): defferencial processing of CSF-1 precursors suggests alternative mechanisms for stimulating CSF-1 receptors. Curr Top Microbio Immunol 1989;149:129-41.
- Kriegler M, Pérez C, DeFay K, Alberg I, Lu SD. A novel form of TNF/cachectin is a cell surface cytotoxic transmembrane protein: ramifications for the complex physiology of TNF. Cell 1988;53:45-53.
- Vilcek J, Lee TH. Tumor necrosis factor new insights into the molecular mechanisms of its multiple actions. J Biol Chem 1991;266:7313-6.
- Conlon PJ, Grabtein KH, Alpert A, Preckett KS, Mopp TP, Gillis S. Localization of human mononuclear cell IL-1. J Immunol 1985;139:98-102.
- Anderson DM, Lyman SD, Raird A, Wignall JM, Eiseman J, Gumpel SD et al. Molecular cloning of mast cell growth factor, a hematopoietin that is active in both membrane bound and soluble forms. Cell 1990; 63:235-43.
- Nexo E, Jorgensen PE, Thim L, Roepstorffy P. Purification and characterization of a low a high molecular weight form of epidermal growth factor from rat urine. Biochem Biophys Acta 1990;1037:388-93.
- Stewart F, Power CA, Lennard SN, Allen Wr, Amet L, Edwards Rm. Identification of the horse epidermal growth factor (EGF) coding sequence and its use in monitoring EGF gene expression in the endometrium of the pregnant mare. J Molecular Endocrinology 1994;12:341-50.
- Carpenter G, Wahl MI. The epidermal growth factor family En: Sporn MM, Roberst AB (eds). Peptide growth factor and their receptors I. New York: Springer-Verlag; 1990.p. l 95, 69-171.
- Parriers G, Chen K, Misono KS, Cohen S. The human urinary epidermal growth factor (EGF) precursor. Isolation of a biologically active 160-kilodalton heparin binding pro-EGF a truncated carboxyl terminus. J Bio Chem 1995;270 (46):27954-60.
- Pesonen K, Viinikka L, Koskimies A, Banks AR, Nicolson M, Perheentupa J. Size heterogeneity of epidermal growth factor in human body fluids. Life Sciences 1987;40:2489-94.
- Nexo E, Jorgensen PE, Hansen MR. Human epidermal growth factor on molecular forms present in urine and blood. Regulat Peptides 1992;42: 75-84.
- Mrczkowski B, Reich M. Identifivation of biologically active epidermal growth factor precursor in human fluids and secretions. Endocrinology 1993;132:417-25.
- Mrczkowski B, Reich M, Chen K, Bell GI, Cohen S. Recombinan human epidermal growth factor precursor is a glycosilated membrane protein with biological activity. Mol Cell Biol 1989;9:2771-8.
- Brown CF, Teng CT, Pentecost BT, DiAugustine RP. Epidermal growth factor precursor in mouse lactating mammary gland alveolar cells. Mol Endocrinol 1989;95:1077-83.
- Schaudies RP, Grimes J, Wray HL, Koldovsky O. Identification and characterization of multiple forms of biological active epidermal growth factor in rat milk. Am J Physiol 1990;259: G1056-G1061.
- Higashiyama S, Abraham JA, Miller J, Fiddes JC, Klagsburn M. A heparin binding growth precursor is a glycosilated membrane protein with biological activity. Moll Cell Biol 1991;9:2779-83.
- Laksmanan J, Salido EC, Lam R, Barajas L, Fisher DA. Identification of pro-epidermal growth factor and high molecular weight epidermal growth factors in adult mouse urine. Biochem Biophys Commun 1990;173:902-11.
- Cowie AT, Forsyth IA, Hart IC. Hormonal Control of Lactation. Berlin: Springer-Verlag;1980:162-5.
- Rogers SA, Miller SB; Hammerman MR. Triiodothyronine stimulates renal epidermal growth factor expression in adult rat. Am J Physiol 1995;268 (1 Pt2): F 128-34.
- Rogers SA, Rasmussen J, Miller SB, Hammerman MR. Effects of growth hormone on rat renal epidermal growth factor expression. Am J Physiol 1994;267 (2 Pt2): F 208-14.
- Mason AJ, Evans BA, Cox DR, Shine J, Richards RI. Structure of mouse kallikrein gene family suggests a role in specific processing of biologically active peptides. Nature 1988;303:301-7.
- MacDonald RJ, Grinblat SM, Johnston CI. Molecular biology of tissue kallikrein. Biochem J 1984;253: 313-21.
- Schachter M. Kallilreins (kinogenases)-a group of serine proteases with bioregulatory actions. Pharmacol Rev 1980;31:1-17.
- Breyer JA, Cohen S. The epidermal growth factor precursor isolated from murine kidney membranes. J Biol Chem 1990;265:16564-70.
- Jahnke GD, Chao J, Walker MP, DiAugustine RP. Detection of kallikrein in the mouse lactating mammary gland: A possible procesing enzyme for the epidermal growth factor precursor. Endocrinology 1994;135:2022-9.
- Jorgensen PE, Nexo E, Poulsen SS, Almendingen M, Berg T. Processing epidermal growth factor in the rat mubmandibular gland by kallikrein like enzymes. Growth Factors 1994;11:113-23.
- Kimball ES, Bohn WH, Cockley KD, Warren TC, Sherwin SA. Cancer Res 1984; 44: 3613-3619.
- Eckert K, Luebbe L, Schoen R, Grosse R. An epidermal growth factor related protein of molecular weight 43 000 purified from the urine of breast cancer patients. Bichemestry 1990;283:3666-71.
- Eckert K, Granetzny A, Fischer J, Grosse R. Purification of a high molecular wieght form of epidermal growth factor form urine of breast cancer patients. Bio Chem 1989;263:5510-6.
- Rall LB, Scott J, Bell GI, Crawford RJ, Penshow JD, Niall HD et al. Mouse prepro-epidermal growth factor synthesis by the kidney and other tissues. Nature (Lond) 1985;313:228-31.
- Lin MS. Labeling proteins with technetium-99m. Subramanian G, Rhodes B, Cooper J, Sood V, eds. Radiopharmaceuticals. New York: Society of Nuclear Medicine 1975;36-8.
- Lin Grace. Screening for proteins in the prostate that interact with HB-EGF and amphiregulins using the yeast two-hybrid system. Bug J 1999;2:42-4.
Recibido: 13 de marzo de 2003. Aprobado: 2 septiembre de 2003.
Lic. Celia María Pereda Meira. Instituto Nacional de Oncología y Radiobiología, F y 29, El Vedado, Ciudad de La Habana, Cuba. Correo electrónico: celiam@infomed.sld.cu
1 Investigadora Agregada. Laboratorio de Marcadores Tumorales. INOR.
2 Investigadora Aspirante. Laboratorio de Marcadores Tumorales. INOR.