Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.45 n.1 Ciudad de la Habana ene.-mar. 2006
Hospital Clinicoquirúrgico Hermanos Ameijeiras
Servicio de Hematología
Tratamiento con quimioterapia de la leucemia mieloide aguda en el Hospital Hermanos Ameijeiras. Experiencia de 20 años de trabajo
Dr. Calixto Hernández Cruz,1 Dra. Dayana Pérez Valiente,1 Dr. José Carnot Uria,2 Dr. Raúl de Castro Arenas,2 Dr. Jorge Muñío Perurena,1 Dr. Carlos A. Martínez Fernández1 y Dr. Guillermo Pérez Román1
Resumen
La leucemia mieloide aguda (LMA) representa el 80 % del total de leucemias agudas que afectan a los seres humanos, su pronóstico continúa siendo muy desfavorable. Se realizó este trabajo para dar a conocer la experiencia acumulada en el hospital, en la presentación y tratamiento de esta enfermedad empleando quimioterapia. Se analizaron los resultados obtenidos en el tratamiento de 193 pacientes con diagnóstico de LMA tratados, a lo largo de 20 años, en el Servicio de Hematología. El promedio de edad de los afectados fue de 42,7 años y el subtipo FAB más frecuente resultó ser la M2. Los casos con LMA no M3 presentaron un índice de remisión completa (RC) de 45,5 % para todas las edades y de 60,4 % para los menores de 60 años. La sobrevida global (SG) fue de 8,9 % a los 5 años de seguimiento para los pacientes < 60 años, sin registrarse sobrevivientes para igual intervalo entre los > 60 años. La sobrevida libre de complicaciones (SLE) en general fue del 16,2 % a los 5 años. Los pacientes con LMA-M3 presentaron un índice de RC del 75 %. La SG y SLE a los 5 años fueron de 40,4 y de 62,2 %, respectivamente. El 67,7 % de los casos falleció a consecuencia de una enfermedad refractaria a tratamiento o en recaída.
Palabras clave: Leucemia mieloide aguda, remisión completa, sobrevida global, sobrevida libre de complicaciones.
La leucemia mieloide aguda (LMA) constituye una de las enfermedades más devastadoras de cuantas puedan azotar a la especie humana. De hecho, es un conjunto de trastornos que se originan en precursores mieloides hematopoyéticos, con detención de la maduración e intensa proliferación de naturaleza monoclonal y maligna, que produce profunda afectación de la función medular e insuficiencia orgánica diversa en el resto de la economía.1
La LMA representa hasta el 80 % del total de las leucemias agudas que afectan a los adultos1 y se ha comprobado que constituyen enfermedades que padecen mayormente personas de la tercera edad. Por ejemplo, en los Estados Unidos, la edad media de presentación de la enfermedad es de 66 años, con una incidencia de 1,0 casos por cada 100 000 hab para los menores de 40 años, en franco contraste con la encontrada para los mayores de esta edad, que resulta mayor de 15 casos por cada 100 000 hab.2,3
Los recientes avances científicos han permitido revolucionar la clasificación de este conjunto de enfermedades y pasar de una nomenclatura basada en el examen morfológico y citoquímico (Clasificación Franco-Americana-Británica),4 a la propuesta por la Organización Mundial de la Salud,5 que reconoce el valor inestimable de los hallazgos citogenéticos y de los reordenamientos moleculares en su identificación. El actual desarrollo del perfil de expresión génica6,7 ha conducido a una caracterización más profunda de las LMA, enfatizando en su gran heteregeneidad.
Su comportamiento clínico es muy variable, se halla desde pacientes con enfermedad fulminante y rápidamente mortal hasta otros con supervivencia más prolongada8 e incluso se han observado casos con remisiones espontáneas, según aislados reportes.9 La probable evolución de las LMA al momento del diagnóstico puede predecirse de acuerdo con una serie de parámetros clínicos y biológicos como son la edad, las alteraciones citogenéticas y la temprana desaparición de los blastos (células malignas) después de instaurada la quimioterapia.10,11
En general, el tratamiento de las LMA transcurre en 2 fases; una de inducción, cuyo objetivo es alcanzar la remisión completa (dada por la ausencia de manifestaciones extramedulares de leucemia, valores hematológicos normales en sangre periférica y menos de 5 % de blastos en médula ósea, sin tener alguno de ellos fenotipo leucémico); y otra de consolidación, con el propósito de mantener esta remisión completa y de eliminar, además, elementos celulares malignos residuales no detectables morfológicamente. Esta última fase puede incluir la posibilidad de implementar el trasplante de células progenitoras hematopoyéticas (TCPH) autólogo o alogénico. En el caso específico de la LMA subtipo M3, se añade además una fase de mantenimiento, donde se emplea quimioterapia a bajas dosis, para reforzar el efecto alcanzado durante los períodos previos de tratamiento.
A pesar del progreso registrado en los últimos años, la dura realidad es que los resultados terapéuticos continúan siendo desalentadores y la mayor parte de los pacientes fallecen a consecuencia de la enfermedad, especialmente en el grupo de los ancianos.8,12-14
Es en este contexto que se realiza el presente trabajo, con el objetivo de dar a conocer la experiencia acumulada en relación con la presentación y los resultados obtenidos en el tratamiento de las LMA en nuestro hospital.
Métodos
Se realizó un estudio retrospectivo-descriptivo de 193 pacientes con diagnóstico de leucemia mieloide aguda, mayores de 15 años de edad, atendidos desde la presentación de su enfermedad, en el Servicio de Hematología del Hospital Clinicoquirúrgico Hermanos Ameijeiras, entre 1984 y abril del 2004.
El diagnóstico se hizo mediante la realización de medulograma (en aquellos casos en que el aspirado medular resultó insuficiente, se procedió a valorar para el diagnóstico la biopsia de médula ósea) en el que debía encontrarse más de un 30 % de blastos, según los criterios de la clasificación FAB empleados.4
En la presentación de la enfermedad se tomaron en cuenta las siguientes variables: edad, sexo, color de la piel, subtipo de LMA, así como si esta era primaria o secundaria a hemopatías o tratamientos previos.
Al concluir el tratamiento inicial impuesto (inducción), se determinó si con este se había alcanzado la remisión completa y evolutivamente la Sobrevida Global y la Sobrevida Libre de complicaciones, de acuerdo con los criterios siguientes:
- Remisión completa (RC)
- Desaparición de síntomas y signos de la enfermedad.
- No manifestaciones de leucemia extramedular.
- Conteos periféricos normales.
- Menos del 5 % de blastos en médula ósea.
- Sobrevida global (SG)
- Desde la fecha de diagnóstico hasta la fecha de la última consulta o el fallecimiento.
- Sobrevida libre de complicaciones (SLE)
- Desde que se alcanza la RC hasta que el paciente recae, se registra la fecha de su última consulta o fallece.
El tratamiento de consolidación (posinducción) fue individualizado en todos los casos. Aquellos pacientes no tributarios de los anteriores tratamientos, recibieron terapéutica meramente paliativa.
También se evaluó el estatus del paciente al momento del fallecimiento, según las consideraciones siguientes:
- Muerte en inducción: Fallecimiento registrado durante los primeros 28d de tratamiento.
- Muerte por enfermedad refractaria: Fallecimiento del paciente en el que nunca se consigue lograr una RC.
- Muerte por recaída: Fallecimiento del paciente en el curso de una recaída, luego de haber conseguido una RC.
- Muerte en remisión: Fallecimiento del paciente luego de haber logrado la RC.
Los datos necesarios para este estudio fueron tomados de las historias clínicas confeccionadas en el Servicio de Hematología.
Los resultados obtenidos fueron expresados con medidas de estadística descriptiva, se confeccionaron tablas para su mejor comprensión. Los análisis de supervivencia se realizaron según el método de Kaplan-Meier.15
Resultados
En el presente estudio se evaluaron 193 pacientes, 101 (52,3 %) del sexo femenino y 92 (47,6 %), del masculino, para una relación de 1:1,09. En relación con el color de la piel, 148 (76,6 %) eran blancos, 27(13,9 %) mestizos y 18 (9,3 %), negros
En cuanto a la edad, esta varió en un rango desde los 15 hasta los 94 años, con un promedio de 42,7 años al momento del diagnóstico. Del total de afectados, 154 (79,6 %) resultaron menores de 60 años, en tanto el resto (39/20,2 %) eran mayores de esta edad.
En la tabla 1 se muestran los diferentes subtipos de LMA hallados, se destaca el predominio del subtipo M2 (45/23,3 %), seguido por la M1 (39/20,2 %) y la M3 (33/17,0 %).
Tabla 1. Frecuencia de los diferentes subtipos de LMA
| Subtipo | No. | (%) |
| M0 | 3 | (1,5) |
| M1 | 39 | (20,2) |
| M2 | 45 | (23,3) |
| M3 | 33 | (17,0) |
| M4 | 26 | (13,4) |
| M5 | 17 | (8,8) |
| M6 | 6 | (3,1) |
| M7 | 4 | (2,0) |
| No clasificadas | 20 | (10,3) |
En 15 pacientes (7,7 %) se comprobó la existencia de una enfermedad secundaria; en 11 de ellos un síndrome mielodisplástico, en 2, quimioterapia y radioterapia previa, en 1 hemoglobinuria paroxística nocturna y en 1, policitemia vera.
El comportamiento de las remisiones completas se puede observar en la tabla 2. Entre los pacientes con LMA no promielocítica (para todas las edades) el índice de RC fue del 45,5 %, mientras que para los menores de 60 años esta fue del 60,4 %. Los pacientes con LMA promielocítica (LMA subtipo M3) alcanzaron un índice de RC del 75,0 %.
Tabla 2. Comportamiento de las remisiones completas
| Tipo de remisión | Subtipo FAB | LMA-M3 | ||||
| LMA no M3 | ||||||
| Todas las edades | < 60 años | |||||
| No. | (%) | No. | (%) | No. | (%) | |
| RC | 56 | (45,5) | 55 | (60,4) | 15 | (75,0) |
| NR | 67 | (54,4) | 36 | (39,5) | 5 | (25,0) |
RC: Remisión completa. NR: No remisión.
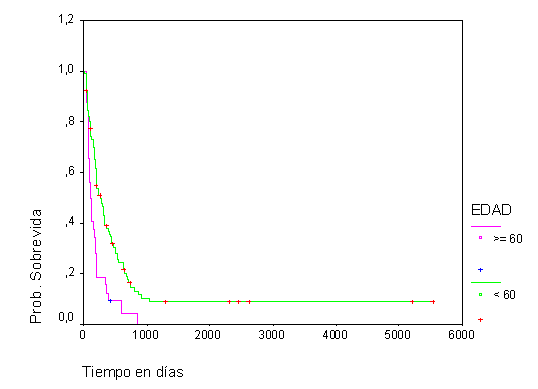
La SG de los pacientes con LMA no M3, menores de 60 años, resultó del 38,1 % y del 8,9 % al año y a los 5 años respectivamente, mientras que para los mayores de 60 años fue del 12,5 % al año, sin apreciarse sobrevivientes a los 3 años de enfermedad (fig.1). La SLE en general obtenida fue del 30,6 % al año y del 16,2 % a los 5 años para los pacientes con este tipo de LMA (fig. 2).
Fig.1 Sobrevida global según edad en LMA no M3
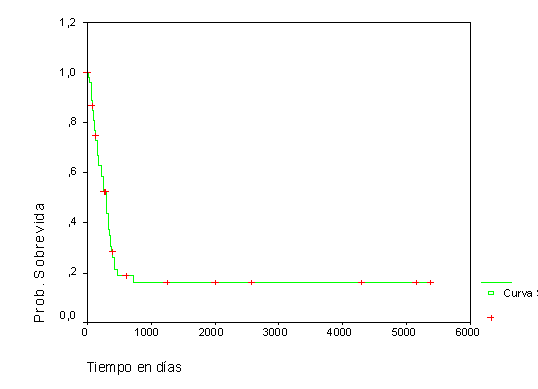
Fig. 2. Sobrevida libre de complicaciones en LMA no M3
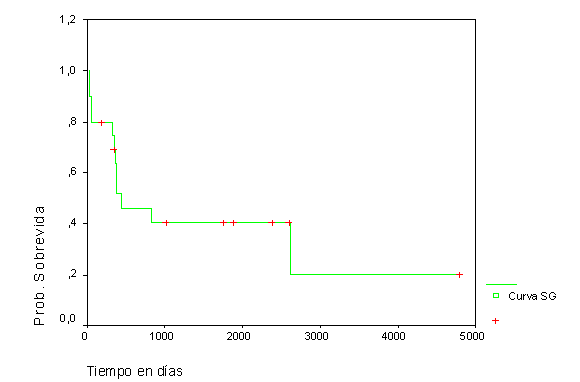
En los casos con LMA tipo M3 la SG observada fue del 57,7 % y del 40,4 % al año y a los 5 años, respectivamente (fig. 3), mientras que la SLE resultó del 71,1 % y del 62,2 % para los anteriores intervalos de tiempo (fig. 4).
Fig. 3. Sobrevida global en LMA-M3

Fig. 4. Sobrevida libre de complicaciones en LMA-M3.
En relación con el estatus del paciente al momento de su muerte, en 71 casos (42,2 %) estos se encontraban con una enfermedad refractaria a tratamiento, 50 (29,7 %) fallecieron durante la inducción, 43 (25,5 %) estando en recaída y 4 (2,0 %) estando en RC.
Discusión
Las LMA representan un grupo de enfermedades cuyo comportamiento clínico, epidemiológico y terapéutico son de necesario conocimiento, para poder definir la más acertada de las estrategias posibles, y que en el orden práctico intenten mejorar los resultados históricos obtenidos en la atención de estas serias entidades.
En la actual serie se apreció un predominio muy ligero en la incidencia de casos del sexo femenino (relación F:M de 1:1,09), aunque en general lo comunicado hasta el momento favorece discretamente la incidencia en el sexo masculino.1-3,16
En la muestra analizada, la mayoría de los pacientes resultaron ser de color de piel blanca (76,6 %). Estudios anteriores han sugerido un comportamiento similar en cuanto a la afectación de pacientes de origen europeo y africano.1,17
Tanto el promedio de edad de los afectados (42,7 años), como la proporción de entre los mayores de 60 años (20,2 %) son inferiores a lo señalado en la literatura; Haferlach, en Alemania, obtuvo en un estudio con 614 pacientes un promedio de 53 años.16 En general, se reporta que esta enfermedad es más frecuente en los pacientes mayores de 60 años.1-3,18 Lo observado en el presente trabajo, puede estar relacionado con el hecho de que hacia nuestro centro, por ser de referencia en el tratamiento intensivo de las LMA, se remitan solo casos con criterio de este tipo de terapéutica, que son por regla general, pacientes no pertenecientes a la tercera edad.
En relación con los subtipos FAB más frecuentes, se encontró el predominio de los subtipos M2 y M1 (con el 23,3 y 20,2 %, respectivamente) lo que coincide con lo observado por otros estudios.1,16 No obstante, se apreció que el subtipo M3 se hallaba en tercer lugar en el orden de frecuencia (17 % de incidencia), superior al 10 % habitualmente señalado hasta ahora,19,20 pero que en este caso debe corresponderse con la remisión sostenida a nuestro hospital, de los pacientes con este diagnóstico para tratamiento centralizado, además del conocido incremento de la incidencia de esta enfermedad entre las personas de origen latino.21,22
El 7,7 % de los pacientes afectados padecía de una LMA secundaria, lo que resulta bajo según lo comunicado, que plantea un comportamiento de aproximadamente 15 %.23,24 Este tipo de leucemia es más frecuente entre los pacientes ancianos,1 cuya incidencia en la presente serie también es baja según ya vimos, lo que podría explicar el disminuido número de pacientes con LMA secundaria.
Al analizar las tasas de RC, SG y SLE, es necesario recordar que es difícil establecer las comparaciones debidas con respecto a lo observado por otros investigadores, ya que los estudios realizados por lo general son heterogéneos en cuanto a la uniformidad de la muestra estudiada y a los esquemas terapéuticos aplicados tanto de inducción como de consolidación.
Entre los casos con LMA no M3, los índices de RC obtenidos (45,5 y 60,4 %, al considerar a afectados de todas las edades y a aquellos menores de 60 años, respectivamente) resultan aceptables, si se tiene en cuenta que el primero comprende a todos los pacientes ancianos, en los que se reportan, aun con esquemas modernos de tratamiento, bajos porcentajes de RC 25,26 en tanto para los menores de 60 años, lo observado por otros grupos de trabajo oscila entre 60 y hasta 80 % de RC, intervalo de variación determinado por el tipo de esquema de inducción elegido y las características propias de la cohorte de pacientes estudiados.27,28
En cuanto a los enfermos con LMA subtipo M3 , la RC alcanzada fue del 75 %, similar a la señalada en otros estudios,29 si bien los esquemas de inducción más recientes, elevan estos resultados hasta un 80-95 % cuando se combina el ácido todo-trans retinoico (ATRA) con las antraciclinas.30
Los resultados observados en cuanto a SG, entre los pacientes con LMA no M3 y para ambos grupos de edades, son similares a lo señalado en la literatura médica,1 que comunica por ejemplo, solo un 10 % de SG a los 5 años para los menores de 60 años; otros autores refieren hasta un 17 % de SG para igual intervalo de tiempo en este grupo de edad,31 superior al 8,9 % aquí obtenido. Se reafirma también en el actual estudio, el mal pronóstico que en general confiere a la evolución de la enfermedad el aparecer a edades avanzadas,13,14,32 al no constatarse en el presente estudio sobrevivientes, luego de 3 años de seguimiento. En cuanto a la SLE (16,2 % a los 5 años), esta resulta algo menor a la comunicada en otros estudios (24 % a los 6 años).33 Es necesario tener presente que estos resultados son los obtenidos a lo largo de 20 a ñ os de trabajo, durante los cuales, y en especial en la última década, los tratamientos de soporte para los períodos de aplasia posquimioterapia y las pautas de consolidación posinducción han mejorado, lo que puede influir en que los resultados aquí mostrados sean superados por estudios en cohortes de pacientes más recientes.
En cuanto a la SG observada entre los pacientes con LMA-M3 (57,7 y 40,4 % al año y 5 años, respectivamente), representa un resultado discreto en comparación con los que se reportan más recientemente, si bien es necesario tener en cuenta el empleo por ellos, de las más modernas pautas de tratamiento, con la introducción en la inducción de la combinación de antraciclinas + ATRA, y la administración de ATRA durante las fases de consolidación y mantenimiento. Un ejemplo de ello lo constituyen los resultados ofrecidos por el grupo español PETHEMA (Programa de Estudio y Tratamiento de las Hemopatías Malignas),34 donde obtienen hasta un 85 % de SG a los 3 años de seguimiento. Situación similar se aprecia al realizar dicho paralelismo en relación con la SLE. En la presente serie se obtuvo 71,1 y 62,2 % para el año y 5 años, respectivamente, en tanto Sanz y otros34 observaron en su estudio hasta un 90 % en 3 años de seguimiento. Otros investigadores comunican resultados de SLE a los 5 años, en un rango que va desde el 16 y hasta un 85 %, de acuerdo con el esquema terapéutico que se emplee.35,36
El estatus de los pacientes al momento de su fallecimiento fue otro de los aspectos evaluados. Estudios anteriores37 señalan que aproximadamente un 66 % de estos casos se deben a recaídas y a la refractariedad al tratamiento, muy similar a lo mostrado en el actual estudio (67,7 %). En lo referente a las muertes en inducción, el 29,7 % aquí obtenido es superior al 17 % que comunican otros autores,37 y que lo relacionamos por la inclusión de los pacientes tratados en la década de los años 80, que no se beneficiaron de las mejorías en los tratamientos de soporte (antibioticoterapia más efectiva, uso de factores de crecimiento, etc.) que sobrevinieron posteriormente y que elevaron las expectativas de vida del paciente aplasiado posquimioterapia. Las muertes en RC fueron similares a las reportadas en igual estudio.37
La presentación, evolución y atención de las LMA continúa siendo una temática compleja dentro del campo de las hemopatías malignas. La experiencia mostrada en el presente estudio, confirma los pobres resultados que en general se obtienen en el resto de los centros, con excepción de la LMA-M3, al emplear solo la poliquimioterapia como arma terapéutica.
Agradecimientos
Los autores agradecen a la Dra. Ángela R. Gutiérrez Rojas, especialista de II Grado en Bioestadísticas del Departamento de Investigaciones y Proyectos, su colaboración en la realización de este trabajo.
Summary
Acute myeloid leukaemia (AML) represents 80% of the total number of acute leukemia affecting human beings and its prognosis remains very unfavourable. This paper was aimed at showing the experience accrued by the hospital in the presentation and treatment of this disease with the use of chemotherapy. The results achieved in the treatment of 193 cases diagnosed with AML and treated at the Hematology Service for 20 years were analyzed. Average age of patients was 42.7 years and the most frequent FAB subtype was M2. Non M3 AML cases showed a complete remission index of 45.5% for all the age groups and of 60.4% for under 60 year-olds. The global survival rate was 8.9% after 5 years of follow-up for patients under 60 years, without survivors for the same length of time in the over 60 years-old group. Complication-free survival was 16.2% in general at 5 years of follow-up. The patients with M3 AML had a complete remission index of 75%. Global survival and complication-free survival at 5 years were 40.4% and 62.2% respectively. The 67.7% of cases died from a disease resistant to treatment or from a relapse.
Key words: Acute myeloid leukaemia, complete remission, global survival rate, complication-free survival rate
Referencias bibliográficas
1. Lichtman MA, Liesveld JL. Leucemia mielógena aguda. En: Beutler E, Lichtman MA, Coller BS. Hematología, Williams. 6a ed. Madrid:Marbán Libros, S.L; 2005.p.1047-83.
2. Xie Y, Davies S, Xiang Y.Trends in leukemia incidence and survival in the United States(1973-1998).Cancer. 2003;97:2229.
3. Jemal A, Murray T, Samuels A. Cancer statistics,2003.CA Cancer J Clin. 2003;53:5.
4. Bennett JM, Catovsky D, Daniel MT. Proposed revised criteria for the classification of acute myeloid leucemia. A report of the French-American-British Cooperative Group. Ann Intern Med. 1985;103:620.
5. Vardiman JW, Harris NL, Brunning RD. The World Health Organization (WHO) classification of the myeloid neoplasms. Blood. 2002;100:2292.
6. Mano H. Stratification of Acute Myeloid Leukemia Based on Gene Expression Profiles. Int J Hematol. 2004;80:389.
7. Kohlmann A, Schoch C, Schnittger S. Molecular characterization of acute leukemias by use of microarray technology. Genes Chromosomes Cancer. 2003;37:396.
8. Ferrara F. Unanswered questions in acute myeloid leukaemia. Lancet Oncol. 2004;5:443.
9. Fozza C, Bellizzi S, Bonfigli S. Cytogenetic and hematological spontaneous remission in a case of acute myelogenous leukemia. Eur J Haematol. 2004; 73:1.
10. Estey EH. Prognostic factors in acute myeloid leukemia. Leukemia. 2001;15:670.
11. Lowemberg B. Prognostic factors in acute myeloid leukemia. Best Pract Res Clin Haematol. 2001;14:65.
12. Schiffer CA, Dodge R, Larson RA. Long-term follow-up of Cancer and Leukemia Group B studies in acute myeloid leukemia. Cancer. 1997;80:2210.
13. Stone RM. The difficult problem of acute myeloid leukemia in the older adult. Cancer J Clin. 2002;52:363.
14. Menzin J, Lang K, Earle CC. The outcomes and costs of acute myeloid leucemia among the elderly. Arch Intern Med. 2002;162:1597.
15. Kaplan EL, Meier P. Non-parametric estimations from incomplete observations. J Am Stat Assoc.1958 ;53:457.
16. Haferlach T, Schoch C, Loffler H. Morphology dysplasia in de novo acute myeloid leukemia (AML) is related to unfavorable cytogenetics but has no independent prognostic relevance under the conditions of intensive induction therapy: results of a multiparameter analysis from the German AML Cooperative Group Studies. J Clin Oncol. 2003;21:256.
17. Sekeres MA, Peterson B, Dodge RK. Differences in prognostic factors and outcomes in African Americans and whites with acute myeloid leukemia. Blood.2004;103:4036.
18. Brincker H. Estimate of overall treatment results in acuie nonlymphocytic leukemia based on age-especific rates of incidence and complete remission. Cancer Treat Rep. 1985;69:5.
19. LoCoco F, Nervi C, Avvisati G. Acute promyelocytic leukemia: a curable disease. Leukemia. 1998;12:1866.
20. Grignani F, Fagioli M, Alcalay M. Acute promyelocytic leukemia from genetics to treatment. Blood. 1994;83:10.
21. Dover BD, Preston-Martin S, Chang E. High frecuency of acute promyelocytic leukemia among latinos with acute myeloid leukemias. Blood. 1996;87:308.
22. Otero JC, Santillana S, Fereyros G. High frecuency of acute promyelocytic leukemia among latinos with acute myeloid leukemias. Blood.1996;88:377.
23. Smith MA, McCaffrey RP, Karp JE. The secondary leukemias: challenges and research directions. J Natl Cancer Inst. 1996;88:407.
24. Smith MA, Rubinstein L, Anderson JR. Secondary leukemias or myelodysplastic syndrome after treatment with epipodophyllotoxins. J Clin Oncol.1999;17:569.
25. Ferrara F, Annunziata M, Copia C. Therapeutic options and treatment results for patients over 75 years of age with acute myeloid leukemia. Haematologica. 1998;83:126.
26. Vey N, Coso D, Bardau VJ. The benefit of induction chemotherapy in patients age> or = 75 years. Cancer. 2004;101:325.
27. Stone RM, Mayer RJ. Treatment of the newly diagnosed adult with the novo acute myeloid leukemia. Hematol Oncol Clin North Am. 1993;7:47.
28. Bishop JF. The treatment of adult acute myeloid leukemia. Semin Oncol. 1997;24:57.
29. Tallman MS, Andersen JW, Schiffer CA. All-trans-retinoic acid induction in acute promyelocytic leukemia. N Engl J Med. 1997;70:496.
30. Asou N, Adachi K, Tamura J. Analysis of prognostic factors in newly diagnosed acute promyelocytic leukemia treated with all-trans-retinoic acid and chemotherapy. Japan Adult Leukemia Study Group. J Clin Oncol. 1998;16:78.
31. Beguin Y, Sautois B, Forget P. Long term follow-up of patients with acute myelogenous leukemia who received the daunorubicin, vincristine, and cytosine arabinoside regimen. Cancer. 1997;79(7):1351.
32. Letendre L, Noel P, Litzow MR. Treatment of acute myelogenous leukemia in the older patient with attenuated high-dose ara-C. Am J Clin Oncol. 1998; 21:142.
33. Harousseau JL, Pignon B, Witz F. Treatment of acute myeloblastic leukemia in adults. The GOELAM experience. Hematol Cell Ther. 1996;38(5):381.
34. Sanz MA, Martin G, Gonzalez M. Risk-adapted treatment of acute promyelocytic leukemia with all-trans-retinoic acid and anthracycline monochemotherapy: a multicenter study by the PETHEMA group. Blood. 2004;103(4):1237.
35. Tallmann MS. Curative therapeutic approaches to APL. Ann Hematol. 2004;83 Suppl 1:S81.
36. Tallmann MS, Andersen JW, Schiffer CA. All-trans retinoic acid in acute promyelocytic leukemia: long-term outcome and prognostic factor analysis from the North American Intergroup protocol. Blood. 2002;100:4298.
37. Matthews JP, Bishop JF, Young GA. Patterns of failure with increasing intensification of induction chemotherapy for acute myeloid leukemia. Br J Haematol. 2001;113:727.
Recibido: 6 de enero de 2006. Aprobado: 16 de marzo de 2006.
Dr. Calixto Hernández Cruz. Hospital Clinicoquirúrgico Hermanos Ameijeiras. Servicio de Hematología, San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, Ciudad de La Habana, Cuba.
1Especialista de I Grado en Hematología.
2Especialista de II Grado en Hematología.