Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.47 n.3 Ciudad de la Habana jul.-sep. 2008
TRABAJOS ORIGINALES
Factor reumatoide: asociación con la erosión radiológica y actividad de la artritis reumatoide
Rheumatoid factor: association with the radiological erosion and with the rheumatoid arthritis activity
Elena KokuinaI; Araceli ChicoII; Liuber CarballarIII; Ángela GutiérrezIV; Jossanne SotoV; Miguel EstévezII; Dionisio PérezII
IEspecialista de II Grado en Inmunología Clínica. Profesora Auxiliar. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
IIEspecialista de II Grado en Reumatología. Profesora Auxiliar. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
IIIEspecialista de I Grado en Reumatología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
IVEspecialista de II Grado en Bioestadística. Profesora Auxiliar. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
VEspecialista de I Grado en Laboratorio Clínico. Profesora Asistente. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
OBJETIVO: Definir la relación del factor reumatoide (FR) con la erosión articular radiológica, la actividad de la enfermedad y la discapacidad funcional de la artritis reumatoide (AR).
MÉTODOS: Se realizó un estudio transversal con 209 pacientes con AR establecida, de estos, 74 con AR de corta evolución (= 2 años). Se evaluaron los indicadores siguientes: FR por aglutinación del látex (FR-A), FR por inmunoturbidimetría automatizada (FR-T), velocidad de eritrosedimentación (VSG), proteína C reactiva (PCR), índice de actividad de la enfermedad (Disease Activity Score 28, DAS28), índice de discapacidad funcional (Health Assessment Questionnaire score, HAQ) y la presencia de erosiones radiológicas.
RESULTADOS: El 77 % de los pacientes positivos de FR-A y el 73 % de los positivos para el FR-T presentaron erosiones radiológicas, opuestamente al 38 % de los negativos para el FR-A (p<0,001) y al 14 % de los negativos para el FR-T (p<0,001). Las cifras medias del FR-A de los pacientes según los 4 grados de afectación articular (máximo: > 6 articulaciones erosionadas; mínimo: 0 erosión, < 6 articulaciones inflamadas) fueron de: 484; 162; 57 y 17 UI/mL (p<0,001); y las del FR-T de: 277; 185; 22 y 33 UI/mL (p<0,01). El valor predictivo positivo (VPP) para la erosión del FR-A >512 UI/mL fue de 92 % y el del FR-T >97 UI/mL fue de 96 %. Los valores medios del DAS28 en los pacientes positivos de FR-A y FR-T fueron de 5,04 y 4,94, respectivamente, mientras que, en los negativos fueron de 4,26 y 3,97 (p<0,001 para ambos); y los del HAQ de 1,31 y 1,29 en los positivos de FR-A y FR-T, respectivamente, mientras que en los negativos de 0,99 y 0,89 (p<0,01 para ambos). Se encontró correlación entre las cifras del FR por ambos métodos y las de VSG, PCR, DAS28 y HAQ (p<0,05 o p<0,01).
CONCLUSIONES: Niveles altos del FR se corresponden con un grado mayor de inflamación y destrucción articular en la AR.
Palabras clave: Factor reumatoide, artritis reumatoide, erosión radiológica, DAS28, HAQ, PCR, VSG.
ABSTRACT
OBJECTIVE: to define the relation of the rheumatoid factor with the radiological articular erosion, the activity of the disease and the functional disability of rheumatoid artritis (RA).
MÉTHODS: A cross-sectional study was conducted among 209 patients with RA. Of them, 74 with RA of short evolution (= 2 years). The following indicators were evaluated: RhF by latex agglutination (RhF-A), RhF by automated immunoturbidimetry (RhF-T), erythrocyte sedimentation rate (ESR), C-reactive protein (CRP), Disease Activity Score 28 (DAS 28), functional disability index (Health Assessment Questionnaire score, HAQ), and the presence of radiological erosions.
RESULTS: 77 % of the RhF-A positive patients and 73 % of the RhF-T positive patients presented radiological erosions in contrast with 38 % of the RhF-A negative patients (p<0.001) and with 14 % of the RhF-T negative cases (p<0.001). The mean RhF-A figures of the patients according to the 4 grades of articular affectation (maximum: > 6 eroded articulations; minimum: 0 erosion; < 6 swollen articulations) were 484, 162, 57 and 17 UI/mL (p<0.001), whereas those of RhF-T were 277, 185, 22 and 33 UI/mL (p<0,01). The positive predictive value (PPV) for the erosion of RhF-A >512 UI/mL was 92 %, and that of RhF-T >97 UI/mL was 96 %. The mean values of DAS28 in the RhF-A and RhF-T positive patients were 5.04 and 4.94, respectively. In the negative, these values were 4.26 and 3.97 (p<0.001 for both). The HAQ values were 1.31 and 1.29 in the RhF-A and RhF-T positive patients, respectively, while in the negative they were 0.99 and 0.89 (p<0.01 for both). Correlation was found between the RhF figures by both methods and those of ESR, CRP, DAS28 and HAQ (p<0.05 or p<0.01).
CONCLUSIONS: High levels of RhF correspond with a higher degree of inflammation and articular destruction in the rheumatoid arthritis.
Key words: Rheumatoid factor, rheumatoid arthritis, radiological erosion, DAS28, HAQ, CRP, ESR.
INTRODUCCIÓN
La artritis reumatoide (AR) es la artritis inflamatoria más frecuente del adulto. Su naturaleza es autoinmune y su principal mecanismo fisiopatológico consiste en la propensión de erosionar y, por tanto, destruir las estructuras óseas. Aún así, la AR es una enfermedad heterogénea y la evolución de la lesión articular es altamente impredecible y variable de paciente a paciente, desde una forma autolimitada hasta otra de destrucción rápida y progresiva la cual provoca discapacidad funcional a casi la mitad de los pacientes después de 10 años de evolución.1 Por tanto, una vez establecido el diagnóstico de AR, urge identificar los pacientes de peor pronóstico para implementar tempranamente tratamientos agresivos encaminados a minimizar la destrucción ósea.2
La característica inmunológica de la AR es la presencia de diferentes autoanticuerpos tanto en el líquido sinovial como en el suero de los pacientes. La determinación sérica de los autoanticuerpos antiinmunoglobulina IgG designados, como el factor reumatoide (FR), ha constituido una herramienta básica en el diagnóstico de la AR por más de 60 años.3 El FR ha sido señalado además como marcador de peor pronóstico porque se ha asociado a mayor frecuencia de erosiones y forma clínica más grave en los pacientes con AR.4-7 Sin embargo, este valor predictivo potencial del FR no ha sido universalmente reproducido, así como tampoco ha sido definido el lugar que le corresponde en la atención clínica de los pacientes con AR.8-11
Un aparente escollo en la estimación del valor pronóstico del FR es la aplicación de diferentes métodos para su determinación. En Cuba, y en nuestro laboratorio clínico en particular, el FR se ha determinado tradicionalmente mediante la fijación o aglutinación de látex (FR-A)12 y, más recientemente, ha sido introducido el método inmunoturbidimétrico automatizado (FR-T),13 ambos detectan el FR clase IgM (IgM).
El estudio actual se diseñó con el objetivo de examinar la posible asociación del FR (IgM) determinado por aglutinación del látex y por inmunoturbidimetría con las lesiones articulares erosivas, los indicadores clínicos de actividad de la enfermedad y de discapacidad funcional en pacientes con AR.
MÉTODOS
Se realizó un estudio transversal en el cual se incluyeron 209 pacientes consecutivos y no seleccionados con diagnóstico definitivo de AR atendidos en la consulta ambulatoria del Servicio de Reumatología del Hospital Clinicoquirúrgico "Hermanos Ameijeiras" desde noviembre del 2005 hasta noviembre del 2007. El diagnóstico de la AR fue establecido por el cumplimiento de un mínimo de 4 de los criterios de ACR para la clasificación de esta enfermedad.14 Se recogió el consentimiento informado de todos los pacientes, se obtuvieron muestras de sangre, y se aplicó un detallado cuestionario y examen físico para estudiar los datos demográficos y clínicos. El tiempo de evolución fue considerado a partir de la fecha del diagnóstico definitivo de AR; si este era = 2 años se consideró como AR temprana o de corta evolución; mientras que si era > 2 años se consideró como AR de larga evolución. La raza se clasificó en caucásica y no caucásica según rasgos y color de piel. Se consideró como antecedentes familiares de AR la presencia de esta enfermedad en padres, hermanos, hijos y tíos. Las articulaciones inflamadas fueron contadas según su número en la escala de 0-1. La deformidad articular se consideró de forma cualitativa como presencia o ausencia de mala alineación no corregible de la articulación (ambos indicadores fueron evaluados al menos por un especialista en reumatología [ACC]). Se calculó el indicador DAS28 (The 28 Joint Count Disease Activity Score) para medir la actividad de la AR.15 La discapacidad funcional fue evaluada mediante el cálculo del Stanford Health Assessment Questionnaire (HAQ) en la escala de 0-3 puntos.16 La evaluación de la intensidad del dolor, la evaluación del estado global de la enfermedad por el paciente, y por el médico fueron valoradas en la escala analógica visual (EVA) de 0-10 puntos.17 Se consideró el tratamiento médico y quirúrgico (sinovectomía). Se realizaron radiografías de manos, muñecas, pies y articulaciones con síntomas clínicos en todos los pacientes cuyos estudios radiográficos tenían más de 1 año de antigüedad, los cuales fueron interpretados por un especialista en radiología y otro en reumatología (ACC). Se consideraron como erosiones articulares las lesiones quísticas subcondrales con estrechamiento del espacio articular y estas fueron contadas según su número en la escala de 0-1. Se determinó la velocidad de eritrosedimentación globular (VSG) por el método de Westergren y la proteína C reactiva (PCR) por el de inmunoturbidimetría automatizada.
Determinación del FR
Las muestras de suero fueron testadas para las determinaciones del FR (IgM) por el método semicuantitativo de aglutinación de partículas de látex (FR-A) (Futura System, Italy) y el método inmunoturbidimétrico automatizado cuantitativo (FR-T, Tina-quant RF II, sistema Roche/Hitachi MODULAR-P, Japan). Se consideraron como positivos títulos = 8 UI/mL de FR-A y valores = 14 UI/mL de FR-T, sobre la base de la recomendación del fabricante y el control de calidad interno. El status (estado) del FR fue definido en 2 categorías: positivo persistente y en aumento (PP), y negativo persistente y en disminución (NP) sobre la base de los resultados anteriores como mínimo de 1 año del FR registrados en la historia clínica.
Análisis estadístico
El análisis estadístico se realizó con el paquete estadístico SPSS v 11.5. Los valores de p calculados fueron resultado de pruebas bilaterales. Se consideró significativo el valor de p = 0,05. El análisis de la asociación del FR-A, FR-T, y del status de FR con las lesiones erosivas articulares fue realizado en pacientes con AR de evolución = 2 años. El análisis de la asociación del FR-A y FR-T con los indicadores clínicos y serológicos de la actividad de la enfermedad y de discapacidad fue realizado en pacientes con AR sin considerar evolución. Para la variable cuantitativa FR-T se construyó la curva COR (del inglés: receiver-operating characteristics curve, ROC) para el cálculo del valor de mayor exactitud (suma de sensibilidad y especificidad) para el diagnóstico de erosión.18 Fue calculada el área bajo la curva, valor que indica la probabilidad de que un paciente con erosiones articulares, seleccionado al azar, tenga cifras más elevadas de FR-T que uno sin erosiones; un valor de 0,5 indica ninguna discriminación y un valor de 1 indica discriminación perfecta. La asociación entre las variables cualitativas fue probada con la prueba de X2, y entre las variables cuantitativas con la prueba t de Student. Para examinar la correlación entre las variables cuantitativas se aplicó el test de correlación de Pearson. La comparación entre los diferentes grupos de afectación articular y de resultados del FR por ambos métodos se realizó mediante el análisis de varianza de un factor (ANOVA).
RESULTADOS
Características de la población de estudio
Fueron incluidos en el estudio 209 pacientes; 74 de ellos con evolución de AR menor o igual a 2 años. La tabla 1 resume los datos demográficos y clínicos de los pacientes clasificados según el tiempo de evolución de AR. Las características demográficas mostraron una distribución similar entre los 2 grupos de evolución, salvo que la proporción de mujeres resultó aún mayor en los pacientes de evolución más larga. La AR resultó de moderada actividad en ambos grupos según las cifras del DAS, VSG y PCR. El grupo de evolución mayor de 2 años presentó una proporción mayor de pacientes con FR, con erosiones y con discapacidad funcional (cifras superiores de HAQ y mayor proporción de pacientes con deformidad articular). El FR-T resultó más sensible para el diagnóstico de AR tanto de corta como de larga evolución.
Asociación del FR con las lesiones erosivas articulares
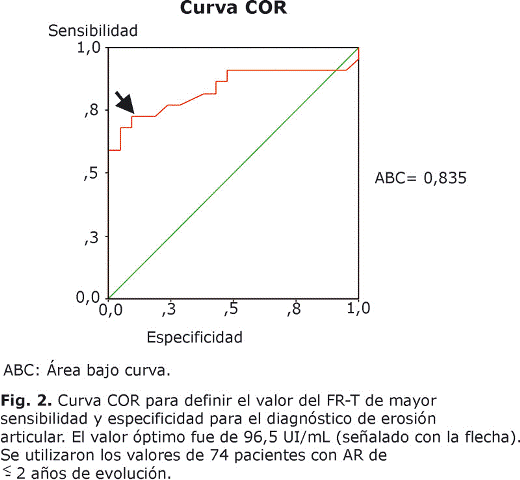
En nuestro cohorte, tanto el FR-A como el FR-T se asociaron a la presencia de erosiones articulares radiográficas con mayor fuerza que la VSG y la PCR. En el grupo de AR temprana, la proporción de pacientes con erosiones en los seropositivos para el FR-A y FR-T (68 %, 30/44; y 63 %, 31/49, respectivamente) fue significativamente superior que en los negativos de FR-A y FR-T (13 %, 4/30; y 12 %, 3/25, respectivamente) (p< 0,001 para ambos); diferencias que se repiten si analizamos el total de los pacientes sin considerar evolución: 77 % (103/133) y 73 % (127/174) en los positivos para FR-A y FR-T, respectivamente, y 38 % (29/76) y 14 % (5/35) en los seronegativos para FR-A y FR-T, respectivamente (p< 0,001 para ambos). En pacientes de AR temprana con erosiones las cifras medias de FR-A y FR-T fueron de 333 y 222 UI/mL; y en pacientes sin erosiones de 27 y 28 UI/mL, respectivamente (p < 0,001 para ambos); mientras que las de VSG de 54 y 33 mm/h (p= 0,003); y de PCR de 28 y 13 mg/L, respectivamente (p = 0,03). La figura 1 representa los valores de estos 4 indicadores en los pacientes clasificados en 4 grupos clínicos según el número de articulaciones erosionadas o inflamadas (= 6 o <6). Las cifras del FR-A, del FR-T y de VSG disminuyeron proporcionalmente al grado de afectación articular. El status PP del FR se asoció también con la presencia de erosiones, el 67 % (20/30) de los pacientes PP de AR temprana tenían erosiones, mientras solo el 15 % (4/26) de los PN (p<0,001). Se obtuvo una curva ROC para el FR-T efectiva para el diagnóstico de erosión por mostrar un área bajo la curva equivalente a 0,835 que permitió calcular la cifra de mayor valor diagnóstico para la erosión articular de la AR, la cual se correspondió con 96,5 UI/mL (fig. 2) y, consecuentemente, los valores superiores a 97 UI/mL se consideraron como valores de "título alto" de FR-T. La sensibilidad de 96,5 UI/mL del FR-T para el diagnóstico de erosión articular fue de 74 % y la especificidad de 98 %. Consideramos como títulos altos de FR-A los = 512 UI/mL, por ser muy superiores a los normales (< 8 UI/mL), los cuales se correspondieron con una sensibilidad de 32 % (11/34) y una especificidad de 98 % (39/40) para las erosiones. Títulos de FR-A = 512 UI/mL y de FR-T = 97 UI/mL se asociaron con valores predictivos positivos (VPP) altos para la erosión articular, mientras que el VPP del status PP de FR para desarrollar enfermedad erosiva articular resultó subóptimo (tabla 2).
Asociación del FR con la actividad y la discapacidad funcional de la AR
Tanto el FR-A, como el FR-T mostraron correlación con la mayoría de los indicadores clínicos y serológicos de actividad de la AR, así como con el indicador de discapacidad funcional asociada a la enfermedad, que es el HAQ (tabla 3). Las correlaciones más notables del FR-A fueron con la VSG, el DAS y la evaluación del estado global de la enfermedad por el médico; mientras que las del FR-T fueron con la PCR y el HAQ. Las correlaciones encontradas explican la diferencia en los valores medios de estos indicadores clínicos en los pacientes con resultados positivos y negativos de FR-A y FR-T (tabla 4). La proporción de pacientes con deformidad articular resultó superior en los pacientes con resultados positivos de FR respecto a los negativos: 87/134 (65 %) vs. 25/75 (33 %) (p<0,01) para el FR-A; y 99/165 (60 %) vs. 9/44 (21 %) (p<0,05) para FR-T (tabla 3), así como la proporción de pacientes con deformidad resultó superior en los pacientes con status PP de FR respecto a la del PN (67 % (66/99) vs. 28 % (20/71), p<0,001).
Tabla 4. Indicadores clínicos de actividad y de capacidad funcional de la artritis reumatoide en pacientes con resultados positivos y negativos
de factor reumatoide (n=209)
| Indicadores clínicos |
| Negativo
| Positivo
| Negativo
|
| EVA dolor, 1-10 ptos (cifras medias) | 5,8*
| 4,9
| 5,8 | 5,4
|
| EGP, 1-10 ptos (cifras medias) | 5,7* | 4,8
| 5,4
| 5,1
|
| EGM 1-10 ptos (Cifras medias) | 5,2***
| 3,9 | 4,8**
| 3,8
|
| DAS28 (cifras medias) | 5,039***
| 4,256
| 4,944***
| 3,966
|
| HAQ, 0 - 3 ptos (cifras medias) | 1,308**
| 0,990
| 1,294**
| 0,891
|
| VSG (mm/h) (cifras medias) | 46**
| 36
| 43***
| 26
|
| PCR(mg/L) (cifras medias) | 20
| 13
| 21**
| 8 |
| Deformidad articular (% pacientes) | 65** | 33 | 60* | 21 |
FR-A: Factor reumatoide por aglutinación del látex. FR-T: Factor reumatoide por inmunoturbidimetría. EVA dolor: Evaluación de la intensidad del dolor. EGP: Evaluación del estado global de la enfermedad por el paciente. EGM: Evaluación del estado global de la enfermedad por el médico. DAS 28: Indicador clínico de actividad de AR. HAQ: Indicador de discapacidad funcional. VSG: Velocidad de sedimentación globular. PCR: Proteína C reactiva.
*** p<0.001(bilateral).
** p<0.01 (bilateral).
* p<0.05 (bilateral).
DISCUSIÓN
La AR puede ser considerada como una emergencia médica por la importancia de identificar tempranamente los pacientes con enfermedad erosiva irreversible e instaurar terapias agresivas dirigidas a prevenir o detener las lesiones. En este trabajo hemos demostrado que la presencia del FR (IgM) distingue a los pacientes de AR con erosiones radiográficas, con una enfermedad más activa y de mayor discapacidad funcional.
La predicción de la enfermedad erosiva de la AR es difícil, críticamente importante, y requiere de estudio continuado. Consistente con la literatura y con nuestros datos (tabla 1), es un hecho que las lesiones erosivas ya aparecen en los 2 primeros años de la enfermedad,19 por lo que se hace necesario identificar los factores pronósticos presentes al inicio. Además de algunas características clínicas, epidemiológicas, socioeconómicas y de salubridad,20 varios estudios señalan que los niveles elevados de la VSG y la PCR se correlacionan fuertemente con un curso menos favorable.21,22 Entre los autoanticuerpos, el FR (IgM) ha sido el más extensamente estudiado, y son numerosas las investigaciones tanto transversales, como longitudinales que se han llevado a cabo con vistas a evaluar el significado pronóstico del FR en la AR temprana, y han permitido atribuirle un papel predictor de enfermedad erosiva.5,6,23-27 En varios de estos se ha demostrado la superioridad predictiva del FR (IgM) respesto a su rival más cercano que son los anticuerpos antipéptido citrulinado (anti-CCP).6,24,28 Nuestro estudio transversal señala una clara asociación entre el FR (IgM) determinado por aglutinación y por inmunoturbidimetría con las lesiones erosivas en pacientes con AR temprana, de menos de 2 años de evolución. La proporción de pacientes con erosiones en los seropositivos de FR por ambos métodos fue muy superior a la de los pacientes seronegativos. La asociación del FR con las erosiones resultó más fuerte que la de la VSG y la PCR, si tomamos en consideración que las diferencias entre las cifras medias de estos indicadores en pacientes con erosiones y sin ellas fueron superiores para el FR-A y FR-T respecto a las de la VSG y la PCR. El FR (IgM) no solamente se asoció a la presencia de erosiones, sino además permitió separar a los pacientes de AR temprana según el grado de inflamación y destrucción articular pues las cifras medias de FR-A y FR-T descendieron proporcionalmente al grado de afectación articular considerando los pacientes con más de 6 erosiones, con menos de 6, sin erosiones pero con más de 6 articulaciones inflamadas y con menos de ese número (fig. 1). Es interesante tener en cuenta que la asociación entre el FR y erosiones resultó tan fuerte en los pacientes de AR temprana, a pesar de seguir las recomendaciones de intervenciones terapéuticas intensivas basadas en metotrexate en dosis altas y esteroides en dosis bajas para los pacientes de AR temprana para detener la enfermedad,29 las cuales han sido aplicadas en la mayoría de nuestros pacientes (tabla 1).
El elevado valor predictivo de los títulos altos de FR-A y de FR-T indicó que éstos se asociaron a un riesgo elevado de desarrollar lesiones erosivas en los pacientes con AR temprana. Cifras = 97 UI/mL de FR-T presentaron gran utilidad diagnóstica de erosión por su excelente sensibilidad y especificidad. La especificidad de los títulos altos de FR (IgM) para las erosiones en AR ha sido reconocida por otros autores y ha permitido la elaboración de algoritmos para identificar pacientes con riesgo de desarrollar enfermedad erosiva articular.23,27
La asociación encontrada del FR (IgM) con las erosiones en la AR temprana se cumplió también para los pacientes con AR sin considerar el tiempo de evolución. En nuestra población de AR la presencia del FR (IgM), así como el status PP del FR se asociaron además con la deformidad articular. La asociación del FR (IgM) con la gravedad de las erosiones y la deformidad articular en AR de larga evolución ha sido revelada en otros estudios, algunos de los cuales la consideraron equivalente o aún más fuerte que la de los otros autoanticuerpos como anti-CCP y FR (IgA).4,30-33
El FR (IgM) por ambos métodos empleados mostró correlación significativa con los indicadores clínicos y serológicos de actividad y discapacidad funcional de la AR en nuestros pacientes, lo que explica las cifras más elevadas de estos indicadores en los pacientes con resultados positivos para FR-A y FR-T respecto a los negativos. Estos resultados se corresponden con los de estudios recientes en los cuales se utilizaron los mismos indicadores de actividad de la enfermedad.23,27,31,32,34 En nuestro análisis, el indicador clínico compuesto DAS28 mostró correlación con los indicadores serológicos de actividad de la enfermedad como la VSG y la PCR, aunque estudios recientes consideran el DAS28 como una medida más exacta de la actividad de la AR que la VSG y la PCR.27,35
Actualmente, en nuestro país muchos laboratorios han sustituido el método de la aglutinación del látex por el inmunoturbidimétrico automatizado para la detección del FR. Los resultados hallados en el presente estudio señalan que aunque ambos métodos se correlacionan con la presencia de erosiones y con los indicadores clínicos de actividad de la AR, y son, por tanto, útiles para el seguimiento clínico de los pacientes con AR establecida, el FR-T ha permitido seleccionar cifras de corte que combinan de forma óptima la sensibilidad y la especificidad para las lesiones erosivas, y por tanto, su valor predictivo de erosión es alto. Valores superiores a 97 UI/mL en un paciente con AR temprana deben considerarse indicativos de erosión radiológica, y constituir un criterio de instauración del tratamiento más eficaz disponible para detener la enfermedad.
Nuestros resultados constituyen evidencias a favor de que el FR (IgM) refleja los procesos clínicamente relevantes de la AR. La asociación encontrada del FR (IgM) con las lesiones erosivas, la actividad de la enfermedad y la discapacidad funcional de la AR sugiere además su potencialidad como marcador pronóstico, lo que puede confirmarse en estudios prospectivos. La limitación del diseño transversal de nuestro estudio ha sido compensada, en parte, por el número considerable de la muestra, que ha permitido robustecer el análisis entre los grupos, y por la calidad de la muestra, por incluir pacientes no seleccionados y ambulatorios, diagnosticados en un centro de atención terciaria de salud. Es probable que los estudios prospectivos en pacientes con AR establecida sean más informativos, sin embargo, también enfrentan el sesgo, en este caso, problemas éticos o la posible pérdida de sensibilidad en la medida en que tratamientos nuevos y más eficaces puedan ser aplicados. Creemos que nuestros resultados poseen algunas implicaciones prácticas directas. Éstos sugieren considerar los títulos altos de FR-A y FR-T en pacientes con AR temprana como criterio de instauración de tratamientos más agresivos y eficaces para detener la destrucción articular. Además, también recomiendan la utilización de las determinaciones del FR-A y FR-T en el seguimiento clínico de los pacientes con AR establecida con fines de evaluar la actividad de la enfermedad.
REFERENCIAS BIBLIOGRÁFICAS
1. Plant MJ, Jones PW, Saklatvala J, Ollier WE, Dawes PT. Patterns of radiological progression in early rheumatoid arthritis: results of an 8 year prospective study. J Rheumatol. 1998;25(3):417-26.
2. Maini RN, Breedveld FC, Kalden JR, Smolen JS, Furst D, Weisman MH, et al. Sustained improvement over two years in physical function, structural damage, and signs and symptoms among patients with rheumatoid arthritis treated with infliximab and methotrexate. Arthritis Rheum. 2004;50(4):1051-65.
3. Waaler E. On the occurrence of a factor in human serum activating the specific agglutination of sheep red corpuscles. Acta Pathol Microbiol Scand. 1940;17:172-88.
4. Nishimura K, Sugiyama D, Kogata Y, Tsuji G, Nakazawa T, Kawano S, et al. Meta-analysis: Diagnostic accuracy of anti-cyclic citrullinated peptide antibody and rheumatoid factor for rheumatoid arthritis. Ann Intern Med. 2007;146(11):797-808.
5. Saraux A, Berthelot JM, Chales G, Le Henaff C, Mary JY, Thorel JB, et al. Value of laboratory tests in early prediction of rheumatoid arthritis. Arthritis Rheum. 2002;47(2):155-65.
6. Bukhari M, Lunt M, Harrison BJ, et al. Rheumatoid factor is the major predictor of increasing severity of radiographic erosions in rheumatoid arthritis: results from the Norfolk Arthritis Register Study, a large inception cohort. Arthritis Rheum. 2002;46(4):906-12.
7. Drossaers-Bakker KW, Zwinderman AH, Vlieland TP. Long-term outcome in rheumatoid arthritis: a simple algorithm of baseline parameters can predict radiographic damage, disability, and disease course at 12-year follow up. Arthritis Rheum. 2002;47(4):383-90.
8. Schumacher HR, Jr, Habre W, Meador R, Hsia EC. Predictive factors in early arthritis: long-term follow-up. Semin Arthritis Rheum. 2004;33(4):264-72.
9. Meyer O, Labarre C, Dougados M, Goupille Ph, Acntagrel A, Dubois A et al. Anticitrullinated protein/peptide antibody assays in early rheumatoid arthritis for predicting five year radiographic damage. Ann Rheum Dis. 2003;62(2):120-6.
10. Manfredsdottir VF, Vikingsdottir T, Jonsson T, Geirsson AJ, Kjartansson O, Heimisdottir M, et al. The effects of tobacco smoking and rheumatoid factor seropositivity on disease activity and joint damage in early rheumatoid arthritis. Rheumatology. 2006;45(6):734-40.
11. Nikolaisen C, Rekvig OP, Nossent HC. Rheumatoid factor by laser nephelometry and Waaler-Rose assay: prognostic value in patients with recent-onset rheumatoid artritis. Scand J Rheumatol. 2005;34(4):269-76.
12. Kokuina E, Chico A, Estevez M, Argüelles A, Casas N, Pérez D et al. Autoanticuerpos diagnósticos en enfermedades autoinmunes sistémicas y específicas de órgano. Rev Cubana Med. 2006;45 (2). Disponible en: http://bvs.sld.cu/revistas/med/vol45_2_06/med01206.htm
13. Borque L, Barozzi D, Ferrari L. The determination of rheumatoid factors by an immunoturbidimetric assay on Boehringer Mannheim/Hitachi analysis systems. Klin Lab. 1994;40:445-53.
14. Arnett FC, Edworthy SM, Bloch DA, McShane DJ, Fries JF, Cooper NS, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum. 1988;31(3):315-24.
15. Prevoo ML, van't Hof MA, Kuper HH, van Leeuwen MA, van de Putte LB, van Riel PL. Modified disease activity scores that include twenty-eight-joint counts. Development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthritis Rheum. 1995;38(1):44-8.
16. Fries JF, Spitz P, Kraines RG, Holman HR. Measurement of patient outcome in arthritis. Arthritis Rheum. 1980;23(2):137-45.
17. Huskisson EC. Visual analogue scales. En: Melzack R, ed. Pain Measurement and Assessment. New York: Raven Press;1983.p. 33-7.
18. Zweig MH, Campbell G. Receiver-operating characteristic (ROC) plots: a fundamental evaluation tool in clinical medicine. Clin Chem. 1993;39(4):561-77.
19. Hulsmans HM , Jacobs JW, van der heijde DM , van Albada Kuipers GA , Schenk Y, Bijlsma JW. The course of radiologic damage during the first six years of rheumatoid arthritis. Arthritis Rheum. 2000;43(9):1927-40.
20. Pincus T, Callahan LF. What is the natural history of rheumatoid arthritis? Rheum Dis Clin North Am. 1993;19(1):123-51.
21. Combe B, Eliaou JF, Daures JP, Meyer O, Clot J, Sany H. Prognostic factors in rheumatoid arthritis. Comparative study of two subsets of patients according to severity of articular damage. Br J Rheumatol. 1995;34(6):529-34.
22. Furst DE. Predictors of worsening clinical variables and outcomes in rheumatoid arthritis. Rheum Dis Clin North Am. 1994:20(2):309-19.
23. Nell VPK, Machold KP, Stamm TA, Eberl G, Heinzl H, Uffmann M et al. Autoantibody profiling as early diagnostic and prognostic tool for rheumatoid arthritis. Ann Rheum Dis. 2005;64(12);1731-6.
24. Vittecoq O, Pouplin S, Krzanowska K, Jouen-Beades F, Ménard JF, Gayet A et al. Rheumatoid factor is the strongest predictor of radiological progression of rheumatoid arthritis in a three-year prospective study in community-recruited patients. Rheumatology. 2003;42(8):939-46.
25. Eguchi K. Early prediction of joint destruction in rheumatoid arthritis. Clin Calcium. 2007;17(4):517-25.
26. Young-Min S, Cawston T, Marshall N, Coady D, Christgau S, Saxne T et al. Biomarkers predict radiographic progression in early rheumatoid arthritis and perform well compared with traditional markers. Arthritis Rheum. 2007;56(10):3236-47.
27. Machold KP, Stamm TA, Nell VPK, Pflugbeil S, Aletaha D, Steiner G et al. Very recent onset rheumatoid arthritis: clinical and serological patient characteristics associated with radiographic progression over the first years of disease Rheumatology 2007;46(2): 342-9.
28. Kroot EJ, de Jong BA, van Leeuwen MA et al. The prognostic value of anti-cyclic citrullinated peptide antibody in patients with recent-onset rheumatoid arthritis. Arthritis Rheum. 2000;43(8):1831-5.
29. Smolen JS, Aletaha D, Machold KP. Therapeutic strategies in early rheumatoid arthritis. Best Pract Res Clin Rheumatol. 2005;19(1):163-77.
30. Bas S, Perneger TV, Seitz M, Tiercy JM, Roux-Lombard P, Guerne PA. Diagnostic tests for rheumatoid arthritis: comparison of anti-cyclic citrullinated peptide antibodies, antikeratin antibodies and IgM rheumatoid factors. Rheumatology. 2002;41(7):809-14.
31. Bas S, Genevay S, Meyer O, Gabay C. Anti-cyclic citrullinated peptide antibodies, IgM and IgA rheumatoid factors in the diagnosis and prognosis of rheumatoid arthritis. Rheumatology. 2003;42(5):677-80.
32. Agrawal S, Misra R, Aggarwal A. Autoantibodies in rheumatoid arthritis: association with severity of disease in established RA. Clin Rheumatol. 2007;26(2):201-4.
33. Mewar D, Coote A, Moore DJ, Marinou I, Keyworth J, Dickson MC, et al. Independent associations of anti-cyclic citrullinated peptide antibodies and rheumatoid factor with radiographic severity of rheumatoid arthritis. Arthritis Research & Therapy. 2006;8:R128.
34. Cabral D, Katz JN, Weinblatt ME, Ting G, Avorn J, Solomon DH. Development and assessment of indicators of rheumatoid arthritis severity: results of a Delphi panel. Arthritis Rheum. 2005;53(1):61-6.
35. Aletaha D, Nell VP, Stamm T. Acute phase reactants add little to composite disease activity indices for rheumatoid arthritis: validation of a clinical activity score. Arthritis Research & Therapy. 2005;7(4):R796-806.
Recibido: 22 de mayo de 2008.
Aprobado: 26 de junio de 2008.
Dra. Elena Kokuina. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", San Lázaro No. 706 entre Belascoaín y Marqués González, Centro Habana, Ciudad de La Habana, Cuba. Email: inmunologia@hha.sld.cu














