Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.48 n.2 Ciudad de la Habana abr.-jun. 2009
TRABAJOS ORIGINALES
Quimioterapia metronómica con ciclofosfamida y metotrexato en pacientes con cáncer de mama metastásico en progresión
Cyclophosphamide and Methrotexate as a Metronome-chemotherapy used in patients with progressing metastatic breast cancer
Jorge L. Soriano GarcíaI; Mayté Lima PérezII; Joaquín González GonzálezII; Noyde Batista AlbuerneII; María V. López SotoIII; Myriam Rodríguez MenéndezIV; Jorge L. Loys FernándezV; Narciso Montejo ViamontesVI
I Especialista de II Grado en Oncología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", La Habana, Cuba.
II Especialista de I Grado en Oncología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", La Habana, Cuba.
III Especialista de II Grado en Anatomía Patológica. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", La Habana, Cuba.
IV Especialista de II Grado en Imagenología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", La Habana, Cuba.
V Especialista de I Grado en Cirugía General. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", La Habana, Cuba.
VI Doctor en Ciencias Médicas. Especialista de II Grado en Cirugía General. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", La Habana, Cuba.
RESUMEN
Introducción: Emplear bajas dosis de agentes citotóxicos de manera continua por períodos prolongados ha demostrado ser una alternativa para tratar el cáncer de mama metastásico (CMM), una brecha ante la resistencia a fármacos conocidos y muy beneficioso en la calidad de vida. Métodos: Se evaluaron 28 pacientes entre abril del 2002 y diciembre del 2005, con CMM en progresión, Eastern Cooperative Oncology Group (ECOG)= 2, tratadas previamente con, al menos, una línea de quimioterapia para enfermedad metastásica y el consentimiento informado de las pacientes. Se administró: 2,5 mg/2v/d de metotrexato por vía oral durante 2 d y 50 mg/d de ciclofosfamida, por 5 d, semanalmente. Se analizó la supervivencia por el método de Kaplan-Meier. Resultados: Se halló una mediana de edad de 56 años (36-74) y 12 pacientes con más de 1 sitio metastásico. Se obtuvo respuesta objetiva (completa + parcial) en 14 pacientes, estabilización de la enfermedad en 8 y progresión, en 6. La mediana del tiempo en obtener respuesta fue 2,8 meses (IC 1,9-3,5) y la mediana de duración de respuesta (en respondedores), 7,9 meses (IC 3,7-26,2). Los sitios metastásicos más respondedores fueron: piel/partes blandas e hígado y las toxicidades más observadas, anemia y leucopenia grado 2 en 11 pacientes, toxicidad hepática grado 3 en 1 y grado 2, en 5; náuseas grado 3 en 3 pacientes y grado 2, en 6. Conclusiones: La quimioterapia metronómica es una opción terapéutica muy útil en el CMM, dados sus beneficios, ventajas de la vía oral, escasa toxicidad y bajo costo.
Palabras clave: Cáncer de mama metastásico, quimioterapia metronómica.
ABSTRACT
Introduction: Continuous use of low doses of cytotoxic agents during lengthy periods has shown to be an alternative to treat metastatic breast cancer (MBC), an opening in face of a resistance of known and beneficial drugs in quality of life. Methods: From April, 2002 and December, 2005, a total of 28 patients was assessed with a progressing MBC, Eastern Cooperative Oncology Group (ECOG)= 2, previously treated with, or at least, a chemotherapy line for metastatic disease, and the respective informed consent from patients. We administered: 2.5 mg/b.i.d. of oral Methrotexate during two days, and 50 mg/quotid of Cyclophosphamide during 5 days weekly. We analyzed survival rate by Kaplan-Meier method. Results: We found a mean age of 56 years (36-74), and 13 patients with more than a metastatic site. There was an objective response (RC + RP) in 14 patients, EE en 8, and progression in 6. Average time to obtain a response was of 2.8 months (CI 1.9-3.5), and average length response (in respondents), 7.9 months (IC 3.7-16.2). The metastatic sites with a higher response rate were: skin/soft parts, and liver, and the more observed ones were: anemia and 2-degree leukopenia in 11 patients, 3 degree hepatic toxicity in one patient, and 5 degree in 5 of them; 3 degree nausea in 3 patients, and 2 degree en 6 of them. Conclusions: Metronome-chemotherapy is a very useful therapeutical option in MBC by its benefits, advantages of oral pathway, a scarce toxicity and a low cost.
Key words: Metastatic breast cancer, metronome-chemotherapy.
INTRODUCCIÓN
El beneficio a la supervivencia (SV) de la quimioterapia citotóxica a dosis máximas tolerables (DMT) ha sido modesto en el tratamiento de la mayor cantidad de las neoplasias malignas con metástasis y, además, ha ocasionado incremento de la toxicidad aguda y crónica en este tipo de pacientes. En los últimos 10 años, varios estudios han demostrado que la administración frecuente de bajas dosis de agentes citotóxicos, sin pausas extendidas, puede no sólo ser tan eficaz como las DMT, sino que, además, resulta menos tóxica.1,2
La angiogénesis desempeña un papel central en el crecimiento, tanto local como de las metástasis a distancia, en el cáncer de mama. Algunas investigaciones realizadas en modelos preclínicos3 sugieren que la angiogénesis precede al proceso de transformación de hiperplasia a neoplasia mamaria.
Múltiples agentes quimioterapéuticos usados rutinariamente para el cáncer de mama, tienen conocida actividad antiangiogénica.4,5 La máxima actividad antiangiogénica usualmente requiere una exposición prolongada a bajas concentraciones de fármacos, justamente lo contrario a la DMT, con las que el objetivo es la óptima muerte celular tumoral. Múltiples reportes confirman la importancia de la dosis y el esquema a emplear en los modelos preclínicos.6,7
Pocos ensayos clínicos han evaluado esquemas antiangiogénicos de la quimioterapia, también llamados metronómicos. Las dosis "metronómicas" implementan un esquema de administración frecuente de dosis mucho más bajas que las DMT. Algunas investigaciones preclínicas sugieren que el mecanismo responsable del efecto antiangiogénico es la inducción de niveles plasmáticos incrementados de trombospondina 1 (potente inhibidor específico endotelial de la angiogénesis).8
La quimioterapia metronómica (QM) puede ser vista como una variación del tratamiento de "densidad de dosis" a excepción de la dosis acumulativa con terapia metronómica, que puede ser significativamente menor que la quimioterapia basada sobre la DMT.9 La QM reduce el nivel de toxicidad, disminuye o elimina la necesidad de tratamientos de soporte con factores de crecimiento para acelerar la recuperación de la médula ósea, y además de tener menor dosis acumulativa de fármaco, exhibe un efecto terapéutico superior, en términos de prolongación de supervivencia, superiores a los regímenes convencionales a DMT.
La visita a la División de Oncología Médica del Instituto Europeo de Oncología en Milán (Italia), como parte de un intercambio académico y la publicación del primer artículo por parte de ese grupo de trabajo, en el 2002,10 nos motivaron a realizar la presente investigación. Otros estudios clínicos se han publicado en el tratamiento del cáncer de mama,11-13 incluso han estimulado a que otros investigadores hayan comenzado a incursionar con esta modalidad de tratamiento en otras neoplasias malignas, como: ovario,14 gliomas,15 pulmón,16 mieloma múltiple,17 entre otros.
El presente trabajo tiene como objetivo, evaluar la eficacia y seguridad del uso de la ciclofosfamida y el metotrexato en pacientes con cáncer de mama metastásico en progresión.
MÉTODOS
Se realizó un estudio prospectivo no aleatorizado desde abril del 2002 hasta diciembre del 2005, con los siguientes criterios de elegibilidad.
Criterios de inclusión
- Pacientes del sexo femenino.
- Confirmación histológica de cáncer de mama en estadio IV en progresión.
- Haber recibido al menos una línea de quimioterapia para su enfermedad metastásica.
- Edad= 18 años y= 80 años.
- Estado general ECOG= 2 (Karnofsky= 60 %).
- Expectativa de vida mayor de 6 meses.
- Funcionamiento normal de los órganos y de la médula ósea, definidos por: leucocitos= 3 000/ìL; conteo absoluto de neutrófilos= 1 500/ìL; plaquetas= 100 000/ìL; bilirrubina total y ALAT/ASAT= 2,5 LSN; aclaramiento de creatinina= 60 mL/min/1,73 m2.
- Consentimiento informado.
Criterios de exclusión
- Paciente que esté recibiendo otro producto en investigación.
- Que padeciera enfermedades intercurrentes no controladas.
- Estado de gestación.
- Presentar metástasis cerebrales.
Se evaluaron 53 pacientes y, de ellas, sólo 28 se incluyeron en la investigación. Las otras 25 no reunieron los criterios de elección porque: 7 pacientes tenían estado general > 2; 7 deseaban otra línea de quimioterapia intravenosa; 6 estaban en otros protocolos de investigación; 3 no dieron su consentimiento informado y 2 tenían edad mayor de 80 años.
Plan de tratamiento
El tratamiento consistió en: ciclofosfamida (tableta de 50 mg), 1 tableta diaria (de lunes a viernes), luego del desayuno, y metotrexato (tableta de 2,5 mg), 1 tableta 8 a.m. y 5 p.m., los días 2 y 4 de cada semana. La profilaxis antiemética no fue indicada de rutina, pero a las pacientes que presentaron al menos, náusea y/o vómitos, acompañados o no de epigastralgia, se les indicó tratamiento con metoclopramida o dimenhidrinato, una tableta de uno u otro fármaco (en dependencia de la tolerancia o no a la metoclopramida), 30 min antes de la administración de algunos de los fármacos antineoplásicos. Se mantuvo el tratamiento hasta comprobar progresión de la enfermedad.
Evaluación
La evaluación basal consistió en: examen radiográfico simple de tórax, ecografía abdominal, gammagrafía ósea y examen radiográfico selectivo y/o TAC y/o RMN (en dependencia de cada caso), ecografía mamaria y mamografía (en caso de requerirlo).
La evaluación de seguimiento fue la siguiente: exámenes imagenológicos en dependencia de la evolución de cada paciente. El examen físico, los exámenes hematológicos y hemoquímicos se realizaron cada 28 d.
La respuesta fue evaluada según los criterios de la OMS, a partir de las 4 sem de comenzar tratamiento, mientras que para evaluar la toxicidad, se utilizó la clasificación de toxicidad del NCI-CTC (versión 3.0). El beneficio clínico fue definido como la proporción de pacientes que obtuvieron remisión completa (RC), remisión parcial (RP) o estabilización de la enfermedad (EE) de al menos 24 sem.
Para la valoración de la toxicidad solo se recogió el mayor grado de toxicidad y proceso registrado por cada paciente. La mediana del tiempo a la progresión fue calculada desde la fecha de la primera dosis de quimioterapia administrada hasta la fecha de confirmación de progresión o recidiva local o a distancia. La mediana del tiempo de supervivencia (SV) fue calculada desde la fecha de la primera dosis de quimioterapia administrada hasta la de muerte o de última noticia. El método de Kaplan-Meier fue usado para estimar el tiempo de supervivencia y a la progresión.
RESULTADOS
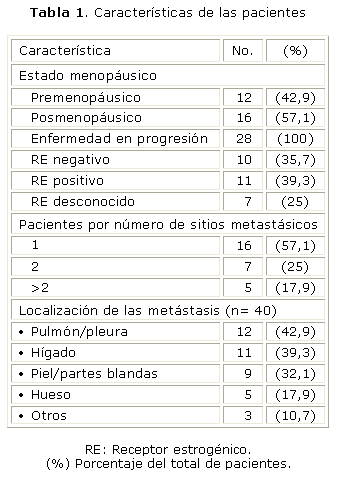
En la tabla 1 se muestran las principales características de las pacientes incluidas en el estudio; las posmenopáusicas fueron más numerosas, la mediana de edad fue 56 años con un rango entre 36 y 74, así como la presencia de solo un sitio metastásico. Los sitios más frecuentemente tomados a distancia fueron: pulmón, hígado y piel y/o partes blandas. Desafortunadamente, en 7 pacientes no fue posible determinar el estado de los receptores. En las 21 restantes predominó el receptor estrogénico positivo. Todas tenían buen estado general y el 100 % estaban clasificadas entre 0 y 1 (según la clasificación ECOG).
La mitad de las pacientes incluidas en la investigación obtuvieron una respuesta objetiva (RC + RP), como puede apreciarse en la tabla 2. El tiempo para la progresión (para todas las pacientes) fue de 3,7 meses, mientras que para obtener respuesta fue de 2,8 meses. La mediana del tiempo de duración de la respuesta para aquellas que obtuvieron algún grado de respuesta fue de 7,9 meses. El beneficio clínico fue observado en 61,1 % (rango: 50,2-73,3 %). El 28,6 % (n= 4) de las pacientes respondedoras se mantenían vivas y conservaban su respuesta, luego de 12 meses de tratamiento, y con buena calidad de vida.
Se administró tratamiento durante 209 meses, con una mediana de tiempo de administración por paciente de 3,3 meses. Solamente 9 (4,3 %) de los ciclos fueron retardados y 4 (1,9 %) tuvieron que administrarse con reducciones de dosis, principalmente por vómitos y elevación de las enzimas hepáticas.
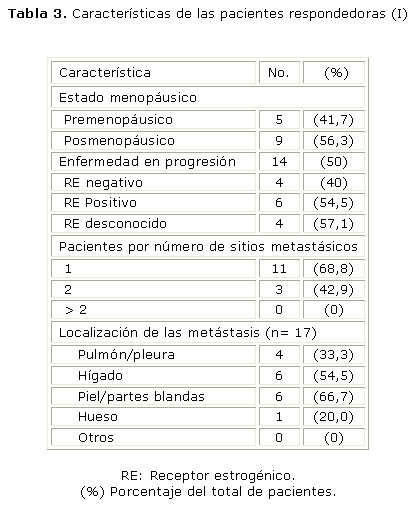
En cuanto a las pacientes respondedoras a este esquema de quimioterapia metronómica (tablas 3 y 4), no existen variaciones considerables en relación con la mediana de edad (54 años, rango entre 39 y 71) o el estado menopáusico, pero predominan las pacientes con alta expresión de receptores estrogénicos, con un solo sitio metastásico y, de éstas, el mayor número en hígado y piel/partes blandas, en relación con la población total en el estudio.
En la mayoría de las pacientes no se produjo una toxicidad considerable (tabla 5). Las toxicidades hematológicas más frecuentes fueron la anemia y leucopenia en el 71,4 y el 60,7 %, respectivamente. Dentro de las toxicidades no hematológicas, las más frecuentes fueron las náuseas y vómitos en el 67,9 % y la elevación de las transaminasas en el 35,7 %. El grado 3 de toxicidad (según NCI-CTC) solo se presentó en 4 pacientes (vómitos y elevación de las transaminasas), que representan poco más del 14 % de los casos. En 3 de ellas, se relacionó con el deterioro de su estado general, secundario a las metástasis hepáticas que presentaban. El otro caso, así como las 5 pacientes restantes que presentaron elevación de las transaminasas tuvieron una recuperación a los valores normales de estas enzimas, una vez que se aplazó la administración de la quimioterapia o se redujo, en 4 ocasiones, la dosis del metotrexato.
DISCUSIÓN
En el desarrollo histórico de los agentes antineoplásicos se ha postulado que el efecto citotóxico sobre las células tumorales está relacionado con la dosis de estos agentes y constituye la principal causa de eficacia antitumoral.18 De hecho, el principio de la intensidad de dosis es soportado por sistemas experimentales, donde un pequeño incremento en las dosis de fármacos puede elevar la muerte celular tumoral. Este aspecto de la intensidad de dosis y la eficacia de la muerte celular tumoral en el cáncer de mama avanzado es aún más controversial, por la alta heterogeneidad de las células tumorales mamarias,19 las interacciones entre los fármacos, las células tumorales, estroma, hormonas, factores de crecimiento y vasos sanguíneos, entre otros.
Algunos estudios han demostrado que la ciclofosfamida, cuando es administrada a DMT, causa apoptosis de las células endoteliales en los nuevos microvasos tumorales formados.20 Un análisis temporal detallado mostró que las células endoteliales fueron las primeras en el tumor en someterse a apoptosis, pero este efecto antiangiogénico, sin embargo, no se traduce en un beneficio terapéutico porque el daño a la vasculatura del tumor fue reparado, en su mayor parte, en los períodos de descanso o reposo entre los ciclos de quimioterapia a DMT.21
El objetivo de los tratamientos antiangiogénicos es el de interferir con la formación de nuevos vasos, por tanto, previenen el crecimiento tumoral y limitan el potencial metastásico. Los fármacos antiangiogénicos inducen cambios a largo plazo en la vasculatura del tumor y son diseñados para tratamientos continuos. Esto coincide con una aparente selectividad por las células endoteliales de la vasculatura tumoral. La quimioterapia a DMT actúa sobre las células en rápida división, y las células endoteliales son poco afectadas por la misma,22 por la baja proporción de células endoteliales en división en los vasos sanguíneos asociados al tumor y a las altas concentraciones locales de factor de supervivencia celular endotelial, factor de crecimiento básico de fibroblastos y de angiopoyetina 1. Por otra parte, mientras que las células tumorales humanas al momento del diagnóstico, tienen miles de mutaciones (las cuales facilitan el desarrollo de resistencia a fármacos), las células endoteliales tienen estabilidad genética y baja frecuencia de mutaciones, lo cual hace que tengan baja probabilidad de resistencia a fármacos.23,24 Los efectos antiangiogénicos de la quimioterapia son enmascarados y marginados por la vía de administración y por el largo período necesario para que el paciente se recupere de los efectos secundarios de la quimioterapia a DMT, especialmente de la mielosupresión, por lo que reduce la capacidad antiangiogénica de los fármacos.
El porcentaje de respuesta objetiva obtenido en el estudio es mucho mayor que el reportado en investigaciones anteriores y está relacionado con el hecho de que las pacientes habían recibido menos líneas terapéuticas para la enfermedad metastásica (acorde con la disponibilidad de medicamentos que teníamos hasta el 2005 y a los estándares de tratamiento para esa fecha) que las referidas en los mencionados artículos, por lo que las pacientes tenían mayor probabilidad de respuesta y de estimulación del sistema inmunológico con menor resistencia a fármacos. Un artículo muy reciente,25 hace énfasis en que la administración de la ciclofosfamida en régimen metronómico inducía una reducción selectiva e intensa de las células T regulatorias circulantes, asociada con una supresión de las funciones inhibitorias en las células T y NK convencionales, lo cual permite una restauración de la proliferación de células T periféricas y reduce la tolerancia del sistema inmune inducida por el tumor y, por ende, favorece el mejor control de la progresión del tumor. Sin embargo, en aquellas pacientes que presentaban mayor número de sitios metastásicos (> 2), con mayor carga tumoral, no se obtuvo respuesta a este tipo de quimioterapia y tuvieron una progresión tumoral muy rápida. Esto puede estar relacionado con resistencia adquirida por: remodelación vascular, crecimiento tumoral independientemente de los mecanismos de angiogénesis e incremento de la tolerancia a la hipoxia.26,27
El mayor número de pacientes respondedoras correspondió a tumores que tenían alta expresión de receptores estrogénicos positivos, lo cual está en correspondencia con lo expresado por otros autores,28,29 que asocian esta condición biológica con mayor estabilización de la enfermedad, menor proliferación, índice replicativo y grado tumoral.
Llama la atención que a pesar del uso prolongado de estos medicamentos y en casos con metástasis, la toxicidad es bastante baja. El número de pacientes con náuseas y vómitos es mucho más alto que el hallado en otros estudios y al parecer se debe a cierta dependencia psicológica a la profilaxis antiemética y, de hecho, una vez que comenzamos a indicar antieméticos del tipo antidopaminérgicos, fueron controlados los episodios de náuseas, excepto en aquellas pacientes que presentaban metástasis hepáticas. La toxicidad hematológica fue posible atenderla de forma satisfactoria.
El objetivo básico del tratamiento con quimioterapia en la paciente con cáncer de mama metastásico (CMM) ha sido históricamente paliativo. De hecho, las principales acciones de la quimioterapia en este tipo de pacientes es la de obtener el máximo control de los síntomas, prevenir las complicaciones e incrementar la supervivencia con mantenimiento de una buena calidad de vida;30,31 por tanto, la introducción de nuevos esquemas de tratamiento, nuevas vías de administración y/o nuevos enfoques terapéuticos debe tener como objetivo fundamental, incrementar, o al menos obtener, una eficacia equivalente a lo anterior, pero con reducción de la toxicidad. Si esto es así, lo nuevo es aceptado por la comunidad médica nacional o internacional. Los resultados presentados aquí, indican que un subgrupo de pacientes con CMM puede lograr un beneficio clínico y supervivencia a largo plazo con esta opción terapéutica.
Este estudio constituye el primer reporte nacional de la utilización de esta modalidad terapéutica (como introducción tecnológica) y abre posibilidades infinitas de su utilización porque los fármacos utilizados son productos genéricos de muy bajo precio.
En un excelente estudio fármaco-económico realizado por Bocci,32 se hace una relación de diferentes esquemas de tratamiento muy utilizados en CMM, y su correlación con el índice de respuestas globales y el costo. Si nosotros comparamos el costo del tratamiento empleado en el esquema utilizado en el presente trabajo (3,25 USD/mes) con el resultado obtenido en términos de respuesta y supervivencia y lo comparamos, en igualdad de condiciones, con los esquemas representados en el trabajo antes mencionado, podemos concluir que es un esquema con un índice de costo-beneficio muy alto.
Los resultados alentadores de este estudio y las investigaciones (fundamentalmente preclínicas realizadas por otros grupos de trabajo33) han hecho posible que desarrollemos un segundo protocolo de investigación utilizando el principio del "switch" de quimioterapia a DMT para reducir grandes volúmenes tumorales (como primera línea de QT) y luego, en aquellos casos en los que se obtenga algún grado de respuesta (RP o EE), continuar con QM, para mantenimiento y obtener una respuesta definitiva y a largo plazo. Por otra parte, nos ha permitido realizar un protocolo clínico de trabajo (protocolo HHA-CM-Oral V.1-07) que puede extenderse a todas las unidades oncológicas del país, para su implementación.
En los próximos meses debe comenzar un ensayo clínico de combinación de QM con ciclofosfamida y metotrexato a la vacuna gangliosídica antiidiotípica 1E10, el cual ha tenido un investigación preclínica muy interesante y donde se demostró mayor capacidad de apoptosis, antiangiogénica y antiproliferativa que la QM sola o la QT a dosis convencionales de MTD, o de otras combinaciones.
Los resultados de este estudio indican que la administración de ciclofosfamida y metotrexato a bajas dosis, y por vía oral, produce beneficio clínico a largo plazo en un subgrupo de pacientes, sin toxicidad significativa, a pesar de su uso prolongado. Esta opción terapéutica constituye una modalidad de tratamiento que puede ser ampliamente utilizada en poblaciones de bajos recursos económicos, por su bajo costo, pero con un fuerte impacto en la respuesta al tratamiento y la supervivencia de las pacientes con cáncer de mama metastásico.
REFERENCIAS BIBLIOGRÁFICAS
1. Folkman J. New perspectives in clinical oncology from angiogenesis research. Eur J Cancer. 1996;32:2534-5.
2. Emmenegger U, Man S, Shaked Y, Francia G, Wong JW, Hicklin DJ, et al. A comparative analysis of low-dose metronomic cyclophosphamide reveals absent or low-grade toxicity on tissues highly sensitive to the toxic effects of maximum tolerated dose regimens. Cancer Res. 2004;64:3994-4000.
3. Schneider BP, Miller KD. Angiogenesis of breast cancer. J Clin Oncol. 2005;23:1782-90.
4. Sweeney C, Sledge G. Chemotherapy agents as antiangiogenic therapy. Cancer Conference Highlights. 1999;3:2-4.
5. Slaton JW, Perrotte P, Inoue K, Dinney CPN, Fidler IJ. Interferon-alpha-mediated down-regulation of angiogenesis-related genes and therapy of bladder cancer are dependent on optimization of biological dose and schedule. Clin Cancer Res. 1999;5:2726-34.
6. Browder T, Butterfield CE, Kraling BM, Shi B, Marshall B, O'Reilly MS, et al. Antiangiogenic scheduling of chemotherapy improves efficacy against experimental drug-resistant cancer. Cancer Res. 2000;60:1878-86.
7. Hahnfeldt P, Folkman J, Hlatky L. Minimizing long-term tumor burden: the logic for metronomic chemotherapeutic dosing and its antiangiogenic basis. J Theor Biol. 2003;220:545-54.
8. Hamano Y. Thrombospondin-1 associated with tumor microenvironment contributes to low-dose cyclophosphamide mediated endothelial cell apoptosis and tumor growth suppression. Cancer Res. 2004;64:1570-4.
9. Kerbel R, Kamen B. The anti-angiogenic basis of metronomic chemotherapy. Nat Rev Cancer. 2004;4:423-35.
10. Colleoni M, Rocca A, Sandri M, Zorzino L, Masci G, Nolé F, et al. Low-dose oral methotrexate and cyclophosphamide in metastatic breast cancer: antitumor activity and correlation with vascular endothelial growth factor levels. Ann Oncol. 2002;13:73-80.
11. Bottini A, Generali D, Brizzi MP, Fox SB, Bersiga A, Bonardi S, et al. Randomized phase II trial of letrozole and letrozole plus low-dose metronomic oral cyclophosphamide as primary systemic treatment in elderly breast cancer patients. J Clin Oncol. 2006;24:3623-8.
12. Colleoni M, Orlando L, Sanna G, Rocca A, Maissonneuve A, Sandri MTP, et al. Metronomic low-dose oral cyclophosphamide and methotrexate plus or minus thalidomide in metastatic breast cancer: antitumor activity and biological effects. Ann Oncol. 2006;7:232-8.
13. Orlando L, Cardillo A, Ghisini R, Rocca A, Balduzzi A, Torrisi R, Peruzzotti G, Goldhirsch A, Pietri E, Colleoni Met al. Trastuzumab in combination with metronomic cyclophosphamide and methotrexate in patients with HER-2 positive metastatic breast cancer BMC Cancer. 2006;6:225.
14. Samaritani R, Corrado G, Vizza E, Sbiroli C. Cyclophosphamide "metronomic" chemotherapy for palliative treatment of a young patient with advanced epithelial ovarian cancer. BMC Cancer. 2007;7:65.
15. Kesari S, Schiff D, Doherty L, Gigas DC, Batchelor TT, Muzikansky A, et al. Phase II study of metronomic chemotherapy for recurrent malignant gliomas in adults. Neuro Oncol. 2007;9:354-363.
16. Correale P, Cerretani D, Remondo C, Martellucci I, Marsili S, La Placa M, et al. A novel metronomic chemotherapy regimen of weekly platinum and daily oral etoposide in high-risk non-small cell lung cancer patients. Oncol Rep. 2006;16:133-40.
17. Suvannasankha A, Fausel C, Juliar BE, Yiannoutsos CT, Fisher WB, Ansari RH, et al. Final report of toxicity and efficacy of a phase II study of oral cyclophosphamide, thalidomide, and prednisone for patients with relapsed or refractory multiple myeloma: a Hoosier Oncology Group Trial, HEM 01-21. The Oncologist. 2007;12:99-106.
18. Henderson IC, Hayes DF, Gelman R. Dose-response in the treatment of breast cancer: a critical review. J Clin Oncol. 1988;6:1501-15.
19. Schnipper LE. Clinical implications of tumor-cell heterogeneity. N Engl J Med. 1986;314:1423-31.
20. Bertolini F, Paul S, Mancuso P, Monestiroli S, Gobbi A, Shaked Y, et al. Maximum tolerable dose and low-dose metronomic chemotherapy have opposite effects on the mobilization and viability of circulating endothelial progenitor cells. Cancer Res. 2003;63:4342-6.
21. Hermans IF, Chong TW, Palmowski MJ, Harris AL, Cerundolo V. Synergistic effect of metronomic dosing of cyclophosphamide combined with specific antitumor immunotherapy in a murine melanoma model. Cancer Res. 2003;63:8408-13.
22. Tonini G, Schiavon G, Silletta M, Vincenzi B, Santini D. Antiangiogenic properties of metronomic chemotherapy in breast cancer. Future Oncol. 2007;3:183-90.
23. Loeb LA, Loeb KR, Anderson JP. Multiple mutations and cancer. Proc Natl Acad Sci USA. 2003;100:776-81.
24. Bielas JH, Loeb KR, Rubin BP, True LD, Loeb LA. Human cancers express a mutator phenotype. Proc Natl Acad Sci USA. 2006;103:18238-42.
25. Ghiringhelli F, Menard C, Puig PE, Ladoire S, Roux S, Martin F, et al. Metronomic cyclophosphamide regimen selectively depletes CD4+CD25+ regulatory T cells and restores T and NK effector functions in end stage cancer patients. Cancer Immunol Immunother. 2007;56:641-8.
26. Emmenegger U, Morton GC, Francia G, Shaked Y, Franco M, Weinerman A, et al. Low dose metronomic daily cyclophosphamide and weekly tirapazamine: a well-tolerated combination regimen with enhanced efficacy that exploits tumor hypoxia. Cancer Res. 2006;66:1664-74.
27. Kerbel RS, Yu J, Tran J, Man S, Viloria-Petit A, Klement G, et al. Possible mechanism of acquired resistance to anti-angiogenic drugs: implication for the use of combination therapy approach. Cancer Metastasis Rev 2001;20:79-86.
28. Rahaman ZU, Frye DK, Smith TL, Asmar L, Therialt RL, Buzdar AU, et al. Results and long term follow-up for 1581 patients with metastatic breast carcinoma treated with standard dose doxorubicin-containing chemotherapy. Cancer. 1999;85:104-11.
29. Orlando L, Cardillo A, Rocca A, Balduzzi A, Ghisini R, Peruzzotti G, et al. Prolonged clinical benefit with metronomic chemotherapy in patients with metastatic breast cancer. Anti-Cancer Drugs. 2006;17:961-7.
30. Johnston S, Stebbing J. Breast cancer: metastatic. Clin Evid. 2002;7:1579-602.
31. Crown J, Dieras V, Kaufmann M. Chemotherapy for metastatic breast cancer-report of a European expert panel. Lancet Oncol. 2002;3:719-27.
32. Bocci G, Tuccori M, Emmenegger U, Liguori V, Falcone A, Kerbel RS, et al. Cyclophosphamide-methotrexate "metronomic" chemotherapy for the palliative treatment of metastatic breast cancer. A comparative pharmacoeconomic evaluation. Ann Oncol. 2005;16:1243-52.
33. Gasparini G, Longo R, Fanelli M, Teicher B. Combination of antiangiogenic therapy with other anticancer therapies: results, challenges, and open questions. J Clin Oncol. 2005;23:1295-311.
Recibido: 24 de febrero de 2009.
Aprobado: 22 de abril de 2009.
Dr. Jorge L. Soriano García. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", Servicio de Oncología, San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, Ciudad de La Habana, Cuba. CP 10 300. Correo electrónico: soriano@infomed.sld.cu