Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.49 n.1 Ciudad de la Habana ene.-mar. 2010
TRABAJOS ORIGINALES
Evaluación del uso de ácido zoledrónico en pacientes con cáncer de mama metastásico a hueso
Assessment on zoledronic acid use in patients with bone metastatic breast cancer
Jorge L. Soriano GarcíaI; Noyde Batista AlbuerneII; Mayté Lima PérezII; Joaquín González GonzálezII; Angela Gutiérrez RojasIII; Patricia Luaces ÁlvarezIV
IEspecialista de II Grado en Oncología. Servicio de Oncología. Hospital Clínico Quirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
IIEspecialista de I Grado en Oncología. Servicio de Oncología. Hospital Clínico Quirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
IIIEspecialista de II Grado en Bioestadística. Departamento de Investigaciones y Proyectos. Hospital Clínico Quirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
IVLicenciada en Matemática. Dirección de Ensayos Clínicos. Centro de Inmunología Molecular. La Habana, Cuba.
RESUMEN
OBJETIVO: Los bifosfonatos constituyen una piedra angular en el tratamiento de las metástasis óseas. En este trabajo se evalúa la eficacia y seguridad del uso del ácido zoledrónico (AZ) en pacientes con cáncer de mama metastásico (CMM) a hueso.
MÉTODOS: Se realizó un estudio retrospectivo y descriptivo de pacientes tratadas en el Servicio de Oncología del Hospital "Hermanos Ameijeiras" (HHA), desde octubre del 2006 hasta diciembre del 2007, con confirmación histológica de CMM óseo y tratadas con AZ. La supervivencia (SV) global y el tiempo para la aparición de nuevos eventos esqueléticos (EER) fue estimada usando el método de Kaplan-Meier. Para la comparación de las medias se utilizó el test de comparación (Wilcoxon) para muestras relacionadas. Para la evaluación de la respuesta al dolor se utilizó la escala visual analgésica (EVA).
RESULTADOS: Las medianas de SV y del tiempo para la aparición de algún EER fueron de 33,82 meses y de 27,82 meses, respectivamente. El 50 % de las pacientes presentaban dolor severo (EVA ³ 7), al inicio del tratamiento, y a los 12 meses, el 66,6 % obtuvieron EVA=0 (p=0,021). En el 42,3 % se reportó un síndrome pseudogripal luego de la primera infusión. No hubo toxicidad hematológica, ni variaciones significativas de los valores de fosfatasa alcalina, LDH, y creatinina. No se reportó ningún caso de insuficiencia renal.
CONCLUSIONES: Este estudio constituye el primer reporte en Cuba de la utilización del AZ en cáncer. Se demostró la eficacia del AZ en reducir los EER, el tiempo de aparición de estos, incremento de la SV, así como la reducción del dolor e incremento de la calidad de vida. El AZ tiene un buen perfil de seguridad.
Palabras clave: Bifosfonatos, cáncer de mama metastásico, ácido zoledrónico, metástasis óseas.
ABSTRACT
OBJECTIVE: the biphosphonates are the cornerstone in the bone metastases treatment. In present paper the effectiveness and safety of the zoledronic acid (ZA) use in patients with bone metastatic breast cancer (MBC).
METHODS: a descriptive and retrospective study was conducted in patients seen in Oncology Service of the «Hermanos Ameijeiras» Clinical Surgical Hospital from October, 2006 to December, 2007 with histological confirmation of MBC treated with ZA. Global survival and appearance time of new skeletal events (SE) was estimated using the Kaplan-Meier method. For means comparison we used the comparison test (Wilcoxon) in related samples. To assessment of pain response the analgesic visual scale (AVS).
RESULTS: the survival means and the appearance time of some SE were of 33.82 months and of 27.72 months, respectively. The 50 % of patients showed AVS ³ 7 at treatment onset, and at 12 months, the 66.6 % had AVS =0 (p=0.021). In the 42.3 % was present a flu-like syndrome after the first infusion. There was not hematologic toxicity or significant variations of alkaline phosphatase values, LDH and creatinine. No case of renal failure.
CONCLUSIONS: present paper is the first report in Cuba on use of ZA in cancer cases. The ZA effectiveness to reduce the SEs was demonstrated, as well as the appearance time of such events, the survival rise, the pain decrease and the quality of life increase. ZA has a good safety profile.
Key words: Biphosphonates, metastatic breast cancer, zoledronic acid, bone metastases.
INTRODUCCIÓN
Las metástasis óseas son un evento común para muchas neoplasias malignas. Estas proporcionan un deterioro significativo de la calidad de vida, conducen a varias complicaciones que requieren la actuación del personal médico para paliar los efectos que se producen.1 Cerca del 80 % de las metástasis esqueléticas son secundarias a tumores malignos de la próstata, mama, pulmón, riñón y tiroides. En los últimos diez años se ha observado un incremento progresivo de la incidencia de las metástasis óseas y las complicaciones esqueléticas asociadas a estas en las pacientes con cáncer de mama (CM).2 Esto se correlaciona con el hecho de que las pacientes viven mucho más después del diagnóstico, producto de una mayor eficacia en los tratamientos.
La supervivencia de las mujeres con CM es de aproximadamente 2 años luego del diagnóstico inicial de las metástasis óseas. De ellas, entre el 40 y el 70 % desarrollarán una complicación esquelética2 y un 50 %, presentarán fracturas patológicas.1
Las radiaciones ionizantes, la cirugía ortopédica, los agentes hormonales y citotóxicos, así como los analgésicos, han sido tradicionalmente utilizados en el tratamiento de las metástasis óseas. Más recientemente se han incorporado los bifosfonatos, dirigidos a inhibir el osteoclasto. Hoy día, estos fármacos son utilizados para la prevención y tratamiento de las complicaciones esqueléticas3 y constituyen el tratamiento de elección en la hipercalcemia inducida por tumores malignos, además de reducir el dolor óseo.
Los bifosfonatos son análogos sintéticos de la molécula natural de pirofosfato, con mayor estabilidad que este y más resistentes a la hidrólisis enzimática por los osteoclastos.4 Los fármacos que pertenecen a este grupo tienen propiedades físico-químicas y fármaco-cinéticas similares, pero difieren en la potencia para inhibir la reabsorción. Estos compuestos son pobremente absorbidos por el tracto gastrointestinal porque tienen escasas propiedades lipofílicas.
El ácido zoledrónico (AZ) pertenece a la tercera generación de estos compuestos, y a diferencia de los otros de esta misma generación (risedronato e ibandronato), tiene dos átomos de nitrógeno y se considera el bifosfonato más potente que se conoce.5
Las bases para el uso de los bifosfonatos, y específicamente el ácido zoledrónico, en el tratamiento de las complicaciones esqueléticas secundarias a las metástasis óseas se deben a la unión a las superficies óseas sometidas a remodelación activa, inhibe la maduración de los osteoclastos y suprime la función de estos, inhibe el reclutamiento de los osteoclastos al sitio de resorción ósea, reduce la producción de citoquinas involucradas en la resorción, inhibe la invasión de las células tumorales y la adhesión a la matriz ósea, induce apoptosis en líneas de células tumorales, inhibe la secreción de la célula tumoral y factores de crecimiento que estimulan los osteoblastos e inhibe en número y actividad a los osteoblastos.6,7
De ahí, que en el presente trabajo pretendamos evaluar la eficacia y seguridad del uso del ácido zoledrónico en pacientes con cáncer de mama metastásico a hueso.
MÉTODOS
Pacientes
Se realizó un estudio retrospectivo y descriptivo desde octubre de 2006 hasta diciembre de 2007, de pacientes tratadas en el Servicio de Oncología del HHA, con los siguientes criterios de inclusión: pacientes del sexo femenino con confirmación histológica de cáncer de mama, y que tuviesen metástasis óseas, edad >18 años y < 80 años, estado general ECOG <3, expectativa de vida mayor de 6 meses, funcionamiento normal de los órganos y de la médula ósea, definidos por: leucocitos >3,000/mL; conteo absoluto de neutrófilos >1,500/mL; plaquetas >100,000/mL; bilirrubina total y ALAT/ASAT <2,5 LSN; aclaramiento de creatinina >60 mL/min/1,73 m2. El resto de las pacientes fueron excluidas del estudio. Las pacientes incluidas debieron tener 12 meses de seguimiento por parte del médico de asistencia (como mínimo).
A las pacientes se les realizó valoración clínica (anamnesis y examen físico) además de los siguientes complementarios: hemograma completo, TGP, TGO, radiografía de tórax, ecografía de mama (si fue necesaria) y abdominal, mamografía (si fue necesaria), gammagrafía ósea, tomografía axial computarizada (TAC) abdominal y/o de tórax (si fue necesario), así como TAC y/o resonancia magnética nuclear (RMN) del sitio óseo comprometido (en los casos que lo necesitaron). Los exámenes diagnósticos citológicos y/o histológicos, así como la determinación de los receptores hormonales, y del oncogén c-erb-b2 (Her-2) utilizados, fueron los que la paciente se realizó al diagnóstico de la enfermedad.
El diagnóstico positivo de la enfermedad metastásica a hueso se realizó acorde a los criterios de la UICC (confirmación radiológica, y/o presencia de acúmulo de radiofármacos, por gammagrafía ósea-GG y/o por cambios significativos en TAC óseas realizadas de forma secuencial, las cuales no pueden ser explicadas en los exámenes radiológicos, como una categoría por sí mismo).
Plan de tratamiento
El tratamiento consistió en: ácido zoledrónico (4 mg) 1 bulbo diluido en 100 mL de solución salina (NaCl al 0,9 %) y administrado en no menos de 15 min en infusión IV intermitente, cada 3 a 4 sem hasta progresión de la enfermedad o deterioro de su estado general que le impida la administración del producto.
Evaluación
Para evaluar la toxicidad, se utilizó la clasificación de toxicidad del NCI-CTC (Cancer Therapy Evaluation Program, Common Terminology Criteria for Adverse Events, Version 3.0. Disponible en: http://ctep.cancer.gov, Publish Date: June 10, 2003). En la valoración de toxicidad solo se recogió el mayor grado de toxicidad y evento registrado por cada paciente.
La evaluación de respuesta se realizó acorde a los criterios de respuesta del sistema RECIST (JNCI 2000;92:205-16), donde las metástasis óseas son consideradas como lesiones no medibles. La presencia de compresión ósea o fractura y sus consecuencias no fueron usadas como criterio único para la evaluación del tratamiento. Fueron evaluadas de la siguiente forma:
a) Respuesta completa: desaparición completa de todas las lesiones por radiografía simple o TAC o GG ósea por al menos 4 sem.
b) Respuesta parcial: disminución parcial del tamaño de las lesiones líticas por radiografía simple o recalcificación de las lesiones líticas por al menos 4 sem.
c) Progresión: incremento en las dimensiones de las lesiones líticas existentes o aparición de nuevas lesiones.
d) Enfermedad estable: debido a la respuesta lenta de las lesiones óseas, la denominación de no cambios, no debe ser aplicada hasta después de 8 sem de haber comenzado el inicio del tratamiento.
Los exámenes imagenológicos fueron realizados de acuerdo con la sintomatología de las pacientes, y en caso de no presentar alguna sintomatología, les fueron realizados los exámenes cada 3 meses.
Los exámenes de laboratorio (conteo hematológico y creatinina) fueron realizados antes de cada administración del ácido zoledrónico. Los exámenes de fosfatasa alcalina, LDH, así como calcio y fósforo, fueron indicados por el médico de asistencia con un intervalo no mayor de 3 meses.
Análisis estadístico
El análisis estadístico fue realizado usando el paquete estadístico SPSS 13.0 para Windows. Se utilizaron métodos de estadística descriptiva para el análisis de las características demográficas y médicas de los pacientes. La supervivencia (SV) global y el tiempo para la aparición de nuevos eventos esqueléticos fue estimada usando el método de Kaplan-Meier, y en los grupos en que se realizó comparación de estos en función de la SV, fue utilizado el test de log-rank. Para la comparación de las medias se utilizó el test de comparación (Wilcoxon) para muestras relacionadas. Para la evaluación de la respuesta al dolor se utilizó la escala visual analgésica (EVA), y la comparación de las medias de los diferentes grupos se realizó mediante el test exacto de Fisher.
RESULTADOS
De las 26 pacientes estudiadas se observó un predominio de estas con el tipo histológico de carcinoma ductal infiltrante, los tumores mayores de 2 cm, el compromiso de los ganglios axilares, así como el grado nuclear 2 (tabla 1). Casi el 70% de las pacientes tenían intervalos libres de enfermedad mayores de 24 meses. Predominaron los receptores hormonales positivos, mientras que en el de HER 2, predominaron los negativos.
Tabla 1. Características de las pacientes (I). Antecedentes de la enfermedad
| Característica | Frecuencia | Porcentaje |
| Histología | ||
| Carcinoma ductal infiltrante | 23 | 88,5 |
| Carcinoma lobulillar infiltrante | 3 | 11,5 |
| Clasificación del tumor | ||
| T1 | 3 | 11,5 |
| T2 | 17 | 65,4 |
| T3 | 4 | 15,4 |
| T4 | 2 | 7,7 |
| Compromiso de ganglios axilares | ||
| Negativo | 2 | 7,7 |
| 1-3 ganglios | 16 | 61,5 |
| 4-9 ganglios | 7 | 26,9 |
| ³ 10 ganglios positivos | - | - |
| Etapas clínicas | ||
| IIa | 3 | 11,5 |
| IIb | 12 | 46,2 |
| IIIa | 6 | 23,1 |
| IIIb | 1 | 3,8 |
| IV | 4 | 15,4 |
| Grado nuclear | ||
| I | 5 | 19,2 |
| II | 21 | 80,8 |
| III | - | - |
| Intervalo libre de enfermedad | ||
| < 12 meses | 1 | 3,8 |
| 12-24 meses | 3 | 11,5 |
| 24-36 meses | 8 | 30,8 |
| > 36 meses | 10 | 38,5 |
| Metástasis al diagnóstico | 4 | 15,4 |
| Receptor de estrógenos | ||
| Positivo | 13 | 50,0 |
| Negativo | 10 | 38,5 |
| Desconocido | 3 | 11,5 |
| Receptor HER2 | ||
| Positivo | 3 | 11,5 |
| Negativo | 18 | 69,2 |
| Desconocido | 5 | 19,2 |
En la tabla 2 se pueden apreciar las características generales de las pacientes incluidas en el estudio al momento del tratamiento con el AZ. Existe un predominio de las pacientes menores de 50 años, no obstante, más del 53 % estaban en estado posmenopáusico. En la mitad de las pacientes, la enfermedad metastásica se limitaba al tejido óseo, pero la gran mayoría se encontraba en más de tres sitios, correspondían a lesiones mixtas, y el estado general ECOG era superior a 1. En casi el 70 % de las pacientes se evidenció dolor y en 12 pacientes (46,2 %) se presentó algún evento esquelético relacionado (EER) previo al uso de los bifosfonatos.
Tabla 2. Características de las pacientes (II). Al momento del tratamiento. Ácido zoledrónico
en cáncer de mama metastásico. Hospital Hermanos Ameijeiras. 2006–2007
| Características | Frecuencia | Porcentaje |
| Edad | ||
| < 50 años | 13 | 50,0 |
| 51-70 años | 10 | 38,5 |
| > 70 años | 3 | 11,5 |
| ECOG | ||
| 0 | 2 | 7,7 |
| 1 | 12 | 46,2 |
| 2 | 10 | 38,5 |
| 3 | 2 | 7,7 |
| Estado menstrual | ||
| Premenopáusicas | 12 | 46,2 |
| Posmenopáusicas | 14 | 53,8 |
| Extensión extraósea | ||
| Solo ósea | 13 | 50,0 |
| Ósea más partes blandas | 5 | 19,2 |
| Ósea más viscerales | 8 | 30,8 |
| Localización en el esqueleto | ||
| Base de cráneo | - | - |
| vertebrales | 8 | 30,8 |
| Pelvis-femorales | 3 | 11,5 |
| Combinaciones | 15 | 57,7 |
| Tipo de extensión | ||
| Localizadas(< 3 sitios) | 11 | 42,3 |
| Diseminadas (> 3 sitios) | 15 | 57,7 |
| Tipo de lesiones | ||
| Osteolíticas | 6 | 23,1 |
| Osteoblásticas | 1 | 3,8 |
| Mixtas | 19 | 73,0 |
| Presencia de dolor | ||
| Sí | 18 | 69,2 |
| No | 8 | 30,8 |
| Eventos esqueléticos previos | ||
| Radioterapia a hueso | 6 | 23,1 |
| Fractura patológica | 2 | 7,7 |
| Cirugía mas radioterapia | 2 | 7,7 |
| Fractura patológica más radioterapia | 1 | 3,8 |
| Compresión medular más cirugía más radioterapia | 1 | 3,8 |
| Hipercalcemia | - | - |
Menos del 50 % de las pacientes alcanzaron alguna remisión objetiva (remisiones completas más remisiones parciales), y predominaron las estabilizaciones de la enfermedad metastásica ósea (Fig. 1). La mediana de supervivencia de las pacientes tratadas con el AZ fue de 33,82 meses (IC 95 %: 25,73; 41,90), mientras que el tiempo para la aparición de algún EER fue de 27,82 meses (IC 95 %: 21,79; 33,86). No hubo diferencias estadísticamente significativas tanto para la supervivencia global, como para el tiempo de la aparición de EER entre el grupo de pacientes con EER previo al uso del AZ y el que no había tenido ningún EER (datos no mostrados).
De forma global, 11 pacientes (42,3 %) experimentaron al menos un EER luego de comenzar el tratamiento con el AZ. Al menos un EER ocurrió en 5 de 14 pacientes (35,7 %) en quienes no habían presentado un EER previo, versus 6 de 12 pacientes (50 %) con EER previo. La distribución de los EER posteriores se describe en la tabla 3.
En la tabla 4 se exponen los resultados de la percepción del dolor, según la escala visual analgésica (EVA) por parte de las pacientes que al comienzo del tratamiento presentaban dolor. Como puede apreciarse, el 50 % de las pacientes (n=9) presentaban dolor severo (EVA e»7) al inicio del tratamiento con el AZ, mientras que a los doce meses, ninguna paciente se encontraba en esa categoría, y el 66,6 % (n=12) no referían dolor alguno (p=0,021).
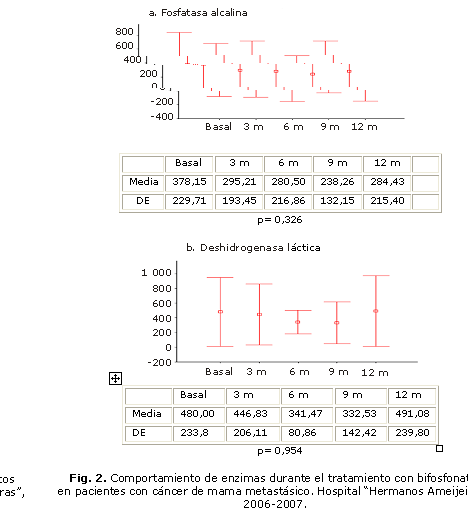
En 11 de las 26 pacientes (42,3 %) se reportó un síndrome pseudogripal, luego de la primera infusión (fiebre de menos de 38,5° C, fatiga, artralgia, mialgia, náusea e incremento del dolor óseo), cuya duración fue inferior a las 48 h, y que requirió en 7 de las 11 pacientes, el uso de analgésicos por 72 h. No hubo toxicidad hematológica y no se demostraron diferencias estadísticamente significativas del comportamiento de las enzimas como la fosfatasa alcalina, y la LDH (Fig. 2).
No se reportó ningún caso de insuficiencia renal y la creatinina (Fig. 3) no tuvo variación significativa con el uso del AZ (12 meses versus basal).
DISCUSIÓN
Las características generales de las pacientes incluidas en el presente estudio se corresponden con el patrón general de afectación de la enfermedad metastásica ósea secundaria a un cáncer de mama,8 donde predominan las mujeres con factores de mayor riesgo para este tipo de localización secundaria: receptores hormonales positivos, con HER-2 negativo, ganglios axilares positivos e intervalos libres de enfermedad mayor de 2 años.
Cerca del 25 % de las pacientes con metástasis óseas permanecen asintomáticas, y el diagnóstico viene realizado por otros motivos o durante la intervención del tumor primario. En el resto, las localizaciones óseas son responsables desde el punto de vista clínico de una serie de complicaciones definidas como EER. Según las guías internacionales estos son: fracturas patológicas, radiaciones sobre un segmento óseo, cirugía ortopédica, compresión medular y la hipercalcemia. La atención al paciente con metástasis óseas y sus complicaciones representan un problema importante y complejo también desde el punto de vista sanitario y los presupuestos que de ello se derivan.1-2
El AZ ha demostrado poseer una alta eficacia en el tratamiento de las metástasis óseas. Estos resultados se han demostrado, primero en modelos preclínicos5 y luego en ensayos clínicos realizados9-11 con un alto poder estadístico. No obstante, si se evaluara la eficacia del mismo, por el número de remisiones que induce podríamos errar en este análisis, pues en este escenario, la estabilización del proceso se puede considerar como un éxito terapéutico. Existen otros indicadores12 que pueden describir mejor el grado de eficacia: el beneficio en términos de calidad de vida, disminución de EER, reducción del dolor, entre otros. Una limitación de nuestro estudio es su carácter retrospectivo, por lo que los exámenes radiológicos no fueron realizados de una forma programada. La densitometría ósea no pudo ser realizada en las pacientes, pues esta técnica comenzó a funcionar de forma regular después de la inclusión de las pacientes.
En un estudio comparativo de no inferioridad entre el AZ (4 mg) y el pamidronato (PM) de 90 mg, donde se analizó el número de eventos por año (excluyendo la hipercalcemia), no existió una diferencia significativa (0,9 para el zoledronato y 1,49 para el pamidronato; p= 0,125), aunque con el método de Anderson Gill (análisis de eventos múltiples), se reporta que el AZ redujo el riesgo de eventos esqueléticos en un 20 % con respecto al PM (RR 0,80, 95 % IC 0,66-0,99; p=0,025). En un subgrupo de pacientes (metástasis líticas y tratadas con terapia hormonal) aumentaba significativamente el tiempo de aparición de la primera complicación esquelética (136 d para el AZ y 45 d para el PM; p< 0,01).
Un metanálisis10 documentó que los bifosfonatos en relación con un placebo, reducen el riesgo de fracturas no vertebrales (RR 0,80; 95 % IC:0,64-0,99), de todas las fracturas (RR 0,75; 95 % IC 0,61-0,93), de necesidad de radioterapia (RR 0,65; 95 % IC 0,54-0,79), de intervención de ortopedia (RR 0,59; 95 % IC 0,43-0,83), y de hipercalcemia (RR 0,43; 95 % IC 0,29-0,63). En nueve estudios (n=2 189) de mujeres con cáncer de mama avanzado y metástasis esqueléticas, evidenciadas por radiología o por gammagrafía, el tratamiento con bifosfonatos redujo el riesgo de ocurrencia de una complicación esquelética (RR 0,79 %; 95 % IC 0,74-0,86).
El principal objetivo del tratamiento de las metástasis óseas con bifosfonatos es el de prevenir los EER.11 Los bifosfonatos actúan directamente en la reducción del dolor secundario a estas, y posiblemente, la de incrementar la SV de los pacientes con metástasis óseas. Se ha demostrado la eficacia en la reducción del riesgo de desarrollo de complicaciones esqueléticas y secundariamente, en el retardo de su aparición.12
Existen fuertes evidencias que los bifosfonatos son eficaces para el control del dolor tanto en los tumores sólidos, como en el mieloma múltiple.13 Los resultados obtenidos en nuestro estudio demuestran que el efecto analgésico de los bifosfonatos es independiente de la eficacia clínica, como la reducción de los eventos esqueléticos relacionados. Este efecto parece estar correlacionado con el proceso de recambio óseo, denominado en inglés «turnover», y solo los pacientes que normalizan este, obtienen una significativa mejoría.13,14
El efecto sobre el dolor es una de las variables principales de respuesta que reviste una notable importancia clínica, debido a que su control es un componente fundamental de la calidad de vida del paciente. El efecto de los bifosfonatos sobre el dolor en el curso del tratamiento por metástasis óseas en el cáncer de mama, ha estado demostrado en la mayoría de los ensayos clínicos aleatorizados con los diversos tipos de bifosfonatos y con todas las formulaciones. Estos datos han sido tomados de los diversos ensayos clínicos a partir de una heterogeneidad de instrumentos de evaluación y escalas. Un significativo efecto sobre el dolor y la reducción del uso de analgésicos ha estado documentado en numerosos ensayos clínicos.10,15
La enfermedad metastásica ósea se asocia invariablemente a una sintomatología dolorosa generalmente intensa, de difícil control y con un importante compromiso de la calidad de vida de la paciente. El control del dolor, por tanto se convierte para estas pacientes en un objetivo prioritario y la calidad de vida del paciente representa la variable principal de eficacia en el tratamiento de las metástasis óseas.15
La severidad del dolor puede ser evaluada por escalas de intensidad, y cuestionarios multidimensionales. Muchos métodos han sido usados para evaluar el dolor provocado por las metástasis óseas, y no existe, universalmente, un instrumento validado y aceptado por la comunidad científica.16 Entre ellas se distingue la escala visual analgésica (EVA),17 que se caracteriza por su sencillez tanto para el médico, como para el paciente, y está muy estrechamente relacionada con el bienestar del paciente. En nuestro estudio pudo corroborarse que a medida que las pacientes recibieron los diferentes ciclos de tratamiento con el AZ, disminuyó el dolor, y por ende, el consumo de analgésicos, de esa manera se incrementó la calidad de vida de estas pacientes.
El mantenimiento de la movilidad, de la autosuficiencia y el control del dolor son componentes fundamentales de la calidad de vida, están ligados a la reducción de las complicaciones esqueléticas. Aún existe la necesidad de adoptar un instrumento para la exploración de la calidad de vida más idóneo y estandarizado que se dirija especialmente a las pacientes con metástasis óseas.
Las complicaciones esqueléticas empeoran la calidad de vida de las pacientes, disminuyen la posibilidad terapéutica y como consecuencia, empeoran el pronóstico. Además de la localización y el tipo de metástasis, también el tipo de tratamiento influye sobre la frecuencia de estas complicaciones. Por esta razón es muy útil la creación de modelos organizativos en los cuales se tenga en cuenta la interdisciplinariedad de las intervenciones diagnósticas, terapéuticas y rehabilitadoras, sobretodo de tipo preventivo, que reduzca los tiempos de espera para diversos procederes y la fragmentación en el manejo de las pacientes con metástasis óseas. Este modelo debe constituirse con el oncólogo, el radioterapeuta, el paliativista, el ortopédico, el radiólogo, el fisiatra, así como enfermeras especializadas y manejadora de datos.18,19
Los marcadores de "recambio" óseo (fundamentalmente, los marcadores de lisis del colágeno)20 parecen potencialmente constituirse en los primeros surrogados de eficacia, dado que los bifosfonatos inhiben profundamente el metabolismo óseo. Existen varios reportes21 que arrojan que las pacientes con CMM que tienen niveles basales elevados de N-Telopéptido (NTX), y que luego normalizan sus valores a los 3 meses de tratamiento con AZ, tienen menor probabilidad de presentar una complicación esquelética, progresión ósea de la enfermedad, y de muerte, respecto a las pacientes que mantienen niveles altos de NTX durante el tratamiento. No obstante, aún este marcador no se emplea de forma rutinaria en la clínica y se recomienda su utilización solo en el marco de investigaciones clínicas.22
La duración óptima del tratamiento no ha sido establecida.23 La duración aconsejada, en ausencia de datos suficientes, es de al menos 2 años (la mayor parte de los estudios reportados son por un período de tratamiento de 2 años). La continuación del tratamiento (más allá de 2 años) es recomendada en pacientes con un mayor riesgo de desarrollar eventos esqueléticos, en base a la tolerancia y las condiciones generales de las pacientes.23-25
La deficiencia de vitamina D reduce la absorción intestinal de calcio, y se asocia a un incremento del "recambio" óseo y a una reducción de la fuerza muscular, aumentando el riesgo de caída.26 Cuando se suministra AZ a un paciente con déficit de vitamina D, se incrementa el riesgo de hipocalcemia,27 debido a un hiperparatiroidismo secundario. La paratohormona estimula la actividad osteoclástica y la disponibilidad de factores de crecimiento del microambiente óseo, favoreciendo la progresión de la enfermedad ósea.28 Dado que la vitamina D ha demostrado tener efecto antiproliferativo en varias neoplasias, y la carencia de esta puede limitar la eficacia de los bifosfonatos, se sugiere y es indispensable, un suplemento diario tanto de calcio (1 200 mg) como de vitamina D (800 UI).29
Las principales toxicidades del AZ son transitorias y de muy corta duración, por lo general, autolimitadas.5,10,23 El perfil de toxicidad es previsible y generalmente muy bien tolerable. La frecuencia de eventos adversos (EA) es bastante baja. Los eventos más frecuentes están relacionados con un síndrome pseudogripal, acompañado de fiebre, dolor óseo, astenia, y rigidez. No se han observado incrementos de EA con los tratamientos a largo plazo (más de dos años) con el AZ. No se han evidenciado alteraciones hematológicas, ni hepáticas a corto, ni a largo plazo.24,25 En el presente estudio, 11 de las 26 pacientes (42,3 %) han recibido AZ por encima de 24 meses, y no han presentado toxicidad crónica.
Aunque se observa un aumento de la creatinina entre las pacientes con CM tratadas con AZ (4 mg), cada 3-4 sem por 2 años, no se han observado incrementos severos que modifiquen el grado de toxicidad. Los efectos sobre la función renal son previsibles y dependen de la dosis y de la velocidad de infusión. A las dosis recomendadas, no es común el incremento significativo de los niveles de creatinina.23-25
La frecuencia30 de osteonecrosis del maxilar (ONM) es extremadamente baja (del 0,7 % al 1,2 %). Los factores de riesgo más importantes son la cirugía dental-alveolar y la patología de la cavidad bucal (implantología y la cirugía periapical), así como los tratamientos a largo plazo con esteroides.31 De lo anterior, se desprende la importancia de realizar cualquier intervención odontológica previo a iniciar el tratamiento con AZ. Solo hubo un caso de infección gingival, la cual no podemos clasificarla como una osteonecrosis de la mandíbula por ser dudosos los exámenes imagenológicos, y la negativa familiar de realizarle una biopsia de la lesión.
La experiencia obtenida en el manejo de las metástasis óseas con el AZ nos ha permitido realizar la hoja informativa necesaria para ser incorporada al texto del Formulario Nacional de Medicamentos, así como la sección correspondiente de los bifosfonatos del sistema de indicaciones estandarizadas del Servicio de Oncología clínica del HHA: protocolos estandarizados, hoja para enfermería, y hoja para farmacia. Este sistema está actualmente en fase de generalización a nivel nacional.
Conclusiones
El presente estudio constituye el primer reporte en Cuba, de la utilización de los bifosfonatos en una localización tumoral. Se ha demostrado la eficacia del AZ en el tratamiento de la enfermedad metastásica ósea por el cáncer de mama en términos de reducción de los EER, el tiempo de aparición de estos, incremento de la SV, así como la reducción del dolor y el consumo de analgésicos, y por ende, la elevación de la calidad de vida. Por otra parte, se ha corroborado el buen perfil de seguridad que posee el AZ cuando se cumplen las guías de su administración, que permiten su utilización incluso más allá de 24 meses.
REFERENCIAS BIBLIOGRÁFICAS
1. Coleman RE. Clinical features of metastatic bone disease and risk of skeletal morbidity. Clin Cancer Res. 200612:6243s-6249s.
2. Selvaggi G, Scagliotti GV. Management of bone metastases in cancer: A review. Critical Reviews in Oncology/Hematology. 2005;56:365-78.
3. Ross JR, Saunders Y, Edmonds PM, Patel S, Broadley KE, Johnston SR. Systematic review of role of biphosphonates on skeletal morbidity in metastatic cancer. BMJ. 2003;327:469-75.
4. Body JJ. Biphosphonates for malignancy-related bone disease: current status, future developments. Support Care Cancer. 2006;14:408-18.
5. Green JR, Rogers MJ. Pharmacologic profile of zoledronic acid: a highly potent inhibitor of bone resorption. Drug Dev Res. 2002;55:210-24.
6. Wellington K, Goa KL. Zoledronic acid. A review of its use in the management of bone metastases and hypercalcemia of malignancy. Drugs. 2003;63:417-37.
7. Neville-Webbe H, Holen I, Coleman RE. The anti-tumour effects and potential of biphosphonates. Cancer Treatments Reviews. 2002;28:305-20.
8. Pérez JE, Machiavelli M, Leone BA. Bone-only versus visceral-only metastatic pattern in breast cancer: analysis of 150 patients. Am J Clin Oncol. 1990;13:294.
9. Rosen LS, Gordon D, Kaminski M. Zoledronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma: a phase III, double-blind, comparative trial. Cancer J. 2001;7:377-87.
10. Pavlakis N, Schmidt R, Stockler M. The Cochrane Database of Systematic Reviews: Biphosphonates for breast cancer. Cochrane Database Syst Rev. 2005;20(3).
11. Kohno N, Aogi K, Minami H, Nakamura S, Asaga T, Iino Y, et al. Zoledronic acid significantly reduces skeletal complications compared with placebo in Japanese women with bone metastases from breast cancer: a randomized, placebo-controlled trial. J Clin Oncol. 2005;23:3314-21.
12. LoRusso P. Analysis of skeletal-related events in breast cancer and response to therapy. Semin Oncol 2001;28(Suppl 11):227.
13. Gralow J, Tripathy D. Managing metastatic bone pain: The role of biphosphonates. J Pain Symptom Manage. 2007;33:462-72.
14. Fulfaro A, Arcara C, Badalamenti G. The use of zoledronic acid in the treatment of painful bone metastases from prostate cancer. Am Soc Clin Oncol. 2003(Abstr 1721).
15. Wardley A, Davidson N, Barrett-Lee P, Hong A, Mansi J, Dodwell D, et al. Zoledronic acid significantly improves pain scores and quality of life in breast cancer patients with bone metastases: a randomized, crossover study of community vs. hospital biphosphonate administration. Br J Cancer. 2005;23;92:1869-76.
16. Cleeland CS. The measurement of pain from metastatic bone disease: capturing the patient's experience. Clin Cancer Research 2006;12(Suppl):6236s-6242s.
17. Caraceni A, Mendoza TR, Mencaglia E, Baratella C, Edwards K, Forjaz MJ, et al. A validation study of the Italian version of the Brief Pain Inventory (Breve questionario per la valutazione del dolore). Pain. 1996;65:87-92.
18. Santini D, Fratto ME, Vincenzi B, Galluzzo S, Tonini G. Zoledronic acid in the management of metastatic bone disease. Expert Opin Biol Ther. 2006;6:1333-48.
19. Clemons M, Dranitsaris G, Cole D, Gainford MC. Too much, too little, too late to start again? Assessing the efficacy of biphosphonates in patients with bone metastases from breast cancer. The Oncologist. 2006;11:227-33.
20. Brown JE, Cook RJ, Major P, Lipton A, Saad F, Smith M, et al. Bone turnover markers as predictor of skeletal complications in prostate cancer, lung cancer and other solid tumors. J Nat Cancer Inst. 2005;97:59-69.
21. Lipton A, Cook RJ, Major P, Smith MR, Coleman RE. Zoledronic acid and survival in breast cancer patients with bone metastases and elevated markers of osteoclast activity. The Oncologist. 2007;12:1035-43.
22. Clamp A, Danson S, Nguyen H, Cole D, Clemons M. Assessment of therapeutic response in patients with metastatic bone disease. Lancet Oncol. 2004;5:607-16.
23. Conte P, Guarneri V. Safety of intravenous and oral biphosphonates and compliance with dosing regimens. The Oncologist. 2004;4(9 Suppl):28-37.
24. Dincer M, Altundag K, Harputluoglu H, Aksoy S, Cengiz M, Gullu I. Renal safety of zoledronic acid administration beyond 24 months in breast cancer patients with bone metastases. Med Oncol. 2008;25:356-9.
25. Guarneri V, Donati S, Nicolini M, Giovannelli S, D'Amico R, Conte PF. Renal safety and efficacy of i.v. biphosphonates in patients with skeletal metastases treated for up to 10 years. The Oncologist. 2005;10:842-8.
26. Holick MF. Vitamin D deficiency. N Engl J Med. 2007;357:266-81.
27. Rosen CJ, Brown S. Severe hypocalcemia after intravenous biphosphonate therapy in occult vitamin D deficiency. N Engl J Med. 2003;348:1503-04.
28. Berruti A, Tucci M, Generali D, Mosca A, Ardine M, Vana F, et al. Management of the side-effects of intravenous biphosphonates: targeting the serum parathyroid hormone elevation. Ann Oncol. 2006;17:1854-5.
29. Schwalfenberg G. Not enough vitamin D. Health consequences for Canadians. Can Fam Physician. 2007;53:841-54.
30. Hoff AO, Toth BB, Altundag K, Johnson MM, Warneke CL, Hu M, et al. The frequency and risk factors associated with osteonecrosis of the jaw in cancer patients treated with intravenous biphosphonates. J Bone Miner Res. 2008;23:826-36.
31. Ruggiero SL, Fantasia J, Carlson E. Biphosphonate-related osteonecrosis of the jaw: background and guidelines for diagnosis, staging and management. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006 Oct;102(4):433-41.
Recibido: 15 de octubre de 2009.
Aprobado: 30 de octubre de 2009.
Dr. Jorge L. Soriano García. Servicio de Oncología. Hospital Clínico Quirúrgico "Hermanos Ameijeiras". San Lázaro # 701 esq. Belascoaín. Ciudad de La Habana. Código postal 10 300. Centro Habana. La Habana, Cuba. Tel. 876-1926. Correo electrónico:soriano@infomed.sld.cu