Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.50 n.1 Ciudad de la Habana ene.-mar. 2011
TEMAS ACTUALIZADOS
Miocarditis viral en el adulto
Viral myocarditis in the adult
Daniel Limonta Velázquez,I Juan F. Batista Cuéllar,II Miguel A. Riaño Arencibia,III Anselmo Abdo CuzaIV
I Máster en Virología. Especialista de I Grado en Medicina General Integral. Especialista de I Grado en Microbiología Médica. Instructor. Instituto de Medicina Tropical "Pedro Kourí" (IPK). La Habana, Cuba.
II Especialista de I Grado en Medicina Interna. Especialista de II Grado en Cardiología. Asistente. Centro de Investigaciones Clínicas (CIC). La Habana, Cuba.
III Especialista de II Grado en Caumatología. Verticalizado en Medicina Intensiva y Emergencias. Profesor Auxiliar. Facultad de Medicina "Miguel Enríquez". La Habana, Cuba.
IV Doctor en Ciencias Médicas. Especialista de I Grado en Medicina Interna. Especialista de II Grado en Medicina Intensiva y Emergencias. Profesor Titular. Centro de Investigaciones Médico Quirúrgicas. La Habana, Cuba.
RESUMEN
La miocarditis viral es resultado de una inflamación del miocardio provocada por diferentes virus. Esta enfermedad cardíaca constituye sin duda una urgencia cardiovascular en el adulto por las complicaciones que ocasiona. El cuadro clínico se caracteriza por arritmias e insuficiencia cardíaca que pueden conducir a la muerte. La secuela más frecuente de la miocarditis viral a largo plazo es la miocardiopatía dilatada. En el presente trabajo se revisa etiología, fisiopatología, sintomatología, diagnóstico y tratamiento de la miocarditis viral en el adulto.
Palabras clave: Miocarditis, virus, insuficiencia cardíaca, arritmias, choque cardiogénico, biopsia endomiocárdica, miocardiopatía dilatada.
ABSTRACT
Viral myocarditis is the result of a myocardial inflammation provoked by different viruses. This cardiac disease is doubtless a cardiovascular urgency in the adult due to its complications. The clinical picture is characterized by arrhythmias and cardiac failure that may to lead to death. The more frequent long-term myocarditis sequela is the dilated myocardiopathy. In present paper etiology, pathophysiology, symptomatology, diagnosis and treatment of viral myocarditis in the adult are reviewed.
Key words: Myocarditis, virus, cardiac failure, arrhythmias, cardiogenic shock, endomyocardial biopsy, dilated myocardiopathy.
INTRODUCCIÓN
Las infecciones virales constituyen sin duda la causa más frecuente de miocarditis. La miocarditis viral se puede presentar en cualquier paciente con abundantes síntomas, desde episodios ligeros de disnea y dolor torácico que desaparecen sin terapia específica hasta el potencialmente fatal choque cardiogénico. En el adulto se puede encontrar la secuela a largo plazo más frecuente de la miocarditis viral que es la miocardiopatía dilatada con insuficiencia cardíaca crónica.1 En este trabajo se presenta una revisión actualizada y práctica de la miocarditis viral en el adulto.
Epidemiología
En la actualidad la verdadera incidencia de la miocarditis viral es desconocida y posiblemente exista un subregistro de la enfermedad porque, usualmente, no se realiza la biopsia endomiocárdica para confirmarla. Además, los datos de la respuesta de anticuerpos en la población contra los enterovirus asociados comúnmente a las miocarditis son difíciles de interpretar a causa de la reacción cruzada que habitualmente ocurre entre ellos.1
Los informes de necropsia, de acuerdo con las diferentes poblaciones estudiadas, muestran incidencias variables de miocarditis con un rango de 0,12 a 12 %. Las miocarditis se observan con más frecuencia en la infancia y después en la adultez, se presenta, sobre todo entre los 20 y 54 años.2,3 En uno de estos estudios de autopsias realizado en Finlandia,3 la miocarditis se presentó fundamentalmente en niños y comenzaba a disminuir de forma importante después de los 54 años (con una proporción de 6,38 a 1,12 en 1 000 muertes). Después de los 55 años y hasta mayores de 75, la proporción diminuyó de 0,39 a 0,11 en 1 000 muertes.3
Etiología
Las infecciones por virus cardiotrópicos se mantienen como la causa principal de miocarditis en países en desarrollo.1 Sin embargo, la miocarditis puede ser provocada por otras causas infecciosas (bacterianas, fúngicas y parasitarias), enfermedades autoinmunes, hipersensibilidad a medicamentos, reacciones tóxicas, cáncer, sarcoidosis, miocarditis eosinofílica y miocarditis de células gigantes.4
Las miocarditis virales son causadas principalmente por virus coxsackie B (pertenecientes a la familia de los enterovirus), adenovirus y parvovirus B19.1,5,6 Sin embargo, se han reportado miocarditis de origen viral por virus de la inmunodeficiencia humana 1 (VIH-1),7,8 virus de la influenza A y B9, rotavirus10 y virus herpes humano como el citomegalovirus,5,11 virus de Epstein-Barr5 y el virus herpes 6.5,11,12 En un trabajo reciente se han descrito miocarditis causadas por coinfecciones de estos virus.6 También se ha documentado miocarditis por virus de la hepatitis C13,14 y arbovirus o virus trasmitidos por artrópodos como el virus dengue15 y el chikungunya.16
To KKW y otros, en una muy reciente investigación en Hong Kong, demostraron que 5 de 23 casos adultos fallecidos por el virus pandémico de influenza A H1N1 del año 2009 presentaban evidencias ecocardiográficas de miocarditis (3 casos confirmados post mortem con miocarditis linfocítica) y que además eran estos 23 individuos los de edad más avanzada.17
En nuestro país existen escasos reportes de miocarditis viral y solo en niños hay reportes de miocarditis causada por virus dengue serotipo 2 en una epidemia de dengue del año 198118 y por adenovirus en un brote epidémico durante el año 2005.19,20
Fisiopatología
Aunque la fisiopatología de la miocarditis viral ha sido ampliamente estudiada en modelos experimentales en ratones y de forma limitada en tejido miocárdico humano, se conoce que la reacción inflamatoria en la miocarditis de etiología viral se debe al daño directo causado por los virus o la respuesta inmune antiviral y se encuentra relacionada con la susceptibilidad genética del hospedero.1
Actualmente se conoce que los virus cardiotrópicos por excelencia como los virus coxsackie B y adenovirus 2 y 5 comparten los mismos receptores sobre células miocárdicas llamados CAR (del inglés, coxsackie-adenovirus receptor).21 Estudios experimentales han demostrado que la expresión de los CAR es más alta en las primeras etapas de la vida y que luego disminuye en el curso de la vida adulta. Estos hallazgos podrían explicar la susceptibilidad en la edad pediátrica a las miocarditis virales.22
El daño directo al miocardio mediado por la invasión viral se ha demostrado por una proteasa que es codificada por el virus coxsackie B3 llamada proteasa 2 A que tiene efecto proteolítico sobre la distrofina (proteína que se une a la actina).23 Además, la proteasa 2A y la proteasa 3C de los virus coxsackie B3 pueden inducir apoptosis de los miocitos.24
Por otro lado se ha demostrado, de forma experimental, que los virus coxsackie B3 comparten determinantes antigénicos con la miosina y este mimetismo molecular induce autoanticuerpos antimiosina y un mecanismo autoinmune de destrucción del tejido miocárdico. Adicionalmente, estos mismos autoanticuerpos antimiosina presentan reacción cruzada con los receptores b1 adrenérgicos situados sobre los miocitos induciéndolos a morir por apoptosis.25
La interrelación que existe entre la respuesta inmune antiviral de tipo innata y la adquirida desempeña un papel fundamental en el desenlace de la infección por virus del tejido miocárdico. Estudios en modelos animales indican que mecanismos efectores de la respuesta innata como el TNF, oxido nítrico, activación del complemento y receptores tipo toll (que reconocen patrones moleculares asociados a microorganismos patógenos) podrían estar involucrados en la inducción del daño miocárdico.26
El infiltrado inflamatorio con abundante presencia de células mononucleares, a predominio de linfocitos, en las lesiones de miocarditis de etiología viral, pone de manifiesto la amplia participación de la respuesta inmune mediada por células. Se ha demostrado que la liberación de ciertas citocinas proinflamatorias por las células T ayudantes (Th1 y Th2) y la más recientemente descrita interleucina 17 producida por las células T tipo 17 (Th17) incrementan la severidad de la miocarditis en modelos animales.21
Entre los factores del hospedero posiblemente relacionados con la infección viral del miocardio se han postulado haplotipos del complejo mayor de histocompatilibilidad como el locus HLA-DQ27 y polimorfismos genéticos del CD45 (participa en el funcionamiento de los linfocitos).28
Se necesita mayor comprensión de los mecanismos fisiopatológicos de la miocarditis que puedan explicar por qué la mayoría de las infecciones por virus cardiotrópicos no resultan clínicamente en inflamación del miocardio y, sin embargo, en una minoría de los casos resulta en daño miocárdico persistente de origen inmunológico.1
Manifestaciones clínicas
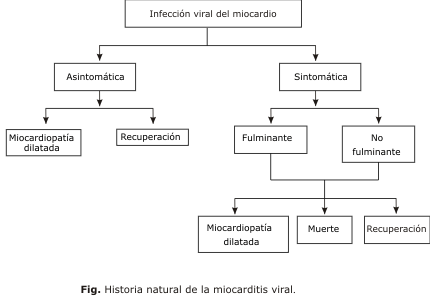
La miocarditis viral, desde el punto de vista de la evolución clínica, puede desarrollarse en 3 estadios: agudo, sub-agudo y crónico. El paso de un estadio a otro no siempre es evidente o puede presentarse la enfermedad inicialmente en una etapa sub-aguda o crónica.29-31 En la historia natural de la enfermedad (fig.), las 3 etapas pueden ser evolutivas, terminar con la curación del paciente, con una secuela o con la muerte, según la susceptibilidad inmunológica individual, la virulencia del agente viral y el estado de salud previo del paciente.29,30
En la práctica clínica, la enfermedad puede ser inicialmente asintomática y evolucionar solapadamente hacia la miocardiopatía dilatada o comenzar con síntomas no específicos, entre los cuales son frecuentes la astenia, fiebre y dolor faríngeo con síntomas de infección viral del tracto respiratorio superior o gastrointestinal en los días previos. También se puede observar una taquicardia no explicable, molestia precordial por compromiso pericárdico o síntomas más relevantes como síncope, disnea severa, arritmias supraventriculares y trastornos de conducción, insuficiencia cardíaca e inestabilidad hemodinámica.4
En ocasiones, el dolor precordial en el curso de la miocarditis puede simular una angina típica con cambios electrocardiográficos que incluyen la elevación del segmento S-T y otros cambios sugestivos del infarto del miocardio, no obstante, los estudios angiográficos muestran coronarias normales.32 Adicionalmente, de forma más infrecuente, el dolor torácico puede asociarse a vasospasmo de las arterias coronarias como reportaron McCully RB y otros.33
No es poco común que en los casos de inicio agudo con predominio de síntomas y signos de la afección miocárdica, el examen físico revele soplos de insuficiencia valvular mitral o tricuspídea, tercer ruido y ritmo de galope ventricular.1
Los casos con cuadro fulminante pueden presentarse con insuficiencia cardíaca severa, choque cardiogénico, embolismos pulmonares por trombos murales en cavidades cardíacas derechas y muerte súbita. No obstante, la presentación benigna es la forma evolutiva más frecuente de la miocarditis aguda de etiología viral.1
Es así que por el amplio espectro de presentaciones clínicas de la miocarditis viral aguda los médicos deben considerar una amplia gama de síndromes del aparato cardiovascular, que pueden ser de causa infecciosa o no, en el diagnóstico diferencial.
Diagnóstico
La evaluación inicial de una miocarditis viral incluye una detallada historia de la enfermedad, un cuidadoso examen cardiovascular y general, y exámenes complementarios en busca de aclarar la posible causa viral. Los exámenes complementarios deben incluir analítica hemática, electrocardiograma, radiografía de tórax, otras técnicas imaginológicas no invasivas y la biopsia endomiocardíaca.21
Algunos exámenes complementarios no específicos podrían mostrar eritrosedimentación acelerada con incremento de leucocitos sanguíneos y proteína C reactiva. Los marcadores de daño miocárdico, troponina I y T, pueden ser útiles para confirmar el diagnóstico de miocarditis si se encuentran aumentados en el suero.34-36 Estos marcadores suelen estar más incrementados que la fosfocinasa de creatina y la fosfocinasa de creatina isoenzima MB.35,36
Las pruebas de detección de anticuerpos antivirales y de aislamiento viral en el suero u otra muestra clínica para determinar la infección por diferentes virus cardiotrópicos podrían apoyar los hallazgos clínicos, de laboratorio e imaginológicos y contribuir así a un diagnóstico presuntivo de esta entidad si no se realiza una biopsia endomiocárdica. Sin embargo, estas pruebas pueden ayudar a determinar la causa en los pacientes con sospecha de miocarditis que no se sometan al procedimiento de la biopsia endomiocárdica.1
A pesar de su amplio uso, la sensibilidad del electrocardiograma en el diagnóstico de la miocarditis es sólo de 47 %.37 En la miocarditis, el electrocardiograma puede mostrar taquicardia sinusal y anormalidades no específicas del segmento ST y de la onda T, pero también pueden observarse cambios sugestivos de lesión miocárdica como infradesnivel o supradesnivel de ST y onda Q patológica.32,33 Adicionalmente, pueden ser encontrados signos agudos de participación pericárdica. La observación de bloqueo completo de rama izquierda o la aparición de ondas Q se ha asociado con altas tasas de mortalidad.38,39
Independientemente de que no existen patrones ecocardiográficos patognomónicos en la miocarditis, han sido bien documentados en casos histopatológicamente probados de esta entidad hallazgos como: dilatación, hipertrofia, miocardiopatía restrictiva y miocardiopatía isquémica, así como trastornos regionales del movimiento de paredes ventriculares como los observados en el infarto del miocardio.40 El ecocardiograma puede servir para diferenciar entre la miocarditis subaguda y la fulminante porque la fulminante se presenta con cavidad cardíaca izquierda más pequeña y paredes engrosadas.41 La disfunción severa del ventrículo derecho ha sido reportada como el indicador más robusto de mortalidad o necesidad de trasplante cardíaco.42
La resonancia magnética cardiovascular ha emergido como la herramienta imaginológica más importante en el procedimiento diagnóstico de la miocarditis. Tal es así que la resonancia magnética cardiovascular contrastada T1-T2, está siendo cada vez más utilizada no sólo para detectar imágenes sugestivas de miocarditis, sino también para señalar las zonas adecuadas para tomar muestras de biopsias endomiocárdicas con alta sensibilidad y especificidad.43-45
Los estudios de Medicina Nuclear también han hecho aportes al diagnóstico y seguimiento de la enfermedad. Dos tipos de estudios se reportan como los más útiles para detectar focos de miocarditis: la gammagrafía con Galio 67 y la gammagrafía con anticuerpos monoclonales antimiosina marcados con Indium 111.46,47
Luego del surgimiento de la biopsia endomiocárdica, los criterios histopatológicos utilizados en su interpretación presentaban dificultades por lo cual en la década de los 80 se realizó una convención de patólogos, en la ciudad de Dallas de los Estados Unidos, que establecieron los criterios que llevan el nombre de dicha ciudad. Los criterios histopatológicos de Dallas describen la miocarditis como un infiltrado celular inflamatorio asociado o no a necrosis de los miocitos en cortes de tejido miocárdico con técnicas de tinción convencionales.48
Los criterios de Dallas presentan limitaciones y han sido cuestionados por la interpretación individual, baja sensibilidad y poco valor pronóstico.49 Estas limitaciones han estimulado la aparición de otras clasificaciones inmunohistológicas que indican inflamación miocárdica, basadas en el marcaje por inmunohistoquímica de antígenos como el CD3, CD4, CD20, CD68 y HLA que incrementan la sensibilidad, tienen valor pronóstico y se pueden utilizar en conjunto con los criterios de Dallas.50
En fecha reciente, el Colegio Americano de Cardiología, la Asociación Americana del Corazón y la Sociedad Europea de Cardiología emitieron un documento que indica la realización de la biopsia endomiocárdica, principalmente frente a la sospecha de 2 entidades: la miocarditis fulminante de causa indeterminada y frente a un cuadro agudo compatible con miocarditis de células gigantes.51 A los pacientes con alto índice de sospecha de estos 2 cuadros de miocarditis se les debe realizar la biopsia endomiocárdica en centros especializados y por personal experimentado, porque aunque infrecuente, puede ocurrir una variedad de complicaciones cardiovasculares e incluso la muerte.21
La biopsia endomiocárdica no sólo es necesaria para aplicar los criterios de Dallas, sino también para realizar técnicas de biología molecular como el PCR con el objetivo de detectar los ácidos nucleicos (ADN o ARN) de diferentes virus y determinar los marcadores inmunohistológicos. El PCR puede demostrar el genoma de un gran número de virus en el tejido miocárdico con alta sensibilidad, especificidad y rapidez.1
Tratamiento
En la actualidad, el tratamiento de la miocarditis viral comprende 3 aspectos fundamentales: medidas generales, tratamiento de las complicaciones y tratamiento específico antiviral.
Las medidas generales incluyen la restricción de deportes o ejercicios de gran intensidad por lo menos durante 6 meses o más de la convalescencia, en dependencia de la afectación de la función ventricular izquierda.52
A los casos con miocarditis que se presentan con miocardiopatía dilatada e insuficiencia cardíaca se les impone la terapéutica estándar de este tipo de insuficiencia que se recoge en las guías actuales del Colegio Americano de Cardiología, la Asociación Americana del Corazón y la Sociedad Europea de Cardiología. Este tratamiento incluye diuréticos, inhibidores de la enzima convertidora de la angiotensina, o antagonistas de receptores de la angiotensina, así como betabloqueadores como el metoprolol, bisopropol y carvedilol cuando el paciente esté clínicamente estable.53,54
En cambio, si el paciente empeora y evoluciona hacia el choque cardiogénico se ha postulado el uso del apoyo circulatorio mecánico a través de dispositivos de asistencia ventricular y la oxigenación extracorporal de membrana con el objetivo de recuperar al paciente o estabilizarlo para un posible trasplante cardíaco.55-58
Adicionalmente, si los pacientes presentan signos de insuficiencia cardíaca severa o choque cardiogénico se pueden utilizar medicamentos inotrópicos endovenosos.53,54 El uso de la digoxina en la insuficiencia cardíaca por miocarditis de causa viral debe ser con dosis bajas, teniendo en cuenta que en un modelo murino de miocarditis viral tratado con este medicamento se demostró un aumento de las citocinas proinflamatorias en el tejido miocárdico y de la mortalidad de los animales.59
Según las guías de las sociedades internacionales de cardiología más importantes mencionadas anteriormente, las arritmias en las miocarditis se deben tratar de forma convencional porque estos trastornos usualmente desaparecen después de la fase aguda de la enfermedad, que dura varias semanas. Sin embargo, los bloqueos atrioventriculares y las taquiarritmias deben ser tratados con los medicamentos habituales y marcapasos temporales o permanentes. Por otro lado, si las arritmias persisten pasada la fase aguda de la miocarditis en forma de taquicardia ventricular sostenida o sintomática se puede administrar terapia antiarrítmica como la amiodarona, colocar un cardiorrevertidor-desfibrilador implantable o valorar un trasplante cardíaco.60
El uso de antiinflamatorios no esteroideos no está recomendado y debe ser evitado porque estos medicamentos en estudios de ratones con miocarditis por virus coxsackie B incrementaron la inflamación del miocardio y la mortalidad.61,62
A pesar de los posibles efectos inmunomoduladores y antivirales de la inmunoglobulina endovenosa, no se recomienda su uso de rutina en el tratamiento de la miocarditis viral. En un ensayo clínico de modulación inmune de la miocardiopatía aguda no se demostró mejoría de los pacientes adultos con miocarditis o miocardiopatía dilatada tratados con inmunoglobulina endovenosa cuando fueron comparados con el grupo placebo.63
El hallazgo frecuente de virus en la miocarditis aguda hace pensar en la posibilidad del tratamiento antiviral y profilaxis con vacunas. Sin embargo, la información sobre una adecuada efectividad del tratamiento antiviral en las miocarditis se limita a estudios en ratones.64,65 Hasta el momento, sólo existe una pequeña serie de 3 casos de un ensayo terapéutico con el antiviral ribavirina endovenoso en seres humanos con miocarditis fulminante por virus influenza y no se demostró efectividad alguna.66 Estos resultados no son inesperados teniendo en cuenta que la mayoría de las miocarditis virales son diagnosticadas varias semanas después de la infección viral aguda cuando el tratamiento antiviral es ya tardío.21
REFERENCIAS BIBLIOGRÁFICAS
1. Dennert R, Crijns HJ, Heymans S. Acute viral myocarditis. Eur Heart J. 2008;(17): 2073-82.
2. Wakafuji S, Okada R. Twenty year autopsy statistics of myocarditis incidence in Japan. Jpn Circ J. 1986;50(12):1288-93.
3. Kyto V, Saraste A, Voipio-Pulkki LM, Saukko P. Incidence of fatal myocarditis: a population-based study in Finland. Am J Epidemiol. 2007;165(5):570-4.
4. Cooper LT, Jr. Myocarditis. N Engl J Med. 2009;360(15):1526-38.
5. Kuhl U, Pauschinger M, Noutsias M, Seeberg B, Bock T, Lassner D, et al. High prevalence of viral genomes and multiple viral infections in the myocardium of adults with "idiopathic" left ventricular dysfunction. Circulation. 2005;111(7):887-93.
6. Kuhl U, Pauschinger M, Seeberg B, Lassner D, Noutsias M, Poller W, et al. Viral persistence in the myocardium is associated with progressive cardiac dysfunction. Circulation. 2005;112(13):1965-70.
7. Felker GM, Thompson RE, Hare JM, Hruban RH, Clemetson DE, Howard DL, et al. Underlying causes and long-term survival in patients with initially unexplained cardiomyopathy. N Engl J Med. 2000;342(15):1077-84.
8. Cioc AM, Nuovo GJ. Histologic and in situ viral findings in the myocardium in cases of sudden, unexpected death. Mod Pathol. 2002;15(9):914-22.
9. Kuiken T, Taubenberger JK. Pathology of human influenza revisited. Vaccine. 2008;26 Suppl 4:D59-66.
10. Fuse K, Kodama M, Okura Y, Ito M, Hirono S, Kato K et al. Predictors of disease course in patients with acute myocarditis. Circulation. 2000;102(23):2829-35.
11. Kyto V, Vuorinen T, Saukko P, Lautenschlager I, Lignitz E, Saraste A, et al. Cytomegalovirus infection of the heart is common in patients with fatal myocarditis. Clin Infect Dis. 2005;40(5):683-8.
12. Mahrholdt H, Wagner A, Deluigi CC, Kispert E, Hager S, Meinhardt G, et al. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis. Circulation. 2006;114(15):1581-90.
13. Matsumori A. Hepatitis C virus infection and cardiomyopathies. Circ Res. 2005;96(2):144-7.
14. Matsumori A, Shimada T, Chapman NM, Tracy SM, Mason JW. Myocarditis and heart failure associated with hepatitis C virus infection. J Card Fail. 2006;12(4):293-8.
15. Promphan W, Sopontammarak S, Pruekprasert P, Kajornwattanakul W, Kongpattanayothin A. Dengue myocarditis. Southeast Asian J Trop Med Public Health. 2004;35(3):611-3.
16. Lemant J, Boisson V, Winer A, Thibault L, André H, Tixier F, et al. Serious acute chikungunya virus infection requiring intensive care during the Reunion Island outbreak in 2005-2006. Crit Care Med. 2008;36(9):2536-41.
17. To KK, Hung IF, Li IW, Lee KL, Koo CK, Yan WW, et al. Delayed clearance of viral load and marked cytokine activation in severe cases of pandemic H1N1 2009 influenza virus infection. Clin Infect Dis. 2010;50(6):850-9.
18. Martínez E. Dengue y dengue hemorrágico. Buenos Aires:Universidad Nacional de Quilmes, 1998.
19. Savon C, Acosta B, Valdes O, Goyenechea A, Gonzalez G, Piñón A, et al. A myocarditis outbreak with fatal cases associated with adenovirus subgenera C among children from Havana City in 2005. J Clin Virol. 2008;43(2):152-7.
20. Valdés O, Acosta B, Pinon A, Savón C, Goyenechea A, González G, et al. First report on fatal myocarditis associated with adenovirus infection in Cuba. J Med Virol. 2008;80(10):1756-61.
21. Blauwet LA, Cooper LT. Myocarditis. Prog Cardiovasc Dis. 2010;52(4):274-88.
22. Kashimura T, Kodama M, Hotta Y, Hosoya J, Yoshida K, Ozawa T, et al. Spatiotemporal changes of coxsackievirus and adenovirus receptor in rat hearts during postnatal development and in cultured cardiomyocytes of neonatal rat. Virchows Arch. 2004;444(3):283-92.
23. Badorff C, Lee GH, Lamphear BJ, Martone ME, Campbell KP, Rhoads RE, et al. Enteroviral protease 2A cleaves dystrophin: evidence of cytoskeletal disruption in an acquired cardiomyopathy. Nat Med. 1999;5(3):320-6.
24. Chau DH, Yuan J, Zhang H, Cheung P, Lim T, Liu Z, et al. Coxsackievirus B3 proteases 2A and 3C induce apoptotic cell death through mitochondrial injury and cleavage of eIF4GI but not DAP5/p97/NAT1. Apoptosis. 2007;12(3):513-24.
25. Li Y, Heuser JS, Cunningham LC, Kosanke SD, Cunningham MW. Mimicry and antibody-mediated cell signaling in autoimmune myocarditis. J Immunol. 2006;177(11):8234-40.
26. Huang CH, Vallejo JG, Kollias G, Mann DL. Role of the innate immune system in acute viral myocarditis. Basic Res Cardiol. 2009;104(3):228-37.
27. Lozano MD, Rubocki RJ, Wilson JE, McManus BM, Wisecarver JL. Human leukocyte antigen class II associations in patients with idiopathic dilated cardiomyopathy. Myocarditis Treatment Trial Investigators. J Card Fail. 1997;3(2):97-103.
28. Tchilian EZ, Gil J, Navarro ML, Fernández-Cruz E, Chapel H, Misbah S, et al. Unusual case presentations associated with the CD45 C77G polymorphism. Clin Exp Immunol. 2006;146(3):448-54.
29. Feldman AM, McNamara D. Myocarditis. N Engl J Med. 2000;343(19):1388-98.
30. Mason JW. Myocarditis and dilated cardiomyopathy: an inflammatory link. Cardiovasc Res. 2003;60(1):5-10.
31. Kawai C. From myocarditis to cardiomyopathy: mechanisms of inflammation and cell death: learning from the past for the future. Circulation. 1999;99(8):1091-100.
32. Dec GW Jr., Waldman H, Southern J, Fallon JT, Hutter AM Jr., Palacios I. Viral myocarditis mimicking acute myocardial infarction. J Am Coll Cardiol. 1992;20(1):85-9.
33. McCully RB, Cooper LT, Schreiter S. Coronary artery spasm in lymphocytic myocarditis: a rare cause of acute myocardial infarction. Heart. 2005;91(2):202.
34. Smith SC, Ladenson JH, Mason JW, Jaffe AS. Elevations of cardiac troponin I associated with myocarditis. Experimental and clinical correlates. Circulation. 1997;95(1):163-8.
35. Franz WM, Remppis A, Kandolf R, Kubler W, Katus HA. Serum troponin T: diagnostic marker for acute myocarditis. Clin Chem. 1996;42(2):340-1.
36. Lauer B, Niederau C, Kuhl U, Schannwell M, Pauschinger M, Strauer BE et al. Cardiac troponin T in patients with clinically suspected myocarditis. J Am Coll Cardiol. 1997;30(5):1354-9.
37. Morgera T, Di Lenarda A, Dreas L, Pinamonti B, Humar F, Bussani R, et al. Electrocardiography of myocarditis revisited: clinical and prognostic significance of electrocardiographic changes. Am Heart J. 1992;124(2):455-67.
38. Magnani JW, Danik HJ, Dec GW Jr., DiSalvo TG. Survival in biopsy-proven myocarditis: a long-term retrospective analysis of the histopathologic, clinical, and hemodynamic predictors. Am Heart J. 2006;151(2):463-70.
39. Nakashima H, Katayama T, Ishizaki M, Takeno M, Honda Y, Yano K. Q wave and non-Q wave myocarditis with special reference to clinical significance. Jpn Heart J. 1998;39(6):763-74.
40. Angelini A, Calzolari V, Calabrese F, Boffa GM, Maddalena F, Chioin R, et al. Myocarditis mimicking acute myocardial infarction: role of endomyocardial biopsy in the differential diagnosis. Heart. 2000;84(3):245-50.
41. Felker GM, Boehmer JP, Hruban RH, Hutchins GM, Kasper EK, Baughman KL, et al. Echocardiographic findings in fulminant and acute myocarditis. J Am Coll Cardiol. 2000;36(1):227-32.
42. Mendes LA, Dec GW, Picard MH, Palacios IF, Newell J, Davidoff R. Right ventricular dysfunction: an independent predictor of adverse outcome in patients with myocarditis. Am Heart J. 1994;128(2):301-7.
43. Laissy JP, Messin B, Varenne O, Iung B, Karila-Cohen D, Schouman-Claeys E, et al. MRI of acute myocarditis: a comprehensive approach based on various imaging sequences. Chest. 2002;122(5):1638-48.
44. Friedrich MG, Strohm O, Schulz-Menger J, Marciniak H, Luft FC, Dietz R. Contrast media-enhanced magnetic resonance imaging visualizes myocardial changes in the course of viral myocarditis. Circulation. 1998;97(18):1802-9.
45. Abdel-Aty H, Boye P, Zagrosek A, Wassmuth R, Kumar A, Messroghli D, et al. Diagnostic performance of cardiovascular magnetic resonance in patients with suspected acute myocarditis: comparison of different approaches. J Am Coll Cardiol. 2005;45(11):1815-22.
46. Dec GW, Palacios I, Yasuda T, Fallon JT, Khaw BA, Strauss HW, et al. Antimyosin antibody cardiac imaging: its role in the diagnosis of myocarditis. J Am Coll Cardiol. 1990;16(1):97-104.
47. O'Connell JB, Henkin RE, Robinson JA, Subramanian R, Scanlon PJ, Gunnar RM. Gallium-67 imaging in patients with dilated cardiomyopathy and biopsy-proven myocarditis. Circulation. 1984;70(1):58-62.
48. Aretz HT. Myocarditis: the Dallas criteria. Hum Pathol. 1987;18(6):619-24.
49. Baughman KL. Diagnosis of myocarditis: death of Dallas criteria. Circulation. 2006;113(4):593-5.
50. Kindermann I, Kindermann M, Kandolf R, Klingel K, Bültmann B, Müller T, et al. Predictors of outcome in patients with suspected myocarditis. Circulation. 2008;118(6):639-48.
51. Cooper LT, Baughman KL, Feldman AM, Frustaci A, Jessup M, Kuhl U, et al. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology. Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. J Am Coll Cardiol. 2007;50(19):1914-31.
52. Maron BJ, Ackerman MJ, Nishimura RA, Pyeritz RE, Towbin JA, Udelson JE. Task Force 4: HCM and other cardiomyopathies, mitral valve prolapse, myocarditis, and Marfan syndrome. J Am Coll Cardiol. 2005;45(8):1340-5.
53. Hunt SA. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). J Am Coll Cardiol. 2005;46(6):e1-82.
54. Dickstein K, Cohen-Solal A, Filippatos G, McMurray JJ, Ponikowski P, Poole-Wilson PA, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur J Heart Fail. 2008;10(10):933-89.
55. Farrar DJ, Holman WR, McBride LR, Kormos RL, Icenogle TB, Hendry PJ et al. Long-term follow-up of Thoratec ventricular assist device bridge-to-recovery patients successfully removed from support after recovery of ventricular function. J Heart Lung Transplant. 2002;21(5):516-21.
56. Topkara VK, Dang NC, Barili F, Martens TP, George I, Cheema FH, et al. Ventricular assist device use for the treatment of acute viral myocarditis. J Thorac Cardiovasc Surg. 2006;131(5):1190-1.
57. Pages ON, Aubert S, Combes A, Luyt CE, Pavie A, Léger P, et al. Paracorporeal pulsatile biventricular assist device versus extracorporal membrane oxygenation-extracorporal life support in adult fulminant myocarditis. J Thorac Cardiovasc Surg. 2009;137(1):194-7.
58. Chen YS, Yu HY. Choice of mechanical support for fulminant myocarditis: ECMO vs. VAD? Eur J Cardiothorac Surg. 2005;27(5):931-2; author reply 932.
59. Matsumori A, Igata H, Ono K, Iwasaki A, Miyamoto T, Nishio R, et al. High doses of digitalis increase the myocardial production of proinflammatory cytokines and worsen myocardial injury in viral myocarditis: a possible mechanism of digitalis toxicity. Jpn Circ J. 1999;63(12):934-40.
60. Zipes DP, Camm AJ, Borggrefe M, Buxton AE, Chaitman B, Fromer M, et al. ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing committee to develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Circulation. 2006;114(10):e385-484.
61. Khatib R, Reyes MP, Smith F, Khatib G, Rezkalla S. Enhancement of coxsackievirus B4 virulence by indomethacin. J Lab Clin Med. 1990;116(1):116-20.
62. Costanzo-Nordin MR, Reap EA, O'Connell JB, Robinson JA, Scanlon PJ. A nonsteroid anti-inflammatory drug exacerbates Coxsackie B3 murine myocarditis. J Am Coll Cardiol. 1985;6(5):1078-82.
63. McNamara DM, Holubkov R, Starling RC, Dec GW, Loh E, Torre-Amione G, et al. Controlled trial of intravenous immune globulin in recent-onset dilated cardiomyopathy. Circulation. 2001;103(18):2254-9.
64. Matsumori A, Crumpacker CS, Abelmann WH. Prevention of viral myocarditis with recombinant human leukocyte interferon alpha A/D in a murine model. J Am Coll Cardiol. 1987;9(6):1320-5.
65. Okada I, Matsumori A, Matoba Y, Tominaga M, Yamada T, Kawai C. Combination treatment with ribavirin and interferon for coxsackievirus B3 replication. J Lab Clin Med. 1992;120(4):569-73.
66. Ray CG, Icenogle TB, Minnich LL, Copeland JG, Grogan TM. The use of intravenous ribavirin to treat influenza virus-associated acute myocarditis. J Infect Dis. 1989;159(5):829-36.
Recibido: 4 de mayo de 2010.
Aprobado: 18 de mayo de 2010.
Dr. Daniel Limonta Velázquez. Instituto de Medicina Tropical "Pedro Kourí" (IPK), Autopista Novia del Mediodia km 6 1/2, La Lisa. La Habana, Cuba. Correo electrónico: dlimonta@infomed.sld.cu