Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión impresa ISSN 0034-7523
Rev cubana med vol.50 no.3 Ciudad de la Habana jul.-set. 2011
TRABAJOS ORIGINALES
Comportamiento de los alelos HLA-DQB1*02 y HLA-DQB1*03 en pacientes con diagnóstico presuntivo de enfermedad celíaca
Behavior of HLA-DQB1*02 and HLA-DQB1*03 alleles in patients with a presumptive diagnosis of celiac disease
Lic. Sylvia Torres Odio, MsC. Zuzet Martínez Córdova, Dra. Flora Calzadilla Lugo, MsC. Igrid García González, Dr. Sergio Santana Porbén, Dr. Guillermo Noa Pedroso, Dr. Yoandy Hernández Casas, Dra. Ángela Rosa Gutiérrez Rojas, Dr. Carlos Domínguez Álvarez
Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
La enfermedad celíaca (EC) es autoinmune y se observa en individuos genéticamente predispuestos, se caracteriza por la intolerancia a determinadas proteínas llamadas gluten (gliadinas y gluteínas) que se encuentran en el trigo, el centeno y la cebada. Se sabe que existe una asociación del sistema HLA y la enfermedad celíaca (HLA-DQ2/HLA-DQ8), pero no existen estudios cubanos acerca de esa asociación por lo que nos propusimos analizar el comportamiento de los alelos DQB1*02 y DQB1*03 mediante un estudio analítico observacional en 65 pacientes con diagnóstico presuntivo de enfermedad celíaca con el objetivo de incluir la detección de estos alelos en el esquema diagnóstico de esta compleja enfermedad. Se halló que los individuos portadores del alelo DQB1*02 (OR: 2,26) fueron más susceptibles de padecer la enfermedad que los no portadores, que el 60 % de los presuntos pacientes con enfermedad celíaca presentaron el alelo HLA-DQ2 y el 3 %, el alelo HLA-DQ8. Se concluyó que el genotipaje HLA-DQ2/HLA-DQ8 es de gran utilidad para el diagnóstico de enfermedad celíaca.
Palabras clave: HLA, enfermedad celíaca, alelo, genotipaje.
ABSTRACT
The celiac disease (CD) is autoimmune and it is present in genetically predisposed subjects, characterized by the intolerance to determined proteins present in wheat, rye and barley: called gluten and gliadin. It is known that there is an association between HLA-system and celiac disease (HLA-DQ2/HLA-DQ8), but there aren't Cuban studies on this association, thus we analyzed the behavior of DQB1*02 and DQB1*03 alleles by means of an observational and analytical study in 65 patients with a presumptive diagnosis of celiac disease to include its detection in the diagnostic scheme of this complex disease. There was found that subjects carriers of the DQB1*02 allele (OR: 2,26) were more susceptible to suffer this disease than those non-carriers, that the 60% of the supposed patients presenting with the celiac disease had the HLA-DQ2 allele and the 3% had the HLA-DQ8 allele. We conclude that the HLA-DQ2/HLA-DQ8 genotyping is very useful for the diagnosis of the celiac disease.
Key words: HLA, celiac disease, allele, genotyping.
INTRODUCCIÓN
La enfermedad celíaca (EC) es autoinmune y se observa en individuos genéticamente predispuestos. Se caracteriza por la intolerancia a determinadas proteínas llamadas gluten (gliadinas y gluteínas) que se encuentran en el trigo, el centeno y la cebada. La exclusión del gluten de la dieta constituye la piedra angular del tratamiento de esta enfermedad.1 Sin la aplicación de un tratamiento oportuno se produce su agravamiento (hemorragias, linfomas, osteoporosis, etcétera).2 En nuestro país se reporta que aproximadamente del 0,5-1,0 % de la población padece la enfermedad.3
Existe una asociación del sistema HLA y la enfermedad celíaca (HLA-DQ2/HLA-DQ8).4 El alelo HLA-DQ2 (DQA1*0501/DQB1*0201) está presente en el 90 al 95 % de la población con la enfermedad mientras que el alelo HLA-DQ8 (DQA1*0301/DQB1*0302) se presenta en el 5 % restante.
En la literatura existe un solo reporte acerca de la frecuencia de las cadenas HLA-DQA1*0501/B1*02 en 22 pacientes cubanos con enfermedad celíaca.3 Debido a la escasez de informes sobre el comportamiento de los alelos HLA en la EC en nuestra población, el Departamento de Genética Molecular, el Servicio de Gastroenterología y el Grupo de Apoyo Nutricional (GAN) del Hospital Clinicoquirúrgico "Hermanos Ameijeiras" deciden elaborar un proyecto de investigación conjunto que permita determinar la frecuencia de los alelos HLA-DQB1*02 y HLA-DQB1*03 en pacientes con un diagnóstico presuntivo de EC e incorporar el genotipaje HLA como parte del esquema diagnóstico de dicha enfermedad.
MÉTODOS
Se realizó un estudio analítico observacional en 65 pacientes de ambos sexos con diagnóstico presuntivo de enfermedad celíaca, remitidos por el Grupo de Atención Nutricional del Hospital Clinicoquirúrgico "Hermanos Ameijeiras" durante el período comprendido entre enero 2008 y mayo 2010. El diagnóstico presuntivo se basó en la presencia de las lesiones Marsh II o Marsh III, según el criterio del algoritmo diagnóstico propuesto por la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) y la North American Society for Pediatric Gastroenterology, Hepatology and Nutrition (NASPGHAN)
Selección de la muestra
La muestra estuvo consituida por todos aquellos pacientes remitidos del Servicio de Apoyo Nutricional que cumplieron con los criterios de inclusión.
Controles
Se empleó un control histórico que incluye 99 individuos de Ciudad de La Habana provenientes de bancos de sangre. El tipaje HLA se realizó por técnicas serológicas y moleculares (García y otros, trabajo no publicado).
Criterios de inclusión
1. Presencia de algunos o de todos los síntomas clásicos de la enfermedad: diarreas frecuentes, esteatorrea, distensión y dolor abdominal, pérdida inexplicable de peso.
2. Resultado de la detección de Acs anti-transglutaminasa.
3. Resultado de la biopsia intestinal.
4. Ambos sexos.
5. Edad de 16 años o más.
6. Sin distinción en el color de la piel.
7. Se contó con el Consentimiento Informado de cada paciente.
Técnicas de análisis de la información
La información obtenida resumió los porcentajes para las variables cualitativas. Para el análisis de la asociación de la EC con los alelos HLA DQ2 y/o DQ8 se empleó el test de Chi cuadrado o el de Fisher, según el tamaño de la muestra. La concordancia se calculó mediante el test de Kappa. El programa utilizado para procesar los datos fue el SPSS 11.5. Se consideró significativa la p= 0,05 o p < 0,05.
Coeficiente Kappa
Se calculó el coeficiente de concordancia entre las pruebas genéticas y serológicas, Kappa, en 54 pacientes con resultados positivos a la EC, según la biopsia intestinal. El parámetro analizado fue: la presencia o no de los Acs anti-tranglutaminasa y de los alelos HLA-DQB1*02 y/o HLA-DQB1*03. Se considera como genética positiva la de los pacientes con los alelos HLA-DQB1*02 y/o HLA-B1*03.
Se calculó el coeficiente de concordancia Kappa en 28 pacientes con resultados negativos a la EC, según la biopsia intestinal. El parámetro analizado fue: la presencia o no de los Acs anti-tranglutaminasa y del genotipaje HLA-DQB1*02 y HLA-DQB1*03. Se tomó como genética positiva la de los pacientes con los alelos HLA-DQB1*02 y/o HLA-B1*03.
Detección de los anticuerpos anti-transglutaminasa ( Acs-ATG)
La detección de los Acs-ATG se realizó utilizando el kit HeberFast Line Antitransglutaminasa desarrollado por Galván y otros,5 que incluye Acs de isotipo IgG e IgA.
Biopsia intestinal
La toma de la muestra de tejido se realizó por endoscopia. El tejido se inmovilizó en parafina y se realizó la tinción con hematoxilina y eosina para visualizar la atrofia de las vellosidades.
Para aplicar el test de concordancia de Kappa se incluyeron 28 individuos con una biopsia negativa: cambios mínimos en la mucosa.
La detección de los alelos HLA-DQB1 se llevó a cabo mediante la reacción en cadena de la polimerasa, empleando cebadores de secuencia específica (PCR-SSP).
RESULTADOS
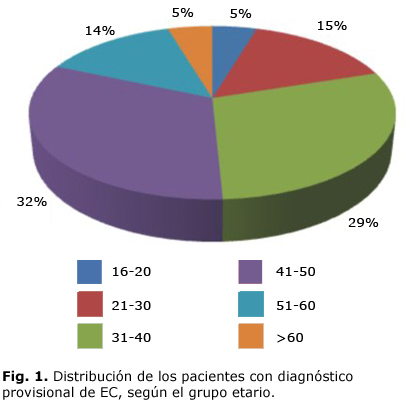
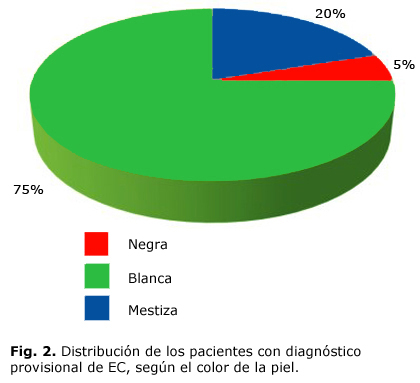
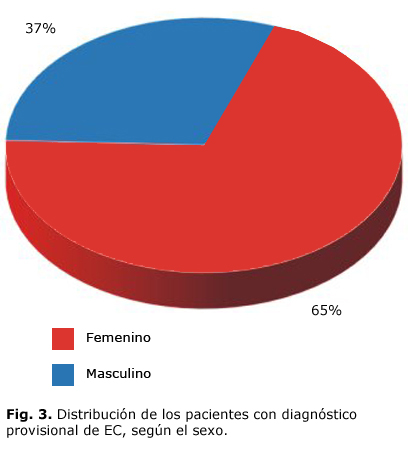
La estratificación etaria de los 65 pacientes se presentan en la figura 1 en la cual se observa que el mayor porcentaje estuvo en el grupo de 41-50 años (32%). Hubo predominio de la piel blanca (75 %) y del sexo femenino (65 %), los detalles de ambas variables se expresan en las figuras 2 y 3. La proporción entre sexos fue F/M 2:1.
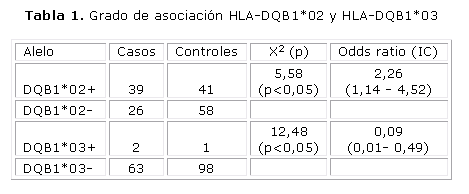
La distribución de los alelos HLA-DQB1*02 y HLA-DQB1*03 se representa en la figura 4, donde se observa el amplio predominio del primero de estos alelos con 60 %. Se corroboró que 34 % no fue portador de ninguno de los alelos de interés (HLA-DQB1*02-/*03-). El grado de asociación entre los alelos investigados se muestra en la tabla 1.
Los resultados de la aplicación del coeficiente Kappa [K= 0,349 (p < 0,05) para 35 % con grado mediano] se muestran en la tabla 2 y [K= 0,140 (p > 0,05) acuerdo insignificante] en la tabla 3.
DISCUSIÓN
El resultado obtenido en este estudio indica que el diagnóstico de la EC en la población cubana adulta es mayor en el grupo etario de 41 a 50 años (32 %) lo cual coincide con lo reportado por la literatura internacional en la cual se afirma que el diagnóstico de la enfermedad se realiza hacia la tercera y cuarta décadas de vida.6 En niños, suelen presentarse los síntomas clásicos con afectaciones del crecimiento y desarrollo, por lo que el diagnóstico se realiza tempranamente.7,8 En el caso de pacientes adultos, los síntomas clásicos suelen aparecer de forma aislada. Por la similitud de estos síntomas con los de otras enfermedades gastrointestinales, el diagnóstico se retrasa incluso hasta 10 años después de comenzados los primeros síntomas.9
La EC, al igual que otras enfermedades autoinmunes como el lupus eritematoso sistémico (LES) y la diabetes mellitus tipo 1 (DM1), presenta mayor incidencia en el sexo femenino y la relación con el sexo masculino es de 2:1, lo cual coincide con lo reportado en la bibliografía consultada (F/M es 3:1 o 2:1).6 La relación F/M en el LES es 9:1. La causa de este comportamiento es desconocida, aunque algunos investigadores plantean que está relacionada con la liberación de hormonas.10
Nuestro estudio indica que la frecuencia de esta enfermedad es mayor en individuos de piel blanca. Una de las causas de este comportamiento radica en que cerca del 10 % de los caucásicos son portadores del haplotipo HLA-DR3DQ2, que representa un riesgo conocido para la enfermedad.11,12
Esta investigación comprende pacientes cuyo diagnóstico de EC aún no es definitivo, sin embargo, el comportamiento de las variables: edad, sexo y color de la piel coincide con el reportado para personas con diagnóstico definitivo.
En los pacientes estudiados predomina el alelo HLA-DQB1*02 (60 %), este resultado es menor que lo reportado en Cuba e internacionalmente.3,13 Consideramos que estos resultados se deben a que la investigación comprendió a pacientes con un diagnóstico provisional de EC, pues este alelo en la población cubana normal posee una frecuencia similar (32,8 %) a lo reportado en otras poblaciones (Europa, EUA, etcétera) por lo que cabe esperar un comportamiento similar de este alelo en los pacientes cubanos con enfermedad celíaca. Lo anterior queda demostrado por el hecho de que la continuidad de este estudio ha permitido evaluar la respuesta al tratamiento (DLG durante 6 meses) de 14 pacientes y considerar que padecían enfermedad celíaca definitiva. De este grupo, el 85,71 % poseen el alelo HLA-DQB1*02. Esto indica que el diagnóstico definitivo del resto de los pacientes nos permitirá reevaluar los resultados obtenidos en cuanto a la frecuencia de los alelos HLA.
Según el odds ratio calculado para el alelo HLA-DQB1*02, en nuestra población los individuos portadores del alelo tienen 2 veces más probabilidades de desarrollar la enfermedad, este resultado coincide con lo reportado en la literatura.14,15
El 3 % de los pacientes fue portador del alelo HLA-DQB1*03, lo cual coincide con la frecuencia reportada (5-10 %) en los pacientes con la enfermedad.16 El odds ratio calculado para este alelo fue 0,09, según este resultado no existe asociación del alelo con la EC lo que difiere de lo informado por la literatura científica internacional, sin embargo, la baja frecuencia de este alelo en la población cubana control (1 %) sugiere la necesidad de aumentar el tamaño de muestra (1 271 individuos sanos y 1 271 enfermos) con el objetivo de calcular la asociación con un grado de confianza del 95 %.
La prueba de concordancia de Kappa se emplea en el caso de enfermedades multifactoriales que requieren de diferentes medios diagnóstico. La EC es un ejemplo de lo anterior pues se emplean en su diagnóstico pruebas genéticas, serológicas e histológicas cuyos resultados deben coincidir en alto grado. La presencia de una lesión Marsh II o Marsh III en la biopsia (biopsia positiva) es suficiente para proponer un diagnóstico provisional.17
Nuestros hallazgos, en cuanto a las pruebas genéticas y sexológicas, muestran una cooncordancia en 35 % de los casos cuyas biopsias resultaron positivas. Esto significa que ambas pruebas pueden emplearse durante el diagnóstico de la enfermedad, con mediano grado de concordancia.
Este grado de concordancia podría explicarse por las limitaciones propias de cada prueba diagnóstico18 y porque los pacientes analizados no tienen un diagnóstico definitivo de EC.
El pesquisaje inicial dentro del algoritmo diagnóstico de la EC se lleva a cabo mediante la aplicación de las pruebas serológicas. En nuestra investigación esta prueba solo incluye la determinación de Acs anti-transglutaminasa IgA e IgG con el kit Herber Fast Line Antitransglutaminasa. De los 28 pacientes con biopsia negativa: yeyunitis crónica inespecífica (YCI), duodenitis crónica inespecífica (DCI) y linfocitosis, el 78,6 % fue positivo a la prueba serológica. La concordancia entre los resultados de las pruebas serológica y de genotipaje no fue significativa en el caso de pacientes con biopsias negativas.
Los resultados falsos positivos a Acs anti-TG2 pueden producirse en pacientes con enfermedades neurológicas, por las reacciones cruzadas que se producen con antígenos neurales.17 Un estudio realizado por Boscolo y otros19 indica que los Acs anti-TG2 pueden dar reacción cruzada con las isoenzimas TG3 y TG6.
Errores en el pesquisaje inicial de pacientes enfermos pueden conducir a la realización de biopsias innecesarias por lo cual consideramos que, en nuestro caso particular, debemos incorporar un número mayor de pruebas serológicas que apoyen el diagnóstico inicial como son la cuantificación de IgA y la detección de Acs anti-PDG IgA, que no son costosas, y los Acs anti-PDG presentan una sensibilidad y una especificidad similares a las de detección de Acs anti-TG2.20
A pesar de nuestras limitaciones en cuanto al diagnóstico de la EC, el nivel de concordancia obtenido en las pruebas genéticas y serológicas nos permite emplearlas como herramientas útiles en el estudio de pacientes con esta afección.
En conclusión, este estudio ha permitido, por vez primera en Cuba, determinar la fuerza de asociación de los alelos HLA con la enfermedad celíaca que afecta en mayor frecuencia a individuos de piel blanca y del sexo femenino. La presencia del alelo DQB1*02 indica mayor probabilidad (2 veces) de padecer la enfermedad. El tamaño de muestra utilizado no permitió determinar la fuerza de la asociación del alelo HLA-DQB1*03 (3 %) con la EC. El genotipaje HLA-DQB1 y la determinación de los Acs anti-transglutaminasa son útiles en diagnóstico de la EC en pacientes con una biopsia positiva (K: 0,349) pero son ineficientes en aquellos con una biopsia negativa.
Gracias a este estudio fue incluido el genotipaje HLA como parte del esquema diagnóstico de la EC en el Hospital "Hermanos Ameijeiras" en aquellos casos de diagnóstico dudoso (muchos síntomas/serología positiva/biopsia negativa), estudios familiares, estudios genéticos, etc.
Recomendaciones
Se recomienda fortalecer la especificidad y la sensibilidad del diagnóstico serológico con la inclusión de pruebas que detecten otros anticuerpos como: anti-antiendomisio y anti-PDG, y aumentar el tamaño de las muestras.
REFERENCIAS BIBLIOGRÁFICAS
1. Setty M, Hormaza L, Guandalini S. Celiac Disease Risk Assessment, Diagnosis, and Monitoring. Mol Diag Ther. 2008;12(5):289-98.
2. Fasano A, Araya M, Bhatnagar S, Cameron D, Catassi C, Dirks M, et al. Federation of International Societies of Pediatric Gastroenterology, Hepatology, and Nutrition Consensus Report on Celiac Disease. J Pediatr Gastroenterol Nutr. 2008;47:214-9.
3. Cintado A, Sorell L, Galván JA, Martínez L, Castañeda C, Fragoso T, et al. HLA DQA1*0501 and DQB1*02 in Cuban celiac patients. Hum Immunol. 2006;67(8):639-42.
4. Caillat-Zucman S. Molecular mechanisms of HLA association with autoimmune diseases. Tissue Antigens. 2008;73(1):1-8.
5. Galván JA, Acevedo B, Novoa L, Palenzuela D, Rubi J, Torres E, et al. Desarrollo, validación y registro del sistema HeberFast Line antitransglutaminasa. Contribución al diagnóstico de la enfermedad celíaca en Cuba. Biotecnología Aplicada. 2008;5(1):62-5.
6. Bai JC, Zeballos E, Fried M, Corazza GR, Schuppan D, Farthing MJG, et al. WGO-OMGE Practice Guidelines. World Gastroenterology News. 2005;10:1-8.
7. Walker-Smith JA, Guandalini S, Schmitz J. Revised criteria for diagnosis of coeliac disease. Report of Working Group of European Society of Paediatric Gastroenterology and Nutrition. Arch Dis Child. 1990;65:909-11.
8. Hill ID, Dirks MH, Liptak GS, Coletti RB, Fasano A, Guardalini S, et al. Guidelines for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2005;40:1-19.
9. United European Gastroenterology. When is a coeliac a celiac? Report of a working group of the United European Gastroenterology Week in Amsterdam, 2001. Eur J Gastroenterol Hepatol. 2001;13:1123-8.
10. Howell WM, Jones DB. The role of human leucocyte antigen genes in the development of malignant disease. MJClin Pathol: Mol Pathol. 1995;48:302-6.
11. Catassi C. Coeliac disease in the year 2000: exploring the iceberg. Lancet. 1994;343:200-3.
12. Schuppan D, Dennis MD, Kelly CP. Celiac Disease: Epidemiology, Pathogenesis, Diagnosis, and Nutritional Management. Nutr Clin Care. 2005;8:54-69.
13. Fasano A, Shea-Donohue T. Mechanisms of Disease: the role of intestinal barrier function in the pathogenesis of gastrointestinal autoimmune diseases. Nat Clin Pract Gastroent Hepatol. 2005;9:5-8.
14. Sollid LM, Markussen G, Ek J. Evidence for a primary association of coeliac disease to a particular HLA-DQA1*05 /B1*02 heterodimer. J Exp Med. 1989;169:345-50.
15. Van de Wal Y, Kooy YM. Unique peptide binding characteristics of the disease-associated DQ (alpha1*0501, beta1*0201) vs. the non-disease-associated DQ (alpha1*0201, beta1*0202) molecule. Immunogenetics. 1997;46:484-92.
16. Cassinotti A, Birindelli S, Clerici M, Trabattoni D, Lazzaroni M, Ardizzone S, et al. HLA and Autoimmune Digestive Disease: A Clinically Oriented Review for Gastroenterologists. Am J Gastroenterol. 2009;104:195-217.
17. Briani C, Samaroo D, Alaedini A. Celiac disease: From gluten to autoimmunity. Autoimm Rev. 2008;7:644-50.
18. Green PHR, Stavropoulos SN, Panagi SG, Goldstein SL, McMahon DJ, Absan H, et al. Characteristics of adult celiac disease in the USA: results of a national survey. Am J Gastroenterol. 2001;96:126-31.
19. Boscolo S, Lorenzon A, Sblattero D, Florian F, Stebel M, Marzari R, et al. Anti transglutaminase antibodies cause ataxia in mice. PLoS ONE. 2010;5(3):1-9.
20. Marietta EV, Rashtak S, Murray JA. Correlation analysis of celiac sprue tissue transglutaminase and deamidated gliadin IgG/IgA. World J Gastroenterol. 2009;15(7):845-8.
Recibido: 17 de febrero de 2011.
Aprobado: 24 de marzo de 2011.
Lic. Sylvia Torres Odio. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", Departamento de Genética Molecular, San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, Ciudad de La Habana, Cuba. CP 10 300. genetica@hha.sld.cu