Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión impresa ISSN 0034-7523
Rev cubana med vol.51 no.1 Ciudad de la Habana ene.-mar. 2012
TRABAJO ORIGINAL
Factores de riesgo para el desarrollo del síndrome de resistencia a la insulina en el trasplante renal
Risk factors for development of insulin-resistance syndrome in the renal transplant
Dra. Esther Ibars Bolaños, Dr. CM. Gerardo Borroto Díaz, Dr. Carlos Guerrero Díaz, Dra. Malicela Barceló Acosta
Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción: el síndrome de resistencia a la insulina es una complicación frecuente en el trasplante renal, derivado de múltiples factores.
Objetivo: conocer cuáles alteraciones vinculadas al trasplante renal y su tratamiento constituyen factores de riesgo para la aparición del síndrome de resistencia a la insulina.
Métodos: se realizó un estudio de casos y controles en 81 pacientes con trasplante renal, supervivencia del injerto mayor de 1 año y que no fueran diabéticos antes del implante. Se conformaron 2 grupos, uno de enfermos con el síndrome, n=39, según los criterios del ATPIII y otro control, n=42. Para detectar factores de riesgo se compararon: variables pretrasplante (edad del receptor, tiempo en diálisis, cifras de glucemia, colesterol y triglicéridos, índice de masa corporal, infección por el virus de la hepatitis C, antecedentes familiares de diabetes) y variables postrasplante (tratamiento inmunosupresor, dosis de esteroides al tercer mes del trasplante, niveles de ciclosporina A y presencia o no de rechazo). Las variables pretrasplante fueron categorizadas de forma conveniente para análisis univariado y multivariado en el que resultaron estadísticamente significativas, en el estudio univariado: el mayor tiempo en diálisis, la mayor edad del receptor, las cifras elevadas de glucemia pretrasplante, la positividad al virus C, el índice de masa corporal superior a 25 y los antecedentes familiares de diabetes, este último factor fue el único con representatividad estadística en el análisis multivariado. Al analizar las variables vinculadas al tratamiento inmunosupresor solo hallamos que los pacientes con el síndrome tenían valores medios de ciclosporinemia mayores, estadísticamente, que aquellos que no desarrollaron la complicación.
Conclusiones: el síndrome de resistencia a la insulina se desarrolla a partir de alteraciones presentes antes del trasplante y al momento del implante, a las que se adicionan otras durante la evolución del implante, fundamentalmente el tratamiento inmunosupresor.
Palabras clave: síndrome de resistencia a la insulina, trasplante renal, factores de riesgo, inmunosupresión.
ABSTRACT
Introduction: the insulin-resistance syndrome (IRS) is a frequent complication in the renal transplantation due to multiple factors.
Objective: to know which alterations linked to renal transplantation and its treatment are risk factors for appearance of insulin-resistance syndrome.
Methods: a case-control study was conducted in 81 patients underwent renal transplantation, with a graft survival higher than 1 year and not to be diabetics before implant. Two groups were established, one including patients with this syndrome (n=39) according to the ATP-III criteria and another as control (n=42). To detect the risk factors pre-transplantation the following variables were compared: age or receptor, time in dialysis, glycemia figures, cholesterol and triglycerides, body mass index (BMI), infection for hepatitis C and a family history of diabetes and post-transplantation variables included immunosuppressive treatment, dose of steroids at third month post-transplantation, cyclosporine A levels and presence or not of rejection. The pre-transplantation variables were categorized in a suitable way for univariate and multivariate analysis where they were statistically significant, in the univariate study: the largest time in dialysis, the great age of recipient, the high figures of pre-transplantation glycemia, the positive to Virus C, body mass index higher than 25 and family history of diabetes, this latter factor was the only with statistic representativeness in multivariate analysis. Analyzing the variables linked to immunosuppressive treatment, only we note that patients with this syndrome had statistically mean values of cyclosporine higher than those without this complication.
Conclusions: the insulin resistance syndrome is developed from the alterations present before transplantation and at the moment of implant with the addition of other during the implant course, mainly the immunosuppressive treatment.
Key words: insulin resistance syndrome, renal transplantation, risk factors, immunosuppression.
INTRODUCCIÓN
Los trastornos metabólicos son frecuentes en los pacientes que viven con un injerto renal (TR).1 La obesidad, la hiperglucemia, la hipertensión arterial y la dislipemia son complicaciones comunes en estos enfermos, todos parecen tener en su fisiopatogenia un incremento de la resistencia a la acción de la insulina en los tejidos periféricos -músculos, tejidos adiposos e hígado-, por lo que se agrupan en el denominado síndrome de resistencia a la insulina (SRI), y existen claras evidencias que vinculan este síndrome al deterioro de la función del injerto, por la nefropatía crónica del trasplante, y a la muerte del enfermo, por afecciones cardiovasculares.2
La uremia es de por sí un estado de resistencia a la insulina (RI). Durante la etapa de tratamiento en métodos dialíticos ya existen, o se van incorporando, factores que contribuyen a incrementar la RI y sus efectos deletéreos: la edad avanzada, el sexo masculino, cierta predisposición genética, la hepatopatía a virus C y B, la malnutrición, tanto en exceso como por defecto, el proceso inflamatorio sistémico con liberación de citoquinas proinflamatorias y el uso de algunos medicamentos para el control de las comorbilidades que aparecen en esta etapa.3
Después del TR, muchas de estas condicionales se mantienen, a las que se añade, como elemento cardinal en la génesis de la RI, el tratamiento inmunosupresor. Los esteroides, la ciclosporina A (CsA) y el tacrolimus, constituyen los pilares del tratamiento preventivo y curativo (esteroides) de la reacción inmunológica de rechazo y se vinculan a la presencia de RI.4
Además, la reacción de rechazo, una complicación relativamente frecuente en estos enfermos, favorece la RI al desencadenar o agravar la respuesta inflamatoria, que obliga al incremento de las dosis de las drogas inmunosupresoras y contribuye, por lo tanto, a magnificar sus efectos deletéreos.5
¿Qué condiciones previas al TR y vinculadas al tratamiento inmunosupresor, constituyen en el grupo estudiado factores asociados al desarrollo del SRI?
La respuesta a esta interrogante constituye el objetivo de nuestra investigación, con ella se podrá identificar individuos de riesgo antes del TR para el desarrollo del SRI, y actuar sobre los factores modificables e introducir variantes de tratamiento inmunosupresor al momento del implante que contribuyan a evitar el desarrollo de esta complicación metabólica.
MÉTODOS
Se realizó un estudio de casos y controles.
El universo estuvo constituido por todos los pacientes a los que se les realizaron trasplantes renales y son atendidos en la Consulta Externa del Hospital Clinicoquirúrgico "Hermanos Ameijeiras" en el período comprendido entre el 1 de enero de 2006 y el 31 de diciembre de 2008. La muestra de estudio se conformó con los pacientes que cumplieron los criterios de elegibilidad (n=81).
Criterios de inclusión
- Supervivencia del injerto mayor de 1 año.
Criterios de exclusión
- Diagnóstico de diabetes mellitus antes del TR.
- Cuando no fue posible la recogida de los datos necesarios para la investigación.
La muestra quedó conformada en 2 grupos:
- Casos: Pacientes con síndrome de resistencia a la insulina diagnosticado por el criterio del Programa nacional de educación sobre el colesterol. Tercer Panel de Tratamiento al Adulto (ATPIII)6 (n=39).
- Controles: Pacientes sin síndrome de resistencia a la insulina (n=42).
Operacionalización de las variables
La información se recogió de la base de datos de TR existente en el servicio de Nefrología del hospital. Se incluyeron los datos de las variables, las cuales se categorizaron de la forma más conveniente, según la hipótesis planteada.
Variables pretrasplante
- Edad del receptor al momento del trasplante (Edad-PreT): años cumplidos.
- Tiempo en diálisis: < 24 meses o ³ 24 meses.
- Glucemia pretrasplante (GpT): £ 4,5 mmol/L o > 4,5 mmol/L.
- Triglicéridos pretrasplante (TGpT): £ 1,7 mmol/L o > 1,7 mmol/L.
- Colesterol pretrasplante (CpT): £ 5,6 mmol/L o > 5,6 mmol/L.
- Índice de masa corporal pretrasplante (IMC-preT)= peso (kg)/(talla m²): £ 24,9 o > 24,9.
- Infección por el virus de la hepatitis C (HVC): Sí o no.
- Antecedentes patológicos familiares de diabetes mellitus: Sí o no.
Variables postrasplante
Tomadas en consulta para establecer el diagnóstico de SRI.
- Presencia de hipertensión arterial: Sí o no.
El diagnóstico se validó por la existencia de cifras tensiónales mayores de 130/80 mmHg en 2 o más determinaciones, en días separados, o el uso de drogas antihipertensivas.
- Circunferencia de la cintura (CCint): cm.
Se midió tomando como referencia el punto situado entre el margen inferior de la última costilla y la cresta iliaca y se consideró patológico un valor mayor de 102 cm en el hombre y de 88 cm en la mujer, respectivamente.
- Valor de triglicéridos (TG): Se determinó por el valor medio de las 2 últimas consultas y se consideró patológico un valor mayor de 1,7 mmol/L.
- Valor de la glucemia (G): Para aplicar los criterios de la ATP-III se tuvo en cuenta como hiperglucemia un valor mayor de 6,1 mmol/L.
- Presencia de diabetes mellitus desarrollada después del trasplante: Sí o no.
- El diagnóstico fue validado según los criterios de la ADA7 o el uso de drogas antidiabéticas y/o insulina.
- Valores de HDLC: Se determinó por el valor medio de las 2 últimas consultas. Se consideraron patológicos los valores < 1,03 mmol/L en hombres y < 1,29 mmol/L en mujeres.
- Tratamiento inmunosupresor.
Prednisona-antimetabolito (P + AM).
· Prednisona + azatioprina (P + A).
· Prednisona + micofenolato mofetil (P + MMF).
Prednisona-anticalcineurínico (P + AC).
· Prednisona + ciclosporina (P + C).
· Prednisona + ciclosporina + azatioprina (P + C + A).
· Prednisona + ciclosporina + micofenolato mofetil (P+ C+ MMF).
· Prednisona + FK506 + micofenolato mofetil (P+ F+ MMF).
- Niveles de ciclosporina A (ng/mL): Se tomó el valor promedio de ciclosporenemia de las 2 últimas consultas.
- Rechazo agudo: Se tomaron aquellos casos con confirmación histológica.
La información obtenida fue llevada a una base de datos mediante Microsoft Excel y procesada con el programa estadístico SPSS versión 16.
Técnicas de análisis
Se realizó un análisis estadístico descriptivo con el uso de medidas de resumen para variables cuantitativas (media y desviación estándar) y para las cualitativas, los porcentajes.
En busca de la posible relación entre el SRI y las diferentes variables, posibles factores de riesgo, se realizó un análisis univariado previo con el empleo de la prueba chi cuadrado de independencia para las variables cualitativas,. En caso de ser significativa se calculó el odds ratio (OR) con su intervalo de confianza de 95 %. En el caso de las variables cuantitativas, se utilizó la t de Student para la comparación de medias en muestras independientes. En todas las pruebas de hipótesis se fijó el nivel de significación 0,05.
Las variables que resultaron estar asociadas al SRI en el análisis univariado fueron introducidas posteriormente en un modelo de regresión logística multivariada (RLM) con respuesta dicotómica.8,9
El modelo se ajustó mediante el método de introducir cada variable y luego se identificaron aquellas cuyos coeficientes fueron significativamente diferentes de 0 (p<0,05). Para ello se utilizó, en cada caso, el test de Wald. Además, se estimaron los odds ratio (OR) puntuales y por intervalos para cada variable seleccionada (Exp. b), los que fueron interpretados.8
Se comprobó la bondad de ajuste del modelo a los datos mediante el estadígrafo Ji cuadrado de Hosmer y Lemeshow. La probabilidad fue mayor de 0,05 por lo que se consideró que el modelo se ajusta a los datos.
RESULTADOS
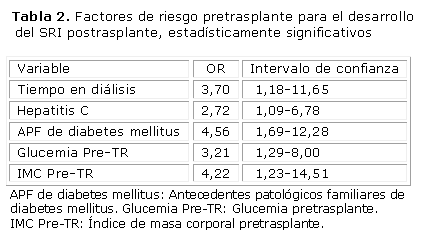
Al analizar la relación existente entre una serie de condiciones presentes antes del trasplante y el desarrollo ulterior del SRI se puso en evidencia que el tiempo en diálisis superior a 24 meses, el antecedente de familiares de primer orden con diabetes, la infección por el virus de la hepatitis C, las cifras de glucemia superiores a 4,5 mmol/L y la condición de sobrepeso, según el IMC, constituyeron variables estadísticamente significativas en el estudio univariado y que, teniendo en cuenta el principio de temporalidad, o sea, el hecho de estar presentes antes del trasplante, pudieran considerarse como factores de riesgo para el desarrollo ulterior del trastorno metabólico que motivó esta investigación (tablas 1 y 2).
Tabla 1. Variables pretrasplante con el desarrollo ulterior de síndrome
de resistencia a la insulina
|
Variables | Síndrome de resistencia a la insulina |
SE (X2) | |||||||
| Con SRI | Sin SRI | ||||||||
| N | % | N | % | ||||||
| Edad pretrasplante (años) | |||||||||
| < 50 | 31 | 79,48 | 33 | 78,57 | p=0,919 | ||||
| ≥ 50 | 8 | 21,52 | 9 | 21,43 | |||||
| Tiempo en diálisis (meses) | |||||||||
| < 24 | 26 | 66,66 | 37 | 88,09 | p=0,021 | ||||
| ≥ 24 | 13 | 33,34 | 5 | 11,91 | |||||
| Positividad al anticuerpo por vírus | |||||||||
| Sí | 27 | 69,23 | 19 | 45,23 | p=0,029 | ||||
| No | 12 | 31,77 | 23 | 54,77 | |||||
| Antecedentes familiares de primer orden de DM | |||||||||
| Sí | 21 | 53,84 | 4 | 9,52 | p=0,002 | ||||
| No | 18 | 46,16 | 33 | 91,48 | |||||
| Glucemia pretrasplante (mmol/L) | |||||||||
| ≤ 4,5 | 16 | 41,02 | 29 | 69,04 | p=0,011 | ||||
| > 4,5 | 23 | 58,98 | 13 | 30,96 | |||||
| Colesterol pretrasplante (mmol/L) | |||||||||
| ≤5,6 | 26 | 66,66 | 35 | 83,36 | p=0,082 | ||||
| > 5,6 | 13 | 33,34 | 7 | 16,64 | |||||
| Triglicéridos pretrasplante | |||||||||
| ≤1,7 | 23 | 58,97 | 33 | 78,57 | p=0,056 | ||||
| > 1,7 | 16 | 41,03 | 9 | 21,43 | |||||
| Índice de masa corporal pretrasplante | |||||||||
| ≤24,9 | 27 | 33,3 | 38 | 46,9 | p=0,016 | ||||
| > 24,9 | 12 | 14,8 | 4 | 4,9 | |||||
SE: Significación estadística. X2: Chi–cuadrado.
En la tabla 3 se expone el estudio multivariado realizado con las variables pretrasplante escogidas para conocer si estaban asociadas al desarrollo de SRI, se observa que solo fue estadísticamente significativa (p=0,032) la correspondiente a los antecedentes familiares de diabetes mellitus en los enfermos con SRI, se pone de manifiesto además que los enfermos con un familiar de primer orden con diabetes, tenían un riesgo 6,8 veces mayor de desarrollar SRI que los que no presentaban esta condición (Exp. b), el intervalo de confianza para esta variable es el único que no cruza la unión (1,858 24,898).
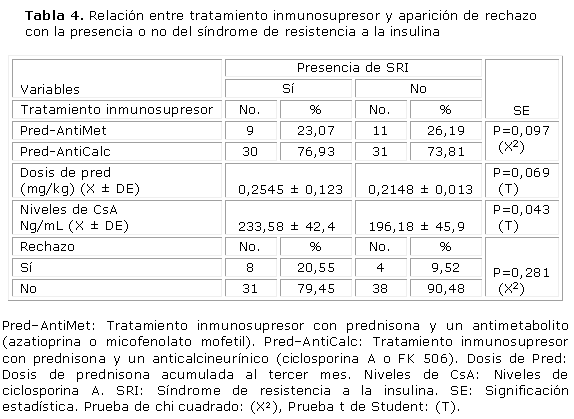
De las variables relacionadas con el tratamiento inmunosupresor, los niveles elevados de ciclosporina A fue la única variable que resultó estadísticamente significativa en la muestra de estudio como se expone en la tabla 4.
DISCUSIÓN
El receptor de un TR presenta una serie de condiciones que propician la insensibilidad de los tejidos periféricos a la acción de la insulina.
La enfermedad renal crónica terminal y los tratamientos de diálisis generan una RI que se va agravando con el tiempo. En un estudio realizado con el objetivo de identificar factores de riesgo pretrasplante para la aparición de los trastornos de la glucemia que se producen después del TR y de la presencia de RI, se puso de manifiesto que el mayor tiempo en diálisis fue una de las variables que influyó significativamente en la aparición de la diabetes postrasplante.10
Ahora, con el presente trabajo, pudimos corroborar estas aseveraciones y el vínculo que existe entre la presencia de SRI en los enfermos TR, con más larga estadía en métodos de sustitución de la función renal.
Otros de los factores que resultó significativo, desde el punto de vista estadístico, en el estudio univariado fue la infección por el virus de la hepatitis C. Se conoce que la infección facilita la aparición de trastornos metabólicos mediante la insulinorresistencia que produce y el déficit relativo en la secreción de insulina.
En un interesante trabajo, se le realizó una prueba de tolerancia a la glucosa a 83 pacientes con trasplantes renales, dosificando insulina en ayunas y calculando los índices HOMA, se encontró mayor resistencia insulínica (HOMAR) y menor secreción de insulina (HOMAB%) en los enfermos infectados por el virus C aunque en ambos grupos había cifras de hiperinsulinemia. Estos fenómenos son las bases fisiopatogénicas de los trastornos metabólicos que componen el SRI.11
Otros han demostrado que la hepatopatía por virus C constituye un factor de riesgo para la aparición de la diabetes melitus postrasplante y los fenómenos metabólicos del SRI.12
La obesidad no produce RI, pero sí agrava la ya existente, sobre todo la adiposidad abdominal o visceral, los adipositos viscerales son metabólicamente diferentes a los del resto del organismo, ellos vierten directamente sus ácidos grasos a la circulación portal, tienen menos receptores insulínicos y más adrenérgicos, además, son un órgano endocrino muy activo capaz de generar una serie de citoquinas que facilitan la aparición de RI como: el factor de necrosis tumoral alfa, la interleuquina 6, la resistina, la leptina y el angiostensinógeno y dejar de producir otros como la adiponectina.
Decloux relacionó la presencia de obesidad pretrasplante y la ganancia de peso después del mismo, con la aparición de SRI, concluyó que ambas alteraciones, obesidad y SRI, propiciaban un menor funcionamiento del injerto.13
Sancho estudia la ganancia de peso temprana, a los 6 meses del trasplante renal, y la relaciona con la aparición de complicaciones como hipertensión, dislipemia, hiperglucemia, las cuales componen el SRI y facilitan, a su juicio, como factores no inmunológicos, la progresión de la nefropatía crónica del TR.14
Otros coinciden en que la obesidad y el sobrepeso en los candidatos al TR están asociados a un peor perfil metabólico y cardiovascular.15
Coincidimos con lo expuesto pues encontramos mayor incidencia del SRI en los enfermos con un IMC elevado al momento del implante.
En la presente investigación, los hallazgos de niveles medios mayores de glucemia y triglicéridos pretrasplante, relacionados con el SRI, pudieran ser expresión de la existencia de RI durante la etapa de diálisis y su repercusión posterior en la aparición del SRI después del TR, aunque al aplicar un test de comparación de medias solo resultaron significativos, estadísticamente, los valores de glucemia.
Es obvio que en el desarrollo del SRI se encuentran factores genéticos que producen un microambiente propicio, susceptible para, bajo el influjo de factores externos, desencadenar esta temible complicación.16 Esto quedó demostrado por el hallazgo de una mayor frecuencia de antecedentes familiares de diabetes en los individuos de nuestra serie que desarrollaron el SRI después del trasplante renal, lo que coincide con lo informado en la literatura.16
Muchos investigadores concuerdan en que el factor patogénico primordial en la génesis del SRI en el TR, lo posee la terapéutica inmunosupresora. Tanto estudios clínicos como trabajos experimentales, demuestran que FK506, CsA y esteroides son drogas que propician los trastornos metabólicos en estos enfermos.5,17
Midtvedt y otros, en Oslo, Noruega, midieron la sensibilidad a la insulina mediante la realización de un clamp euglucémico hiperinsulinémico en 2 grupos de TR bajo un régimen inmunosupresor con CsA, esteroides y micofenolato mofetil. En un grupo retiraron los esteroides y en el otro, los mantuvieron. El índice de sensibilidad a la insulina fue calculado por la tasa de disposición de glucosa, dividido entre la media de la insulina sérica en los últimos 60 min del clamp. El estudio demostró el efecto beneficioso de la retirada o la disminución de los esteroides en la sensibilidad periférica a la hormona.18
Los fármacos anticalcineurínicos: ciclosporina A (CsA) y tacrolimus (FK506) se relacionan con el SRI al inhibir la cacalmodulin lo que disminuye la activación de la protein-kinasa AMP, la cual inhibe la malonil CoA, que es una enzima intermediaria en la síntesis de ácidos grasos libres y triglicéridos. Se ha visto en pacientes con RI una disminución de la AMPkinasa y aumento de la malonil CoA. Esto, unido a la hipomagnesemia, el déficit en la secreción de insulina y la gran lipofilia (unión a moléculas transportadoras de lipoproteínas) que producen estas drogas, favorecen la hiperglucemia postrasplante, la hipertensión arterial y la dislipemia, componentes del SRI.19
Estudios realizados por nuestro grupo ya habían puesto en evidencia la asociación entre las drogas anticalcineurínicas con la RI, la hiperglucemia y la dislipidemia postrasplante.20
En la presente investigación, los valores medios de esteroides y CsA fueron mayores en los enfermos que desarrollaron el SRI, aunque solo los niveles de CsA resultaron estadísticamente significativos. No se evidenció mayor frecuencia de rechazo en los individuos con los trastornos metabólicos. Estos resultados denotan que existen condiciones antes del implante que producen la resistencia insulínica, como el sobrepeso corporal, el mayor tiempo en diálisis, la infección por el virus de la hepatitis C, pero debe existir un medio genético que propicie el desarrollo del trastorno metabólico para que, posteriormente, con la toma de la medicación inmunosupresora, aparezca esta complicación.
REFERENCIAS BIBLIOGRÁFICAS
1. Kishikawa H, Nishimura K, Kato T, Kobayashi Y, Arichi N, Okuno A, et al. Prevalence of the metabolic syndrome in kidney transplantation. Transplant Proc. 2009;41(1):181-3.
2. Sui W, Zou H, Zou G, Yan Q, Chen H, Che W, et al. Clinical study of the risk factors of insulin resistance and metabolic syndrome after kidney transplantation. Transpl Immunol. 2008;20(1-2):95-8.
3. Young DO, Lund RJ, Haynatzki G, Dunlay RW. Prevalence of the metabolic syndrome in an incident dialysis population. Hemodial Int. 2007;11(1):86-95.
4. Vincenti F, Friman S, Scheuermann E, Rostaing L, Jenssen T, Campistol JM. Results of an International Randomized Trial Comparing Glucose Metabolism Disorders and Outcome with Cyclosporine Versus Tacrolimus. Am J Transplant. 2007;42(4):123-7.
5. Lo A. Immunosuppression and metabolic syndrome in renal transplant recipients. Metab Syndr Relat Disord. 2004;2(4):263-73.
6. Expert panel on detection, evaluation and treatment of high blood cholesterol in adults (adult treatment panel III). Executive summary of the third report of the National Cholesterol Education Program (NCEP). JAMA. 2001;285(19):2486-96.
7. American Diabetes Association. Diagnosis and clasification of diabetes mellitus. Diabetes Care. 2004;27(S 1):S5-S10.
8. Silva LC. Excursión a la regresión logística en ciencias de la salud. Madrid: Díaz de Santos; 1993.
9. Dawson-Saunders B, Trapp RG. Bioestadística Médica. México: El Manual Moderno; 1999. p. 249-72.
10. Borroto G, Batista F, Barceló M, Guerrero C. Frecuencia y factores de riesgo de la diabetes mellitus postrasplante renal. Rev Cubana Med. 2002;41(4). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232002000400004&lng=es&nrm=iso&tlng=es [citado 3 enero de 2012]
11. Borroto Díaz G, Guerra Bustillo G, Guerrero Díaz C, Infante Suárez A, Gonzáles Álvarez MV. Impacto del virus de la hepatitis C en las complicaciones inmediatas y los trastornos metabólicos glucémicos del trasplante renal. Rev Cubana Med. 2008;47(4). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232008000400006&lng=es&nrm=iso&tlng=es [citado 3 enero de 2012]
12. Ridruejo E, Cusumano A, Diaz C, Dávalos Michel M, Jost L, Jost HL, et al. Hepatitis C virus infection and outcome of renal transplantation. Transplant Proc. 2007;39(10):3127-30.
13. Decloux D, Kazory A, Simula-Faivre D, Chalopin JM. One-year post-transplant weight gain is a risk factor for graft loss. Am J Transplant. 2005;5(12):2922-8.
14. Sancho A, Ávila A, Gavela E, Beltrán S, Fernández-Nájera JE, Molina P, et al. Effect of overweight on kidney transplantation outcome. Transplant Proc. 2007;39(7):2202-4.
15. Kovesdy CP, Czira ME, Rudas A, Ujszaszi A, Rosivall L, Novak M, et al. Body Mass Index, waist circumference and mortality in kidney transplant recipients. Am J Transplantation. 2010;10:2644-51.
16. Borroto G, Guerrero C. Pérez P, Lorenzo A. ¿Es la diabetes mellitus postrasplante una complicación genéticamente determinada? Rev Cubana Med. 2006;45(4):56-9.
17. Limmerman T. Contribution of insulin resistance to catabolic effect of prednisone on leucine metabolism in humans. Diabetes. 1998;38(3):1238.
18. Midtvedt K, Hjelmesaeth J, Hartmann A, Lund K, Paulsen D, Egeland T. Insulin resistance after renal transplantation: the effect of steroid dose reduction and withdrawal. J Am Soc Nephrol. 2004;15(12):3233-9.
19. Vigano M. Calcineurin inhibitors and mechanisms that is responsible for the appearance of post-transplant diabetes mellitus. G Ital Nefrol. 2003;20(S25):S11-4.
20. Borroto G, Barceló M, Guerrero C, Alonso C. Insulinorresistencia en el trasplante renal. Rev Cubana Invest Biomed. 2002;21(4):241-7.
Recibido: 1 de febrero de 2011.
Aprobado: 1 de agosto de 2011.
Dra. Esther Ibars Bolaños. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", Servicio de Nefrología. San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, La Habana, Cuba. CP 10 300.