Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión impresa ISSN 0034-7523
Rev cubana med vol.53 no.4 Ciudad de la Habana sep.-dic. 2014
TRABAJO ORIGINAL
Mortalidad a largo plazo y pérdida del seguimiento de pacientes en terapia antirretroviral
Long-term mortality and follow-up loss of patients on antiretroviral therapy
Dr. Liodelvio Martínez Fernández,I Dra. Ariadna Corral Martín,II Dra. Ducelina Serrano,III Dra. María Lúcia Furtado,III Dr. Héctor Manuel Díaz Torres,IV Lic. Liuber Yans Machado Zaldívar,IV Dr. Manuel Barzaga TorresV
I Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
II Escuela Nacional de Salud Pública. La Habana, Cuba.
III Instituto Nacional de Lucha contra el SIDA. Luanda, Angola.
IV Laboratorio de Investigaciones del SIDA (LISIDA). La Habana, Cuba.
V Policlínico Universitario "Pedro del Toro". Holguín, Cuba.
RESUMEN
Introducción: los resultados a largo plazo de la terapia antirretroviral combinada (TARVC) en África han sido escasamente reportados.
Objetivo: evaluar la efectividad de la TARVC a través de 2 factores determinantes: la mortalidad y la pérdida del seguimiento.
Métodos: estudio descriptivo, retrospectivo, longitudinal, en 1 000 adultos que comenzaron TARVC en el 2004 y fueron seguidos hasta el 2009 en el hospital "Esperança", en Luanda.
Resultados: el conteo basal medio de linfocitos T CD4+ fue de 147,1 cél/mm3. El 46 % se presentó con estadio clínico III o IV de la Organización Mundial de la Salud. La edad promedio fue 34,6 años. Durante 60 000 meses-personas de seguimiento (media 34 meses), 335 pacientes fallecieron, 153 fueron perdidos en el seguimiento y la retención en el tratamiento a los 5 años fue 51,2 %. La tasa cruda de muerte fue 7,9 por 100 años-persona (95 % IC 5,6-8,3). Se detectó un tiempo medio de supervivencia significativamente menor en las mujeres (39,1 meses vs. 42), en aquellos con un conteo basal de linfocitos T CD4+ menor de 200 cél/mm3 (27,3 meses vs. 32,4), en los clasificados en los estadios avanzados de la OMS (25,6 meses vs. 31,7) y en los que alcanzaban tanto criterios clínicos como inmunológicos para iniciar la terapia (30,4 meses vs. solo con inmunológicos 33,7).
Conclusiones: se observó una buena retención a largo plazo y resultados clínicos. La mortalidad relativamente elevada a los 5 años presenta un desafío importante para lograr mejores resultados de la TARVC y sugiere la necesidad de reforzar las estrategias que promuevan la adherencia al tratamiento.
Palabras clave: terapia antirretroviral, estudio de cohorte, mortalidad, VIH, resultados programáticos, análisis de supervivencia, África Subsahariana.
ABSTRACT
Introduction: long-term results of combination antiretroviral therapy (cART) in Africa have been poorly informed.
Objective: To evaluate the effectiveness of TARVC through 2 factors: mortality and follow-up loss.
Methods: A descriptive, retrospective, longitudinal study was conducted in 1000 adults who began cART in 2004 and were followed until 2009 at "Esperança" Hospital in Luanda.
Results: The CD4 + count mean baseline of T lymphocytes was 147.1 cells/mm3. 46 % presented with clinical stage III or IV according to World Health Organization standards. The average age was 34.6 years. During 60 000 person-months follow-up (mean 34 months), 335 patients died, 153 lost follow up and adherence to treatment after 5 years was 51.2 %. The gross mortality rate was 7.9 (95 % CI 5.6 to 8.3) 100 person-years. A significantly shorter survival mean was detected in women (39.1 months vs. 42), in those with lymphocytes CD4 + count baseline below 200 cells/mm3 (27.3 months vs. 32.4), in those classified in advanced stages according to WHO standards (25.6 months vs. 31.7) and in those reaching both clinical and immunological criteria to start therapy (30.4 months vs. 33.7 immunological only).
Conclusions: A good long-term adherence to treatment and clinical outcomes were observed. The relatively high mortality after 5 years presents a major challenge for better cART results and suggests the need to strengthen strategies to promote treatment adherence.
Key words: antiretroviral therapy, cohort study, mortality rate, HIV, program outcomes, survival analysis, sub-Saharan Africa.
INTRODUCCIÓN
La introducción de la terapia antirretroviral combinada (TARVC) a finales de 1996 mejoró ostensiblemente el pronóstico de los pacientes infectados por el virus de la inmunodeficiencia humana (VIH) en la mayoría de los países desarrollados.1,2 Consecuentemente, el número estimado de muertes al nivel mundial por el VIH/SIDA está declinando, lo cual es atribuible al incremento de los servicios de tratamiento antirretroviral.3 La implementación de la TARVC a grandes números de personas a través de clínicas especializadas a partir del año 2004, en el África Subsahariana, ha traído grandes resultados clínicos, inmunológicos y virológicos en el primer año de TARVC en los pacientes. Estos efectos han sido comparables a los observados en países desarrollados.4-23 Sin embargo, la mortalidad de aquellos pacientes ha sido significativamente mayor, principalmente en los primeros meses de terapia.8,19,21 Múltiples cohortes de este tipo han sido publicados;6,18,24-47 algunos de ellos son grandes5,18,25,28,36,38-44,46 y la minoría ha tenido un intervalo de observación de 5 años o más.25,28,38-44
Una revisión de los programas de TARVC en el África Subsahariana ha sugerido que por pérdida del seguimiento (PDS) y muerte, solo 60 % de los que inician el tratamiento continúan recibiéndolo a los 2 años.48 Sin embargo, un reporte más reciente lo ha estimado en 64,6 % a los 36 meses. Se ha detectado una interacción compleja y dinámica de factores personales, sociales, del sistema de salud, así como estructurales que contribuyen a estos elevados niveles de abandono.49,50 En los países de menos ingresos económicos, los pacientes comienzan el tratamiento con conteos de linfocitos T CD4+ basales más bajos que en los países más ricos19 y esto determina una menor expectativa de supervivencia.51 Los pacientes con inmunodepresión severa permanecen en un riesgo más elevado de sufrir múltiples complicaciones en los primeros meses del inicio de la TARVC. En primer lugar, aunque la TARVC reduce la incidencia de enfermedades marcadoras de SIDA, persiste elevada en los primeros meses.52 En segundo lugar, el síndrome de reconstitución inmunológica (SRI) ocurre más frecuentemente con conteos basales bajos de linfocitos T CD4+.53 En tercer lugar, muchas reacciones adversas a las drogas antirretrovirales ocurren más comúnmente con enfermedad avanzada.54 Por lo tanto, no resulta sorprendente que exista una tasa elevada de morbilidad temprana55-57 y mortalidad19,56 en pacientes que comienzan TARVC en países de baja renta.
El suministro de TARVC comenzó en Angola, en el 2004.58 Ese año, para hacer frente a un incremento significativo en los nuevos diagnósticos de pacientes con VIH/SIDA, fue inaugurado el Hospital "Esperança", en Luanda, como experiencia piloto y como una dependencia relevante del Instituto Nacional de Lucha contra el SIDA. Este hospital fue designado como centro nacional de referencia en Angola para el diagnóstico, cuidado y tratamiento antirretroviral de dichos enfermos. Desde entonces, más de 20 000 pacientes han sido atendidos en esa unidad.
Este estudio fue realizado en una clínica grande y de rápida expansión (> 200 nuevos pacientes cada mes, desde 2004) con el objetivo de evaluar los factores determinantes de los resultados del tratamiento antirretroviral en los primeros 5 años de actividad (60 000 meses-personas de seguimiento) del programa de VIH/SIDA angolano en el Hospital "Esperança".
MÉTODOS
Este estudio descriptivo, retrospectivo, longitudinal evalúa la efectividad de la TARVC de primera línea, en pacientes mayores de 15 años de edad que comenzaron el tratamiento durante el primer año de introducción de la terapia antirretrovira,l en la primera clínica pública de suministro de TARVC del país a través de 2 parámetros clave: la mortalidad y PDS.
Sitio del estudio
Este hospital es actualmente el mayor centro proveedor de TARVC en Angola, África, y se considera una de las mayores clínicas de TARVC en el mundo. Toda la atención y el tratamiento son gratuitos y solo para adultos.
Criterios de inclusión
- Pacientes que iniciaron TARVC con un régimen de primera línea entre el 1 de enero de 2004 y el 31 de diciembre del propio año.
- Haber sido diagnosticado como seropositivo al VIH según los criterios de las guías nacionales angolanas (Normas de Tratamento Anti-Retroviral Instituto Nacional de Luta contra a SIDA. Ministério da Saúde Luanda, 2011), y disponerse de, al menos, un conteo de linfocitos T CD4+ realizado antes del inicio de la terapia antirretroviral.
- Tener cumplidos 15 años de edad o más.
Criterios de exclusión
Pacientes que habían recibido previamente cualquier droga antirretroviral por alguna otra razón (profilaxis posexposición profesional, prevención de la transmisión vertical o tratamiento de la hepatitis B).
Período de observación
Se estableció la siguiente clasificación: fallecido, pérdida del seguimiento o en tratamiento, el 31 de diciembre del 2009, según lo primero ocurrido. Por lo tanto, el período de observación para cada paciente fue desde el inicio de la TARVC en el 2004 hasta el 31 de diciembre del 2009 y, consecuentemente, fue mínimamente de 5 años para todos los pacientes y hasta de 5 años y 11 meses como máximo.
Protocolo de atención al VIH y tratamiento
Los pacientes fueron referidos a la clínica desde las consultas de aconsejamiento voluntario y diagnóstico de otras clínicas generales, hospitales, sitios de atención prenatal, otras clínicas de tratamiento antirretroviral o por iniciativa propia de los pacientes. Todos fueron consultados por un médico, quien llenó un modelo de historia clínica completo, el cual a su vez fue resumido en una base de datos digital. Se les realizó, además, la siguiente batería de exámenes de laboratorio clínico: hemoquímica, hemograma completo, conteo de linfocitos T CD4+, antígeno de superficie de la hepatitis B y serología no treponémica para la sífilis (VDRL). Aquellos con una infección oportunista activa fueron tratados de acuerdo con las guías nacionales (Normas de Tratamento Anti-Retroviral Instituto Nacional de Luta contra a SIDA. Ministério da Saúde Luanda, 2011). Se les ofreció profilaxis de infecciones oportunistas a los que tuviesen indicación según las propias normas. Los que fueron elegibles para iniciar TARVC recibieron sesiones de adherencia y educación de salud y fueron atendidos por un médico en la consulta de inicio de la terapéutica antirretroviral, después de la cual se les programaron visitas mensuales de recogida de los fármacos en la farmacia del centro, consulta médica inicial a los 3 meses y, posteriormente, cada 6 meses.
Según lo establecido en las normas angolanas (Normas de Tratamento Anti-Retroviral Instituto Nacional de Luta contra a SIDA. Ministério da Saúde Luanda, 2011), el tratamiento antirretroviral se inicia cuando el paciente se encuentre en los estadios III o IV del sistema de clasificación clínica de la OMS59 (criterio clínico) o cuando tengan un conteo de linfocitos T CD4+ £ 350 cél/mL (criterio inmunológico) o ambas condiciones (criterios clínico e inmunológico). Los que cumplían alguno de estos criterios comenzaron TARVC con un régimen de primera línea de 2 inhibidores de la transcriptasa reversa análogos de nucleósidos/nucleótidos (ITRNs) [azidothymidine (zidovudina) (AZT) o estavudina (d4T) o didanosina (dDI) y lamivudina (3TC)] y un inhibidor de la transcriptasa reversa no análogo de nuclesósido (ITRNNs) [ya fuese efavirenz (EFV) o nevirapina (NVP)]. Algunos pudieron haber comenzado la terapia con un inhibidor de proteasa (IPs), que pudo haber sido el indinavir (IDV) reforzado o no con el ritonavir (IDV/r) o el nelfinavir (NFV). La mayoría de los pacientes recibieron una combinación de AZT + 3TC + NVP. La mayoría de las mujeres recibieron NVP.
La TARVC de segunda línea consistió en la substitución de un ITRN por otro no utilizado en el régimen inicial de primera línea, manteniéndose el 3TC, así como el cambio del ITRNN por el IDV/r. Por lo tanto, el régimen de segunda línea más frecuentemente prescrito fue dDI + 3TC + IDV/r. En el 2008 fueron introducidas 4 nuevas drogas en la terapia de segunda línea: 2 ITRNs -abacavir (ABC) y tenofovir (TDF), así como 2 IPs: -saquinavir (SQV) y lopinavir reforzado con ritonavir (LPV/r). Como resultado, la mayoría de los pacientes en segunda línea a partir del 2008 recibió una combinación de TDF + 3TC + LPV/r.
Las pruebas de laboratorio (incluyendo el conteo de CD4, carga viral y hemoglobina) fueron realizadas evolutivamente, según el criterio clínico del médico. A la mayoría de los pacientes les fue realizado un conteo basal de linfocitos T CD4+ al menos una vez por año. La detección de la carga viral estuvo disponible solo a partir de finales del 2008.
Obtención de los datos
En el Departamento de Estadísticas del hospital, después de cada consulta del paciente, se traslada inmediatamente cada dato clínico y de laboratorio a una base digital de datos confeccionada, mediante el programa Excel, por técnicos estadísticos. La historia clínica confeccionada por el médico fue revisada posteriormente solo si faltaba algún dato o resultaba incoherente. Para la investigación y el procesamiento estadístico, se fueron coleccionando los datos en un modelo confeccionado al efecto. Toda la información concerniente a las variables del estudio fue recogida para cada paciente: edad, género, estadio clínico según la clasificación de la OMS al momento del inicio de la TARVC, el criterio (clínico, inmunológico o ambos) que llevó a la decisión, fecha de inicio de la terapia, régimen de drogas prescrito y las fechas de fallecimiento, de última consulta de seguimiento y de la estimada de pérdida al seguimiento.
Todo fue incluido en una base de datos de Microsoft Excel 2007 y el análisis estadístico fue realizado utilizando el paquete estadístico MedCalc para Windows.
Definiciones
La variables sociodemográficas fueron la edad, tomada como los años completos al momento del inicio de la TARVC, clasificada en grupos de decenios, y el género, clasificado por el sexo biológico correspondiente. Las variables clínicas e inmunológicas relacionadas con el monitoreo de la progresión de la infección por el VIH/Sida, fueron el estadio clínico de acuerdo con el sistema de clasificación de estadios clínicos de la OMS y el conteo de linfocitos T CD4+. Consecuentemente, los pacientes fueron clasificados en una de 4 categorías del conteo basal (en el momento del inicio de la TARVC) de linfocitos T CD4+: 0 - 99 cél/mL, 100 - 199 cél/mL, 200 - 350 cél/mL y más de 350 cél/mL. Solamente se encontraron utilizados 4 regímenes de primera línea: AZT + 3TC + NEV, AZT + 3TC + EFV, D4T + 3TC + NEV y D4T + 3TC + EFV.
Los pacientes que habían faltado a reconsulta por más de 3 meses posteriores a la última consulta programada fueron considerados como perdidos al seguimiento (PDS). La retención en la atención se refiere a los pacientes que se conoce están vivos y recibiendo TARVC en el Hospital "Esperança" al final del período de observación del seguimiento (31 de diciembre del 2009). Las covariantes se recolectaron lo más cercanas posibles a la fecha de inicio de la TARVC, y no más de 4 meses antes de la misma o un mes después del inicio.
El fallecimiento de los pacientes por cualquier causa fue tomado en consideración mientras se encontrase en TARVC y fue aceptado en forma pasiva ante notificación de cualquier fuente. El Departamento de Estadísticas fue notificado principalmente de ello por los prestadores de servicios al hogar, miembros de la familia o por facilidades residenciales asociadas a la clínica, otros pacientes o trabajadores de salud del propio hospital u otras unidades de salud dentro del programa nacional. A los fallecidos en el hogar se les consideró en el análisis que la muerte ocurrió inmediatamente después de la última visita registrada en la clínica, puesto que para la mayoría de ellos se desconocía la fecha exacta de la defunción.
Análisis estadístico
Se utilizaron variables cualitativas de medidas de resumen para caracterizar a los pacientes, tales como números absolutos y porcentajes. Fueron incluidos datos de todos los pacientes, independientemente de la adherencia o cambio en el régimen de TARVC. La duración del seguimiento varió de acuerdo al fallecimiento, PDS y remisión a otras unidades de salud. Se utilizó el método de Kaplan-Meier para estimar la supervivencia. Las curvas de supervivencia fueron comparadas para las diferentes categorías de la misma variable a través de la prueba de Log-Rank (p < 0,05). Los individuos sin eventos (muerte) al final del período de seguimiento (31 de diciembre del 2009) fueron considerados censurados a la derecha. Para identificar los factores asociados a la supervivencia, se utilizó el modelo de proporciones de riesgo (regresión de Cox) con intervalos de confianza del 95 %. En el análisis multivariado fueron consideradas solo las variables con resultados significativos en el análisis univariado basado en el estimador de Kaplan-Meier. Todos los análisis fueron realizados como intención al tratamiento en relación con la TARVC, ignorándose las interrupciones de esta terapia.
RESULTADOS
Características basales de los pacientes
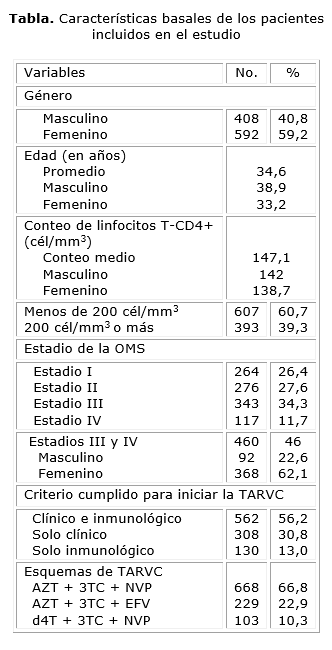
Entre el primero de enero y el 31 de diciembre del 2004, un total de 1 167 pacientes (alrededor de 97 nuevos cada mes) iniciaron TARVC de primera línea. De ellos, 167 (15,3 %) fueron referidos a otras instituciones de salud, por lo tanto, fueron incluidos en el estudio un total de 1 000 pacientes cuyas características basales se muestran en la tabla.
El conteo basal medio de linfocitos T CD4+ fue de 147,1 cél/mm3 y predominaron aquellos con valores inferiores a 200 cél/mm3 (607 pacientes -60,7 %). El 46 % de los pacientes (460) se presentó con enfermedad clínicamente avanzada (estadios III o IV de la OMS), con un conteo linfocitario de 142,3 cél/mm3 y 122 (12,2 %) iniciaron TARVC con menos de 50 cél/mm3. La edad media fue de 34,6 años, predominó el grupo etario de 25 a 34 años (38 %), seguidos por el de 35 a 45 años (31,4 %).
Predominaron las mujeres (592 -59,2 % vs. 408 -40,8 %), a una edad menor (33,2 años vs. 38,9) y con la enfermedad más avanzada (menores conteos de CD4 -138,7 cél/mm3 vs. 142 cél/mm3 y estadios III y IV de la OMS: 368 pacientes -62 % vs. 92 -22,6 %) en comparación con los hombres. La mayoría de los pacientes (668 -66,8 %) inició tratamiento con AZT + 3TC + NVP, 229 (22,9 %) lo hizo con AZT + 3TC + EFV y 103 (10,3 %) con d4T + 3TC + NVP.
Supervivencia, PDS y retención en el tratamiento
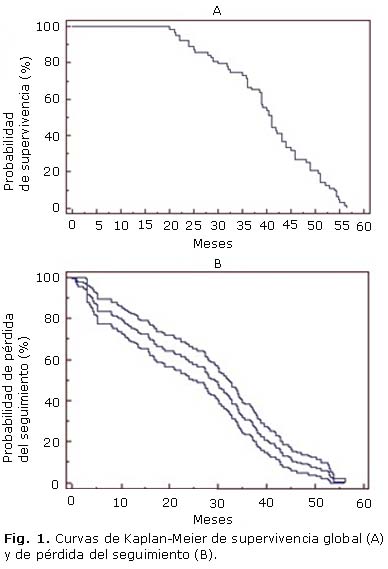
En 60 000 meses-persona de seguimiento (media de 34 meses) (95 % IC: 27,5; 42,6 meses), 335 pacientes fallecieron (33,5 %), 153 (15,3 %) fueron PDS y al final del período de observación, 512 (51,2 %) continuaban vivos y en TARVC. El conteo basal medio de linfocitos T CD4+ de los que fallecieron fue de 127,7 cél/mm3 (IC 121,6-130,4) y en aquellos que fueron PDS fue de 164,4 cél/mm3 (IC 159,2-167,1). La tasa cruda de fallecimiento fue de 7,9 muertes por 100 años-persona (95 % IC 5,6-8,3). Durante los primeros 12 meses de tratamiento, no ocurrieron muertes, mientras que a los 24 meses del inicio de la TARVC, 101 de 1 000 pacientes habían muerto (10,1 %). Otros fallecieron en un tiempo mayor de la introducción del tratamiento (234 pacientes -23,4 %). A los 12 meses de TARVC, 38 de los 1 000 pacientes (3,8 %) habían abandonado las consultas (24,8 % del total que fueron PDS), mientras que 47 (4,7 %/30,7 %) lo habían hecho a los 24 meses. Los estimados de Kaplan-Meier de retención en el tratamiento fueron del 96,2 % al primer año, 85,2 % a los 2 años y 51,2 % (73,2-75,6) a los 5 años. Las curvas crudas de supervivencia y PDS se muestran en la figura 1 (A y B).
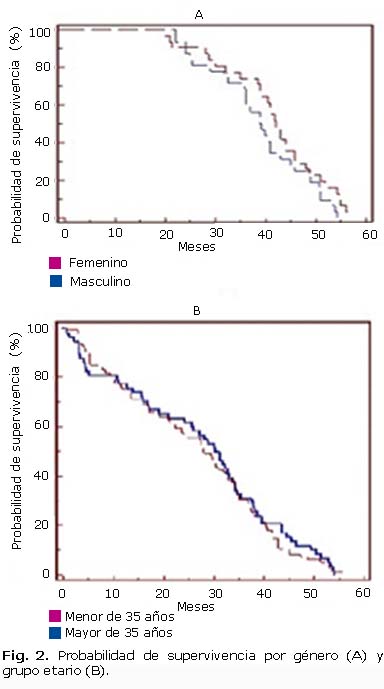
Las mujeres tuvieron menor tiempo medio de supervivencia (39,1 meses vs. 42 meses en hombres), lo cual fue estadísticamente significativo (X2= 4,5821 1 gl p= 0,03) (Fig. 2A). Los menores de 35 años de edad tuvieron menor porcentaje de muertes que los mayores de esa edad (30,2 meses -48,5 % vs. 28 meses -51,1 % / X2= 0,2380 1 gl p= 0,6257), pero no hubo diferencias estadísticas significativas en el tiempo medio de supervivencia y (Fig. 2B).
Los que iniciaron TARVC con un conteo de linfocitos T-CD4+ menor que 200 cél/mm3 tuvieron menor tiempo de supervivencia que aquellos con un conteo mayor (27, 3 meses vs. 32,4, respectivamente) (X2= 5,86562 1 gl p = 0,0012). Consiguientemente, ya había fallecido a los 24 meses de tratamiento el 45,1 % de los que habían iniciado tratamiento con un conteo de linfocitos T-CD4+ menor que 200 cél/mm3, mientras que esto solo le había sucedido al 35,2 % de aquellos con mayores conteos (X2= 5,86782 1 p= 0,001) (Fig. 3A). También resultó significativo el menor tiempo de supervivencia de aquellos pacientes clasificados en los estadios III o IV de la OMS al inicio de la TARVC (25,6 meses) en comparación con aquellos con estadios I o II (31,7 meses) (X2= 9,5088 1 gl p= 0,000), como se observa en la figura 3B.
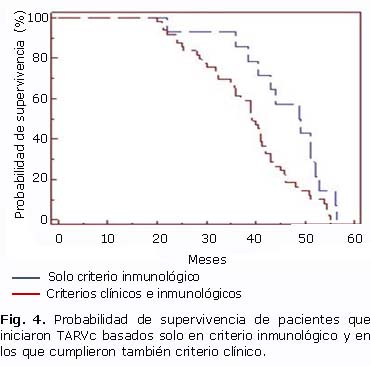
En relación con el criterio alcanzado por los pacientes para iniciar la TARVC, aquellos que iniciaron tratamiento solo con pauta inmunológica tuvieron un tiempo de supervivencia significativamente mayor (33,7 meses) que los que cumplieron criterios tanto clínicos como inmunológicos (30,4 meses) (X2= 15,3452, 1 gl p= 0,000), como se muestra en la figura 4.
Las características basales de esta cohorte de pacientes fue muy similar a la expuesta en todos los reportes previos de resultados de tratamiento antirretroviral, en sitios de bajos recursos económicos del África Subsahariana, los que informan sobre una edad media de 32 a 43 años, con predominio del género femenino entre 54,7 % y 77 %, conteo medio de linfocitos T CD4+ entre 43 y 153 cél/mm3.
Este estudio de cohorte restrospectivo de pacientes seropositivos al VIH en TARVC nos ofrece una visión de la supervivencia y sus determinantes en un hospital urbano en Angola. La tasa de fallecimiento a los 5 años (33,5 %) resultó ser un poco mayor que en la mayoría de los reportes previos (del 5,9 % al 18,95 %),25,28,40,41,43,44 pero similar al 28,5 % informado por Sieleunou38 en el hospital rural de Petté en Cameroon y al 24,6 % notificado por Etard,42 en Dakar, Senegal. Una posible explicación a esto fue la imposibilidad de medir la carga viral para el monitoreo temprano del fallo de la terapia de primera línea hasta finales del año 2008 o la escasez inicial de actividades de adherencia terapéutica en el primer año de una rápida instauración de la TARVC en el país. No obstante, nuestra tasa de mortalidad cruda (7,9 muertes por 100 años-persona) fue muy similar o incluso menor a la de otros reportes que la sitúan entre el 6,3 y el 20,2 /100 años-persona en resultados a largo plazo.34,38,42 Incluso, al no haber tenido fallecimientos en los primeros 12 meses de TARVC, la mortalidad temprana resulta una de las primeras reportadas en esta área geográfica similar a las de los países desarrollados. Los estimados de retención en tratamiento, de 96,2 % al primer año y 85,2 % a los 2 años, afirman esto. Una posible explicación para este comportamiento podría ser, al menos en parte, el acceso con prontitud a la atención y cuidados hospitalarios de tercer nivel en el Hospital "Americo Boavida" en la vecindad del Hospital "Esperança", a los pacientes que lo necesitasen. También puede deberse a un sesgo estadístico por el método inexacto de reporte de los fallecimientos, debido a un posible registro con una fecha posterior a la real.
La proporción de pacientes PDS a los 5 años (15,3 %) se considera bastante baja en comparación con los reportes previos, que describen cifras entre 13 % y 25,4 % en clínicas del África Subsahariana.18,38-42,44 Además, 51,2 % de retención en el tratamiento, a los 5 años, clasifica bien entre lo previamente reportado, cuando se estima el efecto de 3 años más respecto a la retención estimada a los 2 años, de 60 %, en una revisión sistemática de clínicas africanas de tratamiento antirretroviral realizada por Rosen y otros,48 en la que el promedio de las bajas después de los primeros 24 meses se estima en 5 % anual, lo que se corrobora en otra revisión sistemática similar, pero más reciente, realizada por Fox y Rosen,60 que estimaron en 70 % la retención en tratamiento a los 3 años. Este último reporte sugirió que las bajas a los 2 años pueden estarse reduciendo por el acúmulo de la experiencia adquirida con la expansión de la TARVC y la madurez adquirida por los programas de tratamiento, con lo que se alcanza, por tanto, la capacidad de rastrear mejor a los pacientes. Sin embargo, el diseño de nuestra investigación descarta este efecto porque fueron incluidos solo los pacientes que iniciaron tratamiento en el primer año de suministro de TARVC en el hospital, lo que explica, probablemente, el bajo nivel de retención en el tratamiento.
El tiempo de supervivencia ligeramente menor en el sexo femenino fue significativo, lo que puede explicarse por la relación femenino/masculino de 1.45 de los pacientes incluidos en el estudio y el estadio más avanzado de la enfermedad en aquéllas (menor CD4 y estadios clínicos III y IV, según clasificación de la OMS de la enfermedad) en comparación con los hombres. Esto es contrario a lo que se había reportado previamente,25,34,38,40 pero Etard y otros informaron que el género, entre otras características basales, no mostró asociación significativa con supervivencias diferentes42 y otros estudios no habían reportado asociación del género con la mortalidad.16,28,41,43,44 Otras características basales encontradas como estadísticamente significativas en relación con la mortalidad han sido ampliamente reportadas en la literatura, como fueron las de aquellos que iniciaron TARVC con un conteo de linfocitos T-CD4+ inferior a 200 cél/mm3, de los pacientes clasificados en estadios clínicos III o IV de la OMS y los que iniciaron la TARVC cumpliendo criterios clínicos e inmunológicos.16,28,34,38,40-44
Consecuentemente, como en informaciones subsaharianas previas, la experiencia mostró que fue esencial para el enfrentamiento a la epidemia de VIH/SIDA, la rápida expansión de la TARVC utilizando un abordaje a través de salud pública en el área urbana del África Subsahariana, acompañada de un cuidado y tratamiento de elevada calidad y, aun de mayor valor, en el contexto de un país que acababa de salir de una larga y devastadora guerra civil solo 3 años antes.
El análisis de 1 167 pacientes que iniciaron TARVC en el primer año de actividad de una clínica urbana muy activa mostró un buen resultado a largo plazo, así como una buena retención en tratamiento. Los resultados proveen por tanto de una sólida valoración de los resultados de las clínicas de TARVC más allá de los previamente reportados en el África Subsahariana, que habían demostrado éxitos a corto plazo (seguimiento promedio de 12 meses o menos) en clínicas más pequeñas (que típicamente enrolan 50-60 pacientes nuevos por mes)8,9,11,17,20 y también, entre aquellos reportes de resultados de grandes clínicas similares a esta, con seguimiento a largo plazo.18,40-42,44
El análisis tiene muchas fortalezas, incluyendo una gran muestra, ofrece estimados robustos y el uso del análisis de tiempo al evento en lugar de un aborde de corte transversal, lo que supera, por tanto, la limitante de la sobrerrepresentación de pacientes con corto seguimiento. También tuvo algunas limitantes, principalmente relacionadas con la naturaleza observacional del cohorte, ausencia de datos (reportes de fallecidos) y el uso de datos de colección rutinaria de una clínica con gran carga asistencial. Algunas muertes pudiesen haber sido mal clasificadas en el tiempo o como pérdidas del seguimiento.
Se concluye que en este estudio, de una gran cohorte de pacientes de Luanda, Angola, se observaron buenos resultados clínicos y retención en el tratamiento. La relativamente alta mortalidad a los 5 años presenta un importante reto al logro de los mejores resultados posibles de la TARVC y sugiere la necesidad de reforzar las estrategias de promoción de la adherencia al tratamiento, así como de contar con la posibilidad de cuantificar la carga viral para apoyar el diagnóstico temprano de la falla terapéutica al régimen de primera línea, además de otras estrategias bien conocidas, como el diagnóstico en estadios tempranos de la infección por el VIH, al acceso temprano a la atención médica, así como al inicio rápido de la TARVC en los pacientes, sobre todo antes de que lleguen a estadios avanzados de la enfermedad.
REFRENCIAS BIBLIOGRÁFICAS
1. Egger M, May M, Chene G, Phillips AN, Ledergerber B, Dabis F, et al. Prognosis of HIV-1-infected patients starting highly active antirretroviral therapy: a collaborative analysis of prospective studies. Lancet. 2002;360(9327):119-29.
2. Mocroft A, Vella S, Benfield TL, Chiesi A, Miller V, Gargalianos P, et al. Changing patterns of mortality across Europe in patients infected with HIV-1. EuroSIDA Study Group. Lancet. 1998;352(9142):1725-30.
3. Global HIV/AIDS response: epidemic update and health sector progress towards universal access: progress report 2011. WHO Library Cataloguing-in-Publication Data. [citado 8 Ag 2012]. Disponible en: http://www.who.int/hiv/pub/progressreports/update2014-executive-summary/en/
4. Seyler C, Anglaret X, Dakoury-Dogbo N, Messou E, Toure S, Danel C, et al. Medium-term survival, morbidity and immunovirological evolution in HIV-infected adults receiving antirretroviral therapy, Abidjan, Cote d'Ivoire. Antivir Ther. 2003;8(5):385-93.
5. Bekker LG, Myer L, Orrell C, Lawn S, Wood R. Rapid scale-up of a community-based HIV treatment service: programme performance over 3 consecutive years in Guguletu, South Africa. S Afr Med J. 2006;96(4):315-20.
6. Laurent C, Ngom Gueye NF, Ndour CT, Gueye PM, Diouf M, Diakhate N, et al. Long-term benefits of highly active antirretroviral therapy in Senegalese HIV-1-infected adults. J Acquir Immune Defic Syndr. 2005;38(1):14-7.
7. Boileau C, Nguyen VK, Sylla M, Machouf N, Chamberland A, Traore HA, et al. Low prevalence of detectable HIV plasma viremia in patients treated with antirretroviral therapy in Burkina Faso and Mali. J Acquir Immune Defic Syndr. 2008;48(4):476-84.
8. Ferradini L, Jeannin A, Pinoges L, Izopet J, Odhiambo D, Mankhambo L, et al. Scaling up of highly active antirretroviral therapy in a rural district of Malawi: an effectiveness assessment. Lancet. 2006;367(9519):1335-42.
9. Hawkins C, Achenbach C, Fryda W, Ngare D, Murphy R. Antirretroviral durability and tolerability in HIV-infected adults living in urban Kenya. J Acquir Immune Defic Syndr. 2007;45(3):304-10.
10. Lawn SD, Badri M, Wood R. Tuberculosis among HIV-infected patients receiving HAART: long term incidence and risk factors in a South African cohort. AIDS. 2005;19(18):2109-16.
11. Lawn SD, Myer L, Bekker LG, Wood R. Burden of tuberculosis in an antirretroviral treatment programme in sub-Saharan Africa: impact on treatment outcomes and implications for tuberculosis control. AIDS. 2006;20(12):1605-12.
12. Lawn SD, Myer L, Bekker LG, Wood R. CD4 cell count recovery among HIV-infected patients with very advanced immunodeficiency commencing antirretroviral treatment in sub-Saharan Africa. BMC Infect Dis. 2006;6:59.
13. Lawn SD, Myer L, Harling G, Orrell C, Bekker LG, Wood R. Determinants of mortality and nondeath losses from an antirretroviral treatment service in South Africa: implications for program evaluation. Clin Infect Dis. 2006;43(6):770-6.
14. Lawn SD, Myer L, Orrell C, Bekker LG, Wood R. Early mortality among adults accessing a community-based antirretroviral service in South Africa: implications for programme design. AIDS. 2005;19(18):2141-8.
15. Libamba E, Makombe S, Mhango E, de Ascurra Teck O, Limbambala E, Schouten EJ, et al. Supervision, monitoring and evaluation of nationwide scale-up of antirretroviral therapy in Malawi. Bull World Health Organ. 2006;84(4):320-6.
16. Stringer JS, Zulu I, Levy J, Stringer EM, Mwango A, Chi BH, et al. Rapid scale-up of antirretroviral therapy at primary care sites in Zambia: feasibility and early outcomes. JAMA. 2006;296(7):782-93.
17. Wools-Kaloustian K, Kimaiyo S, Diero L, Siika A, Sidle J, Yiannoutsos CT, et al. Viability and effectiveness of large-scale HIV treatment initiatives in sub-Saharan Africa: experience from western Kenya. AIDS. 2006;20(1):41-8.
18. Sanne IM, Westreich D, Macphail AP, Rubel D, Majuba P, Van Rie A. Long term outcomes of antirretroviral therapy in a large HIV/AIDS care clinic in urban South Africa: a prospective cohort study. J Int AIDS Soc. 2009;12:38.
19. Braitstein P, Brinkhof MW, Dabis F, Schechter M, Boulle A, Miotti P, et al. Mortality of HIV-1-infected patients in the first year of antirretroviral therapy: comparison between low-income and high-income countries. Lancet. 2006;367(9513):817-24.
20. Keiser O, Orrell C, Egger M, Wood R, Brinkhof MW, Furrer H, et al. Public-health and individual approaches to antirretroviral therapy: township South Africa and Switzerland compared. PLoS Med. 2008;5(7):e148.
21. Coetzee D, Hildebrand K, Boulle A, Maartens G, Louis F, Labatala V, et al. Outcomes after two years of providing antirretroviral treatment in Khayelitsha, South Africa. AIDS. 2004;18(6):887-95.
22. Brinkhof MW, Boulle A, Weigel R, Messou E, Mathers C, Orrell C, et al. Mortality of HIV-infected patients starting antirretroviral therapy in sub-Saharan Africa: comparison with HIV-unrelated mortality. PLoS Med. 2009;6(4):e1000066.
23. Toure S, Kouadio B, Seyler C, Traore M, Dakoury-Dogbo N, Duvignac J, et al. Rapid scaling-up of antirretroviral therapy in 10,000 adults in Cote d'Ivoire: 2-year outcomes and determinants. AIDS. 2008;22(7):873-82. .
24. Sauvageot D, Schaefer M, Olson D, Pujades-Rodriguez M, O'Brien DP. Antirretroviral therapy outcomes in resource-limited settings for HIV-infected children < 5 years of age. Pediatrics. 2010;125(5):e1039-47.
25. Negin J, van Lettow M, Semba M, Martiniuk A, Chan A, Cumming RG. Anti-retroviral treatment outcomes among older adults in Zomba district, Malawi. PLoS One. 2011;6(10):e26546.
26. Kiboneka A, Nyatia RJ, Nabiryo C, Anema A, Cooper CL, Fernandes KA, et al. Combination antirretroviral therapy in population affected by conflict: outcomes from large cohort in northern Uganda. BMJ. 2009;338:b201.
27. Schrooten W, Florence E, Dreezen C, Van Esbroeck M, Fransen K, Alonso A, et al. Five-year immunological outcome of highly active antirretroviral treatment in a clinical setting: results from a single HIV treatment centre. Int J STD AIDS. 2004;15(8):523-8.
28. Biadgilign S, Reda AA, Digaffe T. Predictors of mortality among HIV infected patients taking antirretroviral treatment in Ethiopia: a retrospective cohort study. AIDS Res Ther. 2012;9(1):15. Epub 2012/05/23.
29. Bakanda C, Birungi J, Mwesigwa R, Nachega JB, Chan K, Palmer A, et al. Survival of HIV-infected adolescents on antirretroviral therapy in Uganda: findings from a nationally representative cohort in Uganda. PLoS One. 2011;6(4):e19261.
30. Peterson I, Togun O, de Silva T, Oko F, Rowland-Jones S, Jaye A, et al. Mortality and immunovirological outcomes on antirretroviral therapy in HIV-1 and HIV-2-infected individuals in the Gambia. AIDS. 2011;25(17):2167-75. Epub 2011/09/02.
31. Davies NE, Karstaedt AS. Antirretroviral outcomes in South African prisoners: a retrospective cohort analysis. PLoS One. 2012;7(3):e33309.
32. Ahonkhai AA, Noubary F, Munro A, Stark R, Wilke M, Freedberg KA, et al. Not all are lost: interrupted laboratory monitoring, early death, and loss to follow-up (LTFU) in a large South African treatment program. PLoS One. 2012;7(3):e32993.
33. Chan AK, van Lettow M, Tenthani L, Kumwenda M, Gawa L, Kadzanja A, et al. Outcome assessment of a dedicated HIV positive health care worker clinic at a central hospital in Malawi: a retrospective observational study. PLoS One. 2011;6(5):e19789. Epub 2011/06/01.
34. Wandeler G, Keiser O, Pfeiffer K, Pestilli S, Fritz C, Labhardt ND, et al. Outcomes of antirretroviral treatment programs in rural Southern Africa. J Acquir Immune Defic Syndr. 2012;59(2):e9-16.
35. Okomo U, Togun T, Oko F, Peterson K, Townend J, Peterson I, et al. Treatment outcomes among HIV-1 and HIV-2 infected children initiating antirretroviral therapy in a concentrated low prevalence setting in West Africa. BMC Pediatr. 2012;12:95.
36. Nglazi MD, Kranzer K, Holele P, Kaplan R, Mark D, Jaspan H, et al. Treatment outcomes in HIV-infected adolescents attending a community-based antirretroviral therapy clinic in South Africa. BMC Infect Dis. 2012;12:21.
37. Mermin J, Ekwaru JP, Were W, Degerman R, Bunnell R, Kaharuza F, et al. Utility of routine viral load, CD4 cell count, and clinical monitoring among adults with HIV receiving antirretroviral therapy in Uganda: randomised trial. BMJ. 2011;343:d6792.
38. Sieleunou I, Souleymanou M, Schonenberger AM, Menten J, Boelaert M. Determinants of survival in AIDS patients on antirretroviral therapy in a rural centre in the Far-North Province, Cameroon. Trop Med Int Health. 2009;14(1):36-43.
39. Nglazi MD, Lawn SD, Kaplan R, Kranzer K, Orrell C, Wood R, et al. Changes in programmatic outcomes during 7 years of scale-up at a community-based antirretroviral treatment service in South Africa. J Acquir Immune Defic Syndr. 2011;56(1):e1-8.
40. Boulle A, Van Cutsem G, Hilderbrand K, Cragg C, Abrahams M, Mathee S, et al. Seven-year experience of a primary care antirretroviral treatment programme in Khayelitsha, South Africa. AIDS. 2010;24(4):563-72.
41. Bussmann H, Wester CW, Ndwapi N, Grundmann N, Gaolathe T, Puvimanasinghe J, et al. Five-year outcomes of initial patients treated in Botswana's National Antirretroviral Treatment Program. AIDS. 2008;22(17):2303-11.
42. Etard JF, Ndiaye I, Thierry-Mieg M, Gueye NF, Gueye PM, Laniece I, et al. Mortality and causes of death in adults receiving highly active antirretroviral therapy in Senegal: a 7-year cohort study. AIDS. 2006;20(8):1181-9.
43. Cornell M, Grimsrud A, Fairall L, Fox MP, van Cutsem G, Giddy J, et al. Temporal changes in programme outcomes among adult patients initiating antirretroviral therapy across South Africa, 2002-2007. AIDS. 2010;24(14):2263-70.
44. Fox MP, Shearer K, Maskew M, Macleod W, Majuba P, Macphail P, et al. Treatment outcomes after 7 years of public-sector HIV treatment. AIDS. 2012;26(14):1823-8.
45. Kipp W, Konde-Lule J, Saunders LD, Alibhai A, Houston S, Rubaale T, et al. Antirretroviral treatment for HIV in rural Uganda: two-year treatment outcomes of a prospective health centre/community-based and hospital-based cohort. PLoS One. 2012;7(7):e40902.
46. Labhardt ND, Keiser O, Sello M, Lejone TI, Pfeiffer K, Davies MA, et al. Outcomes of antirretroviral treatment programmes in rural Lesotho: health centres and hospitals compared. J Int AIDS Soc. 2013;16:18616.
47. Huet C, Ouedraogo A, Konate I, Traore I, Rouet F, Kabore A, et al. Long-term virological, immunological and mortality outcomes in a cohort of HIV-infected female sex workers treated with highly active antirretroviral therapy in Africa. BMC Public Hhealth. 2011;11:700.
48. Rosen S, Fox MP, Gill CJ. Patient retention in antirretroviral therapy programs in sub-Saharan Africa: a systematic review. PLoS Med. 2007;4(10):e298.
49. Musheke M, Bond V, Merten S. Individual and contextual factors influencing patient attrition from antirretroviral therapy care in an urban community of Lusaka, Zambia. J Int AIDS Soc. 2012;15 Suppl 1:1-50.
50. Boyles TH, Wilkinson LS, Leisegang R, Maartens G. Factors influencing retention in care after starting antirretroviral therapy in a rural South African programme. PLoS One. 2011;6(5):e19201.
51. Johansson KA, Robberstad B, Norheim OF. Further benefits by early start of HIV treatment in low income countries: survival estimates of early versus deferred antirretroviral therapy. AIDS Res Ther. 2010;7(1):3. Epub 2010/02/26.
52. Michelet C, Arvieux C, Francois C, Besnier JM, Rogez JP, Breux JP, et al. Opportunistic infections occurring during highly active antirretroviral treatment. AIDS. 1998;12(14):1815-22. Epub 1998/10/29.
53. French MA, Price P, Stone SF. Immune restoration disease after antirretroviral therapy. AIDS. 2004;18(12):1615-27.
54. Carr A, Cooper DA. Adverse effects of antirretroviral therapy. Lancet. 2000;356(9239):1423-30.
55. Moh R, Danel C, Messou E, Ouassa T, Gabillard D, Anzian A, et al. Incidence and determinants of mortality and morbidity following early antirretroviral therapy initiation in HIV-infected adults in West Africa. AIDS. 2007;21(18):2483-91.
56. Seyler C, Messou E, Gabillard D, Inwoley A, Alioum A, Anglaret X. Morbidity before and after HAART initiation in Sub-Saharan African HIV-infected adults: a recurrent event analysis. AIDS Res Hum Retroviruses. 2007;23(11):1338-47.
57. Harling G, Orrell C, Wood R. Healthcare utilization of patients accessing an African national treatment program. BMC Health Serv Res. 2007;7:80.
58. SIDA INLS. Relatório sobre o Progresso do País para dar Seguimento aos Compromissos da Sessão Especial sobre VIH e SIDA da Assembleia Geral das Nações Unidas. 2010. [citado 9 jun 2010]. Disponible en: http://data.unaids.org/pub/Report/2010/angola_2010_country_progress_report_es.pdf
59. WHO case definitions of HIV for surveillance and revised clinical staging and immunological classification of HIV-related disease in adults and children. 2007. [citado 6 nov 2014]. Disponible en: http://www.who.int/hiv/pub/vct/hivstaging/en/
60. Fox MP, Rosen S. Patient retention in antirretroviral therapy programs up to three years on treatment in sub-Saharan Africa, 2007-2009: systematic review. Trop Med Int Health. 2010;15(Suppl 1):1-15.
Recibido: 8 de enero de 2014.
Aprobado: 22 de mayo de 2014.
Dr. Liodelvio Martínez Fernández. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, La Habana, Cuba. CP 10 300. liodelvio@infomed.sld.cu