Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med vol.54 no.2 Ciudad de la Habana abr.-jun. 2015
TRABAJO ORIGINAL
pH urinario y estado nutricional en pacientes cubanos con urolitiasis
Urinary pH and nutritional status in Cuban ptients with urolithiasis
Dr. Raymed Antonio Bacallao Méndez,I Dr. Reynaldo Mañalich Comas,I Dr. Francisco Gutiérrez García,I Dra. Aymara Badell Moore,I Dra. Yadira Caldevilla RodríguezII
I Instituto de Nefrología "Dr. Abelardo Buch López". La Habana, Cuba.
II Hospital Universitario "General Calixto García". La Habana, Cuba.
RESUMEN
Introducción: la obesidad y las urolitiasis son problemas crecientes en el mundo. El pH urinario ácido (bajo) predispone a las urolitiasis.
Objetivo: determinar la posible relación entre el peso corporal y el índice de masa corporal con el pH urinario en pacientes litiásicos.
Métodos: estudio observacional analítico transversal en el que se incluyeron todos los pacientes litiásicos adultos cubanos que se hicieron estudio metabólico renal en el Instituto de Nefrología entre enero de 2011 y diciembre de 2012, que no presentaran ninguna condición con reconocida influencia sobre el pH urinario. Se midió el pH urinario y se hizo minicultivo con una muestra de orina en ayunas. Se midió el peso, la talla y se calculó el índice de masa corporal. La información se procesó mediante el paquete estadístico SPSS versión 15.0. Fue calculada la media, la desviación estándar, máximo y mínimo de edad, peso e índice de masa corporal. Las comparaciones entre las variables se hicieron por análisis de varianza.
Resultados: fueron estudiados 1 724 pacientes con una edad promedio de 41,6 años y una relación hombre/mujer de 2,1/1. El pH urinario medio disminuyó 0,23 unidades del sextil de menos peso corporal al de mayor peso (p= 0,00). El pH urinario medio fue de 5,69 en desnutridos y normopesos, en sobrepesos fue de 5,59 y de 5,53 en obesos (p= 0,00).
Conclusión: el pH urinario en ayunas tiene una relación inversa con el peso corporal y el índice de masa corporal en pacientes adultos con litiasis urinarias sin infección del tracto urinario.
Palabras clave: pH urinario, urolitiasis, obesidad, resistencia a la insulina, síndrome metabólico.
ABSTRACT
Introduction: obesity and urolithiasis are growing problems in the world. The acid (low) urinary pH predisposes urolithiasis.
Objective: determine the possible relationship between body weight and body mass index (BMI) with urinary pH in patients with kidney stones.
Methods: a cross-sectional observational study was conducted in all Cuban adults lithiasic patients who underwent renal metabolic study at the Nephrology Institute from January 2011 to December 2012, and who did not have any conditions with recognized influence on urinary pH. Urinary pH was measured and a mini-culture was performed on a fasting urine sample. Weight, height and body mass index were registered. The information was processed using SPSS version 15.0. Mean age, standard deviation of minimum and maximum age, weight and body mass index were calculated. Comparisons between variables were made by analysis of variance.
Results: 1 724 patients were studied with age average of 41.6 years and a male/female ratio of 2.1/1. The urinary pH mean decreased 0.23 sextile units from less to heavier body weight (p= 0.00). The urinary pH mean was 5.69 in malnourished and normal weight patients, it was 5.59 in overweight patients, and 5.53 in those obese (p= 0.00).
Conclusion: fasting urinary pH is inversely related to body weight and body mass index in adult patients with urinary lithiasis without infection of the urinary tract.
Key words: urinary pH, urolithiasis, obesity, insulin resistance, metabolic syndrome.
INTRODUCCIÓN
La obesidad es un problema de salud a escala global cuya prevalencia se ha incrementado notoriamente en los últimos años, con graves consecuencias socioeconómicas.1 En Cuba también se ha registrado un incremento llamativo en la prevalencia de obesidad, lo que resulta aun más significativo si se considera que en la última década del pasado siglo se identificó un descenso del sobrepeso y la obesidad, a punto de partida de la crisis económica de esos años.2,3
La obesidad, especialmente la abdominal, se asocia a resistencia a los efectos de la insulina sobre la glucosa y la utilización de los ácidos grasos. La resistencia a la insulina, la hiperinsulinemia y las citoquinas de los adipocitos (adipoquinas), pueden favorecer la aparición de disfunción endotelial, un perfil lipídico anormal, hipertensión arterial e inflamación vascular, todo lo cual promueve el desarrollo de enfermedad cardiovascular aterosclerótica.4 La coexistencia de factores de riesgo metabólicos tanto para la diabetes mellitus tipo 2, como para la enfermedad cardiovascular aterosclerótica (obesidad abdominal, hiperglucemia, dislipidemia y HTA) sugirió la existencia de un “síndrome metabólico”; el cual hoy día está muy bien establecido, con criterios diagnósticos ampliamente utilizados.5
Tal como la obesidad, el síndrome metabólico, ha experimentado un marcado incremento en su prevalencia;6 sin dudas en relación directa con el crecimiento experimentado por la obesidad. Paralelamente a este aumento en las prevalencias de la obesidad y el síndrome metabólico se ha puesto de manifiesto un aumento marcado en la prevalencia de la litiasis urinaria, en varias latitudes.7 En Cuba, aunque los datos disponibles son escasos, un estudio clínico-epidemiológico, a pequeña escala, en población urbana mostró un incremento en la incidencia de urolitiasis en los últimos años.8
Más allá de la coexistencia de un aumento en la incidencia y prevalencia de: la obesidad, el síndrome metabólico y las litiasis urinarias, ha quedado evidenciado en grandes estudios epidemiológicos que la frecuencia de presentación de las litiasis urinarias se incrementa en la medida que lo hace el peso corporal y el índice de masa corporal (IMC) de los sujetos;9 de modo que estos datos apuntan a que la relación entre la obesidad y las litiasis urinarias más que temporal es causal, aunque de inicio se desconocía el posible nexo.9,10
Hay múltiples evidencias que apuntan a que el síndrome metabólico y la resistencia a la insulina que trae aparejada es el elemento de unión fisiopatológica entre la obesidad y las litiasis urinarias. Así, la baja bioactividad de la insulina (por la resistencia a la insulina de la obesidad) al nivel del túbulo renal proximal puede llevar a un defecto en la producción de amonio y/o su excreción y de este modo disminuir la capacidad de tampón urinario y ocasionar una mayor excreción de H+ en la orina, con la consecuente caída del pH urinario.11 El pH urinario bajo (ácido) constituye un factor de riesgo para el desarrollo de litiasis de ácido úrico, pues incrementa la proporción de uratos urinarios en forma de ácido úrico muy poco soluble a expensas de una disminución de las sales de urato mucho más solubles, se favorece así la litogénesis de ácido úrico.12 Sin embargo, el pH urinario bajo no solo propicia el desarrollo de litiasis de ácido úrico, sino que también predispone a las litiasis cálcicas (más frecuentes) pues se produce un fenómeno conocido como nucleación heterogénea, en que la sales cálcicas se depositan alrededor de un núcleo de ácido úrico.13
A punto de partida de las evidencias antes descritas, se desarrolla la presente investigación con el objetivo de determinar la posible relación entre el peso corporal y el pH urinario, así como entre el IMC y el pH urinario en pacientes litiásicos cubanos.
MÉTODOS
Se desarrolló un estudio observacional analítico de corte transversal en el que se incluyeron todos los pacientes cubanos adultos con litiasis urinaria que se hicieron estudio metabólico renal en el período comprendido entre enero de 2011 y diciembre de 2012 en el Instituto de Nefrología. No fueron incluidos los extranjeros, vegetarianos, pacientes que utilizaran tratamiento con fármacos que modificaran el pH urinario y no se pudieran suspender una semana antes del estudio, como: diuréticos tiazídicos, inhibidores de la enzima convertidora de la angiotensina, álcalis y alopurinol; así como pacientes con trastornos conocidos que afectan el pH urinario como: enfermedad inflamatoria intestinal, síndromes diarreicos crónicos, acidosis tubular renal, infección del tracto urinario, litiasis de infección e hiperparatiroidismo primario.
A todos los pacientes se les hizo una pequeña entrevista para identificar si presentaban algún criterio de exclusión. Se les recogió una muestra de 15 mL de orina en ayunas de 10 h. Además, se mensuró el peso con una balanza SECA®, y la talla con el tallímetro adjunto a la balanza. Se midió el pH urinario con un pH-metro marca Crison modelo GLP21+, adecuadamente calibrado y certificado. Además se realizó minicultivo en medios de cultivo cistina lactosa deficiente en electrólitos (CLED) y Mac Conkey-Agar para descartar los pacientes con infección del tracto urinario.
Las variables recogidas fueron: edad, sexo, peso, talla y pH urinario; se calculó el IMC. Los datos fueron almacenados en una base de datos de Excel diseñada al efecto. Los pacientes fueron categorizados por el IMC (kg/m2), tal como es recomendado por la OMS: desnutridos: < 18,5; normopesos: 18,5-24,9; sobrepesos: 25-29,9 y obesos ³ 30.14 Además, se subdividieron los pacientes por sextiles de peso corporal.
Toda la información fue procesada de forma automatizada. Se empleó el paquete estadístico Statistical Package for Social Sciences (SPSS), versión 15.0 (Illinois, Chicago). A las variables edad, peso e IMC se le calculó la media, la desviación estándar, el máximo y el mínimo. Las comparaciones entre los sextiles de peso y las categorías de IMC respecto al pH urinario se realizaron mediante análisis de varianza. Para todas las pruebas de hipótesis se fijó un nivel significación a= 0,05.
RESULTADOS
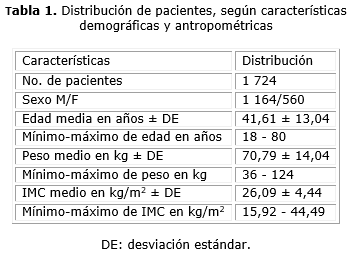
De los 1 724 pacientes estudiados, 1 164 (67,5 %) eran individuos del sexo masculino (tabla 1), con una relación hombre/mujer de 2,1/1. La edad promedio de los pacientes estudiados fue de 41,61 años y el peso medio fue de 70,79 kg. La media del IMC fue de 26,09 kg/m2.
Al distribuir la población por sextiles de peso corporal se encontró que en aquellos sujetos con peso corporal por debajo de 57 kg, el pH urinario medio se encontraba en 5,73 (tabla 2) y disminuía paulatinamente en los sextiles de mayor peso corporal, hasta un pH promedio de 5,5 en los pacientes con peso corporal por encima de 84 kg. Las diferencias entre los sextiles fue estadísticamente significativa, p= 0,00.
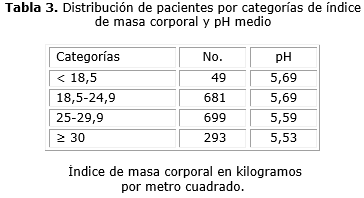
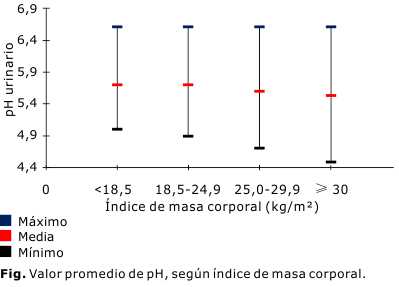
En la tabla 3 se muestra el número de pacientes por categorías nutricionales atendiendo al IMC y el pH urinario, donde resulta evidente los valores más bajos de pH urinario en la medida que se pasa de la categoría de normopeso a sobrepeso y obeso (Fig.); disminuyeron de 5,69 a 5,53. Las diferencias entre las categorías fueron estadísticamente significativas, p= 0,00.
DISCUSIÓN
La mayor frecuencia de presentación de las litiasis urinarias en los hombres respecto a las mujeres es un hecho que se repite en todos los estudios epidemiológicos desarrollados al respecto en las distintas latitudes, y explica la mayor frecuencia de indicación de estudios metabólicos renales entre los varones.15 Del mismo modo, la mayor frecuencia de presentación de las urolitiasis universalmente se registra entre los 35 y 45 años de edad, lo que explica el mayor número de pacientes pertenecientes a este rango de edad.16
El sobrepeso ha sido identificado como un factor de riesgo para el desarrollo de litiasis urinarias, por lo que resultaba esperable el sobrepeso en los pacientes estudiados;13 en buena medida, ello parece estar determinado por los cambios en la acidez urinaria que se dan en estos sujetos y que ampliaremos más adelante en esta discusión. A ello se suma que en la población general adulta se ha hallado un incremento notorio de los sujetos categorizados como sobrepesos.2
Resulta llamativa la caída del pH urinario en la medida en que se incrementan los sextiles de peso corporal de la población, lo que ya había sido encontrado con anterioridad; en tal sentido resulta muy ilustrativo el trabajo de Maalouf y otros, desarrollado en dos grandes clínicas de litiasis de EE. UU. que incluyó 4 883 pacientes; en este estudio el pH urinario cayó del sextil de menos peso corporal al de mayor peso 0,27 unidades de pH.17 Así, se halló una correlación inversa significativa entre el pH urinario y el peso corporal. Dicha correlación persistió luego de ajustar el pH para la concentración de sulfato. Este último indica que el pH bajo no se explicaba totalmente por la carga ácida proteica dietética.
Si bien los resultados de este estudio coinciden con los de otros trabajos precedentes, se destaca el hecho de que los valores de pH identificados en esta investigación sean más bajos que los de otras series.17,18 Ello es debido al tipo de muestra utilizada para el estudio, que en este caso fue obtenida en ayunas, mientras otros estudios han tomado una alícuota proveniente de una colección de orina de 24 h, utilizada generalmente para estudio metabólico renal.17 Con la ingestión de alimentos se produce la denominada marea alcalina, por aumento en el paso de bicarbonato a la sangre proveniente del estómago, lo que hace que aumente el pH urinario.19 En este estudio se prefirió trabajar con la primera muestra de la mañana, en ayunas, porque en caso contrario se debe ajustar el pH para la concentración de sulfato urinario, que es expresión de la ingesta proteica (residuo ácido), como consecuencia del alto contenido de aminoácidos sulfurados (metionina y cisteína) presentes en las proteínas, sobre todo en aquellas de origen animal.13 Ante la imposibilidad de la medición de sulfato urinario, la orina matinal en ayunas resulta una magnífica opción.
Los trabajos que relacionan el pH urinario únicamente con el peso de los sujetos tienen un gran inconveniente, el mayor peso de un individuo respecto a otro puede deberse a una mayor talla y no ser expresión de un mayor contenido graso.14 En tal sentido, resulta muy útil la utilización del IMC, el cual constituye un buen indicador de la adiposidad del individuo, aun cuando dista de ser un marcador idóneo y tiene desventajas claras respecto a los estudios de composición corporal por impedancia bioeléctrica, densitometría dual de rayos X (DEXA), y las mediciones antropométricas como los pliegues grasos.20
El análisis del pH urinario en relación con el IMC de los sujetos muestra una clara disminución del pH en la medida que se avanza en las categorías de IMC, de normopeso a sobrepeso y obeso, lo que ya había sido encontrado anteriormente, aunque todos los trabajos disponible al respecto incluyeron un número menor de sujetos o se basaban en el auto reporte.18,21
Al analizar el origen del pH urinario ácido identificado en los pacientes con valores más altos de IMC, se debe tener presente que un pH urinario persistentemente bajo puede deberse a: 1. aumento en la secreción de H+ en la nefrona distal y 2. entrada reducida de NH3 en el túbulo colector medular. La primera situación se acompaña de alta excreción de NH4+ y la segunda de una relativamente menor excreción del mismo. En los pacientes litiásicos se ha encontrado baja excreción de NH4+. 13 Esto puede deberse a una síntesis disminuida de NH4+ en el túbulo contorneado proximal (TCP) o a una alteración en la secreción de NH3 a nivel medular. Entre las causas de síntesis reducida de NH4+ está el incremento del pH intracelular en el TCP, como se observa cuando hay compromiso en la salida de HCO3- de las células a través del cotransportador sodio-bicarbonato.11 La resistencia a la insulina se acompaña de una menor excreción de amonio, esto es debido a que la insulina aumenta la síntesis de NH4+ a partir de L-glutamina en el TCP y estimula allí el intercambio Na+/H+ o (Na+/NH4+), lo cual favorece la secreción de NH4+ a ese nivel; estas acciones de la insulina propician la amortiguación de iones de hidrógeno y explica por qué la insulinorresistencia podría ser en parte responsable de la excesiva acidez urinaria en estos pacientes.22,23
En aras de corroborar estos elementos fisiopatológicos descritos en buena medida en animales de laboratorio, se desarrolló un estudio en el que se usó el clampeo hiperinsulinémico-euglucémico comparando pacientes con nefrolitiasis y sujetos no litiásicos; y se pudo observar que los pacientes con litiasis presentaban mayor resistencia a la insulina y en los sujetos no litiásicos, el menor requerimiento de glucosa se asoció a menor pH urinario, lo que corroboraba los hallazgos fisiopatológicos antes descritos.24 Obsérvese que la obesidad, un marcador periférico de sensibilidad a la insulina, está inversamente relacionado con el pH urinario, un marcador de sensibilidad renal a la insulina.
Por otra parte, Cameron y otros, compararon el pH urinario en pacientes con diabetes tipo 2 sin litiasis renal, pacientes con litiasis urinaria y sujetos controles. Se observó una relación inversa significativa entre pH y peso corporal en todos los grupos; los pacientes con litiasis y los diabéticos presentaron un pH urinario muy similar y significativamente más ácido que los sujetos controles normales.25 A ello se suman los múltiples estudios que han hallado una mayor frecuencia de litiasis de ácido úrico en pacientes diabéticos, litiasis estas que se ven particularmente propiciadas en orinas ácidas.26
La cristalización del ácido úrico depende de 3 factores: pH urinario, excreción de ácido úrico y volumen urinario. 13 Sin embargo, la presencia de un pH urinario ácido es el principal determinante de la concentración de ácido úrico no disociado en orina y, por lo tanto, el factor predisponente principal para la formación de cálculos úricos. La presencia de un aumento en la uricosuria y un bajo volumen urinario son factores agregados de riesgo litiásico. La mayoría de los pacientes con litiasis úrica idiopática presentan excreción de ácido úrico normal, mientras que el pH urinario está marcadamente disminuido.11,27
La constante de disociación del primer protón del ácido úrico (pKa) es 5,35 en orina a 37 °C. La solubilidad del ácido úrico no disociado es solamente de 96 ± 2 mg/L; en presencia de un pH de 5,35, la mitad del ácido úrico presente en la orina está en su forma no disociada, por lo cual una excreción normal de acido úrico (ej.: 500 mg/d) no va a estar en solución a menos que el volumen urinario sea mayor a 3 L/d. A medida que disminuye el pH urinario por debajo de 5,35, la mayoría del ácido úrico se va a encontrar en su forma no disociada, lo que favorece la cristalización del ácido úrico y la litogénesis.11,13
Debe tenerse presente que la acidez urinaria no favorece únicamente las litiasis úricas, sino que también va a ser un factor trascendente en la litogénesis urinaria como un todo, pues a partir de los núcleos de ácido úrico se puede producir la deposición de sales de calcio y desarrollarse urolitiasis cálcicas que son las más frecuentemente halladas a nivel poblacional.13
Se puede concluir que existe una relación inversa entre el pH urinario y el peso corporal; así como entre el pH urinario y el IMC en pacientes litiásicos, lo que parece tener importancia en el origen de las litiasis en los pacientes con sobrepeso y obesidad. Estos elementos son trascendentes para la prevención, tanto primaria como secundaria, de la litiasis urinaria, pues a la luz de estos hallazgos, la incorporación de los pacientes litiásicos con sobrepeso y obesidad a programas de disminución de peso, así como la alcalinización urinaria, se constituyen en pilares terapéuticos en estos sujetos.
REFERENCIAS BIBLIOGRÁFICAS
1. Schneider H, Dietrich E, Venetz W. Trends and Stabilization up to 2022 in Overweight and Obesity in Switzerland, Comparison to France, UK, US and Australia. Int J Environl Res Public Health. 2010;7(2):460-72.
2. Jiménez Acosta S, Díaz ME, Barroso I, Bonet M, Cabrera A, Wong I. Estado nutricional de la población cubana adulta. Rev Esp Nutr Comunitaria. 2005;11(1):18-26.
3. Porrata C, Suárez A, Hernández M, Jiménez S, Argüelles J, Cabrera A, et al. Dieta y salud en Cuba. Arch Latin Nutr. 1995;45(1-S):214-19.
4. Vila-Bedmar R, Fernández-Veledo S. A new era for brown adipose tissue: New insights into brown adipocyte function and differentiation. Archives of Physiology and Biochemistry. 2011;117:195-208.
5. Alberti K, Zimmet P, Shaw J. The metabolic syndrome a new worldwide definition. Lancet. 2005;366(9491):1059-62.
6. Shin JA, Lee JH, Lim SY, Ha HS, Kwon HS, Park YM, et al. Metabolic syndrome as a predictor of type 2 diabetes, and its clinical interpretations and usefulness. J Diabetes Investig. 2013 Jul 8;4(4):334-43.
7. Stamatelou KK, Francis ME, Jones CA. Time trends in reported prevalence of kidney stones in the United States: 1976-1994. Kidney Int. 2003;63:1817-23.
8. Reyes L, Almaguer M, Castro T. Estudio clínico-epidemiológico de la urolitiasis en un área urbana caribeña. Nefrología. 2002;22:239-44.
9. Curhan GC, Willett WC, Rimm EB, Speizer FE, Stampfer MJ. Body size and risk of kidney stones. J Am Soc Nephrol. 1998;9:1645-52.
10. Taylor EN, Stampfer MJ, Curhan GC. Obesity, weight gain, and the risk of kidney stones. JAMA. 2005;293(4):455-62.
11. Kamel K, Cheema-Dhadli S, Shafiee M, Davids M, Halperin M. Recurrent uric acid stones. Q J Med. 2005;98:57-68.
12. Zerifi R, Bahlous A, Marakchi O, Daudon M, Bartagi Z, Abdelmoula J. Syndrome métabolique: physiopathologie et impact sur la lithogenèse. Ann Biol Clin. 2008;66(1):9-17.
13. Bushinsky DA, Coe FL, Moe OW. Nephrolithiasis. En: Taal MW, Chertow GM, Marsden PA, Skorecki K, Yu ASL, Brenner BM, editores. The Kidney. 9 ed. Philadelphia: Elsevier Health Sciences; 2011. Pp. 1455-507.
14. WHO. World Health Organization. Physical status: the use and interpretation of anthropometry. Report of a WHO Expert Committee. WHO Technical Report Series 854. Geneva: World Health Organization; 1995.
15. Seitz C, Fajkovic H. Epidemiological gender-specific aspects in urolithiasis. World J Urol. Oct. 2013;31(5):1087-92.
16. Trinchieri A. Epidemiology of urolithiasis: an update. Clin Cases Miner Bone Metab. May 2008;5(2):101-6.
17. Maalouf NM, Sakhaee K, Parks JH, Coe FL, Adams-Huet B, Pak CY. Association of urinary pH with body weight in nephrolithiasis. Kidney Int. 2004;65(4):1422-5.
18. Najeeb Q, Masood I, Bhaskar N, Kaur H, Singh J, Pandey R, et al. Effect of BMI and urinary pH on urolithiasis and its composition. Saudi J Kidney Dis Transpl. 2013 Jan;24(1):60-6.
19. Yao X, Forte JG. Cell biology of acid secretion by the parietal cell. Annu Rev Physiol. 2003;65:103.
20. Heymsfield SB, Adamek M, Gonzalez MC, Jia G, Thomas DM. Assessing skeletal muscle mass: historical overview and state of the art. J Cachexia Sarcopenia Muscle. 2014 Mar;5(1):9-18.
21. Li WM, Chou YH, Li CC, Liu CC, Huang SP, Wu WJ, et al. Association of body mass index and urine pH in patients with urolithiasis. Urol Res. 2009 Aug;37(4):193-6.
22. Chobanian MC, Hammerman MR. Insulin stimulates ammoniagenesis in canine renal proximal tubular segments. Am J Physiol. 1977;253:171-7.
23. Gesek FA, Schoolwerth AC. Insulin increases Na+/H+ exchange activity in proximal tubules from normotensive and hypertensive rats. Am J Physiol. 1991;260:695-703.
24. Abate N, Chandalia M, Cabo-Chan AV Jr, Moe OW, Sakhaee K. The metabolic syndrome and uric acid nephrolithiasis: novel features of renal manifestation of insulin resistance. Kidney Int. 2004;65:386-92.
25. Cameron MA, Maalouf NM, Adams-Huet B, Moe OW, Sakhaee K. Urine composition in type 2 diabetes: predisposition to uric acid nephrolithiasis. J Am Soc Nephrol. 2006;17:1422-8.
26. Chung SD, Chen YK, Lin HC. Increased risk of diabetes in patients with urinary calculi: a 5-year followup study. J Urol. 2011 Nov;186(5):1888-93.
27. Marickar F, Salim A. Temporary risk identification in urolithiasis. Urol Res. 2009;37(6):377-80.
Recibido: 11 de junio de 2014
Aceptado: 13 de octubre de 2014.
Dr. Raymed Antonio Bacallao Méndez. Instituto de Nefrología "Dr. Abelardo Buch López", Ave. 26 y Boyeros, municipio Plaza de la Revolución. La Habana, Cuba.
Correo electrónico: raymed@infomed.sld.cu