Introducción
El hipotiroidismo es ocasionado por la secreción deficiente de hormonas tiroideas, y se asocia a comorbilidades como la hipertensión arterial, la dislipidemia y la cardiopatía isquémica. Su incidencia es mayor entre la tercera y sexta década de la vida con predominio en el sexo femenino. Tiene una incidencia en la población general del 1 al 2 % y alcanza el 6-7 % de la población femenina mayor de 60 años. En Cuba, después de la diabetes mellitus, ocupa el segundo lugar en la prevalencia de las enfermedades endocrinas.1
El incremento del riesgo de aterosclerosis en el hipotiroidismo se sustenta esencialmente en los estudios epidemiológicos, resultados de autopsia y en los factores de riesgo tradicionales: hipertensión arterial y perfil lipídico aterogénico (este último observado con mayor frecuencia con niveles de tirotropina (conocida también TSH, del inglés Tyroid-Stimulantig Hormone) mayores de 10 mU/L).2) A esos factores, también se suman la existencia de disfunción endotelial, niveles alterados de proteína C reactiva, homocisteína y patrón de coagulación alterada, así como la resistencia a la insulina, que se vincula con un estado de inflamación crónica de bajo grado favorecido por la gran cantidad de adipoquinas secretadas por el tejido adiposo.3
Por otro lado, el síndrome de insulinorresistencia describe un grupo de anomalías clínicas relacionadas, que ocurren más comúnmente en sujetos con resistencia a la insulina e hiperinsulinemia compensatoria. Este se asocia con un estado inflamatorio crónico y de disfunción endotelial, de evolución continua y progresiva, que confiere al paciente una alta predisposición de riesgo metabólico para desarrollar prediabetes y diabetes mellitus tipo 2 (DM 2), así como un alto riesgo aterosclerótico, que se expresa en la asociación a enfermedad cardiovascular y cerebrovascular, con una alta morbilidad y mortalidad.4
Estudios realizados en Cuba demuestran una estrecha asociación entre insulinorresistencia y aterosclerosis subclínica,5,6) así como un mayor riesgo cardiometabólico en pacientes con hipotiroidismo primario que puede ser modificado con el tratamiento sustitutivo.7) No obstante, no existe ningún estudio controlado a gran escala que arroje evidencia sólida en cuanto a la asociación entre el hipotiroidismo y la insulinorresistencia, así como la influencia de ambos factores asociados a la aparición de ateroesclerosis carotidea subclínica.
Por lo antes expuesto esta investigación tuvo el objetivo de identificar si existe relación entre la presencia de hipotiroidismo primario e insulinorresistencia y la aterosclerosis carotídea subclínica.
Métodos
Se realizó un estudio analítico, multicéntrico, de corte transversal, que incluyó 150 pacientes de 25 a 40 años divididos en dos grupos de comparación: 1) portadores de hipotiroidismo primario de más de un año de evolución de los síntomas y signos (n=75) y 2) insulinorresistentes de más de un año de evolución, sin hipotiroidismo (n=75), a los cuales se les realizaron procederes de laboratorio y ultrasonográficos. Los pacientes fueron atendidos en las consultas de endocrinología de Hospital Clínico Quirúrgico 10 de Octubre, Hospital “Miguel Enríquez” y del Instituto Nacional de Endocrinología, desde enero de 2015 hasta julio de 2017.
Se excluyeron aquellos diagnósticos con cardiopatía isquémica, enfermedad cerebrovascular, insuficiencia renal u otra enfermedad crónica que favoreciera la aparición o el desarrollo de la ateroesclerosis y a los fumadores activos o exfumadores con menos de cinco años de abandono del hábito.
Se analizaron variables clínicas (edad, índice de masa corporal (IMC), tensión arterial sistólica (TAS) y diastólica (TAD)); bioquímicas (colesterol total y triglicéridos); hormonales (insulinemia, índice HOMA-IR y TSH); ultrasonográficas (grosor íntima-media carotideo (GIMC) y velocidad local de propagación del pulso carotideo (VLPP) y ecocardiográficas (índice de masa del ventrículo izquierdo (VI) y volumen de aurícula izquierda (AI).
Variables clínicas y antropométricas: La presión arterial se determinó con un esfigmomanómetro aneroide con columna de mercurio, colocándose el brazalete en el brazo izquierdo, después de 5 min de descanso con el sujeto sentado. A cada paciente se le realizaron dos mediciones de presión arterial, mediando aproximadamente 10 min entre la primera y la segunda medición, ambos valores fueron promediados.
Variables bioquímicas: En todos los participantes, la extracción (10 mL) se realizó por punción en la vena cubital y se depositó la sangre en un tubo con EDTA, un tubo con heparina y un tubo con gel seco para suero. Para la determinación del colesterol total y los triglicéridos se emplearon los reactivos Colestest y Monotriglitest respectivamente, producidos en la empresa “Carlos J. Finlay” La Habana, Cuba.
La insulina se determinó por método de radio inmuno-ensayo (insulina por radioinmunoanálisis [Coat-A-Count Insulin (DPC)] en fase sólida por competencia) con una sensibilidad de 5 uIU/mL y un rango de normalidad de 5 -35 µIU/mL con un coeficiente de variación inter e intraensayo de 6,2 % y 7,1% respectivamente. En el caso del radioinmunoanálisis, el coeficiente de variación del control de calidad oscila habitualmente en nuestro laboratorio entre un 6 y 9 %, rango característico de este tipo de método inmunoradiológico.
El índice de resistencia a la insulina empleado fue el HOMA-IR, calculado a partir de los valores iniciales de glucosa e insulina siguiendo el modelo homeostático (HOMA), de acuerdo con la fórmula: RI = (insulinemia ayuna (μIU/ml) x glucemia ayuna (mmol/L))/22,5. El valor de referencia estandarizado en el laboratorio del Instituto Nacional de Endocrinologνa es 2.6, validados por Arranz y otros,8 por lo que cifras superiores a esta son indicadoras de insulinorresistencia.
Determinación de los parámetros ultrasonográficos
Grosor íntima-media carotideo y velocidad local de propagación del pulso carotideo: Se realizaron mediante métodos previamente descritos y empleados por los autores del estudio.5,7
Masa del VI: Se calculó mediante la medición de las áreas epicárdica y endocárdica del VI, (ventrículo izquierdo), en la vista eje corto paraesternal a nivel medio ventricular. Posteriormente, se procedió a medir el área del VI por el método del elipsoide truncado, descrito por Schiller. El equipo informa automáticamente la masa del VI.
Volumen de la AI: Se promediaron los volúmenes de la AI obtenidos desde la vista 4 cámaras y 2 cámaras apical.
Análisis estadístico
Se compararon los valores promedios de las variables cuantitativas (edad, tiempo de evolución, IMC, glicemia, insulinemia, colesterol, triglicéridos, creatinina, ácido úrico, TSH, GIM carotídeo) entre los grupos y se utilizó la prueba t de student para muestras independientes.
Se realizaron tabulaciones cruzadas de las diferentes variables cualitativas y se utilizó la prueba Chi Cuadrado para evaluar la significación estadística de la posible asociación.
Se consideró TSH elevada mayor o igual a 3,75 mU/mL y Homa-IR elevado mayor o igual a 2,6 mmol/mL.
Con las variables categorizadas de ese modo, se realizó un análisis de curvas COR, con vistas a determinar la capacidad de la TSH y el HOMA-IR definidas anteriormente, para discriminar entre distintos valores de grosor de intima media carotideo; así como identificar el punto de corte que ofrece la mejor combinación de sensibilidad y especificidad. Este análisis ofreció valores propios del estudio.
Se consideró que la variable tenía un buen poder discriminatorio cuando el área bajo la curva COR fue diferente de 0,5 (p<0,05 e IC que no contenía al 0,5).
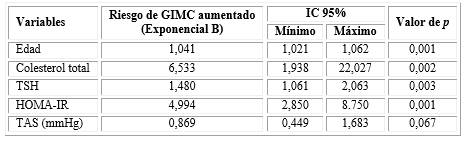
Adicionalmente, se llevó a cabo un análisis de regresión logística con el fin de evaluar el efecto de ambas variables (TSH Y el HOMA-IR) en la predicción de elevación del grosor de intima media carotídeo.
Se excluyeron otros posibles predictores ya que no era objetivo de esta investigación.
Para el análisis estadístico se aplicó el programa SPSS versión 20.0 (SPSS Inc., Chicago, III, USA).
Se empleó un nivel de significación de 5 %.
Resultados
De los 150 pacientes incluidos, la distribución por sexo fue similar en los dos grupos (81,3 % de mujeres). En el grupo con hipotiroidismo, valores medios de IMC, colesterol total, TSH y GIMC significativamente mayores, respecto a los insulinorresistentes. Por otro lado, el HOMA-IR fue significativamente mayor en los insulinorresistentes. La edad, la TAS y TAD, los triglicéridos, la VLPP, el volumen de AI y la masa del VI, no mostraron diferencias significativas entre los dos grupos de comparación (tabla 1).
Tabla 1 Variables clínicas, bioquímicas y ultrasonográficas entre los grupos de comparación
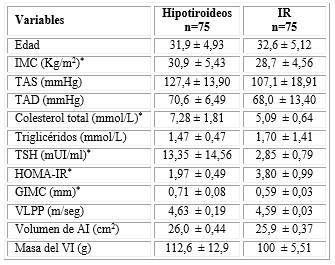
IMC: Índice de masa corporal; TAS: Tensión arterial sistólica; TAD: Tensión arterial diastólica; GIMC: Grosor íntima-media carotideo; VLPP: Velocidad local de propagación del pulso carotideo; AI: Aurícula izquierda; VI: Ventrículo izquierdo.
*p<0,05
El valor de corte de TSH en 4,20 µmol/L mostró la mejor sensibilidad (95,5 %) y especificidad (73,3 %) en la predicción de aumento del GIMC (tabla 2), mientras que el valor de corte de HOMA-IR con mejor sensibilidad (95,5 %) y especificidad (73,1 %) fue 3,10 (tabla 3).
Tabla 2 Sensibilidad y especificidad de la TSH como predictor de elevación del GIMC

Área bajo la curva ROC de 0,857 con intervalo de confianza: 0,705-0,910 (p<0,001).
Tabla 3 Sensibilidad y especificidad del HOMA-IR como predictor de elevación del GIM
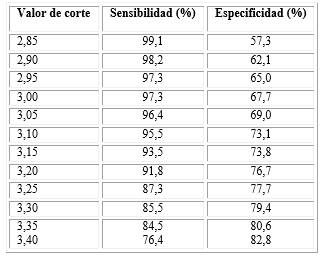
Área bajo la curva ROC de 0,797 con intervalo de confianza: 0,605-0,810 (p< 0,001).
La regresión logística muestra que el colesterol total y el HOMA-IR fueron las variables con una relación significativa con el GIMC, independiente de la influencia de otras variables confusoras, tales como la edad y la TSH (tabla 4).
Discusión
La disminución de la sensibilidad a la insulina es una anomalía determinante en la patogénesis del síndrome metabólico, cuyos componentes son factores de riesgo reconocidos desde hace mucho tiempo para el desarrollo de enfermedades cardiovasculares.
Estudios consultados9,10,11 muestran que los pacientes con TSH > de 2,5 mUI/L presentaron niveles de HDL colesterol más bajos, triglicéridos y HOMA-IR más elevados, lo que no se pudo explicar por diferencias de edad ni en el IMC. Además, estos pacientes mostraron un aumento estadísticamente significativo del riesgo de tener resistencia insulínica medida por HOMA-IR. En ellos se observó una débil pero significativa correlación positiva entre los valores de TSH y HOMA-IR y negativa entre los valores de T4 y HOMA-IR, mientras que no se observó correlación alguna entre TSH e índice de masa corporal. No obstante, la existencia de una asociación entre disfunción tiroidea e insulinorresistencia es tema que necesitará de estudios prospectivos y de intervención para poder ser demostrado.
El peso corporal disminuye en el hipertiroidismo y tiende a aumentar en el hipotiroidismo clínico. Durante los últimos años, algunos estudios han descrito una débil asociación entre los niveles de TSH y el IMC en pacientes con eutiroidismo, inclusive en un metaanálisis reciente, de Moura Souza A12) muestra que de 29 estudios analizados, 18 encuentran una asociación entre valores antropométricos y niveles de TSH dentro de límites normales. No obstante, la TSH más elevada descrita en pacientes obesos puede ser una consecuencia de la obesidad, como lo sugieren los resultados del trabajo de Sanyal y otros.13
Un dato interesante encontrado en este estudio fue el IMC en los tres grupos analizados no fue tan diferente, es más, no fue todo lo mayor que se esperaba en el caso de los insulinorresistentes, lo que implica que los cambios hallados en los niveles de insulina y de HOMA-IR no pueden ser explicados por este motivo, además hay que tener en cuenta el supuesto de que con este rango de edades hasta los 40 años los individuos cuidan más su imagen corporal que en épocas posteriores.
El presente trabajo mostró que el hipotiroidismo y la insulinorresistencia son predictores independientes de aterosclerosis subclínica carotídea, sobre todo cuando la TSH superó los 4,2 mUI/mL y el HOMA-IR los 3.1μIU/mL.
Nagasaki y otros14 reportaron valores de GIMC significativamente mayores en un grupo de pacientes hipotiroideos respecto a un grupo control eutiroideo, aunque no se encontró una correlación positiva entre los niveles de TSH y el GIM. Por el contrario, Díaz y otros15 sí demostraron una correlación positiva y significativa entre el GIM y los niveles de TSH, con niveles significativamente mayores de GIMC en 104 mujeres obesas con tiroiditis de Hashimoto. La presente investigación, similar a otras,16 demostró que esta asociación era independiente de factores de riesgo clásicos para aterosclerosis como la dislipidemia y la hipertensión arterial, y que también están presentes en el hipotiroidismo. También se demostró una correlación significativa del TSH con el GIMC, junto a otros factores como el HOMA-IR, la edad y el colesterol total e independiente a su vez del IMC, la presión arterial, los triglicéridos, así como otros parámetros de rigidez arterial y geometría aurículo ventricular estudiados.
Estudios previos realizados en Cuba5,6) han mostrado mayor IMC, niveles de glucemia en ayunas, triglicéridos y GIMC en pacientes con HOMA-IR >2,6, así como en pacientes hipotiroideos respecto a controles,7 parámetros que también muestran una correlación significativa con los niveles de TSH.
Por último, la población estudiada fue 80 % femenina, y si bien esto no invalida los resultados, ya que la distribución fue similar en todos los grupos analizados, no sería adecuado extender las conclusiones a ambos sexos, teniendo en cuenta la influencia que tiene el género en la presencia de la insulinorresistencia.
Los pacientes con diagnóstico de hipotiroidismo, insulino resistencia o ambos, tienen mayor presencia de aterosclerosis subclínica.