Introducción
El lupus eritematoso sistémico (LES) es un trastorno multi-sistémico considerado como prototipo de enfermedad mediada por inmunocomplejos (IC).1 Los anticuerpos unidos a los auto-antígenos liberados por las células apoptóticas contribuyen a la formación de IC.2 Dentro de la gran diversidad de especificidades antinucleares que se producen en el LES solo unas pocas poseen valor diagnóstico y de seguimiento de la actividad de la enfermedad. Los anticuerpos anti-ácido desoxirribonucleico de doble cadena (anti-ADNdc) constituyen el sello inmunológico del LES, son los de mayor valor clínico y representan los anticuerpos de referencia tanto para el diagnóstico como para el seguimiento de pacientes con LES.3. La presencia de los anticuerpos anti-ADNdc integra los criterios de clasificación del LES, 4,5 así como también está incluida en los índices de evaluación de la actividad del LES en virtud de la fluctuación de los niveles de los anti-ADNdc en correspondencia con la actividad de la enfermedad.6 Los anticuerpos anti-ADNdc de isotipo IgG constituyen el subconjunto de anticuerpos de mayor patogenicidad y en particular asociados a la lesión renal del LES.7
Recientemente los anticuerpos anti-nucleosoma (anti-Nuc), que pertenecen a la misma familia de los anticuerpos anti-ADNdc han mostrado ser un robusto marcador diagnóstico del LES.8 Además, se ha señalado tanto en estudios transversales como longitudinales de pacientes con LES que los niveles de anticuerpos anti-Nuc reflejan fielmente la actividad de la enfermedad.9
Otras especificidades de autoanticuerpos como los antiproteínas ribosomales (anti-RibP) integran también el perfil serológico de pacientes con LES. El papel diagnóstico de los anticuerpos anti-RibP ha sido enfatizado por su elevada especificidad para esta enfermedad.10 En virtud de la asociación encontrada de los anticuerpos anti-RibP con fases de actividad de la enfermedad y varias manifestaciones clínicas del LES se les atribuye un intrigante potencial patogénico que necesita mayor investigación.11
Menos ha sido documentado el valor clínico de los IC circulantes en el LES y su asociación con la actividad de la enfermedad y con la nefritis lúpica (NL). Hipotéticamente, en la fase activa del LES, la mayor producción de auto-anticuerpos en presencia de antígenos nucleares liberados da lugar a la formación de IC, mientras que en la fase inactiva, los auto-antígenos no se liberan y no se producen los IC.
Previamente, se había demostrado una fuerte asociación de los anticuerpos anti-ADNdc y anti-Nuc con la actividad de la enfermedad en nuestros pacientes con LES.12 El presente estudio se realizó con el objetivo de determinar el valor clínico de los inmunocomplejos circulantes en pacientes con lupus eritematosos sistémico.
Métodos
Los métodos se desarrollaron según los procedimientos operativos aprobados. Todos los sujetos fueron involucrados después de obtener su consentimiento informado.
Se realizó un estudio transversal en 93 pacientes adultos consecutivos con diagnóstico de lupus eritematosos sistémico con indicación médica de determinación de anticuerpos según el protocolo de seguimiento clínico de pacientes con LES del servicio de Reumatología del Hospital Clínico Quirúrgico "Hermanos Ameijeiras" en el período comprendido desde diciembre 2017 a octubre 2018.
Los criterios de inclusión fueron: presencia de un mínimo de cuatro criterios para el diagnóstico del LES,4 ausencia de diagnóstico adicional de otra enfermedad del tejido conectivo y ausencia de procesos infecciosos virales y bacterianos.
El diagnóstico de nefritis lupica fue definido por los criterios del Colegio Americano de Reumatología (ACR) considerando: proteinuria persistente ≥ 0,5 g/24 h; presencia de cilindros celulares en orina e histología de nefritis lupica evidenciada en biopsia.13 Los datos demográficos, clínicos y de laboratorio se obtuvieron de la historia clínica hospitalaria y revisados por reumatólogos experimentados.
Como controles del método se determinaron los IC y auto-anticuerpos en las muestras séricas de 22 donantes sanos de banco de sangre compatibles en edad y sexo con los pacientes de LES.
Auto-anticuerpos e inmunocomplejos circulantes
La muestra sérica para la determinación de IC circulantes se obtuvo de la muestra para la determinación de las pruebas de auto-anticuerpos protocolizadas para el seguimiento de la actividad del LES. Las muestras de suero fueron fraccionadas y conservadas a -20 °C hasta la fecha de la determinación. Las determinaciones de los autoanticuerpos anti-ADNdc, anti-Nuc y anti-RibP se realizaron por el método de ELISA dirigido a la detección de los anticuerpos de isotipo IgG (IBL Internacional GmbH, Hamburgo, Alemania). El método de ELISA para los anticuerpos anti-ADNdc utilizó como antígeno el ADNdc recombinante humano; para los anticuerpos anti-Nucs se utilizaron nucleosomas humanos; y para el anti-RibP se emplearon proteínas P ribosomales humanas P0, P1 y P2 aisladas de células eucarióticas. Los valores de corte fueron los recomendados por el fabricante. Se consideraron como muestras positivas de anti-ADNdc las de valores mayores de 46 U/mL; y positivas de anti-Nuc y anti-RibP las de valores mayores de 18 U/mL.
Se consideró como carga de anticuerpos el total de las especificidades antinucleares positivas del paciente. Rango: 0-3.
Los IC circulantes fueron detectados el método por ELISA sobre la base de la unión de la IgG a la molécula de C1q inmovilizada sobre la fase sólida (IBL Internacional GmbH, Hamburgo, Alemania). Para el lavado de los pocillos tanto de las determinaciones de auto-anticuerpos como de los IC circulantes se utilizó la fregadora automática de microplacas (BioTek Instruments, Inc, Vermont, Estados Unidos) y la lectura fotométrica de la densidad óptica se realizó en el lector de microplacas (BioTek Instruments, Inc, Vermont, Estados Unidos). Se aplicó la misma tecnología durante todo el estudio. La determinación de IC circulantes se expresó en µgEq/mL de agregados de IgG. Los valores de corte fueron los recomendados por el fabricante. Se consideraron como positivas de IC circulantes las muestras de valores mayores de 16 µgEq/mL.
Los resultados de las determinaciones de los auto-anticuerpos e IC circulantes fueron registrados en la historia clínica del paciente de la base de datos correspondiente al software GALEN Clínicas del hospital del estudio.
Análisis estadístico
Las pruebas para la normalidad demostraron una distribución asimétrica de todas las variables. La estadística descriptiva se expresó como mediana, amplitud intercuartil y rango mínimo-máximo para las variables continuas y como frecuencia y porcentaje para las variables categóricas.
La correlación entre los niveles de auto-anticuerpos e IC circulantes se realizó con la correlación no paramétrica de Spearman (coeficiente de correlación ρ [rho]).
Los títulos de los IC circulantes en los grupos de pacientes positivos y negativos de anticuerpos se compararon con la prueba de Mann-Whitney.
La frecuencia de nefritis lupica en los grupos de pacientes positivos y negativos de IC circulantes se comparó mediante Chi cuadrado.
La significación estadística fue definida como p< 0,005 calculado bilateralmente (2-tailed). El análisis estadístico se realizó con el paquete estadístico SPSS v 20 para Windows Xp.
Resultados
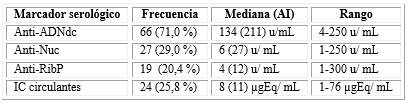
Se estudiaron 93 pacientes con LES, de los cuales 82 (88,2 %) fueron mujeres y 11 (11,8 %) fueron hombres con una edad media de 43 años y el rango mínimo-máximo de 19-72 años. La nefritis lupica estuvo presente en 36 (38,7 %) de los pacientes con LES. Respecto a la carga de anticuerpos, 21 (22,6 %) pacientes resultaron negativos de los anticuerpos anti-ADNdc, anti-Nuc y anti-RibP; 40 (43,0 %) pacientes fueron positivos de uno de estos anticuerpos; 26 (28,0 %) pacientes fueron positivos de dos anticuerpos; y 6 (6,5 %) pacientes fueron positivos de los tres anticuerpos analizados. De los 24 pacientes positivos de IC circulantes solo 5 (20,8 %) fueron negativos de los auto-anticuerpos probados (tabla 1).
En las muestras controles los IC y los anticuerpos anti-ADNdc, anti-Nuc y anti-RibP fueron no detectables.
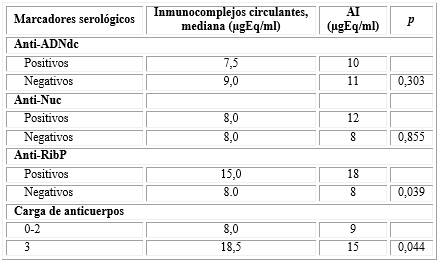
El análisis de correlación de Spearman entre los niveles de IC circulantes y los autoanticuerpos demostró presencia de correlación directa entre los niveles de IC circulantes y los anticuerpos anti-RibP (Rho=0.303, p=0,003) y entre los anticuerpos anti-ADNdc y anti-Nuc (Rho=0,449, p=0,001); y ausencia de correlación entre los IC circulantes y los anti-ADNdc (Rho=0,015, p=0,884), entre IC circulantes y los anti-Nuc (Rho=-0,001, p=0,990), entre los anti-ADNdc y anti-RibP(Rho=0,045, p=0,670), y entre anti-Nuc y anti-RibP (Rho=0,103, p=0,325).
Tabla 1- Presencia de auto-anticuerpos e inmunocomplejos circulantes en 93 pacientes con lupus eritematosos sistémico
La distribución de la afectación renal no fue estadísticamente diferente en los pacientes positivos y negativos de IC circulantes: la nefritis lúpica se presentó en 14 de los 24 (58,3 %) pacientes con IC circulantes, y en 22 de los 69 (31,9 %) pacientes negativos de IC circulantes (p=0,213) (tabla 2).
Discusión
Los resultados muestran el significado clínico de los IC circulantes en el LES. Las concentraciones séricas de los IC en estos pacientes fueron moderadas y su presencia no guardó relación con la nefritis lupica.
Desde décadas pasadas se ha señalado que la persistencia de IC en la circulación de los pacientes con LES y su depósito en los tejidos son los eventos patogénicos causantes de la inflamación y lesiones orgánicas del LES.1. En línea con lo anterior diversos estudios han permitido suponer que el carácter patogénico de los auto-anticuerpos en el LES depende de la formación de IC.14,15 Por otra parte, es bien reconocido que la formación de IC circulantes es la consecuencia fisiológica de las respuestas de anticuerpo a diferentes antígenos, incluyendo los microorganismos.16 La formación de IC circulantes no es una característica específica del LES, se ha descrito en otras enfermedades autoinmunes17 y no integra los criterios de clasificación del LES.4,5La formación de IC es la sombra que sigue a la producción excesiva de anticuerpos, en correspondencia, nuestros resultados han mostrado que a mayor número de especificidades de anticuerpos son mayores los valores de IC circulantes, pero, qué grado de relación existe entre los IC presentes en circulación y las afectaciones orgánicas del LES.
Los mecanismos que favorecen el depósito de IC con el subsecuente daño tisular permanecen controvertidos. Son escasos los trabajos que han encontrado asociación entre los IC circulantes y la expresión clínica del LES.18,19,20 Igualmente, la asociación entre la presencia de IC circulantes y la afectación renal del LES no ha sido consistente. El glomérulo es el sitio preferencial del depósito de IC. Sin embargo, la nefritis lupica, una frecuente y potencialmente funesta complicación del LES, sigue siendo un ejemplo de la brecha que separa la producción de auto-anticuerpos y la afectación de los órganos diana.21 Aunque prácticamente todos los pacientes con LES exhiben depósitos de IC en el mesangio glomerular,22 solo alrededor de 40-60 % desarrollan glomerulonefritis.23
Esto indica que la deposición de IC no causa inflamación renal en una proporción significativa de pacientes con LES y que otros factores pueden determinar el establecimiento de la glomerulonefritis. El depósito de los IC presentes en la circulación puede estar facilitado por las separaciones entre las células endoteliales del glomérulo.24 Pero la abundancia de IC glomerulares exhibida en las biopsias renales de pacientes con LES no puede ser atribuida solamente a la retención de IC circulantes. El énfasis del papel exclusivo del secuestro renal de IC pre-formados en circulación se ha desviado hacia el reconocimiento de la importancia de la formación local de IC. Los IC se pueden formar en el tejido por uniones in situ de auto-anticuerpos de naturaleza poli-reactiva, como los anti-ADNdc con antígenos nativos presentes en la superficie de células renales residentes o los constituyentes de su matriz extracelular como la annexina A2.25 Auto-antígenos como los nucleosomas, liberados en la circulación, pueden ser atrapados o plantados en la membrana basal glomerular y también unir los anticuerpos anti-ADNdc.26. La acumulación de IC por este mecanismo tiene particular importancia en el LES, donde la “siembra” renal de los auto-antígenos está facilitada por el defectuoso aclaramiento de los residuos de apoptosis y el bajo nivel de la actividad de ADNasa I.27
Tempranamente han sido definidos los factores que influyen en la deposición y capacidad nefrotóxica de los IC, entre los que se destacan el tamaño molecular y la carga neta catiónica.28 Una vez depositados el poder inflamatorio de los IC depende de su precisa ubicación en el glomérulo y su capacidad de activar el complemento y las células con receptores Fc (FcRs).29 El enlace de IC compuestos de IgG con los FcRs es un paso clave a favor del desarrollo de la nefritis lupica,30 mientras que modelos experimentales de glomerulonefritis aguda y crónica han demostrado que la activación del complemento tiene un papel inflamatorio menor en la lesión renal.21 Ninguno de los diversos ensayos de laboratorio diseñados para determinar la presencia de IC circulantes evalúa todas las características físicas y biológicas de los IC, ni ha demostrado utilidad como biomarcador de la nefritis lupica.31 Nosotros hemos aplicado un método que detecta IC formados por IgG con capacidad de unir el componente C1q del complemento, uno de los de mayor valor clínico. No obstante, el ensayo de IC fijadores de C1q detecta solo los IC que tienen sitios de unión al complemento vacantes, pero no puede detectar los IC que tienen ocupados todos sus sitios de unión al C1q.18 También es menester considerar que los anticuerpos anti-C1q, frecuentes en el suero de pacientes con LES, pudieran interferir con los resultados del ensayo de IC por la unión al C1q empleado en este trabajo.32
Otra de las variables que influye en la capacidad patogénica de los IC es su composición molecular. La identificación y cuantificación de los autoanticuerpos que forman los IC circulantes no ha resultado tarea fácil. En el contexto de los pacientes con LES se ha considerado que los enlaces entre los anticuerpos anti-ADNdc y el ADN circulante son los de mayor contribución a la formación de IC.33 Como evidencia indirecta para definir la participación de los auto-anticuerpos anti-ADNdc, anti-Nuc y anti-RibP en la formación de IC circulantes en nuestros pacientes con LES realizamos las correlaciones entre sus niveles séricos y el de los IC, que mostraron una moderada correlación directa solo entre los anticuerpos anti-RibP y los IC circulantes. La ausencia de correlación entre los niveles séricos de anti-ADNdc y los anti-ADNdc presentes en IC circulantes ha sido referida en varios estudios de pacientes con LES.18,33,34,35 En otras investigaciones se ha determinado que los anticuerpos anti-ADNdc y anti-Nuc fueron los menos representados de las especificidades de anticuerpos incorporadas en IC aislados del suero de pacientes con LES.19,36 La relación entre los anticuerpos anti-ADNdc y los IC circulantes pudiera ser inversa, es decir, el consumo de los anti-ADNdc libres al formar los IC podría producir falsos negativos de anticuerpos ADNdc.35 Se consideró poco probable esta explicación para nuestros resultados, donde solo una pequeña fracción de pacientes con IC circulantes fueron negativos de anticuerpos anti-ADNdc.
La disociación encontrada en este estudio de los niveles séricos de anti-ADNdc y anti-Nuc, marcadores serológicos más utilizados en la medición de la actividad del LES.6,9 respecto a los IC circulantes no permite suponer que los niveles séricos de estos últimos puedan representar un marcador útil de la actividad de la enfermedad. Algunos estudios han observado asociación entre los IC circulantes y la actividad del LES,18,19,20 pero dos de estos se limitaron a un número reducido de pacientes,18,19 mientras que otro, consideró como actividad del LES la puntuación del SLEDAI-2K ≥1 (del inglés: Systemic Lupus Erythematosus Disease Activity Index 2000).20 En la comunicación de Sekita K18 los IC que mostraron mayor poder discriminatorio de la actividad lúpica fueron los fijadores al componente C3d del complemento sérico a diferencia de los IC unidos al componente C1q.18 Como correspondía, los niveles séricos de anti-ADNdc se correlacionaron con los de anticuerpos anti-Nuc en nuestros pacientes con LES.
Los niveles de IC circulantes se correlacionaron de modo directo pero moderado con los niveles séricos de anti-RibP en los pacientes con LES. La presencia de los anticuerpos anti-RibP en los IC circulantes ha sido detectada por técnicas de gran especificidad dirigidas a identificar la composición molecular de los IC en los pacientes con LES.19,37 Aunque un reciente meta-análisis11 encontró cierto grado de asociación de los anti-RibP con una mayor actividad de la enfermedad, posiblemente explicable por la asociación de estos anticuerpos con manifestaciones graves del LES como las neuro-psiquiátricas y la nefritis lúpica, los anticuerpos anti-RibP no gozan de la reputación de los anti-ADNdc como marcadores serológicos de la actividad del LES.6 Respecto a nuestros resultados, cabe considerar que los anti-RibP, al igual que los IC han estado implicados en la patogenia del LES.38 Los anti-RibP han demostrado ser inductores directos de la apoptosis celular39 lo que contribuye a la acumulación de células muertas propia del LES, lo que puede exacerbar la respuesta autoinmune con el alza en los niveles de auto-anticuerpos e IC.
Este estudio analizó por primera vez la presencia de CIC-C1q en una cohorte bien definida de pacientes cubanos con LES. Nuestras observaciones permiten concluir que los IC aparecen en la circulación de pacientes con LES como expresión de múltiples especificidades de auto-anticuerpos. Los IC circulantes, presentes en la minoría de pacientes con LES no se asociaron a la nefritis lúpica, ni a marcadores serológicos de actividad de la enfermedad como los anticuerpos anti-ADNdc y anti-Nuc. El supuesto vínculo entre la presencia de IC circulantes y la actividad del LES, así como la afectación renal requiere de estudios adicionales de seguimiento clínico.