Artículo original
Respuesta al tratamiento con poliquimioterapia en pacientes con carcinoma no microcítico
Treatment response to polychemotherapy in patients with non-microcytic carcinoma
0000-0002-9791-0283Donel González Díaz
1
*
, 0000-0002-3099-4988Manuel Díaz Toledo
1
, 0000-0002-6345-4259Drialis Díaz Garrido
1
, 0000-0002-4923-1526Sergio Fernández García
1
1Hospital Neumológico Benéfico-Jurídico. La Habana, Cuba.
RESUMEN
Introducción:
El cáncer de pulmón constituye una de las principales causas de muerte en Cuba. La mayoría de los enfermos acuden al servicio de salud en etapa avanzada de la enfermedad, la poliquimioterapia es uno de los tratamientos utilizados.
Objetivos:
Evaluar la respuesta al tratamiento con cisplatino-etopósido vs cisplatino-paclitaxel, en pacientes con carcinoma no microcítico en estadios avanzado de la enfermedad.
Métodos:
Se realizó un estudio descriptivo, prospectivo, en 40 pacientes diagnosticados con carcinoma no microcítico en estado avanzado de la enfermedad, que fueron asignados de forma aleatoria a uno de los dos grupos de tratamiento de cisplatino + etopósido (n=20) y cisplatino + paclitaxel (n=20) en el Hospital Neumológico Benéfico Jurídico en el período comprendido desde enero de 2017 a septiembre de 2018.
Resultados:
Predominaron pacientes del sexo masculino entre 50 a 69 años de edad, 37,5 % en estadio IV. En 72,5 % de los pacientes se encontró una respuesta clínica al tratamiento, en la modalidad de cisplatino + etopósido 70 % y en cisplatino + paclitaxel 75 % respectivamente. Se observó un porcentaje similar de respuesta objetiva antitumoral, 32,5 % de los pacientes tuvieron una reducción parcial de la lesión tumoral, mientras que en otro 32,5 % se observó estabilidad de la enfermedad. Por el contrario, en 35 % restante hubo progresión de la enfermedad.
Conclusiones:
Se concluye que ambas modalidades tienen una efectividad similar en la evolución clínico-radiológica de los enfermos de carcinoma no microcítico en etapa avanzada.
Palabras-clave: carcinoma no microcítico; etapa avanzada; poliquimioterapia
ABSTRACT
Introduction:
Lung cancer constitutes one of the main causes of death in Cuba. Most of the patients come to the health service at an advanced stage of the disease. Polychemotherapy is one of the treatments used.
Objectives:
To assess the response to treatment with cisplatin-etoposide vs. cisplatin-paclitaxel, in patients with advanced non-small cell carcinoma.
Methods:
A descriptive, prospective study was conducted in 40 patients diagnosed with advanced non-small cell carcinoma. They were randomly assigned to one of the two treatment groups: cisplatin + etoposide (n = 20) and cisplatin. + paclitaxel (n = 20) at the Pneumologic Hospital from January 2017 to September 2018.
Results:
Male patients predominated, ages ranged between 50 and 69 years, 37.5% were in stage IV. Clinical response to treatment was found in 72.5% of patients, that is, 70% in the modality of cisplatin + etoposide and 75% in cisplatin + paclitaxel. Similar percentage of objective antitumor response was observed, that is, 32.5% of the patients had partial reduction of the tumor lesion, while disease stability was observed in 32.5%. In contrast, in the remaining 35.0%, disease progression was observed.
Conclusions:
Both modalities are concluded to have similar effectiveness in the clinical-radiological evolution of persons suffering from non-microcytic carcinoma in advanced stage.
Key words: non-microcytic carcinoma; etapa avanzada; poliquimioterapia
Introducción
Las enfermedades malignas se ubican entre las principales causas de muerte en los países desarrollados. El cáncer de pulmón es la que más contribuye a la mortalidad tanto en hombres como en mujeres. Se considera una neoplasia muy agresiva y mortal, la mayoría de los pacientes mueren antes del primer año después del diagnóstico. Todo ello unido a las grandes limitaciones que originan en el paciente, su familia y la sociedad, hacen de esta afección un serio problema de salud en Cuba y en el resto del mundo.1,2
En Cuba, los tumores malignos son la principal causa de muerte en todas las edades, y a partir de los 65 años constituyen la segunda causa de fallecimientos, precedido por las enfermedades del corazón. Son, además, la principal causa de años de vida potencialmente perdidos de 1-74 años.3
La determinación del estadio es un aspecto de gran importancia en términos de implicaciones terapéuticas y pronósticos. El estadio de la enfermedad se basa en una combinación de factores clínicos, imagenológicos y de laboratorio, así como de otros medios diagnósticos: broncoscopia, mediastinoscopia y mediastinotomia, de los cuales también se nutre el TNM (tumor, ganglio, metástasis). Esta clasificación desempeña una función fundamental en la selección de la terapia definitiva en los pacientes afectados de cáncer de pulmón.4
La dificultad en el diagnóstico radica en que los síntomas suelen ser tardíos y por ello hasta 80 % de los pacientes se presentan en etapas avanzadas. En este sentido, 78 % de los pacientes con cáncer de pulmón tienen una enfermedad localmente avanzada o metastásica (estadíos III y IV) cuando se les diagnostica, mientras que solo 22 % se presenta como una enfermedad posiblemente curable (estadios I y II).5
El tratamiento es un desafío particular de la oncología, ya que existen diferentes esquemas de tratamiento los cuales se usan para detener o minimizar la proliferación de células cancerosas mediante la eliminación de las mismas o evitando su multiplicación, dentro de ellos se incluyen poliquimioterapia, radioterapia, vacunas y técnicas intervencionistas por broncoscopia.6
Los pacientes con cáncer de pulmón no microcítico en etapas avanzadas generalmente no se tratan con cirugía ni radioterapia. Estos pacientes tienen riesgos muy elevados de que el cáncer reaparezca en otro lugar, por lo tanto, la mayoría de los pacientes con estos estadios solo reciben poliquimioterapia. El desarrollo del tratamiento sistémico para el cáncer de pulmón es de máxima importancia para disminuir la morbimortalidad de la enfermedad.7
La Sociedad Americana de Oncología recomendó tratar a los pacientes con diagnósticos de cáncer no microcítico en etapas avanzadas con esquemas o combinaciones de platinos, ya que mejora el beneficio clínico global, así como respuesta y calidad de vida, pues actúa sobre las diferentes etapas del ciclo celular, de ahí la importancia del uso de la quimioterapia con más de una droga.7
Las combinaciones de dos fármacos se han convertido en una opción de tratamiento adecuado, ya que todos son capaces de inducir entre 30 y 40 % de respuestas objetivas, además suelen conseguir reducción del tamaño del tumor, aliviar el malestar que este provoca e impide la diseminación adicional.8
Los esquemas basados en cisplatino mostraron aumento de la supervivencia y efectividad y una reducción de la mortalidad entre los tres y seis meses. Esta reducción está asociada con una mejoría en la calidad de vida de los pacientes al considerar el impacto de la quimioterapia en el alivio de los síntomas causados por el tumor.8
Rara vez la quimioterapia puede lograr que el cáncer de pulmón diseminado desaparezca por completo, por lo tanto, los pacientes con enfermedad en este estadio nunca se consideran “curados” de su cáncer, independientemente del éxito de este tratamiento. Lo más importante para este grupo de paciente es minimizar los síntomas y evitar la progresión de la enfermedad siempre que sea posible.8) Por lo antes expuesto el objetivo de la investigación fue evaluar la respuesta al tratamiento con cisplatino-etopósido vs cisplatino-paclitaxel en pacientes con carcinoma no microcítico en nuestro medio.
Métodos
Se realizó un estudio prospectivo en pacientes diagnosticados con carcinoma no microcítico en estadios no quirúrgicos, los cuales fueron asignados de forma aleatoria a uno de los dos grupos de tratamiento de poliquimioterapia en el Hospital Neumológico Benéfico Jurídico en el período comprendido entre enero de 2017 a septiembre de 2018.
El universo estuvo constituido por pacientes con diagnóstico cito histológico de carcinoma no microcítico en estadios no quirúrgicos. La muestra quedó constituida por 40 pacientes que cumplieron los siguientes criterios en el periodo de estudio.
Criterios de inclusión
Pacientes de ambos sexos de más diagnóstico histológico de carcinoma no microcítico de pulmón, mayores de 18 años de edad, en estadios no quirúrgicos de la enfermedad (IIIA, IIIB y IV)
Pacientes que estuvieron de acuerdo en participar en la investigación.
Criterios de exclusión
Pacientes que ya habían recibido tratamiento quirúrgico, radioterapia y/o con quimioterapia.
Pacientes que física o mentalmente no pudieron cumplir con los tratamientos para el estudio
Pacientes que tuvieron escala de ECOG (Eastern Cooperative Oncology Group)9 3, 4 y 5. ECOG
Criterios de salida
Menos de tres ciclos de tratamiento con citostáticos.
No se realizaron los estudios imagenológicos evolutivos (radiografía de tórax y tomografía axial computarizada).
Interrupción del tratamiento por toxicidad grave.
Los datos fueron recogidos por el médico principal de la investigación, el que, directamente, fue el encargado junto al personal de enfermería asistencial de la entrega del consentimiento informado, la aleatorización de los grupos de tratamiento y la recogida de la información a través del encuesta de recolección del dato primario y el ECOG (midió respuesta clínica) y RECIST10 (Comité de Criterios de Evaluación de Respuesta en Tumores Sólidos, midió respuesta radiológica), que fueron aplicados en dos momentos de la investigación, al inicio y después del tratamiento. (Anexo 1 y 2).
Una vez firmado el consentimiento informado, los pacientes fueron asignados de forma aleatoria a uno de los dos grupos de tratamiento de poliquimioterapia: cisplatino-etopósido y cisplatino-paclitaxel. La aleatorización se realizó a simple ciega, se contó con una lista de aleatorización de tratamiento, donde los pacientes estaban numerados y a su lado apareció el grupo de tratamiento que le correspondía. Así se evitaron elementos subjetivos.
Se consideró respuesta al tratamiento según el grado de actividad del enfermo al inicio y final de la poliquimioterapia para lo cual se empleó la escala de ECOG.9
Se consideró respuesta objetiva antitumoral según los criterios internacionales propuestos, RECIST, que emplea el método imagenológico como es la tomografía computarizada convencional, tomándose como referencia los cambios entre el examen inicial durante el diagnóstico y al final del tratamiento.10
Procesamiento y análisis de la información
Los datos se procesaron y analizaron en una Pc Pentium 4, a través de la hoja de cálculo Excel Microsoft Office de Windows 8.1. Se desarrolló una base de datos en el sistema SPSS v. 23 para vaciar cada dato correspondiente al estudio para realizar los cálculos y análisis posteriores.
Análisis estadístico
Se utilizaron los siguientes estadígrafos: el Chi cuadrado de Pearson y la T de Student. Se definió la presencia de asociación significativa para valores de p<0,05. Se diseñaron tablas y gráficos para el mejor análisis e interpretación de los resultados.
Resultados
Se incluyeron un total de 40 pacientes con una edad media de 63,1 ± 8,9 años y un rango de edad de 46 a 78 años. Para la población total en estudio predominaron los grupos de edad de 50 a 59 años y de 60 a 69 años con 32,5 % cada uno, respectivamente. Al comparar la edad y la modalidad de tratamiento empleada, hubo una distribución homogénea entre los grupos de comparación, sin encontrarse diferencias significativas (tabla 1).
Tabla 1 Distribución de los pacientes en estudio según grupos de edad y modalidad de tratamiento
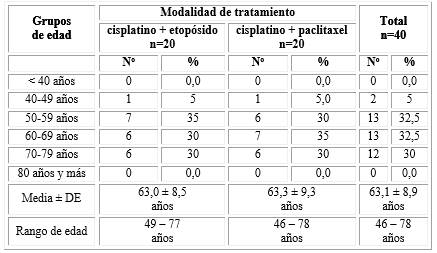
X2=0,154; p=0,985
La tabla 2 presenta que del total de pacientes incluidos, 25,0 % eran del sexo femenino y el 75,0 % restante del sexo masculino. Al comparar la distribución por sexo y la modalidad de tratamiento no se encontraron diferencias significativas.
Tabla 2 Distribución de los pacientes en estudio según sexo y modalidad de tratamiento
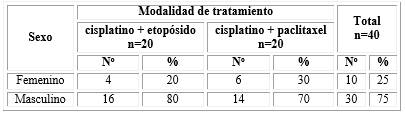
X2=0,533; p=0,716
La tabla 3 presenta que 37,5 % de los pacientes se encontraban en estadio IV de la enfermedad, seguidos en orden de frecuencia por el estadio IIIa con 35,0 % y el menos frecuente fue el estadio IIIb con 27,5 %. Al comparar el estadio con la modalidad de tratamiento recibida, se observó un mayor porcentaje de pacientes en estadio IIIa en el grupo con cisplatino + etopósido (45,0 %) respecto al cisplatino + paclitaxel (25,0 %), aunque las diferencias no fueron significativas.
Tabla 3 Distribución de los pacientes en estudio según etapa clínica y modalidad de tratamiento

X2=2,023; p=0,363
En 72,5 % de los pacientes se encontró una respuesta clínica al tratamiento dada por la estabilidad en la clasificación ECOG durante la evolución, mientras que en 27,5 % restante no se observó una respuesta clínica favorable. Al comparar las dos modalidades de tratamiento evaluadas, se observó un porcentaje similar de respuesta clínica, sin encontrarse diferencias (tabla 4).
Tabla 4 Distribución de los pacientes en estudio según respuesta clínica al tratamiento y su modalidad
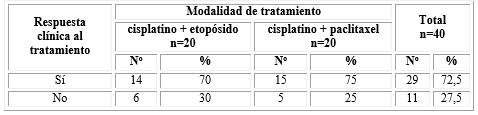
X2=0,125; p=0,500
El 32,5 % de los pacientes tuvo una reducción parcial de la lesión tumoral, mientras que en otro 32,5 % se observó estabilidad de la enfermedad. Por el contrario, en 35,0 % restante se objetivó progresión de la enfermedad. Al comparar las dos modalidades de tratamiento evaluadas, se observó un porcentaje similar de respuesta objetiva antitumoral, sin encontrarse diferencias (tabla 5).
Tabla 5 Distribución de los pacientes en estudio según respuesta objetiva antitumoral y modalidad de tratamiento
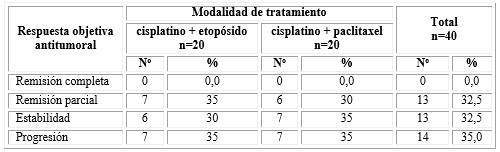
X2=0,154; p=0,926
Discusión
En relación con las características demográficas de la población en estudio, los pacientes que predominaron fueron del sexo masculino, con edad entre 50 a 69 años. Kannemann en 66 pacientes con carcinoma no microcítico describió 83,3 % de pacientes del sexo masculino, la mayoría con edad media entre 63 y 68 años.11
Díaz Toledo reportó de igual manera en un estudio descriptivo del Hospital Benéfico Jurídico un predominio de hombres y de pacientes con edades entre 60-69 años (42,6 %), mientras que en el estudio realizado por Suárez en el Hospital Militar Central Carlos J. Finlay, 61,6 % eran del sexo masculino y 65,7 % tenían edad entre 51 y 70 años.12,13
Diferentes estudios similares al relacionar las edades de los pacientes muestran resultados semejantes como por ejemplo los realizados en La Habana: Díaz Garrido y Fernández García que si bien se hicieron con un enfoque clínico epidemiológico diferente a nuestro estudio y compararon posteriormente con otros grupos, registró una tendencia estadísticamente significativa para pacientes de la tercera edad y del sexo masculino, datos estos que concuerdan con los hallazgos anteriores.14,15
La estadificación clínica es esencial para la determinación precisa de la magnitud o gravedad de una enfermedad tumoral maligna. Un diagnóstico temprano es crucial para un acercamiento terapéutico con intención curativa; pero lamentablemente, su diagnóstico suele realizarse en estadios avanzados cuando ya las posibilidades terapéuticas son paliativas.16
En la literatura revisada muestra mayor proporción los casos reportados en estadios IV coincidiendo con nuestro estudio, como por ejemplo un meta análisis en España mostró que según las etapas clínicas avanzaban eran mayor el número de casos diagnosticados, en el estadio IV: 51,1 %, estadio IIIB: 11,1 % y estadio IIIA: 7 %.17
La capacidad para realizar las actividades habituales, incluyendo el cuidado personal, el estado funcional, evaluado habitualmente mediante escala de Eastern Cooperative Oncology Group (ECOG), tiene un poder pronóstico elevado, lo cual ha sido objeto de estudio de muchos autores.8
Diferentes resultados se obtuvieron en estudios científicos que, al utilizar terapia combinada a base de cisplatino, llegaron a la conclusión que después del tratamiento indicado, los pacientes con ECOG de 0 - 1 la respuesta fue altamente significativa con relación al grupo - 2. Similar a los resultados obtenidos en nuestro estudio.8
En un estudio que comparó la combinación cisplatino + etopósido frente a cisplatino + pemetrexed en carcinoma no microcítico reportaron que la supervivencia global no fue significativamente diferente, a los dos y tres años entre los dos grupos de comparación (76 % frente 77 %, 52 % frente a 52 % y 40 % frente a 37 %, respectivamente), mientras que la respuesta objetiva antitumoral se alcanzó en 33 % el cual fue bastante similar al observado en nuestro estudio en el grupo cisplatino + etopósido.18
En otro estudio comparativo, realizado por Sen y otros, la combinación cisplatino + etopósido demostró superioridad en cuanto a la supervivencia global, aunque la tasa de respuesta parcial (RP) o completa (RC), fue idéntica para ambas modalidades (80 % en ambos casos) y muy superior a la encontrada en este trabajo.19
Por su parte, Liang y otros reportaron en pacientes con CPCNP estadio III no resecable, una tasa de respuesta objetiva antitumoral (parcial o completa) mayor para la combinación cisplatino + etopósido frente a carboplatino + paclitaxel (73,7 % frente a 64,5 %, respectivamente), aunque las diferencias no fueron significativas.20
De igual manera, Santana Dávila y otros no encontraron diferencias en la supervivencia global o libre de progresión de la enfermedad entre aquellos tratados con cisplatino + etopósido frente a carboplatino + paclitaxel.21
La respuesta clínica y la respuesta objetiva antitumoral son similares entre ambas modalidades de tratamiento, por lo que ambos esquemas de poliquimioterapia resultaron efectivos en el carcinoma no microcítico en etapas avanzadas.
Referencias bibliográficas
1.
. Longo DL, Kasper DL, Jameson JL, Fauci AS, Hauser SL, Loscalzo J. Harrison's Principles of Internal Medicine [book in CD ROOM]. 18 ed. New York: McGraw-Hill Companies, Inc.; 2012[acceso: 23/02/2019]. Disponible en: Disponible en: https://accessmedicina.mhmedical.com/book.aspx?bookID=2461
1.
[ Links ]
2.
. Siegel R, Ward E, Brawley O, Jemal A. Cancer statistics, 2011: The impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin. 2011[acceso: 23/02/2019];61:212-36. Disponible en: Disponible en: https://www.pubmed.ncbi.nlm.nih.gov
2.
[ Links ]
3.
. Guerra González L, Ortiz Carrodeguas RA, Rodríguez Pino A. Algunas reflexiones sobre el cáncer de pulmón. Medicent Electrón. 2017[acceso: 23/02/2019];21(2). Disponible en: Disponible en: https://www.revmidecentro.sld.cu
3.
[ Links ]
4.
. Sánchez J, Hernández J, Jiménez MF, Padrones S, Rosell A, Rami R. Normativa SEPAR sobre estadificación del cáncer de pulmón. Arch Bronconeumol. 2011[acceso: 23/02/2019];47:454-65. Disponible en: Disponible en: https://www.archbronconeumol.org
4.
[ Links ]
5.
Zalduendo P. Cáncer de pulmón. Síntomas, tipos, tratamiento y esperanza de vida. Vidasana Clínica Universidad de Navarra / Previsora Bilbaína. Posted on, 2016[acceso: 23/02/2019]. Disponible en: Disponible en: https://www.enfermedadesgraves.com
5.
[ Links ]
6.
. Instituto Nacional del Cáncer de los Institutos Nacionales de la Salud de Estados Unidos. Cáncer de pulmón de células no pequeñas: Tratamiento para profesionales de salud (PDQ(r)). 2016[acceso: 23/02/2019]. Disponible en: Disponible en: http://www.cancer.gov/espanol
6.
[ Links ]
7.
. Asociación de Neumología y Cirugía Torácica del Sur. Documento de consenso Neumosur sobre el diagnóstico, estadificación y tratamiento del cáncer de pulmón. Rev Esp Patol Torac. 2017[acceso: 23/02/2019];29(2)Suplemento 1:127-31. Disponible en: Disponible en: https://www.neumosur.net
7.
[ Links ]
8.
. De Vita H. Principios y prácticos de Oncología. 2018[acceso: 23/02/2019].
https://www.libreriacienciaymedicina.com/oncologia
8.
[ Links ]
9.
. Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, et al. Toxicity and response criteria of the eastern cooperative oncology group. Am J Clin Oncol. 1982[acceso: 23/02/2019];5:649-55. Disponible en: Disponible en: https://www.pubmed.ncbi.nlm.nih.gov
9.
[ Links ]
10.
. Nishino M. New response evaluation criteria in solid tumor (RECIST) guidelines for advanced non small cell duna cancer, comparison with original recist and impact on assessment of tumor responde to targeted therapy. Am J Roentgenology. 2016[acceso: 24/04/2019];95(3). Disponible en: Disponible en: https://www.ncb.nlm.nih.gov
10.
[ Links ]
11.
. Kannemann A, Muñiz A, Playá G, López Brea M, García A, Arangüena L, et al. Carcinoma no microcítico de pulmón localmente avanzado tratado con quimioradioterapia en el Hospital Universitario Marqués de Valdecilla (HUMV) en 2013 y 2014: Resultados de toxicidad y supervivencia. Rev Med Valdecilla. 2017[acceso: 23/02/2019];2(1). Disponible en: Disponible en: https://www.pubmed.ncbi.nlm.nih.gov
11.
[ Links ]
12.
. Díaz M, Cayón I, Crespo TT, Lucrecia N, Rosas C. Quimioterapia en cáncer de pulmón avanzado en pacientes mayores de 60 años de edad del Hospital Benéfico-Jurídico (2008-2011). Rev Haban Cienc Med. 2014[acceso: 23/02/2019];13(2). Disponible en: Disponible en: http://scielo.sld.cu/scielo
12.
. [ Links ]
13.
. Suárez B, Reyes D, Suárez A, Rosell A. Factores que influyen en la demora diagnóstica de la neoplasia de pulmón en egresados vivos. Revista Cubana de Medicina Militar. 2018[acceso: 23/02/2019];47(1):43-9. Disponible en: Disponible en: http://www.revmedmilitar.sld.cu
13.
[ Links ]
14.
. Garrido Díaz D. Respuesta al tratamiento oncoespecífico no quirúrgico en carcinomas no microcíticos etapa IIIa. Acta med. Grupo Ángeles. 2017[acceso: 23/02/2019];15(1):20-24. Disponible en: Disponible en: http://www.scielo.org.mx
14.
[ Links ]
15.
. Fernández García S. Evolución clínica e imagenológica de los pacientes con cáncer de pulmón de células no pequeñas en etapa IIIb tratados con poliquimioterapia. Revista Cubana de Tecnología de la Salud. 2019[acceso: 23/02/2019].;10(3). Disponible en: Disponible en: http://www.revtecnología.sld.cu
15.
[ Links ]
16.
. Goldstraw P, Crowley J, Chansky K, Giroux DJ, Groome PA, Rami-Porta R, et al. The IASLC Lung Cancer Staging Project: Proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM classification of malignant tumors. J Thorac Oncol. 2017[acceso: 23/02/2019]; 2:706-14. Disponible en: Disponible en: https://www.pubmed.ncbi.nlm.nih.gov
16.
[ Links ]
17.
. Auperin A, Le Pechoux C, Rolland E, Curran WJ, Furuse K, Fournel P, et al. Meta-analysis of concomitant versus secuential radiochemotherapy in locally advanced non-small cell lung cancer. J Clin Oncol. 2016[acceso: 23/02/2019]; 28:2181-90. Disponible en: Disponible en: http://www.ijcem.com
17.
[ Links ]
18.
. Senan S, Brade A, Wang L, Vansteenkisten J, Dakhil S, Biesma B, et al. PROCLAIM: Randomized Phase III Trial of Pemetrexed-Cisplatin or Etoposide-Cisplatin Plus Thoracic Radiation Therapy Followed by Consolidation Chemotherapy in Locally Advanced Nonsquamous Non-Small-Cell Lung Cancer. J Clin Oncol. 2016[acceso: 23/02/2019];34:953-62. Disponible en: Disponible en: https://ascopubs.org
18.
. [ Links ]
19.
. Sen F, Tambas M, Ozkaya K, Emin M, Ciftci R, Ozkan B, et al. Concomitant etoposide and cisplatin provided improved survival compared with docetaxel and cisplatin in patients with locally advanced non-small cell lung cancer treated with chemoradiotherapy. Medicine. 2016[acceso: 23/02/2019]; 95:30. Disponible en: Disponible en: https://www.ncbi.nlm.nih.gov
19.
[ Links ]
20.
. Liang J, Bi N, Wu S, Chen M, Lv C, Zhao L, et al. Etoposide and cisplatin versus paclitaxel and carboplatin with concurrent thoracic radiotherapy in unresectable stage III non-small cell lung cancer: a multicenter randomized phase III trial. Annals of Oncology. 2017[acceso: 23/02/2019];28(4):777-83. Disponible en: Disponible en: https://www.ncbi.nlm.nih.gov/pubmed
20.
[ Links ]
21.
. Santana Davila R, Devisetty K, Arce-Lara C, Sparapani R, Whittle JC. Cisplatin and etoposide versus carboplatin and paclitaxel with concurrent radiation for stage III non-small cell lung cancer: An analysis of Veterans Health Administration data. J Clin Oncol. 2015[acceso: 23/02/2019];33:567-74. Disponible en: Disponible en: https://www.ncbi.nlm.nih.gov/pubmed
21.
[ Links ]
Anexo 1
Escala de ECOG
Escala de valoración de un paciente según el ECOG (Eastern Cooperative Oncology Group).
ECOG 0: El paciente se encuentra totalmente asintomático y es capaz de realizar un trabajo y actividades normales de la vida diaria.
ECOG 1: El paciente presenta síntomas que le impiden realizar trabajos arduos, aunque se desempeña normalmente en sus actividades cotidianas y en trabajos ligeros. El paciente sólo permanece en la cama durante las horas de sueño nocturno.
ECOG 2: El paciente no es capaz de desempeñar ningún trabajo, se encuentra con síntomas que le obligan a permanecer en la cama durante varias horas al día, además de las de la noche, pero que no superan el 50% del día. El individuo satisface la mayoría de sus necesidades personales solo.
ECOG 3: El paciente necesita estar encamado más de la mitad del día por la presencia de síntomas. Necesita ayuda para la mayoría de las actividades de la vida diaria como por ejemplo el vestirse.
ECOG 4: El paciente permanece encamado el 100% del día y necesita ayuda para todas las actividades de la vida diaria, como por ejemplo la higiene corporal, la movilización en la cama e incluso la alimentación.
ECOG 5: Paciente fallecido.
Puede consultarse en: Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, et al. Toxicity and Response Criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5: 649-55.
Anexo 2
Criterios de evaluación de Respuesta en Tumores Sólidos
(JNCI92 (3)205-216.2000)
De acuerdo a los Criterios de Evaluación de Respuesta en tumores sólidos (RECIST) solamente se considerarán los cambios en los diámetros mayores de los tumores (Medición unidimensional)
Enfermedad medible: Se define como aquellas que pueden ser exactamente medidas en al menos una dimensión (diámetro mayor) y poseen un diámetro igual o mayor que 20 mm usando técnicas convencionales o mayor o igual que 10mm usando TAC espiral
Enfermedad no medible: Son todas aquellas lesiones (o sitios de enfermedad) incluyendo las pequeñas cuyo diámetro mayor sea menor de 20 mm. Las lesiones óseas, la ascitis, los derrames pleurales o pericárdicos, las linfangitis, las enfermedades inflamatorias de la mama, las masas abdominales (no seguidas por TAC) y las lesiones císticas son considerados no medibles.
Lesiones diana: Todas las lesiones medibles hasta un máximo de 5 lesiones por órgano y 10 lesiones en total representativas de todos los órganos involucrados. Deben ser seleccionadas sobre la base de su tamaño (lesiones de mayores diámetros). La suma de los diámetros mayores de todas las lesiones diana será calculada y reportada como la suma base inicial.
Lesiones no diana: El resto de las lesiones o sitios de enfermedad, incluyen lesiones medibles que exceden el máximo de lesiones por órgano o el total de todos los órganos involucrados así como las lesiones no medibles.
Respuesta Completa: Desaparición de todas las lesiones diana.
Respuesta Parcial: Reducción de al menos el 30 % de la suma de los diámetros mayores de las lesiones diana, tomando como referencia la suma de diámetros mayores de base.
Enfermedad Progresiva: Incremento de al menos el 20 % en la suma de los diámetros mayores de las lesiones diana, tomando como referencia la suma más pequeña de diámetros mayores registrada desde el inicio del tratamiento o la aparición de una o más lesiones.
Enfermedad Estable: Reducción no suficiente para calificar como respuesta parcial o incremento insuficiente para calificar como enfermedad progresiva, tomando como referencia la suma más pequeña de diámetros mayores desde el inicio del tratamiento.



















