Introducción
El cáncer de pulmón (CP) constituye uno de los mayores problemas de salud en el mundo por su elevada mortalidad. Su incidencia sigue una curva ascendente en los últimos años. El diagnóstico precoz no es frecuente y el índice de curabilidad es bajo. El tratamiento más moderno no mejora mucho la sobrevida, y cerca del 90 % de los pacientes mueren en los primeros cinco años después del diagnóstico.1 Es la primera causa de muerte por enfermedades malignas en Cuba tanto en hombre como mujeres.2
El CP es una enfermedad compleja y multifactorial. La expresión clínica es el resultado de la predisposición genética individual en interacción con factores medioambientales: el tabaquismo activo o pasivo, la contaminación atmosférica y ciertas profesiones de riesgo.3
Los tratamientos oncológicos no quirúrgicos, como la poliquimioterapia (PQT) y la radioterapia (RT), están indicados en aquellos pacientes en los que la cirugía no es posible por el grado de extensión clínica de la enfermedad. Su intención es paliativa, para intentar mejorar la calidad de vida en algunos casos y en otros, aumentar la supervivencia. Ambos, en su mecanismo de acción, promueven citotoxicidad y liberación de ciertas especies reactivas del oxígeno (ERO).3
El estrés oxidativo (EO) se produce por la pérdida de la homeostasia de las vías de señalización específicas y control redox de procesos celulares, debido a una excesiva producción de ERO, las que van a provocar variaciones en los mecanismos antioxidantes y alteraciones en el estado redox celular. En el CP se ha descrito al EO como uno de los mecanismos que participan en la patogénesis de esta enfermedad. El incremento de las concentraciones de ERO a nivel pulmonar, producidas por el tabaquismo y los contaminantes ambientales, traen consigo la activación de varios componentes de las vías de señalización que activan los procesos inflamatorios. Eventos que, unido a los cambios del epitelio mesenquimal, la alteración de la reparación del ADN y la proliferación celular, constituyen los mecanismos patogénicos más estudiados en el CP.4,5
En Cuba no existen antecedentes en el estudio del comportamiento de los marcadores de EO en pacientes con cáncer de pulmón, por lo que el objetivo de esta investigación fue caracterizar a pacientes con cáncer de pulmón según los marcadores de estrés oxidativo y de defensa antioxidante en el momento del diagnóstico y después de concluido el tratamiento con poliquimioterapia.
Métodos
Se realizó un estudio analítico, comparativo, longitudinal y prospectivo. El universo de estudio estuvo conformado por los pacientes diagnosticados con cáncer de pulmón en el periodo de mayo de 2016 a mayo de 2018.
Para la selección de la muestra se siguieron los siguientes criterios de inclusión:
Pacientes con diagnóstico confirmado de cáncer de pulmón en estadios III b/IV, atendidos en Hospital Neumológico Benéfico Jurídico (HNBJ).
Mayores de 18 años.
Voluntariedad de participar en la investigación expresada mediante la firma de consentimiento informado.
Enfermos cuyo esquema de tratamiento solo incluyó la PQT.
Pacientes en los que fue posible realizar las determinaciones al diagnóstico y al finalizar el esquema de tratamiento
Se excluyeron los pacientes con los siguientes criterios:
Pacientes que presentaron otra enfermedad crónica en fase de agudización con implicaciones en la alteración de la homeostasis redox.
Consumo de antioxidantes en el momento del estudio.
Enfermedad de carácter infeccioso agudo en el último mes.
Exposición a radiaciones en el último mes.
Ingestión diaria o dos veces por semana de alcohol.
Embarazo o lactancia.
Abandono de tabaquismo 6 meses previos antes de comenzar terapéutica.
Exposición a radiaciones en el último mes.
Se recogieron los datos relacionados con antecedentes patológicos familiares y personales. Se interrogó sobre la historia natural de la enfermedad: fecha de inicio de los síntomas y signos; variante histológica; etapa clínica: Tumor, Nódulo, Metástasis (TNM); tratamiento oncoespecífico con poliquimioterapia y estado general según grado de actividad medido por la escala de Zubrod.6
Se utilizó un grupo control de referencia para contrastar los resultados en los pacientes antes y después del tratamiento, el que estuvo conformado por 34 individuos aparentemente sanos, y de ambos sexos. Estas personas fueron previamente entrevistadas y se les realizó un examen físico y estudios de laboratorio clínico (pruebas de función hepática, glucemia, creatinina, lipidograma y parámetros hematológicos) para confirmar su estado de salud. Además, se constató la no utilización de suplementos antioxidantes y hábitos tóxicos como el consumo de alcohol y el tabaquismo. Así como se descartaron procesos infecciosos agudos o enfermedades crónicas en agudización.
Para las determinaciones de los marcadores de EO, a todos los participantes se les extrajo 5 mL de sangre venosa en ayunas, la que se colectó en tubo con EDTA como anticoagulante. En el caso de los pacientes la muestra se tomó antes de iniciar el tratamiento oncológico y su culminación.
Para los marcadores de daño oxidativo se empleó el plasma. El que se separó por centrifugación (250 g durante 15 min a 4 ºC). Las actividades de las enzimas antioxidantes se determinaron en el lisado de eritrocitos. El lisado se obtuvo lavando el pellet obtenido al separar el plasma, con solución fría de NaCl al 0,9 % y la lisis se realizó con agua destilada fría. Todas las muestras se almacenaron a -20 ºC hasta la determinación de los marcadores, que no superó los 10 días.
Marcadores de daño oxidativo:
Daño Oxidativo a Lípidos: Se evaluó a través de la concentración plasmática de malonildialdehído (MDA).
Daño oxidativo a proteínas: Determinación de la concentración plasmática de productos avanzados de la oxidación de proteínas (PAOP).
Concentraciones de plasmáticas de peróxidos totales, medidos por el ensayo del xilenol naranja (FOX).
Marcadores de defensa antioxidante:
Actividad de la enzima Superóxido Dismutasa (SOD1).
Actividad de la enzima Catalasa (CAT).
Actividad de la enzima Glutatión Peroxidasa (GPx).
Actividad enzimática de la Glutation S-Transferasa (GST)
Determinación de la concentración plasmática de grupitos tioles (-SH).
Capacidad antioxidante total plasmática, medida mediante el ensayo FRAP.
Todos estos marcadores fueron determinados mediante métodos espectrofotométricos descritos previamente por el grupo de trabajo del Laboratorio de Estrés Oxidativo del Centro Nacional de Genética Médica (CNGM).7
Se debe aclarar que por restricciones con reactivos solo fue posible determinar dentro de los marcadores de defensa antioxidante, en los individuos sanos, la actividad de las enzimas SOD1 y CAT, las restantes solo se realizaron en los casos.
Análisis estadístico
Se compararon los marcadores de daño oxidativo y defensa antioxidante antes y después de recibir el tratamiento con poliquimioterapia de todos los pacientes involucrados en este estudio respecto a los controles y a los valores de referencia del laboratorio. De acuerdo a la distribución de los datos y la homogeneidad de varianza se aplicaron los test estadísticos relevantes en cada caso (chi cuadrado o la prueba de Fisher). Un valor de p < 0,05 fue considerada estadísticamente significativo. El análisis estadístico se realizó con el paquete estadístico SPSS 21,0. Se midió además la magnitud de la asociación a través del cálculo del odds ratio (OR).
Esta investigación fue aprobada por los Consejos Científicos y Comités de Ética Médica del HNBJ y del CNGM. Los principios de la bioética, según la declaración de Helsinki, guiaron la actuación de los investigadores. La información se utilizó con fines puramente científicos.
Resultados
Se incluyeron un total de 86 casos divididos en dos grupos de comparación: casos diagnosticados con cáncer de pulmón (n= 52) y sanos (n= 34). En los pacientes con cáncer de pulmón, el 55,8 % tenían una edad de 60 años y más, seguido en orden de frecuencia por el grupo etáreo de 50 a 59 años con el 32,7 %, mientras que el 9,6 % tenían entre 40 a 49 años, solamente un paciente era menor de 40 años. Entre los sanos, fueron más frecuentes los individuos con edad menor de 40 años y entre 40 a 49 años (41,1 %); mientras que el 38,2 % tenían entre 50 a 59 años, solamente el 2,9 % eran mayores de 60 años. El 63,5 % de los pacientes con diagnóstico de cáncer de pulmón eran del sexo masculino. En el grupo de los individuos sanos la distribución por sexos fue equitativa (50 %).
De acuerdo con el estadio de la enfermedad, 30 pacientes fueron clasificados como estadio IIIB para un 57,7 %, mientras que 22 fueron clasificados en estadio IV, lo que representa el 42,3 % restante.
El tipo histológico de tumor predominante fue el carcinoma de pulmón de células no pequeñas (CPCNP) en 45 pacientes, para un 86,5 %; mientras que solo 7 pacientes presentaron la variante de carcinoma microcítico o de células pequeñas. Dentro de los subtipos del CPCNP, el tipo más frecuente fue el adenocarcinoma en 26 pacientes (57,7 %), luego el carcinoma epidermoide en 18 pacientes (40,0 %). Solo un paciente presentó cáncer de pulmón de células grandes.
La principal modalidad de poliquimioterapia empleada fue la combinación de Cisplatino más Etopósido, en el 61,5 % de los casos, seguido en orden de frecuencia por el Cisplatino más Vinblastina, para un 17,3 %.
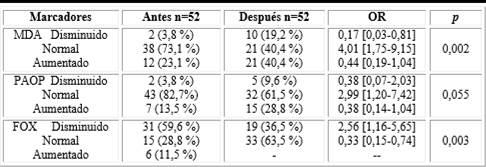
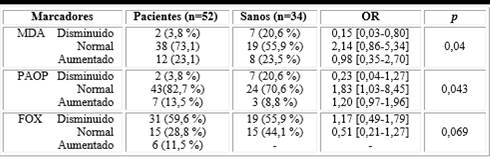
La tabla 1 muestra los marcadores de daño oxidativo de manera comparativa entre el grupo de pacientes en el momento del diagnóstico y el grupo de individuos sanos. Los pacientes mostraron un incremento significativo de las concentraciones de MDA (p = 0,04) y de PAOP (p = 0,043). Se aprecia que, en los pacientes la probabilidad de tener un daño oxidativo a proteínas aumentado es 1,2 veces mayor con respecto a los sujetos sanos.
Por su parte, las FOX no mostraron diferencias significativas entre los grupos de comparación. No obstante, se encontró en los sanos un mayor porcentaje con este marcador normal, respecto a aquellos con diagnóstico de cáncer de pulmón (44,1 % vs 28,8 %) y ninguno de los individuos sanos tuvo este marcador aumentado, frente a un 11,5 % en el grupo de casos.
Tabla 1 Marcadores de daño oxidativo para los casos antes de iniciado el tratamiento oncológico y el grupo de individuos sanos
En relación con la capacidad de defensa antioxidante, en la tabla 2 se observa que las actividades de las enzimas SOD1 y CAT estaban elevadas en los sujetos sanos respecto al grupo de los pacientes al momento del diagnóstico (52,9 % vs 19,2 %) y (17,6 % vs 1,9 %), respectivamente.
Tabla 2 Marcadores de defensa antioxidante en los casos antes de iniciado el tratamiento oncológico y los individuos sanos

La tabla 3 muestra que después de recibir el tratamiento con poliquimioterapia, en el 40,4 % de los pacientes se incrementaron las concentraciones de MDA. Las concentraciones de PAOP también tendieron a incrementarse, pero sin llegar a ser significativo el cambio (28,8 %). Por otra parte, se apreció un menor porcentaje de pacientes con alteraciones en las concentraciones de peróxidos totales después de la quimioterapia, alcanzando un mayor número de pacientes el rango de normalidad (63,5 %) y ninguno de los pacientes tuvo este marcador aumentado después del tratamiento.
Después de la quimioterapia se observó que en los pacientes se incrementaron las actividades enzimáticas de la SOD1 y la CAT (tabla 4). En el caso de la SOD1, la probabilidad de tener un aumento en la actividad después de la quimioterapia fue de 2,85 veces (40,4 %). De manera similar, la probabilidad de que los pacientes presentaran altos valores de actividad de la CAT (15,4 %) una vez concluido el tratamiento es 9,27 veces mayor, pero se mantuvo normal en el 63,5 %. Respecto a la capacidad antioxidante total plasmática y las concentraciones de grupos tioles (-SH) no se observan cambios sustanciales en estos marcadores finalizada la PQT. Por otra parte, se constataron cambios en las actividades enzimáticas de la GPx y la GST. En el caso de la actividad de la GPx esta se mantuvo normal en el 48,0 % de los pacientes concluido el tratamiento oncoespecífico y disminuyó en un 13,5 %, lo que significó que estuviera disminuida 3,89 veces después de finalizado el tratamiento, mientras que, el 76,9 % alcanzó niveles normales de actividad de la GST, luego de terminado la PQT.
Discusión
Los datos clínicos epidemiológicos de la presente investigación están en correspondencia con los reportados en la literatura médica nacional e internacional. Con relación a las diferencias de prevalencia de cáncer de pulmón entre géneros y edad, en la mayoría de las series de pacientes la relación hombre/mujer es mayor de tres.8) González-Díaz y otros9) expresaron que predominaron pacientes del sexo masculino (75,0 %), entre 50 a 69 años de edad y Kannemann y otros10 describieron que el 83,3 % de sus pacientes fueron del sexo masculino, la mayoría con edad media entre 63 y 68 años.
De las variantes histológicas, actualmente el adenocarcinoma es el subtipo histológico más frecuente, entre el 35-40 % de los casos, experimentando una elevación significativa, con la correspondiente reducción del carcinoma escamoso (30,0 % de los casos).11Rodríguez Cascaret y otros12 en un estudio con 55 pacientes ingresados en el Servicio de Medicina Interna del Hospital Oncológico Universitario “Conrado Benítez García” de Santiago de Cuba entre 2008-2009 y Senan y otros13 donde el 75,6 % de los pacientes presentaron similares resultados.
En relación con el estadio clínico, en el presente estudio predominaron los pacientes en estadio IV, lo que justifica que el tratamiento empleado fuera la quimioterapia. Estos resultados concuerdan la literatura revisada, tanto nacional como foránea.3,9,10
Pocos estudios han abordado los cambios que se producen en los marcadores de EO en los pacientes con CP en estadios avanzados tratados con PQT.14,15 Los resultados derivados de la presente investigación muestran que los pacientes al momento del diagnóstico presentan alteraciones en la homeostasis redox, atendiendo al incremento del daño oxidativo sistémico observado. En este caso se refleja en los altos niveles de MDA, PAOP y peróxidos totales, unido a una disminución en la capacidad de respuesta antioxidante primaria. En esta situación, el aumento en la producción de ERO está en dependencia de diversos mecanismos tales como, la activación oncogénica, mayor tasa metabólica, disfunción mitocondrial y la pérdida de funcionabilidad de la proteína p53. Los factores de crecimiento y las citoquinas liberadas también estimulan la producción de estas especies reactivas.14
El cisplatino es uno de los fármacos más frecuentemente utilizado en el tratamiento del CP. Aunque la quimioterapia basada en platino ha demostrado ser eficaz en el tratamiento de esta enfermedad, existe una gran variabilidad interindividual en las tasas de respuesta.16 Todo ello justifica el interés de estudiar la influencia del EO en la respuesta a los esquemas con platino.
Se describe que los tratamientos que combinan al cisplatino y a la vinblastina producen el aumento de los niveles intracelulares de ERO, siendo la mitocondria uno de los principales blancos celulares de la acción de estos agentes. En el caso del cisplatino, es capaz de interaccionar con las proteínas mitocondriales dando lugar a la pérdida de grupos sulfihídrilos, además de la inhibición de la entrada de calcio y la reducción del potencial de membrana. Eventos que inducen el incremento de la producción de ERO, activándose vías de señalización que promueven mecanismos de muerte celular mediados por estas especies.17,18 Los resultados arrojaron que los pacientes, después de recibir la PQT, mostraron un incremento sustancial en el daño oxidativo a lípidos y a proteínas, lo que se ve reflejado por el aumento de las concentraciones de MDA y de PAOP. En este sentido, recientemente se ha demostrado que las ERO generadas por el tratamiento con el cisplatino pueden incrementar los procesos de peroxidación lipídica, evento que conduce a la alteración estructural y funcional de proteínas y activar la apoptosis.18
Sin embargo, las células tumorales en respuesta a esta situación pueden incrementar la expresión de antioxidantes endógenos.19,20 Lo que podría explicar el aumento en las actividades enzimáticas de la SOD1 y la CAT. Esta adaptación redox no solo podría permitir la sobrevivencia de la célula tumoral, sino que además podría significar un posible mecanismo de resistencia a estos fármacos. Por otro lado, se apreció que debido a los efectos de las terapias empleadas, las actividades de otras enzimas antioxidantes disminuyeron o no variaron, como es el caso de la GPx y la GST. Sin cambios en los niveles de grupos tioles y en la capacidad antioxidante plasmática. Lo que por el contrario apuntaría al hecho de que se haya logrado la respuesta terapéutica esperada sin la aparición de estos fenómenos de quimiorresistencia. De ahí la importancia de valorar en su conjunto todos los biomarcadores, atendiendo a la complejidad de los mecanismos de mantenimiento de la homeostasis redox.
La poliquimioterapia se relaciona con una exacerbación del estrés oxidativo y una disminución del sistema de defensa antioxidante endógeno.