Introducción
Embriológicamente el conducto onfalomesentérico o uraco conecta el saco vitelino con el intestino medio y cierra, completamente, entre la quinta a séptima semanas de vida intrauterina. A la semana 17 posterior al nacimiento, el canal se oblitera y forma el ligamento medio umbilical. Un fracaso en el proceso normal de regresión produce varias anormalidades dependiendo la localización, ya sea en el lado intestinal, vesical o umbilical.1,2
Los vestigios del conducto onfalomesentérico pueden producir anomalías como quistes a nivel de la pared abdominal o intraabdominales, divertículos (denominado de Meckel). Su persistencia produce fístulas enterocutánea o vesicocutánea, persistencia de un cordón fibroso o resto de epitelio intestinal ectópico a nivel umbilical, así como neoplasias.3
Se han descrito varios tipos de tumores malignos y benignos derivados de los vestigios del conducto onfalomesentérico, los más frecuentes son el maligno (el adenocarcinoma y el carcinoide). Sin embargo, también se han mencionado otras variedades de tumores tanto epiteliales como no epiteliales, entre las descritas: subtipos de adenocarcinomas, TEGI (tumores del estroma gastrointestinal), leiomiosarcomas, lipomas, linfomas, adenomiomas y adenomas vellosos.4
El adenocarcinoma de Uraco fue descrito por Begg en 1931,5 se reportan 400 casos hasta el año 2014.3 Es más frecuente en el sexo masculino, entre los 50-60 años de edad.6 Es el tipo histológico más frecuente de los tumores del conducto onfalomesentérico 80 a 90 %, de los cuales los llamados entéricos productores de mucina corresponden al 63,6 %.
Existen 2 teorías que se proponen para el desarrollo de estos. La presencia de remanentes embriológicos de origen entérico que persisten en la coacla y la presencia de metaplásia a partir de cistitis glandularis.6,7,8,9
Estos tumores (Uracales) no tienen una nomenclatura consensuada en la literatura, carecen de criterios diagnósticos y no poseen un sistema de estadificación estandarizado.10
Se reporta el caso de un paciente masculino con el diagnóstico de un adenocarcinoma mucinoso uracal.
Caso clínico
Se presenta el caso clínico de un paciente masculino de 50 años de edad, raza blanca y con antecedentes patológico de herniorrafía umbilical hace 2 años. El cuadro clínico inicia con distensión y dolor abdominal difuso, no localizado, de leve intensidad, de 2 meses de evolución. Fue intervenido quirúrgicamente interpretándose como una hernia umbilical. Un mes después de la cirugía la clínica del paciente continúa y se asocian síntomas dispépticos y estreñimiento, los cuales conllevan a ser reintervenido, quirúrgicamente, por el diagnóstico de hernia umbilical recidivante. Durante el proceder, se detecta la presencia de ascitis, se extrajeron alrededor de 1300 ml de líquido ascítico turbio y amarillo. Su citología resultó negativa para células neoplásicas y se tomaron muestras de biopsias de pared abdominal y peritoneo.
El paciente continua con los síntomas, se realiza ultrasonido abdominal-pélvico y se observa a nivel de fosa ilíaca izquierda e hipogastrio una imagen redondeada de ecoestructura heterogénea, contornos regulares, bien definidos de paredes no engrosadas que mide 47x40x45 mm e imagen isoecoica en tejido muscular, intraabdominal, de forma difusa, en relación con el mesenterio, presencia de líquido libre intraabdominal de moderada cuantía con abundantes elementos ecogénicos, por lo que es referido a nuestra institución hospitalaria para su diagnóstico y tratamiento.
Examen físico del abdomen (datos positivos): doloroso a la palpación profunda a nivel de fosa iliaca izquierda e hipogastrio. Se palpa masa de bordes regulares bien definidos de 4 cm de diámetro en la misma localización.
El protocolo de estudio inició con exámenes de laboratorio: hemograma y leucograma normales, eritrosedimentación: 20 mm/h. Química sanguínea: pruebas de síntesis hepáticas, citolisis, colestasis, lipidograma, tiempos de coagulación, función renal y bilirrubinas normales. Lactato deshidrogenasa elevada (LDH):120 U/L. Elevación de marcadores tumorales CEA: 16 470 ng/ml. Ca 125: 113, 10 U/ml. Serología para virus de inmunodeficiencia humana (HIV): Negativo. Conteo de Addis: normal. Ultrasonido abdominal: hígado con engrosamiento nodular, que hace la capsula irregular a este nivel. En bazo en su cara diafragmática se observan lesiones similares a las del hígado que ocupan el espacio subfrénico izquierdo, gruesas masas que se encuentran entre el páncreas y rodeando el estómago diseminadas por toda la cavidad abdominal con el aspecto de carcinosis peritoneal.
Detrás de la vejiga, a nivel de hipogastrio, se observan múltiples masas de baja ecogenicidad que forman paquetes a ese nivel la de mayor tamaño mide 45x 42 mm y se encuentra en íntima relación con asas intestinales. En la tomografía computarizada contrastada oral y endovenoso se observa la presencia de abundante líquido intraabdominal que forma bolsones en excavación pélvica, masa a nivel de cúpula vesical y engrosamiento del peritoneo parietal y visceral (Fig. 1). La radiografía de tórax es normal (Fig. 2 A y B) .
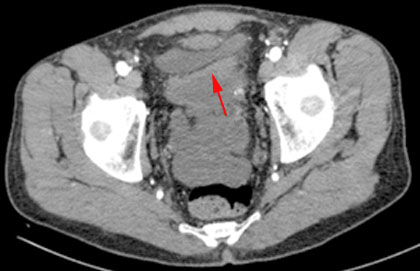
Fig. 1 Corte axial de tomografía computarizada de pelvis. Masa heterogénea, adyacente a la pared de la cúpula vesical que corresponde a neoplasia (flecha).
Se realiza una gastroduodenoscopía y se observó un abombamiento hacia cara posterior del bulbo duodenal en su curvatura externa, que es de forma redondeada de 3 cm con mucosa de iguales características a la circundante e impresiona una compresión extrínseca. Se realizó colonoscopía hasta el fondo de ciego y válvula ileocecal que fue normal. El estudio histológico de las muestras de biopsias de pared abdominal y peritoneo obtenidas en la intervención quirúrgica previa, reporta infiltración de la pared abdominal y peritoneo por un adenocarcinoma mucinoso papilar de probable origen en tracto digestivo (que fue descartado) o del conducto onfalomesentérico o uracal. (Fig. 3 A y B, 4 A y B).
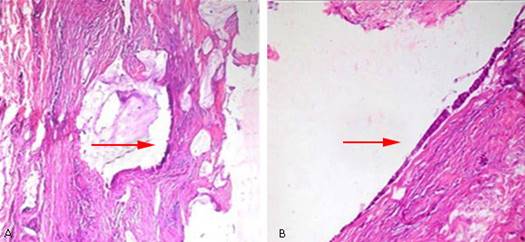
Fig. 3 Visión microscópica de biopsia de peritoneo y pared abdominal con tinción hematoxilina y eosilina.
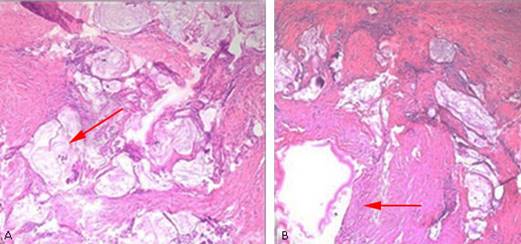
Fig. 4 Visión microscópica de biopsia de peritoneo y pared abdominal con tinción hematoxilina y eosilina.
Al paciente se le realizó tratamiento con quimioterapia neoadyuvante con: oxiplatino y 5 fluoracilo. Se intervino, quirúrgicamente, se hizo reducción de masa tumoral, resección de epiplón mayor y epiplón gastrocólico. Se obtuvo nueva muestra de tejido para valoración histológica que reportan un adenocarcinoma mucinoso CK7 negativo, CK20 positivo, lo cual confirma el origen de la neoplasia. En la actualidad, el paciente se encuentra en quimioterapia adyuvante.
Discusión
El adenocarcinoma del Uraco es una entidad rara. En Cuba se ha reportado un solo caso por Martínez y Rodríguez,11 en 1984. Es más frecuente en varones (69 %), según un estudio realizado por Collings y otros.12 El origen embriológico de dos localizaciones (vejiga e intestino) engloba variedades histológicas de ambas regiones. El caso presentado es el subtipo denominado “carcinoma Uracal no glandular”, ya que al encontrar bases morfológicas de metaplasia focal del recubrimiento del Uraco crea bases para el desarrollo de un adenocarcinoma de tipo intestinal.8,9,10,11,12,13
Los síntomas de presentación son muy variables y ocurren de acuerdo a la localización y estadio de la enfermedad. De esa manera, la detección temprana es un reto, ya que por lo común en fases precoces carece de sintomatología. Los síntomas inespecíficos como el dolor abdominal de localización umbilical en un 8,5 % de los casos, la masa palpable a nivel abdomino-pélvico 17 %, la secreción mucosa por la uretra 17 %, la secreción fétida o sanguinolenta por el ombligo, infecciones del tracto urinario a repetición, síntomas urinarios irritativos u obstructivos,6,11,13,14 no siempre están presentes. En fases avanzadas, los pacientes pueden presentar hematuria hasta 85 %.6,14 La ascitis se atribuye al cuadro metastásico de carcinosis peritoneal más que al propio tumor.
Los sitios más comunes de metástasis son: el hígado, ganglios linfáticos, peritoneo, pulmones y huesos.8,15 Además, es frecuente el hallazgo de masa palpable localizada en fosas iliacas como ocurre en este paciente, es de señalar que esta característica es muy sugestiva, exigiendo a los médicos el conocimiento de este tipo de tumores poco frecuentes.(11,13)
Existen varios criterios para el diagnóstico del carcinoma uracal. Los más sencillos son los criterios del Anderson Cáncer Center,11,13 que consisten en la presencia de 2 criterios mayores y 4 criterios menores. Los criterios mayores son: localización del tumor en la línea media, y una alta demarcación entre tumor y la superficie epitelial normal. Los criterios menores incluyen: histología entérica, ausencia de displasia urotelial, ausencia de cistitis quística y la ausencia de un adenocarcinoma primario de otro origen.
A pesar de ser sencillo, su uso no está generalizado, el paciente actual cumple todos los criterios propuestos por este centro. Además existen otros criterios diagnósticos más utilizados por varios investigadores en estudios que son los creados por Sheldon y otros16 que comprenden: tumor en la cúpula vesical, ausencia de cistitis quística o cistitis glandularis, invasión predominante de la muscularis o tejidos más profundos con una diferenciación entre el tumor y la superficie del urotelio vesical que es libre de proliferación glandular o polipoidea, presencia de vestigios del Uraco con el tumor, extensión del tumor dentro de la pared vesical con ocupación del espacio de Retzius, o pared abdominal anterior u ombligo y no evidencia de tumor primario alguno.
Otros criterios diagnósticos fueron adaptados, recientemente, por la Organización Mundial de la Salud en el año 2016 para el diagnóstico del adenocarcinoma uracal y consisten en:
Localización del tumor en la cúpula vesical o pared anterior.
Epicentro del carcinoma en la pared vesical.
Ausencia absoluta de cistitis quística o cistitis glandularis más allá de la cúpula vesical o pared anterior.
Ausencia de tumor primario conocido en algún sitio; sin embargo, esta clasificación aún no es la más utilizada por ser nueva.9,14,17
El diagnóstico diferencial es muy importante ya que se encuentra entre el adenocarcinoma de dos orígenes el Vesical vs Entérico y la histología e inmunohistoquímica proporciona una orientación importante. En el presente caso se excluye el origen vesical, por las características siguientes: existe una alta demarcación entre el tumor y la superficie de urotelio vesical, además de ausencia de carcinoma vesical insitu o metaplasia. Para la diferenciación de tumor de origen entérico se realizaron las exploraciones respectivas las cuales fueron negativas.
Para el estadiamiento de los adenocarcinomas uracales existen dos sistemas de clasificación propuestos por Sheldon y otros16 y el sistema Mayo propuesto por Ahsley y otros,17 que no están validados.9
El tratamiento de elección para las formas no metastásicas del adenocarcinoma del Uraco es la resección quirúrgica del tumor. También es aceptada la resección en bloque con una cistectomía parcial para obtener márgenes quirúrgicos seguros, existen estudios que mencionan el beneficio para el paciente con mejor pronóstico es al realizar una resección de todo el ligamento medio vesical incluido el tumor con márgenes quirúrgicos negativos. Se incluye además, la quimioterapia, que queda reservada para aquellos casos de enfermedad irresecable quirúrgicamente y los casos con recidiva, la terapia de elección eficaz es el 5- Fluoracilo asociado a Cisplatino.8,18 En el presente caso por el estadio avanzado del paciente se realizó, primeramente, quimioterapia neoadyuvante con 5- Fluoracilo y Oxiplatino. Generalmente este tipo de tumor es resistente a la radioterapia y el tratamiento con quimioterapia adyuvante al momento es incierto.8
El pronóstico de esta entidad es desfavorable, ya que por la forma y escasa frecuencia de presentación en pocas ocasiones es diagnosticado y mucho menos de manera precoz, sino ya hasta fases o estadios avanzados.16,18,19 Teniendo una supervivencia a 5 años de 49 % si el tumor se encuentra localizado y ausente de metástasis. Además de una recurrencia que varía del 15 al 41 % en 2 años aun cuando se realiza tratamiento quirúrgico, existen malos indicadores de predicción y de temprana recurrencia que son la presencia clínico-patológica de un margen quirúrgico positivo, estadio avanzado, grado de afectación de ganglios linfáticos y presencia inicial de metástasis a distancia.8
El caso clínico del estudio presenta un estadio muy avanzado de la enfermedad, con una clínica inusual, que al momento del diagnóstico ya se encontraba en estado avanzado con presencia de invasión de nódulos linfáticos regionales y carcinomatosis peritoneal, lo que determina un mal pronóstico a pesar del tratamiento instaurado.
El diagnóstico del adenocarcinoma uracal está dado por un alto índice de sospecha clínica y su correlación con estudios imagenológicos, además de su confirmación con la histología/inmunohistoquímica.
La presentación del caso actual deja en evidencia la falta de conocimiento y la baja sospecha de esta patología por su poca frecuencia de presentación y pone en manifiesto la necesidad de que la comunidad médica conozca más sobre el tema. Así como el establecimiento de nuevos y concretos algoritmos diagnósticos, sistemas de estadiamiento y una guía terapéutica concisa, que permita el diagnóstico temprano de este tipo de cáncer, así como su mejor tratamiento que aumentaría la sobrevida de los pacientes con adenocarcinoma uracal.















