Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr v.83 n.2 Ciudad de la Habana abr.-jun. 2011
Leucemia congénita aguda
Acute congenital leukemia
Nilvia Esther González García,I Regla Broche Cardó,II Lissette Trelles Porro,II María de los Ángeles Cubero Rego,II Eduardo Morales Mesa,III Alberto Arencibia Núñez,IV Luis Enrique Pérez Ulloa IV
IEspecialista de I Grado en Neonatología. Unidad de Cuidados Especiales Neonatales. Hospital Pediátrico Universitario «William Soler». La Habana, Cuba.
IIEspecialista de I Grado en Neonatología y Medicina General Integral. Unidad de Cuidados Especiales Neonatales. Hospital Pediátrico Universitario «William Soler». La Habana, Cuba.
IIIEspecialista de II Grado en Neonatología. Unidad de Cuidados Especiales Neonatales. Hospital Pediátrico Universitario «William Soler». La Habana, Cuba.
IV Especialista de I Grado en Hematología. Unidad de Cuidados Especiales Neonatales. Hospital Pediátrico Universitario «William Soler». La Habana, Cuba.
RESUMEN
La leucemia aguda durante el período neonatal es poco frecuente de evolución rápida y pronóstico sombrío. Sus características clínicas y biológicas difieren de las encontradas en niños de mayor edad, y su inicio se caracteriza por afectación cutánea, hepatoesplenomegalia, hiperleucocitosis e infiltración del sistema nervioso central. Se han observado pacientes con formas tanto mieloides como linfoides, pero la leucemia mieloide aguda parece predominar en esta etapa de la vida. Se presenta el caso de un paciente con leucemia congénita clasificada morfológicamente, con aparición de manifestaciones clínicas de enfermedad hematológica desde el nacimiento y diagnóstico de leucemia linfoblástica aguda congénita.
Palabras clave: Recién nacido, leucemia congénita.
ABSTRACT
Acute leukemia during neonatal period is not frequent, of a fast course and gloomy prognosis. Its clinical and biological features differ of that present in older children and it onset is characterized by cutaneous affection, hepatosplenomegaly, hyperleukocytosis and infiltration of central nervous system (CNS). There are patients presenting with myeloid and lymphoid types, but the acute leukemia seems to predominate in this stage of life. This is the case of a patient with acute leukemia morphologically classified, with appearance of clinical manifestations of hematologic disease from birth and a diagnosis of congenital acute lymphoblastic leukemia.
Key words: Newborn, congenital leukemia.
INTRODUCCIÓN
La leucemia aguda durante el período neonatal es rara en extremo, con una incidencia inferior al 1 % entre todas las leucemias infantiles. Es la segunda causa de enfermedad oncológica neonatal y la principal causa de mortalidad asociada a neoplasia en este período.1 Se clasifica de naturaleza congénita cuando se diagnostica en los primeros 28 días después del nacimiento, y neonatal cuando se manifiesta entre la cuarta y sexta semana de la vida.2, 3
Es más frecuente la forma mieloide que la linfoide y suele presentarse con hiperleucocitosis, hepatosplenomegalia, afectación cutánea y del sistema nervioso central (SNC). Como es bien sabido, la leucemia es una proliferación neoplásica de las células hematopoyéticas. La célula donde ocurre la transformación leucémica (blasto) puede ser un precursor de estirpe linfoide, mieloide o capaz de diferenciarse en ambos linajes.1
Por ser una entidad extremadamente rara en este período de la vida y tener un pronóstico sombrío, se presenta el caso de un paciente afectado desde el nacimiento y se comentan las peculiaridades del diagnóstico, el pronóstico y el tratamiento.
PRESENTACIÓN DEL CASO
Recién nacido de 48 horas de vida, hijo de madre de 19 años, con antecedentes de salud, embarazo actual con sepsis vaginal tratada en el tercer trimestre e ingreso por crecimiento intrauterino retardado. Nace a las 37,3 semanas de gestación, con peso de 2 330 g.
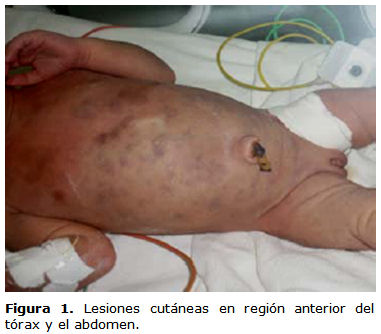
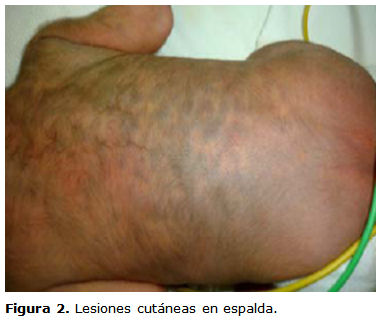
Desde el nacimiento presenta lesiones violáceas en la cara anterior y posterior del tórax y el abdomen, de tamaño variable (figuras 1 y 2). A las 24 h de la vida no hay signos evidentes de sangrado activo y la hemoglobina, el hematocrito y el leucograma con diferencial están dentro de límites normales, por lo que se plantea la posibilidad de una melanosis.
A las 48 h de la vida las lesiones de la piel se han extendido a las extremidades, aparece ictericia ligero, distensión abdominal y hepatoesplenomegalia. Los complementarios muestran reticulocitosis, trombocitopenia marcada y 95 % de blastos en la periferia; plantean el diagnóstico presuntivo de leucosis congénita. Por tanto, se traslada a la Unidad de Cuidados Intensivos Neonatales. Se le realizan complementarios que arrojaron los resultados siguientes: hematocrito: 0,35; leucocitos: 350 x 109/L; blastos: 100 %; normoblastos: 0,05 %; promielocitos: 0,01 %; segmentados: 0,01 % y linfocitos: 0,03 %; plaquetas: 80 x 109/L, glucemia: 3,9 mmol/L; gasometría: pH 7,25, pCO2 38,9, pO2 34, SB 17,9, EB -9,5; saturación de O2 54,3 (acidosis metabólica descompensada con hipoxemia), que se corrige; coagulograma TP: c: 16" p: 18"; TPK: c: 30" p: 35"; plaquetas: 2 x 109/L y grupo Rh: O+.
Se inicia tratamiento hematológico con hiperhidratación, concentrado de plaquetas y exanguinotransfuciones hasta lograr disminuir los leucocitos por debajo de 100 x 109/L. Se realizan 2 intercambios hasta que los leucocitos alcanzan valores de 62,7 x 109/L, blastos: 0,78 %, linfocitos: 0,20 %, segmentados: 0,02 %, plaquetas: 5 x 109/L, creatinina: 36, TGP: 11,9 UI, TGO: 58,9 UI, fósforo: 2,15 mmol/L, bilirrubina total: 121,6 mmol/L, bilirrubina directa: 69,5 mmol/L, albúmina: 38,4 g/L, fosfatasa alcalina: 272 UI. Al tratamiento se añade alopurinol (10-15 mg/[kg·d]) e hidroxiurea, alcalinizando la orina con bicarbonato de sodio.
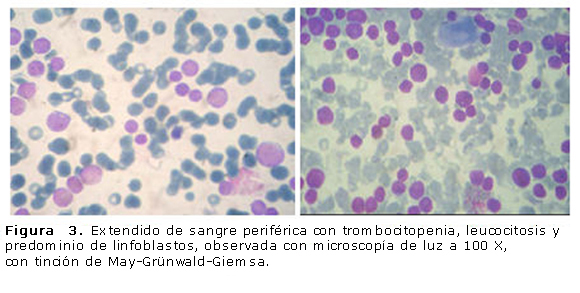
A los 9 días de vida está estable hemodinámicamente, no hay incremento de las lesiones infiltrativas cutáneas. Se realiza medulograma que resulta compatible con una leucemia aguda no linfoblástica de variedad M5A (monocítica) con tinción con mieloperoxidasa (MPO), Sudán y PAS negativas (figura 3). Se mantiene igual tratamiento. A los 11 días de vida los leucocitos bajan a 16,2 x 109/L, segmentados: 0,23 %, linfocitos: 0,44 %, blastos: 0,35 %, eosinófilos: 0,05 %, plaquetas: 70 x 109/L, hemoglobina: 99 g/L, reticulocitos: 182 x 10-3. Se suspende el alopurinol y se mantiene la hidroxiurea por la neutropenia. Se continúa con el concentrado de plaquetas y se transfunde con glóbulos. Cuarenta y ocho horas después se observa hipoactivo, con llanto débil, ictericia verdínica, disminución del peso, sangrado digestivo alto, distensión abdominal y circulación colateral. El cuadro clínico se interpreta como una sepsis con localización entérica, y se inicia un tratamiento con omeprazol, cefepime, vancomicina e intaglobin en dosis moduladoras. En los complementarios presentaba: plaquetas: 2 x 109/L, leucocitos: 90 x 109/L y blastos: 0,95 %. Se aumenta la dosis de hidroxiurea a 50 mg/(kg·d) y se mantiene el concentrado de plaquetas cada 8 h.
A los 17 días de vida, con los elementos morfológicos de los estudios realizados, el cuadro clínico y la evolución del paciente, se concluye por genética y confirman que no existen estigmas clínicos de síndrome de Down aunque el cariotipo es no útil, además de lograr una citorreducción inicial. Reaparece la leucocitosis con evidencia de infiltración orgánica, cutánea y la presencia de blastos grandes que impresionan mieloides pudiera tratarse de una variedad no linfoblástica. En la medula ósea la proporción de blastos linfoides es predominante y además las características citoquímicas lo confirman, pues son negativas para MPO y SNB.
Aunque los estudios inmunofenotípicos están pendientes, se considera una leucemia linfoide aguda del lactante, que tiene características clínicas y evolutivas particulares. Por ello se le debe aplicar el protocolo de tratamiento de Inferfant 2006 que incluye medicamentos activos contra el componente linfoide y mieloide. Se considera un paciente de alto riesgo, pues tiene menos de 6 meses y leucocitosis, por lo que hay que evaluar la respuesta inicial al esteroide. Se inicia tratamiento prednisona parenteral e intratecal más metotrexato.
Presenta un inmunofenotipo CD-13 positivo en el 97 %, el resto es negativo. A los 5 días de inducción hay disminución de los leucocitos a 23,4 x 109/L; mantiene la trombocitopenia (plaquetas: 5 x 109/L), blastos: 0,74 %, linfocitos: 0,22 %. Se suspende la hidroxiurea. Tres días después sufre deterioro clínico compatible con sepsis generalizada; se realiza cambio de antibiótico (meronem); se observa un aumento de los blastos, de los neutrófilos, trombocitopenia y leucopenia. La respuesta a la prednisona ha sido favorable, por lo que se mantiene la terapia intratecal. A los 25 días de vida se inició quimioterapia con vincristina, citrabina y daudoruvimicina.
Al mes de edad mostró un deterioro clínico y hematológico tras un proceso infeccioso grave, con dificultad respiratoria, hemoptisis y trombocitopenia marcada. Se ventila y presentó un sangrado importante por las vías respiratorias, con paro cardiorrespiratorio irreversible a las maniobras de recuperación.
DISCUSIÓN
De acuerdo con la cinética del crecimiento celular en la leucemia es razonable suponer que cuando esta enfermedad se diagnostica en las 4 primeras semanas de vida es porque esta se originó en el útero, por lo que debe considerarse congénita.2,3
Su confirmación en un neonato requiere de una minuciosa investigación y cuidados esmerados. Las manifestaciones cutáneas son comunes, además de las petequias y equimosis. Cerca del 50 % pueden presentar infiltración cutánea nodular («leucemoa cutis»). Los nódulos de la piel son de tamaño variable, pueden medir entre 2 mm y 3 cm de diámetro; son de color gris pizarra o azulado y se palpan como tumores fibromatosos del tejido subcutáneo profundo. Estas manifestaciones preceden varios días o semanas a las otras manifestaciones de la enfermedad. La hepatomegalia y la esplenomegalia son frecuentes, y las linfoadenopatías son poco comunes. Generalmente estos niños presentan poco incremento de su peso, fiebre «inexplicable», diarrea, palidez intensa, petequias e insuficiencia respiratoria secundaria a la leucostasis en los vasos pulmonares, que complica la evolución clínica. Muestran, además, somnolencia, poco apetito y sangrado umbilical, gastrointestinal o genitourinario.2,4-6
Como es natural, esta enfermedad se caracteriza por un número elevado de leucocitos, que en nuestro paciente llegaron a 350 x 109/L con 100 % de blastos. Para establecer el diagnóstico se deben cumplir 3 criterios esenciales: 1) que haya proliferación de células de las series mieloide y linfoide; 2) que exista infiltración de estas células en los tejidos hematopoyéticos y 3) que el paciente no haya padecido infecciones congénitas o padezca hipoxia o enfermedades hemolíticas. En tales circunstancias pueden ocurrir manifestaciones clínicas y hematológicas parecidas a las de la leucemia.2,3,7-9 Nuestro paciente cumplió estos criterios.
Las características clínico-biológicas de las leucemias congénitas difieren significativamente de las del resto de las leucemias infantiles. El predominio de las formas mielomonocíticas es bien conocido. Las alteraciones cromosómicas afectan en el 50 % a la región 11q23, con translocaciones (4; 11) o bien (11; 19). Hay una elevada frecuencia de coexpresión de marcadores mieloides y linfoides, que indican la afectación de precursores hematopoyéticos muy indiferenciados.7,9
El pronóstico es infausto, con unas tasas de supervivencia inferiores al 30 % en la mayoría de las series publicadas,2 si bien se han descrito casos de remisiones espontáneas.4 Las lesiones cutáneas son frecuentes y a menudo constituyen el signo guía; preceden en un 7 % de los pacientes a la afectación medular y la biopsia cutánea puede indicar el diagnóstico. Pueden estar constituidas por nódulos subcutáneos o máculas papulosas azuladas que dan el aspecto de «bebé pastel de arándanos» (del inglés blueberry muffin baby).5,6
Hay que tener en cuenta el diagnóstico diferencial con otras entidades como infecciones virales intrauterinas, histiocitosis, neuroblastoma u otras alteraciones hematológicas (hematopoyesis dérmica). En este paciente las lesiones cutáneas orientaban a una leucemia monoblástica. El síndrome de lisis tumoral es más frecuente en este tipo de leucemias. 6,7
El diagnóstico se confirma al estudiar la médula ósea, donde generalmente se observa hipercelularidad con una mayor proporción de formas inmaduras, así como ausencia de megacariocitos y de precursores de células rojas. En este caso el reporte del estudio de médula ósea fue una leucemia linfoblástica aguda L2, de células T. En este paciente lo primero que se trató fue la lisis tumoral, de lo cual no encontramos referencias en la literatura revisada.2,7
El análisis cromosómico de la sangre y la médula ósea, al resolverse la reacción leucemoide, permitió comprobar el predominio de las células de cariotipo normal. En el presente caso desafortunadamente no se pudo obtener el cariotipo, pero clínicamente su fenotipo no correspondía a un síndrome de Down.1,2,5,9
El tratamiento fue satisfactorio a la dosis recomendada, así como la hiperhidratación y la alcalinización de la orina, complementados con diurético y alopurinol. Aunque este tratamiento difícilmente puede ser establecido como norma ya que nuestra experiencia es limitada, es una alternativa más que sería deseable intentar en otros casos. Se debe dar tratamiento para leucemia a los niños con cariotipos normales o con alteraciones cromosómicas diferentes a la trisomía 21, ya que en tales casos existen posibilidades remotas de remisión espontánea.9,11-14
REFERENCIAS BIBLIOGRÁFICAS
1. Hart I. Fetal and neonatal leukemia. A case report. Am J Pediatr Hematol Oncol. 2003;25:348-61.
2. Bresters D, Reus A, Veerman A, Van Wering E, Does-van den Berg A, Kaspers G. Congenital leukaemia: The Duth experience and review of the literature. Br J Haematol. 2002;117:513-24.
3. Polski JM, Galambos C, Gale G, Dunphy C, Evans L, Batanian J. Acute megakaryoblastic leukemia after transient myeloproliferative disorder with clonal karyotype evolution in a phenotypically normal neonate. J Pediatr Hematol Oncol. 2002;24:50-4.
4. Bayouumy M, Gin T, Jamil A. Prenatal presentation supports the in utero development of congenital leukaemia: A case report. Am J. Pediatr Hematol Oncol. 2003;25(2),148-52.
5. Cárdenas CR. Leucemia aguda no linfoblástica. En: Rivera Luna R, ed. Diagnóstico del niño con cáncer. 1a ed. España: Mosby/ Doyma libros; 1994. Pp. 137-42.
6. Pierce MI. Leukemia in the newborn infant. J Pediatr. 1959;54:691-706.
7. Allen DS. Leucemia congénita. En: Avery ME. y Schaffer. Enfermedades del recién nacido. 6 ed. 1988 México: Interamericana, McGraw-Hill; 2003. P. 961.
8. Miranda del Olmo H, Cardiel L, Verdusco M, Durán M, Bolea V, Reynoso E, Calderón J, López R. Clínicas de Perinatología. México. Hematología Neonatal. 2000;27(3):537-54.
9. Zipurdky A, Brown E, Cristeinsen H, Sutherland R, Doyle J. Leukemia and/or mieloproliferative syndrome in neonates with Down's syndrome. Seminars in Perinatology 1997;21(18):97-101.
10. Dinulos J, Hawkins D, Clark B, Francis J. Spontaneous remission of congenital leukaemia. J Pediatr. 1997;131:300-3.
11. Arci RJ, Howard JW. Neoplasias. En: Avery Gordon B, Fletcher Mary A, MacDonald Mhairi G. Neonatología, fisiopatología y manejo del recién nacido. 5a ed. Argentina: Panamericana; 2001. Pp. 1295-301.
12. Luchtman-Jones L, Schwartz AL, Wilson DB. The blood and hematopoietic system. Fanaroff Avroy A, Martin Richard J. Neonatal-perinatal medicine. Diseases of the fetus and infant. 6a ed. USA: Library of Congress Cataloging-in-Publication Data; 1997. Pp. 1201-51.
13. Sande JE, Arceci RJ, Lampkin BC. Congenital and neonatal leukemia. Seminars in Perinatology. 1999;23(4):274-85.
14. Zwaan CM, Kaspers GJL. Different drugs sensitivity profiles of acute myeloid and lymphoblastic leukemia and normal peripheral blood mononuclear cells in children with and without Down's syndrome. Blood. 2001;99(1):245-51.
Recibido: 3 de marzo de 2011.
Aprobado: 16 de marzo de 2011.
Eduardo Morales Mesa. Unidad de Cuidados Intensivos Neonatales, Hospital Pediátrico Universitario «William Soler». San Francisco 10112, Altahabana. La Habana, Cuba.
Correo electrónico: eduarm@infomed.sld.cu