Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión impresa ISSN 0034-7531
Rev Cubana Pediatr vol.84 no.4 Ciudad de la Habana oct.-dic. 2012
ARTÍCULO DE REVISIÓN
Staphylococcus aureus, evolución de un viejo patógeno
The evolution of an old pathogen called Staphylococcus aureus
MSc. Dra. Ileana Álvarez Lam,I MSc. Dr. Jorge Ponce BittarII
IHospital Pediátrico "William Soler". La Habana, Cuba.
IIFacultad de Ciencias Médicas "Enrique Cabrera". La Habana, Cuba.
RESUMEN
El Staphylococcus aureus está considerado uno de los microorganismos más importantes en la práctica médica diaria. Es capaz de provocar una amplia gama de enfermedades, ya sea por acción directa o mediante la acción de sus toxinas. El tratamiento de estas infecciones se ha convertido en algo extraordinariamente complejo en la época actual como consecuencia de la aparición en la comunidad de cepas de S. aureus, resistentes a la meticillina, que provocan infecciones en pacientes sin factores de riesgo, fundamentalmente niños y adolescentes. En este artículo se hace una revisión, que va desde los cambios en la epidemiología de este patógeno, hasta las implicaciones que para el tratamiento médico presupone este fenómeno.
Palabras clave: Staphylococcus aureus, resistencia, meticillina, MRSA, comunidad.
ABSTRACT
Staphylococcus aureus is considered one of the most important micro-organisms in the daily medical practice. It can cause a wide range of diseases either by direct action or through the toxins. At present, it is extremely complex to treat these infections, since methicillin-resistant S. aureus strains have emerged in the community setting, leading to infections affecting patients without risk factors, mainly children and adolescents. This article reviewed the changes of this pathogen in epidemiology and the implications of this event for the medical treatment.
Key words: Staphylococcus aureus, resistance, methicillin, methicillin-resistant Staphylococcus aureus, community.
INTRODUCCIÓN
Considerado por la Sociedad Americana de Enfermedades Infecciosas (IDSA) como uno de los 6 microorganismos de mayor importancia en la práctica médica diaria, el Staphylococcus aureus es causa frecuente de infecciones en la comunidad y de un número importante de infecciones relacionadas con los cuidados médicos.1,2 Este microorganismo posee un alto grado de patogenicidad, y es responsable de una amplia gama de enfermedades, que van desde procesos banales hasta infecciones graves que comprometen la vida del paciente. S. aureus coloniza la piel y mucosas de 30 a 50 % de adultos y niños sanos; el 20 % de forma permanente y hasta 30 % de forma intermitente. Las fosas nasales anteriores son las zonas habituales de colonización, aunque la región inguinal, las axilas, la región del periné y la faringe, son otros sitios frecuentes de colonización. Generalmente la población colonizada lo está con S. aureus sensible a la meticillina (MSSA) y solamente de 1-5 %, quizás 9 %, lo están con Staphylococccus aureus meticillino resistente (MRSA), lo que aumenta significativamente el riesgo de infección por este microorganismo.2
Las infecciones estafilocócicas tienen un período de incubación sumamente variable. Las principales fuentes de infección son las personas infectadas, menos frecuente los portadores asintomáticos, manos y fómites contaminados, y el mecanismo de transmisión más importante es el contacto directo. Las infecciones producidas por S. aureus, sensibles o resistentes a la meticillina, tienen el mismo espectro clínico, las diferencias vienen dadas por las implicaciones en el tratamiento y los mecanismos de prevención de su transmisión.
Evolución de la resistencia
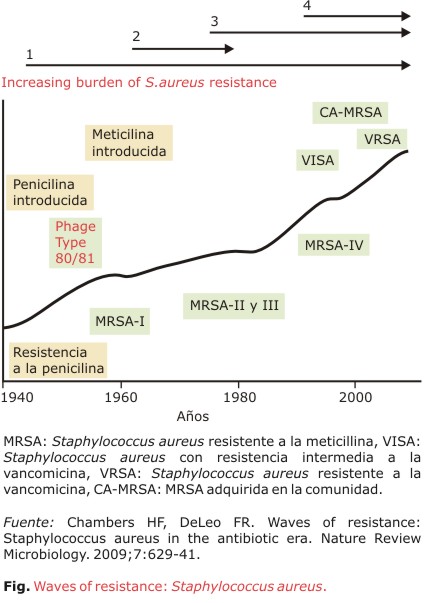
Desafortunadamente, este patógeno ha ido desarrollando resistencia a los antimicrobianos de forma vertiginosa. El primer aislamiento de Staphylococcus aureus resistente a la meticillina (MRSA) fue descrito en Inglaterra en 1961, y se consideró como un patógeno asociado a los cuidados de salud. Posteriormente, en 1963, se reportó el primer brote epidémico de MRSA nosocomial.3 En 1997 se describe en Japón la primera cepa de S. aureus con resistencia intermedia a la vancomicina (VISA o GISA),4 y en el año 2002 aparece en Estados Unidos la primera cepa resistente a la vancomicina (VRSA).5 La figura muestra las etapas del desarrollo de la resistencia de este microorganismo.6
De acuerdo con datos del Centro para el Control de Enfermedades (CDC), en los Estados Unidos, la proporción de infecciones resistentes a los antibióticos ha ido en aumento. El Sistema Nacional de Vigilancia de Infecciones Nosocomiales (National Nosocomial Infectious Surveillance System, NNIS), también de los Estados Unidos, determinó que la prevalencia de cepas MRSA en pacientes hospitalizados se incrementó del 4 % en 1980, al 31,9 % en 1996. En 2001 se tenía un 55 % de prevalencia, y para 2004 llegó al 63 %. En el año 2005 MRSA causó más de 94 000 infecciones potencialmente mortales y casi 19 000 muertes en los Estados Unidos, la mayoría de las cuales estuvieron vinculadas a instituciones de salud.7,8 Esta situación no tuvo variación en el continente europeo. En España, de acuerdo con los resultados publicados en el Estudio de Prevalencia de las Infecciones Nosocomiales en España (EPINE) correspondiente al año 2011, las infecciones nosocomiales por Staphylococcus aureus tuvieron una prevalencia del 8,1 %, y de estos aislamientos, el 43,0 % resultaron ser meticillino resistentes.9
Las infecciones por MRSA fueron, en su inicio, de origen nosocomial (HA-MRSA), y ocurrían frecuentemente en personas hospitalizadas, enfermas o en trabajadores de la salud, por eso se les denominó MRSA adquirido en el hospital (HA-MRSA); sin embargo, a finales de los años 90, ha existido una emergencia de MRSA porque provoca infecciones en la comunidad, con una susceptibilidad antimicrobiana diferente que las cepas hospitalarias. Estas cepas representan un problema potencialmente muy serio, y los primeros reportes que llamaron la atención sobre ellas fueron las muertes por neumonía necrotizante de 4 niños sanos en Estados Unidos entre 1997 y 1999.10
El origen de las cepas de MRSA adquirida en la comunidad (CA-MRSA) todavía está sujeto a debate. Se piensa que su origen no es debido a la diseminación del hospital hacia la comunidad, sino que este nuevo agente nace de la asociación de 2 genotipos: el genotipo resistente de un Staphylococcus epidermidis y el genotipo de un Staphylococcus aureus meticillina sensible más virulento, es decir, a consecuencia de un intercambio genético entre estafilococos (transferencia horizontal de genes).11,12
La mayor parte de estas infecciones se localizan en piel y partes blandas, y ocurren en personas en las que no se reconocen factores de riesgo, principalmente niños y adolescentes. Generalmente ocurre en poblaciones cerradas o semicerradas (militares, reclutas, prisioneros, atletas y guarderías), hombres que tienen sexo con hombres y grupos con bajo estatus económico. Estas cepas han sido encontradas en todo el mundo -incluyendo Norteamérica y Europa- con áreas que reportan una incidencia de alrededor del 20 %.13-17 El primer reporte de una infección por CA-MRSA en Sudamérica fue hecho en Brasil en el año 2005.18
Desde el punto de vista microbiológico, las cepas CA-MRSA son genéticamente diferentes del clásico S. aureus meticillina multirresistente, que se conoce del ámbito hospitalario (cuadro).19-22 Las cepas CA-MRSA poseen atributos específicos de virulencia. Primero, existe una exotoxina -la leucocidina de Panton-Valentine (PVL)- presente en aproximadamente el 93 % de estos aislamientos, que está asociada con procesos inflamatorios severos en piel y partes blandas, así como a neumonía necrotizante;19,20 segundo, poseen mayor rapidez de duplicación celular y una alta capacidad de diseminación, lo cual se ha atribuido al hecho de que su tamaño pequeño les permite incorporarse a la cabeza de un bacteriófago y así transferirse entre cepas de distintos clones por transducción;21 y tercero, los genes de resistencia a meticilina se encuentran en una región de reciente identificación (SCCmec IV o V) distinta a la que poseen los MRSA hospitalarios clásicos, que no contienen los genes de resistencia a antibióticos adicionales que son típicos de las cepas HA-MRSA.22
Aunque la diferenciación de estas cepas resulta extremadamente difícil, pues debe realizarse basada en técnicas de biología molecular, existen criterios clínicos que nos permiten definir una infección por CA-MRSA: el aislamiento de las cepas se realizará en pacientes ambulatorios o en las primeras 48 horas de hospitalización, ausencia de infección o colonización por MRSA, no existen antecedentes en el último año de hospitalización, diálisis o cirugía, el paciente no tiene insertados dispositivo o catéter permanente, y no hay antecedentes de familiares trabajadores sanitarios o de trabajar en un hospital.11
Mecanismo de resistencia
El mecanismo por el cual S. aureus se hace resistente a la meticillina está bien definido. La adquisición de un gen llamado mecA facilita la elaboración de una proteína ligadora de penicilina con actividad transpeptidasa de muy baja afinidad por los betalactámicos (PBP2a), que es transportada por un elemento genético móvil, el cassette cromosómico estafilocócico (SCCmec). Desde su aparición en la década de 1960, el SCCmec ha evolucionado a tipos diferentes de elementos genéticos móviles (I-VIII), de los que cada uno alberga un grupo distinto de genes. Los SCCmec I, II, III -y más recientemente el SCCmec VIII- son estructuralmente más grandes, incorporan genes de multirresistencia y se relacionan con las cepas de MRSA hospitalario, mientras que el SCCmec IV (con más frecuencia) y los tipos restantes (V-VII) son más pequeños, no incorporan otros genes de resistencia antibiótica, y se relacionan con las cepas de MRSA adquirido en la comunidad.23
El factor de virulencia que más se ha relacionado con SCCmec IV, y por tanto con las cepas de CA-MRSA, ha sido la PVL. Descrita en 1932, es una toxina específica de S. aureus con actividad leucocitotóxica y dermonecrótica, debido a la presencia de 2 componentes: la subunidad luk-SPV, que se une al receptor de los leucocitos y los macrófagos; y la subunidad luk-FPV, que produce la apertura de los canales de calcio de la membrana celular, altera su permeabilidad y provoca la lisis celular.24 Actualmente se cuestiona su papel en la gravedad de estas infecciones. Se están investigando nuevos factores asociados que podrían conferir un mayor grado de virulencia o contribuir a la gravedad de las infecciones por S. aureus productor de PVL, como son: las modulinas solubles en fenol y el elemento móvil para el catabolismo de la arginina (ACME), descritos recientemente en modelos murinos.25 El gen de la PVL no es exclusivo de las cepas de MRSA comunitarias, puede encontrarse en cepas sensibles a meticillina (MSSA) procedentes de la comunidad, pero es muy raro en MRSA de origen hospitalario.26
Algunos estudios han puesto de manifiesto que las cepas MRSA parecen tener relación clonal entre ellas. Después de haber analizado 3 000 aislamientos de MRSA que circularon en diferentes áreas geográficas del mundo y en diferentes periodos, se encontró que estas cepas tienen una estructura clonal conservada, y que se cuenta con un número reducido de clonas con capacidad de diseminación global. Estas se conocen como clonas MRSA pandémicas. Se han identificado 6 clonas pandémicas: ibérico, brasilero, pediátrico, húngaro, NewYork/Japón y EMRSA-16, cuyos nombres derivaron de las regiones donde fueron detectadas por primera vez o de alguna propiedad epidemiológica.27 Frecuentemente estos clones se usan como referentes de tipificación en estudios epidemiológicos.28
La determinación de las clonas MRSA en América Latina es reciente, y es la clona brasileña la que predomina en esta región, aunque en 1997 fue detectada en un hospital pediátrico de la Ciudad de México una clona diferente denominada clona M.29 Solo unas pocas clonas de CA-MRSA se han diseminado a través del mundo. Se han identificado 2 clonas principales: la USA 300 y la USA 400.30 La clona USA 300 se ha localizado en jugadores de fútbol y presos,31 mientras que la cepa USA 400 se ha encontrado en varias poblaciones étnicas.32
Implicación médica
La sospecha clínica y/o determinación microbiológica de una cepa MRSA cambia por completo la conducta terapéutica ante una infección. Generalmente son infecciones difíciles de manejar y con un mayor costo. Debemos recordar que las cepas MRSA son, por origen, resistentes a todos los betalactámicos (penicilinas, cefalosporinas, monolactámicos y carbapenémicos). Las infecciones por CA-MRSA pueden tratarse con otros antimicrobianos de acción antiestafilocócica, como: clindamicina, clotrimoxazol, fosfomicina, doxiciclina, rifampicina, vancomicina y teicoplanina; sin embargo, los HA-MRSA son genéticamente multirresistentes, y son los glucopéptidos (vancomicina y teicoplanina) su indicación terapéutica.33,34
Nuevos antimicrobianos con acción antiestafilocócica han entrado al mercado. El linezolid, perteneciente al grupo de las oxazolidononas, ha demostrado por muchos estudios ser más efectivo que la vancomicina para el tratamiento de estas infecciones,35,36 aunque ya se han descrito cepas de MRSA resistentes a este antimicrobiano mediante una mutación en el gen que codifica la subunidad 23S del ARNr.37
La telavancina, la dalbavancina, la daptomicina, el ceftobiprol y la tigeciclina son otros ejemplos de estos nuevos fármacos; sin embargo, sus elevados costos aún no nos permiten contarlos en nuestro arsenal terapéutico.38-40 Indiscutiblemente, el lavado de manos, el uso juicioso de antibióticos, el aislamiento, y el respeto de la unidad individual de cada paciente, debe seguir siendo la norma que guíe sabiamente nuestro trabajo diario.
REFERENCIAS BIBLIOGRÁFICAS
1. Talbot GH, Bradley J, Edwards JE, Gilbert D, Scheld M, Bartlett JG. Bad bugs needs drugs: an update on the development pipeline from the antimicrobial availability task force. Clin Inf Dis. 2006;42:657-68.
2. Gordon JG, Lowy FD. Pathogenesis of methicillin-resistant Staphylococcus aureus infection. Clin Infect Dis. 2008;46:350-9.
3. Jevons, M. "Celbenin"-resistant staphylococci. BMJ. 1961;1:124-5.
4. Hiramatsu K, Hanaki H, Ino T, Yatuba K, Oguri T, Tenover FC. Methicillin-resistant Staphylococcus aureus clinical strain with reduced vancomycin susceptibility. J Antimicrob Chemother. 1997;40:135-6.
5. Centers for Disease Control and Prevention. Staphylococcus aureus resistant to vancomycin-United States, 2002. Morb Mortal Wkly Rep. 51:565-7.
6. Chambers HF, DeLeo FR. Waves of resistance: Staphylococcus aureus in the antibiotic era. Nature Review Microbiology. 2009;7:629-41.
7. National Nosocomial Infectious Surveillance System (NNIS). System Report, data summary from January 1992 through June 2004, issued October 2004. Am J Infect Control. 2004;32:470-85.
8. Diederen BM, Kluytmans JA. The emergence of infections with community-associated methicillin resistant Staphylococcus aureus. J Infect. 2006;52:157-68.
9. Sociedad Española de Medicina Preventiva, Salud Pública e Higiene. 2011. Estudio de prevalencia de las infecciones nosocomiales en España. EPINE 1990-2011: 22 años. 22º Estudio. Informe Global de España [monografía en Internet]; España [citado 8 de febrero de 2012]. Disponible en: http://www.vhebron.net/ac/preventiva/epine/9-epine_1990-2011.pdf
10. Centers for Disease Control and Prevention. Four pediatric deaths from community-acquired methicillin-resistant Staphylococcus aureus. Minnesota and North Dakota, 1997-1999. Morb Mortl Wkly Rep. 1999;48:707-10.
11. Saïd-Salim B, Mathema B, Kreiswirth BN. Community-acquired methicillin-resistant Staphylococcus aureus: an emerging pathogen. Infect Control Hosp Epidemiol. 2003;24:451-5.
12. Bustos-Martínez JA, Hamdan-Partida A, Gutiérrez-Cárdenas M. Staphylococcus aureus: la reemergencia de un patógeno en la comunidad. Rev Biomed. 2006;17:287-305.
13. Broseta A, Chaves F, Rojo P, Otero JR. Emergencia de un clon de Staphylococcus aureus resistente a meticilina de origen comunitario en la población pediátrica del sur de Madrid. Enferm Infecc Microbiol Clin. 2006;24:31-5.
14. Hisata K, Kuwahara-Arai K, Yamanoto M, Ito T, Nakatomi Y, Cui L, et al. Dissemination of methicillin-resistant staphylococci among healthy japanese children. J Clin Microbiol. 2005;43:3364-72.
15. Vourli S, Perimeni D, Makri A, Polemis M, Voyiatzi A, Vatopoulos A. Community acquired MRSA infections in a paediatric population in Greece. Euro Surveill. 2005;10:78-9.
16. Wylie JL, Nowicki DL. Molecular epidemiology of community and health care-associated methicillin-resistant Staphylococcus aureus in Manitoba, Canada. J Clin Microbiol. 2005;43:2830-6.
17. Aramburu C, Harbarth S, Liassine N, Girard M, Gervaix A, Scherenzei J. Community-acquired methicillin-resistant Staphylococcus aureus in Switzerland: first surveillance report. Euro Surveill. 2006;11:42-3.
18. Ribeiro A, Dias C, Silva-Carvalho MC, Berquó L, Ferreira FA, Soares Santos RN, et al. First report of infection with community-acquired methicillin-resistant Staphylococcus aureus in South America. J Clin Microbiol. 2005;43:1985-8.
19. Vandenesch F, Naimi T, Enrigth MC, Lina G, Nimmo GR, Heffernan H, et al. Community-acquired methicillin-resistant. Staphylococcus aureus carrying Panton-Valentine leukocidin genes: world emergence. Emerg Infect Dis. 2003;9:978-84.
20. Lina G, Piémont Y, Godail-Gamont F, Bes M, Peter MO, Gauduchon V, et al. Involvement of Panton-Valentine Leukocidin-producing Staphylococcus aureus in primary skin infections and pneumonia. Clin Infect Dis. 1999;29:1128-32.
21. Ma XX, Ito T, Tiensasitorn C, Jamklang M, Chongtrakool P, Boyle-Vavra S, et al. Novel type of staphylococcal cassette chromosome mec identified in community-acquired methicillin-resistant Staphylococcus aureus strains. Antimicro Agents Chemother. 2002;46:1147-52.
22. Ito T, Ma XX, Takeuchi F, Okuma K, Yuzawa H, Hiramatsu K. Novel type V staphylococcal cassette chromosome mec driven by a novel cassette chromosome recombinase, ccrC. Antimicrob Agents Chemoter. 2004;48:2637-51.
23. Zhang K, McClure JA, Elsayed S, Conly JM. Novel staphylococcal cassette chromosome mec type, tentatively designated type VIII, harbouring class A mec and type 4 ccr gene complexes in Canadian epidemic strain of methicillin-resistant Staphylococcus aureus. Antimicrob Agents Chemother. 2009;53:531-40.
24. Panton P, Valentine F. Staphylococcal toxins. Lancet. 1932;222:506-8.
25. Wang R, Braughton KR, Kretschmer D, Bach TH, Queck SY, Li M, et al. Identification of novel cytolytic peptides as key virulence determinants for community-associated MRSA. Nat Med. 2007;13:1510-4.
26. Konig B, Prevost G, Piemont Y, Konig W. Effects of Staphylococcus aureus leukocidins on inflammatory mediator release from human granulocytes. J Infect Dis. 1995;171:607-13.
27. Aires de Sousa M, de Lencastre H. Bridges from hospitals to the laboratory: genetic portraits of methicillin-resistant Staphylococcus aureus clones. FEMS Immunol Med Microbiol. 2004;40:101-11.
28. Cruz C, Moreno J, Renzoni A, Hidalgo M, Reyes J, Schrenzel J, et al. Tracking methicillin-resistant Staphylococcus aureus clones in Colombian hospitals over 7 years (1996-2003): emergence of a new dominant clone. Int J Antimicrob Agents. 2005;26:457-62.
29. Ribeiro A, Dias C, Silva-Carvalho MC, Buquol L, Ferreira FA, Santos RN, et al. First report of infection with community-acquired methicillin-resistant Staphylococcus aureus in South America. J Clin Microbiol. 2005;43:1985-8.
30. King MD, Humphrey BJ, Wang YF, Kourbatova EV, Ray SM, Blumberg HM. Emergency of community-acquired methicillin-resistant Staphylococcus aureus USA 300 clone as the predominant cause of skin and soft-tissue infections. Ann Intern Med. 2006;144:309-17.
31. Diep BA, Gill SR, Chang RF, Phan TH, Chen JH, Davidson MG, et al. Complete genome sequence of USA300, an epidemic clone of community-acquired methicillin-resistant Staphylococcus aureus. Lancet. 2006;367:731-9.
32. David MZ, Rudolph KM, Hennessy TW, Boyle-Vavra S, Daum RS. Molecular epidemiology of methicillin-resistant Staphylococcus aureus. Lancet. 2006;367:731-9.
33. Liu C, Bayer A, Cosgrove SE, Daum RS, Fridkin SK, Gorwitz RJ, et al. Clinical Practice Guidelines by the Infectious Diseases Society of America for the Treatment of Methicillin-Resistant Staphylococcus aureus. Infections in Adults and Children. Clinical Practice Guidelines. CID. 2011;52:1-38.
34. Mensa J, Barberán J, Llenares P, Picazo JJ, Bouza E, Alvarez Lerma F, et al. Guía de tratamiento de la infección producida por Staphylococcus aureus resintente a la meticilina. Rev Esp Quimioter. 2008;21(4):234-8.
35. Kollef MH, Rello J, Cammarata SK, Croos-Dabrera RV, Wunderink RG. Clinical cure and survival in Gram-positive ventilator-associated pneumonia: retrospective analysis of two double-blind studies comparing linezolid with vancomycin. Intensive Care Med. 2004;30:388-94.
36. Shorr AF, Kunkel MJ, Kollef M. Linezolid versus vancomycin for Staphylococcus aureus bacteremia: pooled analysis of randomized studies. J Antimicrob Chemother. 2005;56:923-9.
37. Roberts SM, Freeman AF, Harrington SM, Holland SM, Murray PR, Zelazny AM. Linezolid-resistant Staphylococcus aureus in two pediatric patients receiving low-dose linezolid therapy. Pediatric Infect Dis J. 2006;25(6):562-4.
38. Fritsche TR, Rennie RP, Goldstein BP, Jones RN. Comparison of dalbavancin MIC values determined by Etest (AB BIODISK) and referencedilution methods using gram-positive organisms. J Clin Microbiol. 2006;44(8):2988-90.
39. Mangili A, Bica I, Snydman DR, Hamer DH. Daptomycin-resistant, methicillin-resistant Staphylococcus aureus bacteremia. Clin Infect Dis. 2005;40(7):1058-60.
40. Denis O, Deplano A, Nonhoff C, Hallin M, De Ryck R, Vanhoof R, et al. In vitro activity of ceftobiprole, tigecycline, daptomycin, and 19 other antimicrobials against methicillinresistant Staphylococcus aureus strains from a national survey of Belgian hospitals. Antimicrob Agents Chemother. 2006;50(8):2680-5.
Recibido: 11 de mayo de 2012.
Aprobado: 9 de junio de 2012.
Ileana Álvarez Lam. Hospital Pediátrico Universitario "William Soler". San Francisco # 10 112, reparto Altahabana, municipio Boyeros. La Habana, Cuba. Correo electrónico: arlet@infomed.sld.cu