Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión impresa ISSN 0034-7531
Rev Cubana Pediatr vol.85 no.2 Ciudad de la Habana abr.-jun. 2013
ARTÍCULO ORIGINAL
Eficacia y seguridad de la eritropoyetina en la anemia de la prematuridad
Efficacy and safety of erythropoietin for anemia of prematurity
MSc. Dra. Anett Sijó Yero,I Dra. Giselle Saurez Martínez,II Dra. Danys Velázquez Noda,III Dr. Leonel Méndez Alarcón,IV Dr. Antonio Alfonso Dávila,V MSc. Lic. Alicia Vargas Batista,VI Dra. Maytee Robaina García,VI Dra. Patricia Piedra Sierra,II Dra. Alina Lorenzo Rodríguez,VII Dra. Ana Campos González,VIII MSc. Lic. Ivis Mendoza HernándezVI
IHospital Ginecobstétrico de 10 de Octubre. La Habana, Cuba.
IICentro de Inmunología Molecular. La Habana, Cuba.
IIIHospital Ginecobstétrico "Ramón González Coro". La Habana, Cuba.
IVHospital Ginecobstétrico "Eusebio Hernández". La Habana, Cuba.
VHospital Clínicoquirúrgico "Enrique Cabrera". La Habana, Cuba.
VICentro Nacional Coordinador de Ensayos Clínicos. La Habana, Cuba.
VIIHospital Ginecobstétrico "América Arias". La Habana, Cuba.
VIIIHospital Ginecobstétrico de Guanabacoa. La Habana, Cuba.
RESUMEN
Introducción: la eritropoyetina alfa recombinante forma parte del tratamiento de la anemia de la prematuridad. En Cuba su uso ha sido limitado y controvertido en cuanto a esquema y dosis empleada.
Métodos: ensayo clínico prospectivo, multicéntrico, no aleatorizado, de eficacia y seguridad de eritropoyetina en la disminución de transfusiones en el recién nacido pretérmino de muy bajo peso. Se incluyeron 72 neonatos con edad gestacional menor de 34 semanas posmenstruales, y peso al nacer menor o igual a 1 500 g, con más de 7 días posnatales e ingesta de 50 mL/kg/día.
Resultados: todos recibieron eritropoyetina 300 U/kg, subcutánea, 3 veces/semana, hasta las 40 semanas de edad gestacional y suplemento de hierro y vitaminas. La eritropoyetina fue muy segura, solo se notificó con relación posible una retinopatía de la prematuridad, ligera y recuperada.
Conclusiones: se transfundieron 7 pacientes (9,7 %) en el curso del estudio. El uso tardío de eritropoyetina en el pretérmino de muy bajo peso confirma su eficacia y seguridad.
Palabras clave: anemia en la prematuridad, transfusión de glóbulos rojos, eritropoyetina humana recombinante, transfusión neonatal.
ABSTRACT
Introduction: recombinant alpha erythropoietin is part of the treatment for anemia of prematurity. The use of this one in Cuba has been restricted and controversial as to schedule and dose.
Methods: prospective, non-randomized multicenter assay on the safety and efficacy of erythropoietin in the reduction of blood transfusion in very-low-weight preterm newborn. Seventy two neonates with gestational age under 34 post-menstruation weeks, weighing equal or less than 1 500 g, over 7 days of life after birth and fed on 50 mL/kg/day were included in the study.
Results: all of them received 300 U/kg erythropoietin by subcutaneous administration three times a week up to reaching 40 weeks of gestational age and an iron and vitamin supplement. Erythropoietin is very safe; it was just possibly related to slight retinopathy of prematurity, but overcome.
Conclusions: seven patients were transfused (9.7 %) in the course of study. The late use of erythropoietin in very-low-weight preterm child confirms its efficacy and safety.
Key words: anemia of prematurity, red blood cell transfusion, human recombinant erythropoietin, neonatal transfusion.
INTRODUCCIÓN
La anemia del prematuro (AP) es el trastorno hematológico más frecuente del recién nacido (RN) de muy bajo peso (MBP), menor de 1 500 g y de extremadamente bajo peso (EBP), menor de 1 000 g. Las causas desencadenantes de esta AP son las exposiciones repetidas a extracciones de sangre como parte de los cuidados intensivos neonatales, y una producción inadecuada de eritropoyetina en el desarrollo posnatal. Para su prevención y control, el tratamiento incluye la transfusión de glóbulos rojos y el uso de agentes estimulantes de la eritropoyesis, como la eritropoyetina humana recombinante (rHuEPO).1
La transfusión sanguínea tiene efecto inmediato en la corrección de la AP, principalmente en un paciente que requiere una reposición lo antes posible del volumen eritrocitario en sus primeros días de vida.2 Sin embargo, los riesgos por la exposición a múltiples donantes y las infecciones graves de transmisión sanguínea como la hepatitis B, C, citomegalovirus y VIH, son sus principales limitaciones de uso.3,4 Las mejoras en las tecnologías transfusionales han logrado minimizarlas, y por tanto, su práctica es la de elección en la AP,5 pero no todas las unidades asistenciales disponen de esas tecnologías de avanzada para contrarrestar esos riesgos.
Precisamente el tratamiento de rHuEPO es una alternativa para evitar estos inconvenientes, la cual promueve la eritropoyesis y disminuye significativamente el número y el volumen de las transfusiones, incluso en recién nacidos EBP.6,7 Sin embargo, existen dudas sobre su beneficio clínico, por asociarse a eventos graves como la retinopatía de la prematuridad (ROP), principalmente en su administración temprana (menos de 7 días posnatales).8-12 Tanto el tratamiento con transfusiones como el uso de rHuEPO siguen siendo un tema controvertido, porque no es bien conocido el impacto absoluto sobre la AP;13-15 no se ha logrado consenso en la selección del mejor tratamiento, en qué momento, cuál esquema y dosis emplear.6,16
En Cuba se sigue una política transfusional restrictiva, y existe una estrategia consciente para disminuir las extracciones de sangre, con el propósito de reducir la aparición de la AP,17 pero no todas las recomendaciones son aplicables en cada unidad de neonatología, específicamente las que demandan técnicas avanzadas, como la disponibilidad de unidades satélites de eritrocitos. Por tanto, el uso de rHuEPO es una opción terapéutica factible en el tratamiento de la AP, sin embargo la experiencia de uso en esta indicación en nuestro contexto es limitada, no encontramos estudios precedentes publicados que argumenten su efecto terapéutico en la AP; por tal motivo, se diseñó un protocolo de investigación para evaluar el uso de rHuEPO en la disminución de los requerimientos transfusionales, su relación con la respuesta hematológica, e identificar los eventos adversos secundarios al tratamiento en esquema y dosis predeterminados. Se describe el reporte final del primer ensayo clínico considerando la hipótesis que la administración tardía de rHuEPO reduciría a 25 % o menos la necesidad de transfusiones de glóbulos rojos.
MÉTODOS
Se realizó un ensayo clínico prospectivo multicéntrico, abierto, no aleatorizado, fase III, que incluyó pacientes recién nacidos pretérmino con peso £ 1 500 g y edad gestacional (EG)< 34 semanas, más de 7 días de edad posnatal y una ingesta de leche materna y/o artificial de al menos 50 mL/kg/día. Los padres o tutores responsables firmaron un consentimiento informado de participación de los neonatos en el estudio. Se excluyeron los prematuros con enfermedad hemorrágica o hemolítica, y malformación congénita mayor.
El protocolo de investigación fue aprobado por los Comités de Ética para la Investigación Clínica de las instituciones participantes, y se autorizó por la Agencia Nacional Reguladora de Medicamentos (CECMED). El monitoreo, manejo y análisis estadístico de los datos estuvo a cargo del Centro Nacional Coordinador de Ensayos Clínicos (CENCEC).
Todos los pacientes recibieron rHuEPO alfa 300 U/kg, subcutánea, 3 veces/semana, hasta las 40 semanas de edad gestacional corregida. Se siguieron criterios de transfusión según las guías transfusionales internacionales de Sola.18 Se administró suplemento de hierro (fumarato ferroso), en dosis de 4 mg/kg de peso/día hasta 6 mg/kg/día, oral concomitante con rHuEPO y vitaminas. Se estimó la variable de respuesta principal: requerimiento transfusional de glóbulos rojos y se calculó el IC 95 % correspondiente. Se analizaron también las variables secundarias siguientes: número y volumen de transfusiones de glóbulos rojos recibidas por paciente, respuesta hematológica (cifras de hemoglobina y hematocrito); además, se evaluó conteo de reticulocitos, hierro sérico, ferritina e índice de saturación de transferrina, conteo absoluto de neutrófilos y plaquetas, antes del tratamiento con rHuEPO, a los 30 días, a las 40 semanas de EG, y al mes de finalizado el tratamiento. Adicionalmente se determinó la proporción de eventos adversos (EAs), según tipo, frecuencia, intensidad, gravedad y relación causal.
Para el cálculo de tamaño de muestra se consideró de interés clínico la reducción absoluta de más del 20 % respecto a valores reportados de la variable principal en pacientes que no reciben tratamiento. Se dispuso una prueba estadística bilateral, error tipo I de 0,05 y potencia del 90 %, que definió necesario a incluir 72 neonatos. El análisis estadístico fue por intención de tratamiento y por protocolo. Se diseñó a priori un análisis univariado y múltiple para evaluar factores que influyen en la necesidad de transfusiones (peso, edad posnatal, edad gestacional, sexo, valoración nutricional comorbilidad, oxigenación, valor inicial de hemoglobina, transfusiones previas, dosis de rHuEPO y cumplimiento de tratamiento).
RESULTADOS
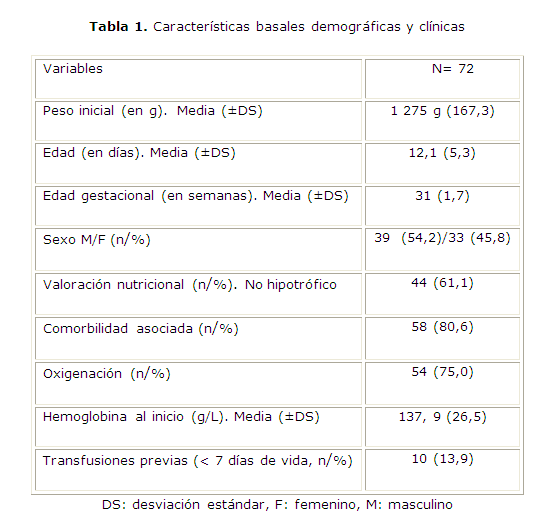
Entre octubre de 2009 y octubre de 2010 se incluyeron 72 pacientes de 6 hospitales maternos, según el tamaño muestral previsto. Las características basales demográficas y clínicas se corresponden con los criterios de selección (tabla 1), con un predominio ligero de masculinos sobre femeninos. Los prematuros no hipotróficos estuvieron en porcentaje mayoritario, igualmente los pacientes con varias comorbilidades asociadas, y fueron las más representativas: sepsis, depresión al nacer, membrana hialina y hemorragia ventricular. Más de la mitad de los pacientes recibió oxigenoterapia. En cuanto a las cifras de hemoglobina basales, los neonatos incluidos manifestaron cifras afines con la edad gestacional y peso de recién nacido pretérmino de MBP, y 10 de ellos recibieron transfusiones precoces, antes de la inclusión en el estudio.
Todos los pacientes se expusieron al tratamiento con rHuEPO durante un tiempo que osciló entre 26 y 77 días, y el tiempo medio de tratamiento fue 47 días (DS de 11). Los neonatos recibieron en promedio 21 dosis, mínimo 12 y máximo 33. La dosis de rHuEPO administrada estuvo en un rango entre 316,2 U y 649,2 U, con una media de 502 U (DS de 74 U). A todos los neonatos se les administró la dosis indicada de 300 U/kg. El tratamiento, según esquema completo (suplementos y frecuencia de administración además de las dosis), se cumplió estrictamente en 65 pacientes (90,3 %). Se reportaron 6 interrupciones (8,3 %) durante el estudio, 5 por abandono voluntario después que los pacientes egresaron del hospital (con peso de 2 500 g y 40 semanas de EG), y 1 paciente por sepsis grave y fallecimiento.
Del total de pacientes tratados, solo se transfundieron 7 pacientes (9,7 %); IC 95 %: 2,2 a 17,3; (p< 0,001), lo que confirmó la hipótesis planteada. No requirieron transfusión durante el tratamiento 65 pacientes (90,3 %). En los 7 pacientes transfundidos, 4 recibieron solo 1 transfusión (5,6 %), mientras que los otros 3 requirieron 3, 4 y 8 transfusiones, respectivamente (1,4 %). En 2 de estos pacientes existían referencias de transfusiones previas a la inclusión en el estudio. El volumen total de eritrocitos que recibieron los pacientes transfundidos osciló entre 10 y 120 mL, en promedio 39,9 mL (IC 95 %: -0,05 a 7,9 mL).
En cuanto a la evolución de los parámetros hematológicos, los valores de hemoglobina, hematócrito y ferritina disminuyeron significativamente en el tiempo, con respecto a los valores iniciales; sin embargo, al final del estudio y aun en el seguimiento, el promedio de la hemoglobina y hematócrito se mantuvo por encima de 100 g/L y 33 %, respectivamente (tabla 2). Por el contrario, los reticulocitos mostraron un incremento significativo y se mantuvieron sin variaciones los valores de hierro sérico y el índice de saturación de transferrina.
Al analizar la relación de cada variable de control con la respuesta, se observó que los pacientes del sexo masculino, estado nutricional hipotrófico y con hemoglobina basal mayor, se asociaron significativamente a los prematuros no transfundidos. Igualmente, el cumplimiento del tratamiento influyó en los requerimientos transfusionales, a pesar de que los pacientes no transfundidos recibieron un promedio de dosis de rHuEPO significativamente menor (tabla 3). El análisis conjunto de todas las variables mostró que la probabilidad de no ser transfundido aumenta con el cumplimiento del tratamiento, y esto es así independientemente del resto de las variables estudiadas (OR de 45; IC 95 % 2,3 a 907,7; p= 0,013). Ningún otro factor evidenció influencia en la probabilidad de no ser transfundido.
Se reportaron 36 eventos adversos en 18 pacientes de los 72 incluidos (25,0 %). Los eventos adversos notificados con mayor frecuencia fueron: infección respiratoria alta, intertrigo moniliásico y sepsis tardía, así como reflujo gastroesofágico (tabla 4). En cuanto al grado de intensidad predominaron los eventos moderados y leves, y en mínima frecuencia, se presentaron los eventos severos. Dentro de los eventos graves, según la consecuencia para el paciente, se notificaron: 1 retinopatía del prematuro (ROP), 1 neumotórax a tensión, 1 displasia broncopulmonar y 1 sepsis tardía por Candida albicans. La displasia pulmonar coincidió en el mismo paciente que presentó una sepsis muy severa, que falleció por esta causa. De todos los EAs reportados en el estudio, solo un evento se clasificó con causalidad posible con rHuEPO (2,8 %): la ROP, de intensidad ligera y total recuperación.
DISCUSIÓN
El presente trabajo reporta el primer ensayo clínico de uso de rHuEPO en la AP en Cuba. Los hallazgos descritos confirman que la administración de rHuEPO después de la primera semana de vida, en combinación con suplemento de hierro, reduce significativamente los requerimientos transfusionales en el recién nacido MBP, resultado comparable con los publicados en ensayos clínicos controlados en condiciones similares.6,19
A pesar del efecto conocido de la rHuEPO en el incremento de las cifras de hemoglobina y hematócrito, en este estudio disminuyeron significativamente; no obstante, se mantuvieron por encima de los esperados para la edad y peso de este tipo de prematuro de MBP. Este comportamiento sugiere que el uso de rHuEPO en la prevención de la AP, sostiene valores superiores a los considerados como criterio transfusional, aunque no acontezca un aumento de la respuesta hematológica per se. Una explicación a este resultado pudiera ser la influencia de la propia inmadurez del paciente pretérmino y las enfermedades graves asociadas, que obligan a la práctica de múltiples extracciones de sangre, al menos en las 2 primeras semanas de vida, lo cual induce una anemia de tipo hemorrágica.12 En nuestra investigación prevalecieron los pacientes prematuros no hipotróficos, con comorbilidades asociadas, expuestos a oxigenación. Probablemente el número de flebotomías y el volumen de las extracciones influyeron en dicha respuesta hematológica, a pesar del uso de rHuEPO.
Otros factores fisiopatológicos reconocidos en la literatura, también pudieron contribuir a la respuesta hematológica limitada a rHuEPO, como es la restricción de la vida del hematíe del neonato, el acelerado crecimiento pondo-estatural y los niveles bajos de eritropoyetina endógena, aun en condiciones de hipoxia, lo que provoca una anemia de aparición tardía, la anemia hiporregenerativa.2,20
Ciertamente, el uso de rHuEPO en el recién nacido pretérmino tiene un papel significativo en la prevención de la transfusión sanguínea, y su rol en la respuesta hematológica en este tipo de paciente, aunque más conservador, asegura niveles adecuados de hemoglobina y hematócrito, no solo en cantidad, sino también en calidad del eritrocito, dado por un incremento significativo del conteo de reticulocitos, indicador de una eritropoyesis activa.
Otros parámetros del metabolismo del hierro tuvieron un comportamiento variable: la ferritina descendió significativamente, mientras que el hierro sérico y el índice de saturación de transferrina no mostraron variación, hallazgos que indican la existencia de una disminución del hierro de depósito (ferritina), sin afectación del hierro funcional (hierro sérico y transferrina). Si bien no todos los trabajos publicados describen una disminución de la ferritina, probablemente en nuestras condiciones experimentales influyó el momento de inicio del tratamiento de la rHuEPO y el suplemento de hierro y vitaminas (administración tardía).
Asimismo se comprobó que el cumplimiento estricto del plan terapéutico devino éxito en la respuesta. Pudiera ser contradictorio que en esta serie los pacientes respondedores recibieron una dosis promedio menor que los transfundidos, pero coincidieron con pacientes con una mayor EG a la inclusión, por tanto, arribaron más rápido a las 40 semanas, y el tiempo de exposición a la rHuEPO estuvo planificado justamente a este momento.
En cuanto al perfil de seguridad, se confirmó que la administración concurrente de rHuEPO y el hierro es muy bien tolerada, lo que posibilitó el cumplimiento del tratamiento en dosis y esquema planificado. Este resultado concuerda con las referencias de uso de este fármaco en la AP.19,21 Solamente se identificó como evento relacionado una ROP, notificado en una paciente de 29 semanas de EG, segundo gemelar, con peso al nacer de 1 300 g, edad posnatal a la inclusión de 16 días, que recibió dos transfusiones previas a su inclusión y una durante el estudio; además, se mantuvo con ventilación mecánica y oxigenoterapia durante 16 días. Su hermana gemela, con iguales condiciones al nacimiento, no estuvo expuesta a ventilación, ni oxigenoterapia, tampoco a transfusiones previas. Todas estas comorbilidades e intervenciones médicas, más allá de la exposición a la rHuEPO, pudieron favorecer la aparición de ROP. Varios metanálisis publicados describen que el uso tardío de la rHuEPO, a diferencia del uso precoz, no modifica la aparición de eventos adversos comunes en estos neonatos, incluidos la muerte y la ROP; del mismo modo, nuestros hallazgos son compatibles con esta afirmación.19
Una de las limitaciones de este estudio fue no tener un grupo control concurrente, que permitiera evaluar con mayor rigor la validez de los datos. No obstante, la realización de un estudio clínico prospectivo y multicéntrico, con monitoreo de todas las posibles variables de control, soportan un nivel de evidencia superior a la de estudios observacionales. Adicionalmente, consideramos que una investigación sobre las implicaciones de uso de rHuEPO en el neurodesarrollo y su relación costo efectividad podrá contribuir a un uso razonable como parte de la prevención y tratamiento de la AP en nuestras condiciones. Actualmente se propone un ensayo de extensión que incluya estas variables.
REFERENCIAS BIBLIOGRÁFICAS
1. Plaisant F. Evolution of neonatal transfusion practices: current recommendations. Transfus Clin Biol. 2011;18:262-8.
2. Kotto-Kome AC, Garcia MG, Calhoun DA, Christensen RD. Effect of beginning recombinant erythropoietin treatment within the first week of life, among very-low-birth-weight neonates, on "early" and "ate" erythrocyte transfusions: a meta-analysis. J Perinatol. 2004;24:24-9.
3. Niederhauser C, Candotti D, Weingand T, Maier A, Tinguely C, Stolz M, et al. Reverse vertical transmission of hepatitis B virus (HBV) infection from a transfusion-infected newborn to her mother. J Hepatol. 2012;56:734-7.
4. Alarcon Allen A, Baquero-Artigao F. Review and guidelines on the prevention, diagnosis and treatment of post-natal cytomegalovirus infection. An Pediatr (Barc). 2011;74:52 e1-e13.
5. Fanaro S. Blood transfusion in infants: techniques and adverse events. J Matern Fetal Neonatal Med. 2011;24 Suppl 1:47-9.
6. Vazquez Lopez MA, Llamas MA, Galera R, Sanchez AR, Lendinez F, Gonzalez-Ripoll M, et al. Comparison between one and three doses a week of recombinant erythropoietin in very low birth weight infants. J Perinatol. 2011;31:118-24.
7. Tempera A, Stival E, Piastra M, De Luca D, Ottaviano C, Tramontozzi P, et al. Early erythropoietin influences both transfusion and ventilation need in very low birth weight infants. J Matern Fetal Neonatal Med. 2011;24:1060-4.
8. Fortes Filho JB, Eckert GU, Procianoy L, Barros CK, Procianoy RS. Incidence and risk factors for retinopathy of prematurity in very low and in extremely low birth weight infants in a unit-based approach in southern Brazil. Eye (Lond). 2009;23:25-30.
9. Schneider JK, Gardner DK, Cordero L. Use of recombinant human erythropoietin and risk of severe retinopathy in extremely low-birth-weight infants. Pharmacotherapy. 2008;28:1335-40.
10. Ohlsson A, Aher SM. Early erythropoietin for preventing red blood cell transfusion in preterm and/or low birth weight infants. Cochrane Database Syst Rev. 2006:CD004863.
11. Brown MS, Baron AE, France EK, Hamman RF. Association between higher cumulative doses of recombinant erythropoietin and risk for retinopathy of prematurity. J AAPOS. 2006;10:143-9.
12. Von Kohorn I, Ehrenkranz RA. Anemia in the preterm infant: erythropoietin versus erythrocyte transfusion—it's not that simple. Clin Perinatol. 2009;36:111-23.
13. Bishara N, Ohls RK. Current controversies in the management of the anemia of prematurity. Semin Perinatol. 2009;33:29-34.
14. Mainie P. Is there a role for erythropoietin in neonatal medicine? Early Hum Dev. 2008;84:525-32.
15. Strauss RG. Controversies in the management of the anemia of prematurity using single-donor red blood cell transfusions and/or recombinant human erythropoietin. Transfus Med Rev. 2006;20:34-44.
16. Strauss RG. 2008 Emily Cooley Memorial Lecture: lessons learned from pediatric transfusion medicine clinical trials . . . a little child shall lead them. Transfusion. 2009;49:1996-2004.
17. Colectivo de Autores. Pediatría. VII ed. La Habana: Editorial Ciencias Médicas; 2006. p. 434-5.
18. Sola A ¿Qué sabemos en la actualidad de EPO para la anemia de la prematurez? En: Diálogos en Neonatología: aprendiendo de las preguntas. Buenos Aires: Edimed; 2009. p. 166.
19. Aher S, Ohlsson A. Late erythropoietin for preventing red blood cell transfusion in preterm and/or low birth weight infants. Cochrane Database Syst Rev. 2006:CD004868.
20. Carbonell-Estrany X, Figueras-Aloy J, Alvarez E. Erythropoietin and prematurity—where do we stand? J Perinat Med. 2005;33:277-86.
21. Aher SM, Ohlsson A. Early versus late erythropoietin for preventing red blood cell transfusion in preterm and/or low birth weight infants. Cochrane Database Syst Rev. 2006:CD004865.
Recibido: 17 de septiembre de 2012.
Aprobado: 17 de noviembre de 2012.
Anett Sijó Yero. Hospital Ginecobstétrico de 10 de Octubre. Nuestra Señora de Regla # 52, entre Remedios y Quiroga, Luyanó, municipio 10 de Octubre. La Habana, Cuba. Correo electrónico: anettsijo@infomed.sld.cu