Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr vol.87 no.4 Ciudad de la Habana oct.-dic. 2015
Rev Cubana Pediatr. 2015;87(4)
ARTÍCULO ORIGINAL
Factores asociados a daño renal permanente en niños con primera infección febril del tracto urinario
Factors associated to permanent renal damage in children with first febrile urinary tract infection
MSc. Magalys Martínez Silva, Dra.C. María Caridad Duarte Pérez, MSc. Ana Guillén Dosal, MSc. Esther Cristina Acosta Moya
Servicio de Nefrología. Hospital Pediátrico Docente “Juan Manuel Márquez”. La Habana, Cuba.
RESUMEN
Introducción: los pacientes con infección del tracto urinario febril pueden desarrollar daño renal permanente y complicaciones futuras.
Objetivo: determinar los factores asociados a daño renal permanente en pacientes con primera infección febril del tracto urinario.
Métodos: estudio prospectivo y longitudinal en 235 pacientes pediátricos ingresados con primera infección febril del tracto urinario, en el período de mayo de 2007 a diciembre de 2011. Las variables estudiadas fueron: edad, sexo, duración e intensidad de la fiebre, conteo global de leucocitos sanguíneos, velocidad de sedimentación globular, proteína C reactiva, ultrasonido renal y vesical, reflujo vesicoureteral, agente etiológico, gammagrafía renal con Tc99m DMSA en fase aguda y evolutiva. Se analizó la asociación entre el daño renal permanente y las variables antes expuestas.
Resultados: de los 125 pacientes con alteraciones gammagráficas en la fase aguda de la infección, 50 mostraron hallazgos compatibles con daño renal permanente, constatados en gammagrafía evolutiva, lo que representa el 21,3 % de los pacientes estudiados y el 40 % de los casos con pielonefritis aguda, 40 fueron menores de 1 año. No se demostró asociación estadísticamente significativa con la edad, el sexo, y la duración e intensidad de la fiebre. Se encontró asociación muy significativa (p= 0,009) entre leucocitosis superior a 15 000/mL y daño renal permanente. El reflujo vesicoureteral se constató en el 65,6 %, y el riesgo de presentar daño renal permanente fue mayor en aquellos en los cuales se aisló un microorganismo diferente de E. coli.
Conclusiones: la leucocitosis ≥ 15 000/mL, el reflujo vesicoureteral y la infección por un microorganismo diferente de E. coli, se asocian de forma independiente con la presencia de cicatrices renales al aplicar la regresión logística.
Palabras clave: infección del tracto urinario, daño renal permanente, factores asociados.
ABSTRACT
Introduction: the patients with febrile urinary tract infection may develop permanent renal damage and face future complications.
Objective: to determine the factors associated to permanent renal damage in patients with first febrile urinary tract infection
Methods: prospective longitudinal study of 235 pediatric patients admitted to hospital with first febrile urinary tract infection in the period of May 2007 through December 2011. The study variables were age, sex, duration and intensity of fever, global blood leukocyte count, globular sedimentation velocity, C-reactive protein, renal and vessical ultrasound, vesicoureteral reflux, etiological agent, DMSA Tc99m renal scintigraphy at acute and evolutionary stage. The association of permanent renal damage and the study variables was analyzed.
Results: of 125 patients with scintigraphic alterations at acute phase of infection, 50 showed findings compatible with permanent renal damage and confirmed in the evolutionary scintigraphy, which accounted for 21.3 % of studied patients and 40 % of cases with acute pyelonephritis; 40 were younger than one year-old. No statistical significant association of this disease with age, sex, duration and intensity of fever was confirmed. Leukocyte count over 15 000/mL and permanent renal damage were significantly associated (p= 0,009). Vesicoureteral reflux was present in 65.6 % of cases and the risk of permanent renal damage was greater in those patients in whom a microorganism other than E.coli was isolated.
Conclusions: leukocyte count of 15 000/mL or higher, vesicoureteral reflux and infection caused by microorganisms other than E.coli are independently associated with the presence of renal scarring when applying the logistic regression.
Keywords: urinary tract infection, permanent renal damage, associated factors.
INTRODUCCIÓN
La pielonefritis aguda (PNA) constituye la infección bacteriana más frecuente en la infancia. Puede causar daño renal permanente (DRP), y este, a largo plazo, asociarse con complicaciones como la hipertensión arterial, la detención del crecimiento renal y la insuficiencia renal crónica.1-4
El DRP es el resultado de interacciones complejas entre factores del hospedero y factores externos, entre ellos se encuentra la edad de presentación, las infecciones recurrentes, la intensidad de la fiebre, el retraso en el tratamiento, la presencia de reflujo vesicoureteral (RVU), los índices de inflamación como el conteo de leucocitos sanguíneos, la velocidad de sedimentación globular (VSG) y los niveles de proteína C reactiva (PCR), así como también la virulencia de la bacteria, la inmunidad del hospedero y la susceptibilidad genética.1,3,5-7
La producción de factores inflamatorios, incluyendo citoquinas como el factor transformante del crecimiento-β (TGF-β) y el óxido nítrico, desencadenan una respuesta inflamatoria con aumento de la permeabilidad vascular y migración de neutrófilos, los cuales resuelven la infección, pero, al mismo tiempo, son también responsables de la formación de las cicatrices renales.8-10 La fibrogénesis renal comienza por la infiltración de células mononucleares y fibroblastos en el intersticio, seguida por una fase de señal fibrogénica, en la cual son liberados factores de crecimiento y citoquinas por las células residentes renales.
El TGF-β ha sido considerado como el mayor factor promotor de la fibrosis. El uso de la gammagrafía renal con Tc99m DMSA dio la posibilidad de documentar la extensión y progresión a DRP. Kim y Canning11 consideran que la primera meta en la evaluación de niños con historia de infección del tracto urinario (ITU) es prevenir el DRP, que las anomalías congénitas renales están presentes en algunos fetos con reflujo sin historia de infección, que la mayoría del DRP asociado al reflujo es congénito y no adquirido, aunque algún daño es el resultado de una respuesta inflamatoria a una ITU. Esto nos motivó a determinar los factores asociados al DRP en pacientes con primera infección febril del tracto urinario.
MÉTODOS
Se realizó un estudio prospectivo y longitudinal, cuyo universo estuvo constituido por la totalidad de los pacientes que ingresaron en el servicio de Nefrología del Hospital Pediátrico “Juan Manuel Márquez” con diagnóstico de primera ITU febril, de mayo de 2007 a diciembre de 2011, los cuales se siguieron en la consulta externa de Nefrología por un período de 1 a 5 años. La muestra quedó constituida por 235 pacientes, al no quedar excluido ninguno.
Las variables de estudio fueron las siguientes: edad, sexo y duración de la fiebre. Según el tiempo que permanece el niño con esta antes del diagnóstico y tratamiento, se clasificó en < 72 h y ≥ 72 h, así como la intensidad < 39 °C y ≥ 39 °C. Se consideraron los valores del conteo global de leucocitos sanguíneos en < 15 000/mL y ≥ 15 000/mL, VSG (< 30 mm/h y ≥ 30 mm/h), y PCR (< 20 mg/dL y ≥ 20 mg/dL).
El US renal y vesical, se consideró positivo si existió: dilatación pielocalicial (diámetro antero-posterior de la pelvis renal mayor de 5 mm), doble sistema excretor, dilatación del uréter, alteraciones vesicales, RVU, agente etiológico, y primera y segunda gammagrafía renal. Se consideró DRP a las alteraciones morfológicas y funcionales que son irreversibles, y pueden expresarse en la gammagrafía renal con Tc99m DMSA evolutiva por defectos de captación corticales, o en los contornos laterales, por la presencia de adelgazamiento cortical o disminución del volumen renal.
Las muestras de orina para urocultivo fueron tomadas por chorro medio o punción vesical suprapúbica. A estos pacientes se les realizó US renal y vesical durante el ingreso. En los primeros 7 días del diagnóstico se evaluaron con gammagrafía renal con Tc99m DMSA. La gammagrafía se catalogó como anormal cuando se encontraron una o más áreas de hipocaptación cortical del trazador, disminución difusa de la captación, alteraciones del tamaño renal o función renal relativa (FRR) ≤ 43 %. La uretrocistografía miccional (UCGM) se realizó después de la fase aguda, y se informó como normal, o presencia de RVU de diferentes grados (según clasificación internacional). A los pacientes con alteraciones gammagráficas en la fase aguda de la infección se les repitió el estudio 6 a 9 meses después de la ITU.
La investigación fue avalada por el Comité de Ética Médica para las Investigaciones del Hospital Pediátrico Docente “Juan Manuel Márquez”. Se tuvo en cuenta el consentimiento informado de los padres o tutores de los pacientes que participaron en el estudio. Para la asociación entre variables cualitativas se utilizó la prueba de X2 y el test exacto de Fisher, y para las cuantitativas continuas se utilizó la prueba t de Student. El modelo de regresión logística dicotómica sirvió de soporte para verificar la influencia de las variables predictoras. Se empleó el nivel de significación p< 0,05.
RESULTADOS
Se estudiaron 235 pacientes, de ellos 170 del sexo femenino (72,3 %) y 65 varones (27,7 %), comprendidos 191 en el grupo de edad de los menores de 1 año (81,3 %), 41 estuvieron entre 1 y 5 años (17,4 %) y solo 3 pacientes fueron mayores de 5 años (1,3 %).
Cuando se identificaron, a partir de los cultivos de orina, a los microorganismos causales de infección, se observó que E. coli se aisló en la mayoría de los casos (87,6 %). Klebsiella spp., Proteus spp. y Enterobacter spp. le siguieron en ese mismo orden en cuanto a la frecuencia, mientras que Pseudomona spp., Acinetobacter spp., Citrobacter spp. y Serratia spp. se aislaron en 1 caso cada una.
La UCGM mostró que 46 pacientes (19,6 %) presentaron RVU primario y 2 valvas de uretra posterior y reflujo secundario, los cuales se excluyeron del análisis estadístico por presentar malformación urológica. De los casos con RVU primario, en 24 el reflujo fue de bajo grado (grados I, II y III), y 22 con reflujo de alto grado (grados IV y V). Del total de los casos estudiados, 125 presentaron alteraciones gammagráficas en la fase aguda de la infección (pielonefritis), lo que representa el 53,2 %, a los cuales se les repitió el estudio de 6 a 9 meses después del insulto inicial.
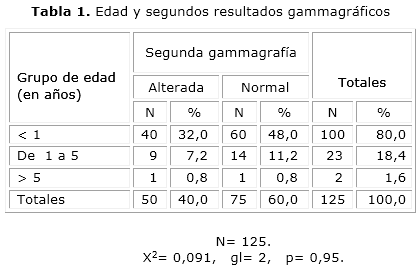
Del total, 50 mostraron hallazgos compatibles con DRP, lo que representa el 21,3 % de todos los pacientes estudiados y el 40 % de los casos con PNA (Fig.). La FRR menor o igual a 43 % estuvo presente en 50 de los casos iníciales, y se mantuvo en 38 de los que desarrollaron cicatrices renales. De los casos con DRP, 40 fueron menores de 1 año (tabla 1), 9 estuvieron comprendidos entre 1 y 5 años, y solo 1 fue mayor de 5 años.
Cuando se realizó análisis estadístico para verificar la relación de la edad con los resultados gammagráficos, no se encontró relación significativa (p= 0,95), y lo mismo sucedió con el sexo (p= 0,055). Al relacionar la duración e intensidad de la fiebre con la presencia de cicatrices renales no se demostró tampoco asociación estadísticamente significativa.
El análisis de las variables de laboratorio dicotomizadas mostró una asociación muy significativa (p= 0,009) entre el conteo global de leucocitos sanguíneos superior a 15 000/mL y la presencia de DRP, no sucediendo lo mismo con la VSG y la PCR. Al realizar el análisis de las variables (duración e intensidad de la fiebre, conteo global de leucocitos sanguíneos, VSG y PCR sérica), como cuantitativas por comparación de medias y al aplicar el test de Student, solo mostraron significación estadística la VSG y la PCR.
Las variables imaginológicas investigadas fueron el resultado del US renal y vesical, y la presencia de RVU en la UCGM. Ambas mostraron una fuerte asociación con la presencia de cicatrices renales en el estudio univariado. De los 50 pacientes con DRP, el 65,6 % tenía reflujo. Otro aspecto importante asociado con la presencia de DRP, lo constituyó la presencia de infección con un microorganismo diferente de E. coli, y en estos casos el riesgo de presentar un DRP, fue más de 46 veces superior (tabla 2).
Como puede apreciarse en la tabla 3, al aplicar la regresión logística, solo el conteo global de leucocitos sanguíneos ≥ 15 000/mL, la presencia de RVU (UCGM positiva) y la infección por un microorganismo diferente de E. coli, se asociaron de forma independiente con la presencia de cicatrices renales.
DISCUSIÓN
En la investigación actual más del 80 % de los casos fueron menores de 1 año, lo cual coincide con los reportes previos, en los que las ITU febriles tienen su mayor incidencia en el primer año de vida en ambos sexos.8,12 De ellos, el porcentaje de pacientes que desarrolló un DRP fue de 21,3 %, y representó el 40 % de aquellos con PNA. Se ha señalado que el DRP se presenta en el 50 % de los niños diagnosticados con PNA;1 sin embargo, Donoso y otros13 reportan un porcentaje más bajo (39 %), más cercano al obtenido en el presente estudio.
No se encontraron asociaciones estadísticamente significativas entre la edad, el género y la presencia de alteraciones en la segunda gammagrafía, sugestiva de DRP. Resultado similar reporta Oh y otros.14 Tampoco se encontró relación entre la duración e intensidad de la fiebre y la presencia de DRP; estos resultados son congruentes con lo reportado por Doganis y otros,15 quienes concluyen que el tratamiento apropiado y precoz de la infección disminuye la probabilidad de afectación renal en la fase aguda, pero no previene la formación de cicatrices renales, resultados similares encontraron Lee y otros.16
Oh y otros,14 en Corea del Sur, muestran que el retraso en la terapéutica fue un factor predictivo importante para la formación de cicatrices renales. Consideran que la reacción inflamatoria aguda y los metabolitos tóxicos liberados de los leucocitos polimorfonucleares infiltrantes, parecen dañar el tejido renal, y que la duración de esta reacción puede determinar la severidad y la extensión de las lesiones. En el Hospital “William Soler”, de La Habana, un grupo de investigadores estudiaron este tema, y no se comprobó relación entre el inicio de los síntomas, el comienzo de la terapéutica y la lesión cortical.17
Para el DRP, la leucocitosis superior a 15 000/mL se comportó como un predictor, los valores promedios de la PCR y la VSG fueron superiores en los casos con cicatrices renales, pero solo se demostró asociación al aplicar pruebas de comparación de medias. Yildiz y otros18 señalan que los niveles de PCR de alta sensibilidad constituyen un marcador para la progresión de la inflamación a la cronicidad.
La E. coli se asoció, en el presente estudio, con un incremento del riesgo de cicatrices renales. Resultados similares también se han reportado por otros autores.9,10 El RVU, constituyó otro factor asociado con la presencia de DRP en el análisis multivariado. Es considerado un factor de riesgo para el desarrollo de DRP, y estuvo presente entre el 20 al 40 % de los casos estudiados con primera ITU.16,19-26
Sin embargo, existen autores que no han encontrado una fuerte asociación. Taskinen y Ronnholm27 revelaron que las cicatrices renales siguiendo la pielonefritis, en la mayoría de los casos no están asociadas con RVU, y que son causadas por la infección. Las alteraciones detectadas por el US renal se asociaron con la presencia de alteraciones gammagráficas representativas de DRP en el análisis univariado, pero no en el multivariado. Varios autores señalan que el US presenta baja sensibilidad para detectar cicatrices renales.4,28 En el presente estudio en el análisis estadístico univariado fueron predictores de DRP la leucocitosis superior a 15 000/mL, los valores elevados de VSG y PCR, el RVU, el aislamiento microbiológico diferente a E. coli y la presencia de alteraciones ultrasonográficas. En el análisis multivariado solo la leucocitosis superior a 15 000/mL, la presencia de RVU y la infección por un microorganismo diferente a E. coli podían predecir de forma independiente la presencia de DRP.
Se concluye que los pacientes con primera ITU febril, infectados por un microorganismo diferente a la E. coli, que presentan leucocitosis y RVU, tienen alto riesgo de DRP, por lo que se recomienda deben ser evaluados 6 meses después de la infección con gammagrafía renal.
REFERENCIAS BIBLIOGRÁFICAS
1. Koyle MA, Elder JS, Skoog SJ, Mattoo TK, Pohl HG, Reddy PP, et al. Febrile urinary tract infection, vesicoureteral reflux, and renal scarring: current controversies in approach to evaluation. Pediatr Surg Int. 2011 Apr;27(4):337-46.
2. De la Cruz PJ. Infección del riñón y de las vías urinarias. En: Gordillo Paniagua G, Exeni AR, De la Cruz J, editores. Nefrología Pediátrica. 2da ed. Madrid: Elsevier; 2003. p. 329-56.
3. Park YS. Renal scar formation after urinary tract infection in children. Korean J Pediatr. 2012 Oct;55(10):367-70.
4. Marks SD, Gordon I, Tullus K. Imaging in childhood urinary tract infections: time to reduce investigations. Pediatr Nephrol. 2008 Jan;23(1):9-17.
5. Faust WC, Diaz M, Pohl HG. Incidence of post-pyelonephritic renal scarring: a meta-analysis of the dimercapto-succinic acid literature. J Urol. 2009 Jan;181(1):290-7.
6. Peters C, Rushton HG. Vesicoureteral reflux associated renal damage: congenital reflux nephropathy and acquired renal scarring. J Urol. 2010;184(1):265-73.
7. Slabbaert K, Bogaert G. Vesicoureteric reflux (VUR) in children: where are we now? Arch Esp Urol. 2012 May;65(4):450-8.
8. Montini G, Tullus K, Hewitt I. Febrile urinary tract infections in children. N Engl J Med. 2011 Jul 21;365(3):239-50.
9. Montini G, Rigon L, Zucchetta P, Fregonese F, Toffolo A, Gobber D, et al. Prophylaxis after first febrile urinary tract infection in children? A multicenter, randomized, controlled non inferiority trial. Pediatrics. 2008 Nov;122(5):1064-71.
10. Montini G, Hewitt I. Urinary tract infections: to prophylaxis or not to prophylaxis? Pediatr Nephrol. 2009 Sep;24(9):1605-9.
11. Kim SS, Canning DA. Is there a relationship between urinary tract infection, vesicoureteral reflux and renal damage in children? Nature Clinical Practice Urology. 2008;5(5):240-1.
12. Garin EH, Olavarria F, Garcia Nieto V, Valenciano B, Campos A, Young L. Clinical significance of primary vesicoureteral reflux and urinary antibiotic prophylaxis after acute pyelonephritis: a multicenter, randomized, controlled study. Pediatrics. 2006 Mar;117(3):626-32.
13. Donoso RG, Lobo SG, Arnello VF, Arteaga VM, Coll CC, Hevia JP, et al. Renal scars after one year of follow up in children with a first episode of acute pyelonephritis. Rev Med Chil. 2006 Mar;134(3):305-11.
14. Oh MM, Cheon J, Kang SH, Park HS, Lee JG, Moon du G. Predictive factors for acute renal cortical scintigraphic lesion and ultimate scar formation in children with first febrile urinary tract infection. J Urol. 2010 Mar;183(3):1146-50.
15. Doganis D, Siafas K, Mavrikou M, Issaris G, Martirosova A, Perperidis G, et al. Does early treatment of urinary tract infection prevent renal damage? Pediatrics. 2007 Oct;120(4):e922-8.
16. Lee YJ, Lee JH, Park YS. Risk factors for renal scar formation in infants with first episode of acute pyelonephritis: a prospective clinical study. J Urol. 2012 Mar;187(3):1032-6.
17. Amaya Sorto TA, Durán Álvarez S, Valdés Mesa M, Hernández Hernández JS, Peña Quian Y. Daño renal cortical en niños con primera infección del tracto urinario alto. Rev Cubana Pediatr. 2012;84(1):58-66.
18. Yildiz B, Poyraz H, Cetin N, Kural N, Colak O. High sensitive C-reactive protein: a new marker for urinary tract infection, VUR and renal scar. Eur Rev Med Pharmcol Sci. 2013;17:2598-604.
19. Preda I, Jodal U, Sixt R, Stokland E, Hansson S. Imaging strategy for infants with urinary tract infection: a new algorithm. J Urol. 2011 Mar;185(3):1046-52.
20. Andersson l, Preda I, Hahn-Zoric M, Hanson LA, Jodal U, Sixt R, et al. Urinary proteins in children with urinary tract infection. Pediatr Nephrol. 2009;24:1533-8.
21. Saadeh SA, Mattoo TK. Managing urinary tract infections. Pediatr Nephrol. 2011 Nov;26(11):1967-76.
22. Preda I, Jodal U, Sixt R, Stokland E, Hansson S. Normal dimercaptosuccinic acid scintigraphy makes voiding cystourethrography unnecessary after urinary tract infection. J Pediatr. 2007 Dec;151(6):581-4.
23. Ismaili K, Lolin K, Damry N, Alexander M, Lepage P, Hall M. Febrile urinary tract infections in 0- to 3-month-old infants: a prospective follow-up study. J Pediatr. 2011 Jan;158(1):91-4.
24. Sorkhi H, Nooreddini HG, Amiri M, Osia S, Farhadi-Niakee S. Prediction of vesicoureteral reflux in children with first urinary tract infection by dimercaptosuccinic Acid and ultrasonography. Iran J Pediatr. 2012 Mar;22(1):57-62.
25. Mahyar A, Ayazi P, Tarlan S, Moshiri A, Hamidfar M, Barikani A. When is the best time for voiding cystourethrogram in urinary tract infection of children? Acta Med Iran. 2012;50(7):468-72.
26. Fouzas S, Krikelli E, Vassilakos P, Gkentzi D, Papanastasiou DA, Salakos C. DMSA scan for revealing vesicoureteral reflux in young children with urinary tract infection. Pediatrics. 2010 Sep;126(3):e513-9.
27. Taskinen S, Ronnholm K. Post-pyelonephritic renal scars are not associated with vesicoureteral reflux in children. J Urol. 2005 Apr;173(4):1345-8.
28. Merguerian PA, Sverrisson EF, Herz DB, McQuiston LT. Urinary Tract Infections in Children: Recommendations for Antibiotic Prophylaxis and Evaluation. An Evidence-Based Approach. Curr Urol Rep. 2010;11:98-108.
Recibido: 26 de febrero de 2015.
Aprobado: 20 de abril de 2015.
Magalys Martínez Silva. Hospital Pediátrico Universitario “Juan Manuel Márquez”. Avenida 31 y calle 76, municipio Marianao. La Habana, Cuba. Correo electrónico: masilva@infomed.sld.cu