Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr vol.90 no.1 Ciudad de la Habana ene.-mar. 2018
PRESENTACIÓN DE CASO
Ictus isquémico masivo secundario a miocarditis viral en un niño
Massive ischemic stroke secondary to viral myocarditis in a child
José Miguel Suescún-Vargas,I Lina María Saza-Mejía,II Adriana Sofía Morales-Cárdenas,III Rocío del Pilar Pereira-OspinaIV
IInstituto Roosevelt. Escuela de Medicina y Ciencias de la Salud. Universidad del Rosario. Bogotá, Colombia.
IIEscuela de Medicina y Ciencias de la Salud. Universidad del Rosario. Bogotá, Colombia.
IIIFacultad de Medicina. Pontificia Universidad Javeriana. Bogotá, Colombia.
IVInstituto Roosevelt. Bogotá, Colombia.
RESUMEN
Introducción: los accidentes cerebrovasculares son raros en niños, y generalmente se asocian a trombofilias; sin embargo, se deben considerar procesos infecciosos de tipo miocarditis infecciosa que pudieran conducir a formación de trombos.
Presentación del caso: se presenta el caso de un niño de 13 meses de edad, previamente sano, con evidencia de accidente cerebrovascular isquémico extenso, que comprometió ambos hemisferios cerebrales, con antecedente de infección gastrointestinal que podría sugerir sepsis y miocarditis secundaria a esta, que contribuye a un evento trombótico, el cual, probablemente, desencadenó el proceso cerebrovascular descrito.
Conclusiones: las infecciones, aunque se han relacionado como la tercera causa de eventos cerebrovasculares, se deben tener en cuenta para así instaurar tratamiento antibiótico oportuno, y con esto, evitar secuelas.
Palabras clave: evento cerebrovascular; evento isquémico; infección; miocarditis; niño.
ABSTRACT
Introduction: cerebrovascular accidents are rare in children, and they are generally associated with thrombophilia. However, infectious processes such as myocarditis should also be considered, for they may lead to thrombus formation.
Case presentation: a previously healthy 13-month-old male child presents with evidence of extensive ischemic cerebrovascular accident compromising both cerebral hemispheres, with a history of gastrointestinal infection which might suggest the presence of sepsis and myocarditis secondary to it contributing to a thrombotic event which probably triggered the cerebrovascular process herein described.
Conclusions: although they have been ranked as the third cause of cerebrovascular events, infections should be taken into account so as to timely indicate the appropriate antibiotic treatment and avoid the occurrence of sequels.
Key words: cerebrovascular event; ischemic event; infection; myocarditis; child.
INTRODUCCIÓN
El accidente cerebrovascular (ACV) en niños entre los 30 días de vida y los 18 años tiene una incidencia de 1,6-13/100000, y genera una alta morbilidad, por lo que es primordial diagnosticarlo de forma temprana. Es importante reconocer si se trata de un ACV de tipo isquémico o hemorrágico, ya que la morbilidad a largo plazo en niños es elevada;1 por ello, hay que considerarlo como diagnóstico diferencial en los servicios de urgencias ante un niño con cuadro clínico de déficit neurológico, esto, con el fin de reconocerlo, optimizar la perfusión cerebral, y así disminuir el área de lesión secundaria.1
Los ACV son de dos tipos (isquémicos o hemorrágicos). Los primeros se dividen en arteriales y debidos a trombosis del seno venoso.2 Esta afección dentro de la población pediátrica es más frecuente en recién nacidos y lactantes, con una incidencia anual de 1,2 a 8 por 100 000 niños, y de 1 por 2 500 a 4 000 neonatos,3 y se documenta que en menores de un mes es más frecuente en niños que en niñas.4
Las causas de ACV en lactantes y niños son generalmente heterogéneas. Se tienen que tener en cuenta causas: genéticas, congénitas, metabólicas y desórdenes sistémicos que raramente se producen en adultos. Por eso, es de gran importancia distinguir e identificar factores de riesgo, y diagnósticos diferenciales o factores predisponentes para que esto ocurra.5
La etiología varía según el grupo etario, de esta forma, se pueden clasificar en los grupos siguientes:
a. Perinatal y neonatal
b. Niños (1-15 años)
c. Adolescentes y adultos jóvenes (15-40 años)5
En los neonatos, los factores perinatales como, el estado protrombótico materno durante el trabajo de parto, la activación endotelial, el aumento de factores vitamina K dependientes, la disminución de la proteína S, la diabetes gestacional y la preeclampsia, juegan un papel muy importante.5
Las principales causas en niños incluyen migraña, trauma (disección), patologías cardíacas, vasculopatías, causas genéticas y hematológicas.5 En los niños de mayor edad se pueden clasificar las causas como se presenta en el cuadro.
Cuadro. Causas de ictus arterial isquémico en niños6,7
| Anemia |
| Anemia |
| Aumento de las células sanguíneas (conducen a mayor viscosidad) |
| Policitemia |
| Adquiridas |
| Cateterismo |
| Deficiencias de factores de coagulación y anomalías |
| Deficiencia de proteína C |
| Mutaciones genéticas identificadas en factores de coagulación o enzimas que afectan la coagulación |
| Factor V Leiden |
| Anticuerpos antifosfolipídicos |
| Anticoagulante lúpico |
| Dislipidemias |
| Aumento en lipoproteína (a) |
| Cardiacas |
| Enfermedades congénitas |
| Vasculopatías |
| Enfermedad de Moyamoya |
| Infecciones |
| Meningitis |
| Drogas y toxinas |
| Cocaína |
| Síndromes genéticos |
| Síndrome de Marfan |
A pesar de que existe una clara identificación de los factores de riesgo más importantes, aún hay un grupo de pacientes (cerca del 50 %) cuya etiología no se puede definir, que quedan dentro del grupo de los ictus "criptogénicos".6,7
PRESENTACIÓN DEL CASO
Paciente masculino, de 13 meses de edad, producto de primer embarazo. La madre inició controles prenatales a las 22 semanas de gestación, y tuvo parto vaginal eutócico a las 38 semanas. El peso al nacer fue de 2 560 g y la talla de 49 cm (egreso conjunto).
Fue llevado al servicio de urgencias por cuadro clínico que inició con fiebre, cuatro episodios eméticos de contenido alimentario asociado a deposiciones líquidas sin moco ni sangre en dos ocasiones, por lo que se le administró suero de rehidratación oral sin necesidad de hospitalización. Reconsultaron a los cuatro días por persistencia de intolerancia a la vía oral y deshidratación, y al examen físico se evidenció lo anteriormente mencionado, más sintomatología respiratoria (sibilancias), por lo que se inició tratamiento con líquidos endovenosos y salbutamol.
Fue remitido a nuestra institución para valoración por el servicio de Neuropediatría, por cuadro clínico de tres días de evolución consistente en varios episodios eméticos (6 al día). No refirieron fiebre y diarrea, pero sí se evidenció mal estado general, rigidez generalizada y sin contacto visual con el examinador. La madre negó convulsiones. Se comprobó oximetría en descenso progresivo, que requirió inicio de ventilación mecánica.
Al ingreso a Unidad de Cuidado Intensivo Pediátrico (UCIP), el paciente estaba en falla ventilatoria por deterioro neurológico continuo, con ventilación mecánica, con parámetros altos. Requirió paso de catéter central y paso de sonda nasogástrica. Los exámenes complementarios solicitados mostraron leucocitosis con neutrofilia, anemia leve, y los tiempos de coagulación dentro de límites normales.
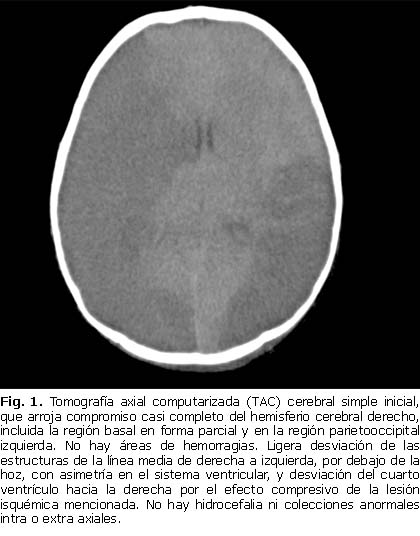
La tomografía axial computarizada (TAC) cerebral simple y con contraste evidenció hipodensidad en territorios de la arteria cerebral media derecha (tronco) y media izquierda (M2), con pérdida de la diferenciación corticosubcortical, que sugiere evento cerebrovascular con edema maligno de la cerebral media izquierda y desviación de la línea media, hallazgos compatibles con accidente cerebrovascular extenso frontotemporoparietoccipital derecho, territorio de la cerebral posterior izquierda y cerebelo izquierdo (figura 1). Bajo sedación el paciente presentó signos de descerebración, acompañados de hipertensión arterial leve y tendencia a la bradicardia, por lo que se indicó neuroprotección por sospecha de hipertensión endocraneana.
A causa de la alta sospecha de meningoencefalitis, se inició cobertura con antibiótico empírico biconjugado, y se pospuso la punción lumbar por el riesgo de herniación cerebral. Se realizó ecocardiograma, que mostró severa disfunción sistólica del ventrículo izquierdo, hipertensión pulmonar leve y derrame pericárdico leve, pero no se apreciaron trombos o masas intracardiacas. El reporte de troponina fue negativo, creatinfosfoquinasa MB elevada y creatinfosfoquinasa total normal. Fue valorado por el servicio de Cardiología Pediátrica, el cual -por los hallazgos anteriormente descritos y el cuadro clínico del paciente- consideraron que podría corresponder a una miocarditis viral, con formación de trombos por la dilatación y embolización del sistema nervioso central (SNC), por lo que se administró tratamiento con inmunoglobulina G.
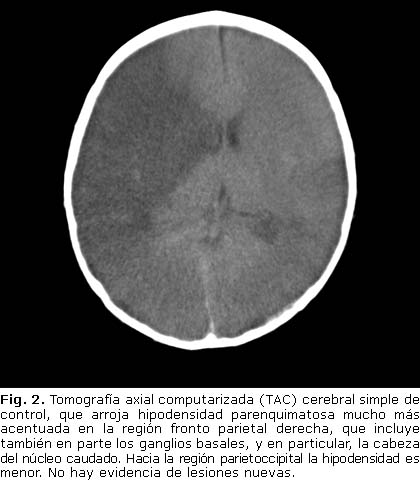
Neurología Pediátrica revisó los resultados de la panangiografía y TAC cerebral de control solicitadas (figura 2), las cuales mostraron áreas focales de estenosis con defectos murales de llenamiento en carótida interna supraclinoidea derecha, primer segmento de la arteria cerebral anterior y cerebral media derechas; en el lado izquierdo, compromiso focal del primer segmento de arterias cerebrales posteriores, compatibles con trombosis parcial de vasos en proceso de recanulación. Descartaron con esto enfermedad de Moyamoya.
Hematología pediátrica consideró que se trataba de un evento isquémico de características tromboembólicas (dímero D elevado), por lo cual se inició anticoagulación con heparina de bajo peso molecular (HBPM) y se descartó trombofilia. El paciente logró ser extubado con requerimiento de oxígeno a bajo flujo, momento en el cual las pupilas estaban anisocóricas poco reactivas a la luz, no realizaba seguimiento visual y tenía las extremidades en flexión.
Luego de ser extubado el paciente mejoró la succión y deglución, por lo que se retiró la sonda nasogástrica, y por recomendación de terapia del lenguaje, se inició tolerancia a vía oral. Fue traslado a la sala luego de 16 días de estancia en UCIP, tuvo una mejoría neurológica progresiva, los potenciales evocados auditivos y visuales fueron normales, y los potenciales somatosensoriales mostraron lesión cortical difusa. Presentó disminución de la hipertonía, aumento de la movilidad de hemicuerpo derecho, y, como secuela, hemiparesia izquierda. Durante la hospitalización no presentó hipoglicemia. Se le dio egreso con HBPM por tres meses, terapia física, de lenguaje y ocupacional, para rehabilitación integral.
DISCUSIÓN
Los ictus isquémicos en niños son infrecuentes, su incidencia se estima alrededor de 2,5-13 casos por 100 000 niños por año, de los cuales 0,6-8/100 000 corresponden a accidentes de tipo isquémico, y alrededor de 1,2-5/100 000 son de tipo hemorrágico.6
Con respecto a la presentación clínica, varía de acuerdo con la edad. En neonatos la manifestación más frecuente es la convulsión, aunque también pueden presentar letargia, apnea, irritabilidad, hipotonía y/o fontanela abombada. Algunos niños pueden estar aparentemente asintomáticos, y tras dos meses de evolución, presentar hipertonía (generalmente de un miembro) y/o convulsiones.6
En los infantes las manifestaciones clínicas son similares a las de los adultos, pueden presentar: convulsiones, signos de focalización neurológica, a veces pueden referir cefalea; en caso de tratarse de múltiples microinfartos, se observarán dificultades en el aprendizaje.6
El tiempo de consulta al médico es de aproximadamente 28,5 horas, ya que generalmente la sintomatología se atribuye a otras causas comportamentales, o no se identifica por ser sutil. El tiempo promedio de diagnóstico es de aproximadamente 35,7 horas; sin embargo, en neonatos la consulta es aún más tardía, pues la mayoría de veces el familiar refiere un mes de evolución de hipoactividad del infante, asociado a hiporexia e irritabilidad, que atribuyen a otras causas, y consultan cuando aparece la hipertonía. Es decir, esta enfermedad se presenta con una gran variabilidad clínica, por lo tanto, es difícil hacer el diagnóstico de forma temprana, ya que el personal de salud atribuye la sintomatología a afecciones mucho más frecuentes.7
En el caso que nos ocupa, el paciente presentó mal estado general, rigidez generalizada, no hubo contacto visual con el examinador y presentó falla ventilatoria.
El ACV se encuentra entre las 10 primeras causas de mortalidad en pacientes de 5 a 24 años. Tiene una incidencia de 25-40/100 000 en neonatos a término, de 100/100 000 en neonatos prematuros y de 13/100 000 en niños mayores de un año. No es muy frecuente que en el servicio de urgencias pediátricas este se considere como la causa principal de deterioro neurológico.8
Entre los diagnósticos diferenciales se encuentran: crisis focales, hipoglicemia, migrañas complicadas, neoplasias intracraneales e infecciones en el SNC (meningitis, encefalitis herpética y absceso cerebral, entre otras); todas las anteriores pueden cursar con sintomatología similar, y la mayoría se presentan con mayor frecuencia en población pediátrica, por lo que tienen un índice de sospecha clínica mucho más alto.9 En el caso del paciente presentado se descartó hipoglicemia, y se sospechó inicialmente que el cuadro podría relacionarse con una meningoencefalitis, pero debido a la clínica del paciente y a los hallazgos en el ecocardiograma y en la panangiografía, se sospechó un ictus arterial isquémico, cuya causa estuvo relacionada con un evento cardioembólico debido a miocarditis.
Para el tratamiento de esta afección se deben realizar medidas de soporte luego del ictus, como:
1. Control de la hipertensión, oxigenación, fiebre y mantener niveles adecuados de glucosa.
2. Tratar la anemia y deshidratación.
3. En ausencia de convulsiones, no es necesaria la administración profiláctica de anticonvulsivantes.10
En la población pediátrica el tromboembolismo es raro, y el tratamiento es complejo, ya que el 50 % de los medicamentos que se utilizan no están aprobados en población pediátrica.11 La trombólisis con activador tisular del plasminógeno (tPA) se deberá considerar en pacientes seleccionados con trombosis del seno venoso. Faltan estudios de eficacia y seguridad del tPA en población pediátrica.10 La recomendación de tratamiento para un ictus arterial isquémico secundario a un evento cardioembólico, es la anticoagulación con HBPM o antagonistas de vitamina K, por al menos 3 meses.11 En el caso de nuestro paciente se decidió realizar anticoagulación con HBPM por tres meses, ya que la clínica y los paraclínicos sugerían un ictus arterial isquémico.
En el evento agudo, si se identifica la causa como disección arterial o anormalidades protrombóticas, está indicada la anticoagulación, y se pueden utilizar HBPM con el uso un poco controvertido de warfarina, o agentes antiplaquetarios durante los siguientes 3 a 6 meses. Se ha visto que la aspirina no aumenta significativamente el riego de accidentes hemorrágicos, tanto en adultos como en niños, por lo que se podría utilizar de manera segura tan pronto como sea posible administrarla siempre, y cuando el paciente no tenga ninguna contraindicación. En un estudio prospectivo no aleatorizado se comparó el uso de antiagregantes vs. HBPM, sin encontrar diferencias significativas entre los dos grupos con respecto a la recurrencia de ACV.6
El pronóstico es desalentador en aproximadamente 60 % de los casos, y entre las secuelas más comunes se encuentran los déficits motores residuales, los déficits cognitivos y las dificultades comportamentales, con un serio impacto en el desarrollo social y laboral. El riesgo de recurrencia depende del factor desencadenante; sin embargo, de manera general, este va del 10 al 30 %, y según publicaciones recientes el factor determinante para la recurrencia es la arteriopatía (1 de cada 5 niños tuvo recurrencia en un año), seguido de deficiencia de proteína C y altos niveles de lipoproteína.12,13 En un estudio realizado por Lori Billinghurst y otros,14 la incidencia acumulativa de crisis sintomática remota, luego de ictus arterial isquémico a los dos años, fue del 19 % en neonatos y del 7 % en niños. Retomando el caso clínico y haciendo referencia a lo anteriormente mencionado, este paciente tuvo marcadas secuelas motoras bilaterales y déficit cognitivo visual y auditivo.
Vásquez y otros15 investigaron sobre las complicaciones en pacientes con ictus arterial isquémico asociado a afecciones cardiacas, y observaron que estos pacientes tienen un pronóstico más pobre, con alteraciones en múltiples áreas, como sensitivas, motoras, cognitivas y comportamentales. Encontraron que la presentación a edad temprana, el tamaño del ictus, la fiebre y la hemiparesia, son factores de peor pronóstico en estos casos.
Se debe recordar que procesos infecciosos como los presentados en el caso clínico descrito, con alta sospecha de miocarditis viral, pueden predisponer a la formación de trombos, y así, ocasionar un ictus de predominio isquémico; por lo que tiene gran importancia, en niños con sepsis (independiente de su origen), valorar la funcionalidad cardíaca mediante un ecocardiograma, para detectar la presencia de posibles trombos, o defectos estructurales cardíacos que predispongan su formación. Las infecciones, aunque se han relacionado como la tercera causa de ACV, se deben tener en cuenta para así instaurar tratamiento antibiótico oportuno, y con esto, evitar secuelas.
Se deben excluir otros tipos de causas, en especial defectos genéticos en la coagulación y enfermedades autoinmunes, que aunque rara vez se presentan en lactantes, pueden ser predisponentes a ictus cerebral.
Es importante recordar que los niños tienen mayor poder de recuperación que los adultos con lesiones comparables. La ausencia de enfermedad vascular generalizada y la presencia de circulación colateral minimiza el daño cerebral; de igual forma, al ser un cerebro en desarrollo, este tiene mayor plasticidad, lo cual hace que otras zonas cerebrales asuman las funciones de áreas no perfundidas y/o zonas de penumbra, es así que un adecuado plan de rehabilitación puede contribuir a mejorar el pronóstico a largo plazo en estos niños.5,16
Se concluye que el ictus en niños y lactantes es una afección poco frecuente; sin embargo, no se puede excluir este diagnóstico como una de las causas de déficit neurológico súbito en niños, aunque se deben tener en cuenta los factores de riesgo asociados, para poder realizar un diagnóstico diferencial que pueda guiar el estudio clínico.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses en la realización del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Morgan L. Evaluation and Management of the Child with Suspected Acute Stroke. Clin Pediatr Emerg Med. 2015;16(1):29-36.
2. Adam Kirton G de Veber. Cerebrovascular Disease in Children. In: Kryhl L, Gaillard J, Cole E, editors. Swaiman's Pediatric Neurology. Fifth Edit. Philadelphia: Elsevier Saunders; 2012. p. 1395-436.
3. de Veber GA, Kirton A, Booth FA, Yager JY, Wirrell EC, Wood E, et al. Epidemiology and Outcomes of Arterial Ischemic Stroke in Children: The Canadian Pediatric Ischemic Stroke Registry. Pediatr Neurol. 2017 Apr;69:58-70.
4. Saliba E, Debillon T, Auvin S, Baud O, Biran V, Chabernaud JL, et al. Accidents vasculaires cérébraux ischémiques artériels néonatals: synthèse des recommandations. Arch Pédiatrie. 2017 Feb;24(2):180-8.
5. de Veber G, Singhal AB, Caplan LR. Stroke in children and young adults. In: Caplan LR, editor. Caplan's Stroke: A Clinical Approach. 5th ed. Cambridge: Cambridge University Press; 2016. p. 477-510.
6. Kirkham F, Sébire G, Steinlin M, Sträter R. Arterial ischaemic stroke in children: Review of the literature and strategies for future stroke studies. Thrombosis and Haemostasis. 2004;92:697-706.
7. Golomb MR. Stroke in neonates and children: overview. In: Stroke in children and young adults. Chapter 3. Second edition. Philadelphia: Saunders Elsevier; 2009. p. 69-80.
8. Rivkin MJ, Bernard TJ, Dowling MM, Amlie-Lefond C. Pediatric Neurology Guidelines for Urgent Management of Stroke in Children. Pediatr Neurol. 2016;56:8-17.
9. Tsze DS, Valente JH. Pediatric Stroke: A Review. Emergency Medicine International. 2011;2011:1-10.
10. Roach ES, Golomb MR, Adams R, Biller J, Daniels S, Deveber G, et al. Management of stroke in infants and children: a scientific statement from a Special Writing Group of the American Heart Association Stroke Council and the Council on Cardiovascular Disease in the Young. Stroke. 2008 Sep;39(9):2644-91.
11. Monagle P, Chan AKC, Goldenberg NA, Ichord RN, Journeycake JM, Nowak-Gottl U, et al. Antithrombotic therapy in neonates and children: Antithrombotic Therapy and Prevention of Thrombosis. 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012 Feb;141(2 sup):e737S-e801S.
12. Fullerton HJ, Wintermark M, Hills NK, Dowling MM, Tan M, Rafay MF, et al. Risk of Recurrent Arterial Ischemic Stroke in Childhood: A Prospective International Study. Stroke; a Journal of Cerebral Circulation. 2016;47:53-9.
13. Paediatric Stroke Working Group. Royal College of Physicians of London. Stroke in Childhood: Clinical Guideline for Diagnosis, Management and Rehabilitation [homepage en Internet]; London (United Kingdom): Royal College of Physicians, 2004 [citado 14 de marzo de 2017]. Disponible en: http://icnapedia.org/guidelines/open/f98c6540-a541-4bed-837d-ef293ac458bf.pdf
14. Billinghurst LL, Beslow LA, Abend NS, Uohara M, Jastrzab L, Licht DJ, et al. Incidence and predictors of epilepsy after pediatric arterial ischemic stroke. Neurology. 2017 Feb;88(7):630-7.
15. Vázquez López M, de Castro de Castro P, Barredo Valderrama E, Miranda Herrero MC, Gil Villanueva N, Alcaraz Romero AJ, et al. Outcome of arterial ischemic stroke in children with heart disease. Eur J Paediatr Neurol. 2017;(5):730-7.
16. Katrak SM. Vasculitis and stroke due to tuberculosis. In: Caplan LR, editor. Uncommon Causes of Stroke. Cambridge: University Press; 2008. p. 41-5.
Recibido: 3 de abril de 2017.
Aprobado: 23 de julio de 2017.
José Miguel Suescún Vargas. Instituto Roosevelt. Carrera 4ª este (avenida Circunvalar), No. 17-50. Bogotá, Colombia. Correo electrónico: jose.suescun@urosario.edu.co