Introducción
El derrame pleural paraneumónico se produce en el curso de una infección respiratoria, neumonía bacteriana por lo general. Inicialmente la pleura se inflama, después hay filtración de proteínas, leucocitos y fluidos al espacio pleural; a continuación, esta cavidad es invadida por bacterias y se instaura el empiema pleural. La presente guía tiene como objetivo: uniformar el tratamiento del empiema pleural en los servicios de cirugía pediátrica del país. Se actualizan los contenidos de la guía anterior publicada en el año 2005.
Empiema pleural
Concepto
Empiema pleural se define como la infección de la cavidad pleural que provoca que se acumule fluido purulento en ella o la presencia de bacterias en la tinción de Gram en el líquido pleural.1,2
Epidemiologia
Se puede desarrollar entre 2 hasta 12 % de los niños con neumonía, más común en menores de 5 años.2,3 Es raro en neonatos.4 Tiene igual incidencia en ambos sexos. El riesgo se incrementa en pacientes inmunodeficientes, con parálisis cerebral infantil, síndrome de Down, cardiopatías congénitas, trombocitopenia congénita, prematuros, fibroquísticos y con tuberculosis.2,3
Etiología
Ocurre en la mayoría de los casos asociado a una neumonía bacteriana. Los gérmenes causantes han ido cambiando en el tiempo debido al uso de antibióticos, al desarrollo de resistencia antimicrobiana y la vacunación, puden ser:
Infecciones bacterianas: Streptococcus pneumoniae; Staphylococcus aureus, incluido el meticilin resistente; Streptococcus viridans; Streptococcus pyogenes; Actinomyces species y Pseudomonas aeruginosa. El H. influenzae tipo b, no representa hoy un problema pues la población infantil se vacuna contra esta bacteria.
Otros agentes: Mycoplasma, virus, M. tuberculosis, hongos.2,5,6,7,8
Se describen otras causas, menos frecuentes: ruptura de absceso pulmonar, bronquiectasia abscedada secundaria a infecciones del mediastino, postraumática, posquirúrgica y por extensión de un absceso intrabdominal.9
Clasificación
La Sociedad Americana de Cirugía Torácica clasifica la entidad en tres fases:
Fase exudativa: dura de 24 a 72 horas, el líquido es claro con poca celularidad e incremento de la permeabilidad y reactividad del tejido local que favorece el paso del líquido intersticial pulmonar.
Fase fibrinopurulenta: se desarrolla entre los días 3 al 15. Fase de transición con cantidades abundantes de leucocitos, con proliferación fibroblástica y depósito de fibrina en el espacio pleural que inicia la formación del pulmón y conduce a la formación de colecciones; comienza la formación de una membrana limitante alrededor del pulmón. El líquido pleural es turbio o francamente purulento.
Fase organizada: ocurre entre la segunda y sexta semana. Se caracteriza por la invasión de fibroblastos con la formación de membranas de tejido fibroso hasta crear una gruesa coraza de fibrina rígida que limita los movimientos respiratorios. 10,11,12
Diagnóstico positivo
Cuadro clínico: fiebre persistente, malestar general, pérdida del apetito, tos, dolor torácico y disnea.
Examen físico
Inspección: frecuencia respiratoria elevada, disminución de la expansibilidad torácica, abombamiento del hemitórax afecto, escoliosis antálgica.
Palpación: disminución de la expansibilidad, abolición o disminución de las vibraciones vocales al llanto.
Percusión: matidez del área afecta.
Auscultación: disminución del murmullo vesicular. En las fases iniciales, puede auscultarse un roce pleural cuando hay poco líquido.2,9,13)
Exámenes complementarios
Laboratorio
Leucograma: leucocitosis, por lo general a predominio de neutrófilos.
Hemoglobina y hematocrito: pueden estar disminuidos. Se han registrado casos de anemia hemolítica secundaria a neumonía por Mycoplasma y síndrome hemolítico urémico como complicación de una infección por neumococo.14
Velocidad de sedimentación globular (eritrosedimentación): elevada.
Proteína C reactiva: positiva (si método cualitativo) o elevada (si método cuantitativo).
Coagulograma: puede verse trombocitosis secundaria, que mejora después de la tercera semana y por lo general no requiere tratamiento.
Gasometría: disminución de la presión de oxígeno y de la saturación de oxígeno de la hemoglobina.
Radiológicos
Rx tórax posteroanterior: el hallazgo más temprano es la obliteración del ángulo costofrénico (signo del menisco). La presencia de un nivel hidroaéreo en las radiografías indica fístula broncopleural, neumotórax, presencia de microorganismos formadores de gas o ruptura esofágica. La radiopacidad de más de la cuarta parte del hemitórax afecto, sin sobrepasar su mitad sugiere un derrame pleural de moderada cuantía; mientras que si la radiopacidad sobrepasa la mitad del hemitórax afecto, estamos en presencia de un derrame de gran cuantía.
Rayos X de tórax vista Pancoast: el líquido pleural libre se localiza a lo largo de todo el hemitórax y se aprecia radiológicamente como una línea radio opaca paralela a la caja torácica. Las variaciones en la línea pleural durante los cambios de posición, ayudan a establecer la presencia de derrame, sin embargo, los líquidos tabicados pueden no variar con los cambios de posición del paciente. En niños mayores de un año la presencia de una línea axilar mayor de 1 cm se considera suficiente volumen para indicar la evacuación del derrame.2,9
Ultrasonido pleural: es la modalidad de imagen preferida para la evaluación de estos pacientes. Confirma la presencia de fluidos en la cavidad pleural, determina el volumen, delimita la colección, puede determinar la presencia de fibrina, floculos, elementos de suspensión y los septos en colecciones tabicadas, ayuda a aclarar hallazgos dudosos a la radiografía e identifica el sitio más apropiado para la punción pleural. Ofrece numerosas ventajas respecto a la tomografía computarizada: Detecta con mayor exactitud septos y locuolaciones tempranas, está más disponible, no emite radiaciones ionizantes, no se requiere de sedación para el estudio. Tiene como mayor desventaja que la precisión del estudio es operador dependiente.2
Tomografía computarizada: es útil para la evaluación de la extensión parenquimatosa de la enfermedad (ejemplo, formación de abscesos, necrosis), sobre todo en derrames de gran cuantía. Resulta una herramienta útil para la planificación de la intervención quirúrgica pues precisa la anatomía y brinda información útil sobre el estado del parénquima pulmonar. En los centros donde no esté disponible, se debe coordinar su realización previo a la intervención quirúrgica.2,16
Microbiológicos
Cultivo de líquido pleural: realizar cultivo bacteriológico incluyendo la tinción de Gran. Se notifica una positividad de hasta 63 %.17,18,19
Hemocultivo: solo es positivo entre 2-20 % de los pacientes con empiema. Son particularmente útiles en caso de ser negativo el cultivo pleural.17,18,19
Estudios microbiológicos especiales como la detección antigénica (aglutinación en látex) o la reacción en cadena de la polimerasa. Si se requiere, de manera excepcional se debe coordinar con el Instituto de Medicina Tropical (IPK), en La Habana.
Otros estudios del líquido pleural: pueden ser, además de las determinaciones microbiológicas, realizar estudios bioquímicos para determinar pH, LDH y Glucosa.
Estudio citológico: se indica solo si se sospecha causa tumoral, cuando por ejemplo concomitan masas mediastinales. 3,20,21
Tratamiento
Es el siguiente.
Ingreso, generalmente en unidades de cuidados progresivo.s
Medidas de soporte.
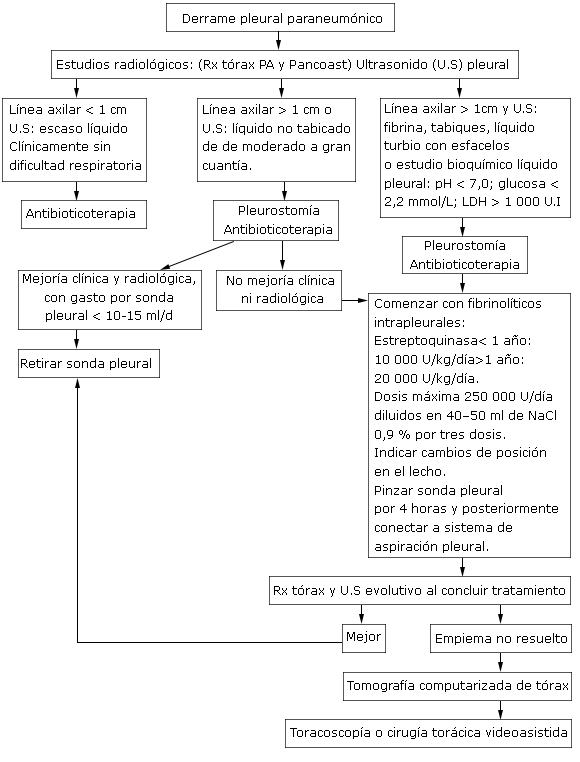
Pacientes con derrame pleural con buen estado general, sin compromiso ventilatorio que se manifieste con línea axilar < 1cm en el Rx tórax vista Pancoast, por lo general no requieren ser evacuados.23
Si la línea axilar es > 1cm, precisar por ultrasonido pleural la no existencia de tabiques, realizar pleurostomía insertando una sonda pleural de diámetro adecuado según el peso de niño (anexo 2), que se conectará a un sello de agua. Realizar estudio bioquímico y microbiológico al líquido pleural. En estadios iniciales se puede intentar realizar toracocentesis.
Evitar drenar rápido grandes volúmenes de líquido pleural, por el riesgo de provocar edema pulmonar por reexpansión; de manera que se debe pinzar la sonda pleural por una hora posterior a la evacuación inicial de 10 ml/kg.23
Si hay presencia de tabiques, líquido pleural turbio, con esfacelos, o que el estudio bioquímico informe pH /7; glucosa /2,2 mmol/L; LDH/ 1000 UI, se comenzará tratamiento con fibrinolíticos intrapleurales: estreptoquinasa recombinante, una dosis diaria por tres días y aplicar a través de la sonda pleural, la que permanecerá pinzada por 4 horas para posteriormente conectarla a un sistema de aspiración. (ver en anexo 3 especificaciones para su uso). Los fibrinolíticos están contraindicados en pacientes con fístula broncopleural o cuando exista burbujeo del sello de agua, por el riesgo de neumotórax a tensión cuando se pinze la sonda pleural; se contraindica su uso también cuando existen trastornos de la coagulación.3,13,23
No es necesario realizar estudios radiológicos mientras se esté aplicando estreptoquinasa intrapleural.
La sonda pleural se retirará cunado su gasto sea mínimo 10-15 ml/24 horas y exista mejoría de las condiciones clínicas. No es necesario pinzar la sonda previo a su remoción.3,23
Tratamiento quirúrgico, está indicado si: deterioro clínico y radiológico posterior a concluir el uso de fibrinolíticos. Persistencia de sepsis asociada a colección pleural a pesar del drenaje torácico. Depósito de gruesa coraza de fibrina en la cavidad pleural que impide la reexpansión pulmonar. Fístula broncopleural con neumotórax.
El tratamiento quirúrgico puede ser mediante cirugía torácica videoasistida (centros con medios y personal calificado) o a través de una toracotomía realizando una decorticación pleural.23
En empiemas cuyo tiempo de evolución supera la fase organizada se realizará una decorticación tardía a través de una toracotomía posterolateral.23
Complicaciones
Fístulas broncopleurocutaneas
Abscesos pulmonares
Fibrotorax
Mediastinitis
Peritonitis secundaria por ruptura a través del diafragma
Pericarditis purulenta
Osteomielitis. 24