Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol v.37 n.2 Ciudad de la Habana Mayo-ago. 2011
OBSTETRICIA
Resultados de la pesquisa de hiperplasia adrenal congénita en recién nacidos
Results of screening on congenital adrenal hyperplasia in newborns
Remigio Coto Rodeiro,I Joel A. Varona Sánchez,II Julio A. Borrego López,III Luis Ernesto Formoso MartínIV
IMáster en Atención Integral a la Mujer. Licenciado en Bioquímica. Hospital Ginecoobstétrico “Ramón González Coro”. La Habana, Cuba.
IIMáster en Atención Integral a la Mujer. Especialista de II Grado en Ginecología y Obstetricia. Asistente. Hospital Ginecobstétrico “Ramón González Coro”. La Habana, Cuba.
IIIMáster en Atención Integral a la Mujer. Especialista de I Grado en Ginecología y Obstetricia. Asistente. Hospital Ginecobstétrico “Ramón González Coro”. La Habana, Cuba.
IVMáster en Atención Integral a la Mujer. Especialista de II Grado en Ginecología y Obstetricia. Profesor Auxiliar. Hospital Ginecobstétrico “Ramón González Coro”. La Habana, Cuba.
RESUMEN
Se realizó un estudio retrospectivo, lineal, de carácter evaluativo de la marcha del programa desde su implantación en noviembre de 2005 hasta abril de 2007 en cuanto a parámetros de calidad: edad del recién nacido en el momento de la toma de la muestra, tiempo que demoró esta en llegar al laboratorio, calidad de las muestras, cantidad de muestras no útiles y número de resultados elevados, de los municipios a los que se le ofertan los servicios del laboratorio SUMA del Hospital Docente Ginecoobstétrico "Ramón González Coro". Fueron analizadas un total de 7 780 muestras de sangre seca sobre papel de filtro de recién nacidos, de las cuales, el 62,2 % se realizaron al 5to. día, con un promedio de 7 días entre la toma y la recepción en el laboratorio, con muy buena calidad, 80 muestras no útiles con una cobertura del 99,98 % y un total de 43 resultados elevados, además se analizaron varios factores que influyen en los niveles de 17OH-Progesterona cuantificados en el UMELISA 17OH-Progesterona Neonatal como son: peso al nacer, género, edad del recién nacido en la fecha de la toma de la muestra, edad gestacional (por ciclo menstrual o fecha de última menstruación) en el momento del parto, número de fetos y forma del parto, se detectó que hay incremento en los niveles de 17OH-Progesterona en los bajo peso al nacer, prematuros, en los partos por cesárea y embarazos con más de 1 feto.
Palabras clave: Hiperplasia adrenal, enfermedades genéticas, programa de pesquisa.
ABSTRACT
An evaluative, linear and retrospective study was conducted on the underway of the program from its implementation from November, 2005 to April, 2007 related to the following quality parameters: newborn's age at the sample take moment, time elapsed from its arrival to laboratory, samples quality, number of non-useful samples and number of high results, figure of municipalities receiving the SUMA laboratory services from the "Ramón González Coro" Gynecology and Obstetrics Teaching Hospital. A total of 7 780 newborns dry blood samples were analyzed using filter paper and the 62.2 % was carried out at fifth day over an average of 7 days between take and the reception in laboratory with a very good quality, there were 80 non-useful samples with a coverage of 99.98 % and a total of 43 high results and also we analyzed some factors influencing in levels of 17OH-Progesterone quantified in the UMELISA 17OH-progesterone Neonatal including: birth weight, gender, newborn age and date of take sample, gestational age (by menstrual cycle or date of last menstruation) at labor moment, quantity of fetus and the type of labor, noting an increase in levels of 17OH-progesterone in those with a low-birth weight, prematures and in cases of cesarean section and pregnancy of more than one fetus.
Key words: Adrenal hyperplasia, genetic diseases, screening program.
INTRODUCCIÓN
La hiperplasia adrenal congénita (HAC) engloba un conjunto de enfermedades genéticas de transmisión autosómica recesiva, con penetrancia variable, y que conllevan a un trastorno en la esteroidogénesis suprarrenal.1 Puede afectarse la síntesis de glucocorticoides, mineralocorticoides y andrógenos que originan un grupo heterogéneo de cuadros clínicos que pueden presentarse en los diversos períodos de la vida.2,3
La glándula suprarrenal sintetiza a partir del colesterol tres tipos de hormonas: glucocorticoides (zona fascicular), mineralocorticoides (zona glomerular) y andrógenos (zona reticular). En esta síntesis participan una serie de enzimas, alguna de las cuales son comunes y otras específicas de cada una de ellas.4
El hipotálamo secreta el factor de liberación de corticotropina (CRF) que actúa sobre la adenohipófisis liberando corticotropina (ACTH), esta hormona controla la esteroidogénesis en la glándula suprarrenal al estimular la conversión de colesterol a pregnenolona. El cortisol regula la secreción de CRF cerrando de esta forma el sistema hipotálamo-hipófisis-suprarrenal.
La síntesis de aldosterona depende en menor medida de la ACTH y es regulada fundamentalmente por el sistema renina-angiotensina y los niveles plasmáticos de potasio. El bloqueo en la acción de alguna de las enzimas implicadas en la síntesis del cortisol libera a la ACTH de la inhibición que sobre ella ejercen los diversos esteroides aumentando su concentración plasmática.5
El aumento de ACTH estimula el crecimiento y la función de la corteza suprarrenal con la intención de mantener cifras de cortisol plasmáticas adecuadas. Este aumento produce un exceso en la síntesis de otros esteroides producidos por vías alternativas no afectadas por el defecto enzimático que darán lugar a diversas manifestaciones clínicas. Al mismo tiempo se produce una hiperplasia de la corteza hiperestimulada, por lo que el conjunto de estos trastornos se conoce con el nombre de hiperplasias suprarrenales congénitas.6,7
Todas las enzimas que participan en la esteroidogénesis son citocromos (P450c) excepto la 3b-hidroxiesteroidehidrogenasa (3b-HSD). Las enzimas 3 b-HSD, 21 y 17 b-hidroxilasa son citosólicas y el resto mitocondriales.8
Dependiendo de la gravedad del trastorno enzimático, pueden predominar los efectos de la deficiencia de esteroides en cuya formación interviene la enzima o los efectos de la producción excesiva sintetizados por vías alternativas no bloqueadas.9
Algunos defectos son incompatibles con la vida, mientras que otros se detectan en la edad adulta o pasan desapercibidos. Los defectos más graves se manifiestan en el feto, suelen afectar a las primeras enzimas de la esteroidogénesis, y en ellos predomina la clínica de hipocortisolismo con insuficiencia suprarrenal. En casos menos graves el exceso de ACTH permite mantener el cortisol basal dentro de límites normales presentando solo la clínica ante situaciones de estrés.10,11
Las suprarrenales comienzan a funcionar en el feto hacia la semana 10-12 de vida, en el mismo momento en el que comienza a diferenciarse el seno urogenital; esta diferenciación es bipotencial evolucionando a uno u otro sexo según los estímulos hormonales que reciba. La mayoría de los casos de HAC presentan hiperproducción de andrógenos con virilización variable del feto femenino (seudohermafroditismo femenino). En otros casos hay un defecto en la síntesis de andrógenos que porduce falta de masculinización del feto masculino (seudohermafroditismo masculino).12,13
El 80 % de los casos de HAC corresponden a la forma clásica de la enfermedad. Su presentación ocurre en el período neonatal y resulta en un bloqueo completo o casi completo de la actividad enzimática. Dentro de esta forma se encuentran dos subclases de pacientes: los perdedores de sales y los virilizantes simples.14
MÉTODOS
Tipo de investigación
El tipo de proyecto utilizado en esta investigación es un proyecto de evaluación donde se realizó un estudio descriptivo, retrospectivo y de corte transversal, en la marcha del programa de pesquisa neonatal de la HAC por un período de 18 meses, desde su comienzo en noviembre de 2005 hasta abril de 2007, en el Laboratorio SUMA del Hospital Docente Ginecoobstétrico "Ramón González Coro".
Universo y muestra
Para la evaluación del comportamiento del programa se analizaron 7 780 muestras de sangre seca sobre papel de filtro recibidas en el departamento entre noviembre de 2005 y abril de 2007, que correspondieron a todos los recién nacidos de los municipios: Plaza de la Revolución (1 722), Cerro (1 494), Habana del Este (2 305), Guanabacoa (1 638) y Regla (621).
En el análisis de los factores que influyeron en los niveles elevados de 17OHP de sangre seca sobre papel de filtro en recién nacidos, universo de estudio, se evaluaron 3 830 muestras de recién nacidos (RN) colectadas como promedio entre el 5-7 día de vida. La calidad de estas muestras fue evaluada de muy buena. La sangre se colectó de la porción media o lateral de la superficie plantar del talón de los neonatos.
Equipos y accesorios
Lector de placas fluorímetro- fotómetro PR-521, CIE.
Lavador de placas MW 2001, CIE.
Ponchador manual P51
Refrigerador
Placas micro Elisa de poliestireno de la Nunc, Alemania
Cámara húmeda para la incubación
UMELISA 17-OH Progesterona Neonatal
Para la determinación de los niveles de 17-OHP se empleó el UMELISA 17-OH Progesterona Neonatal, un ultramicroELISA, basado en la competencia entre el antígeno natural (17-OHP) presente en las muestras de sangre y el antígeno marcado con la enzima fosfatasa alcalina (FA), por una cantidad limitada de sitios de unión a los anticuerpos policlonales específicos anti-17-OHP. Ensayo para la determinación de los niveles de 17-OHP en muestras de sangre seca sobre papel de filtro. El valor de corte empleado en el programa cubano de pesquisa neonatal de la HAC es de 55 nmol/L.
Se perforaron discos de 3 mm de diámetro de los calibradores, el control del ensayo y las muestras en sangre seca sobre papel de filtro, se empleó el ponchador manual P-51. Los discos se adicionaron a cada pocillo de la placa de elusión y se le añadieron 40 mL de la solución de conjugado 17OHP-FA. La elusión se realizó durante 30 min en cámara húmeda a 20-25 ºC. Se transfirieron 10 mL del eluato a las placas de poliestireno sensibilizadas con los AcP. Las placas se incubaron 2 h en cámara húmeda a 37 ºC. Transcurrido este tiempo, se realizaron 6 lavados adicionando 25 mL de la solución de lavado a cada pocillo, empleando el lavador MAS 301. Se adicionaron 10 mL del sustrato 4-metilumberiferilfosfato a cada uno y se incubó en cámara húmeda a 20-25 ºC durante 30 min. Para la lectura e interpretación de los resultados se empleó el lector de placas Fluorímetro-Fotómetro PR 521.
Para la puesta en marcha del programa se confeccionó como método empírico un modelo de recolección de datos que debe ser llenado por la enfermera del consultorio responsable de la toma de la muestra, unido al papel de filtro donde se depositaron las 4 gotas de sangre de talón y que constituye la muestra del paciente. Posteriormente todos los datos fueron almacenados en una base de datos creada por el Centro de Inmunoensayo, entidad responsabilizada con la asistencia técnica y analítica de todos los programas neonatales que se ejecutan en el país.
Como método estadístico se empleó el descriptivo donde fueron organizados y clasificados los valores obtenidos de 17OHP mediante tablas de distribución de frecuencias, gráficos y medidas de tendencia central como mediana y media. Como método teórico se empleó el de análisis y síntesis de los resultados.
Variables analizadas
- Edad del recién nacido en el momento de la toma de la muestra (ETM): se agruparon las muestras colectadas al 5to día de nacidos, entre el 6to y el 10mo día de nacido y más de 10 días para el análisis del comportamiento del programa.
- Tiempo de llegada al laboratorio: tiempo en días que demora la muestra desde su recolección por la enfermera del consultorio y su recepción en el Laboratorio.
- Calidad de la muestra: incluye si la muestra es útil o no para el diagnóstico.
- Total de elevados: todas aquellas muestras con cifras superiores al nivel de corte de 17OHP.
- Peso al Nacer (PN): si el peso del recién nacido fue mayor o menor de 2 500 g.
- Género: Femenino o masculino.
- Número de fetos: feto único o gemelar.
- Edad gestacional (EG) en el momento del parto: Medidas por fecha de última menstruación si fueron mayores o menores de las 37 semanas de gestación.
- Forma del parto: si el parto fue fisiológico o parto por cesárea.
La EG, el PN, la ETM, la forma del parto, el número de fetos y el género se obtuvo de los datos recogidos en la tarjeta de colecta. El PN es medido en balanza y la EG es determinada por historia menstrual confiable y por ultrasonografía.
Todos los datos anteriores fueron almacenados en base de datos en computadora, en el momento de procesar las muestras, acoplada al lector de placas PR-521 donde se realizó la lectura, validación e interpretación de los resultados.
RESULTADOS
En este período que analizamos, la cobertura del programa es del 99,88 % y disminuyó el tiempo de llegada de las muestras al laboratorio a 7 días. Hubo dificultades con la entrega a tiempo de modelos de recolección de las muestras y por ello disminuyó a un 47,4 % la toma al 5to. día, se incrementó a un 36,63 % la toma entre el 6to. y 10mo. día, y a un 15,97 % con más de 10 días. El total de muestras no útiles también aumentó a 28.
Influencia del peso al nacer
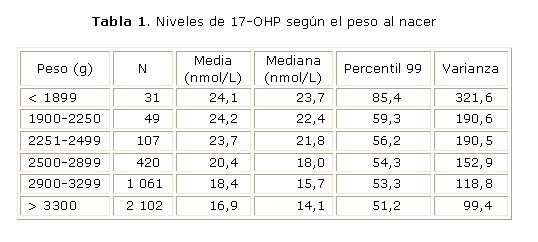
En la tabla 1 se observa que de 3 770 muestras estudiadas, 187 presentaron PN inferior a los 2 500 g. De estas muestras 6 presentaron valores superiores al VC (3,2 %). Mientras que de las 3 583 muestras con PN superior a los 2 500 g, solo el 0,6 % (23 muestras) tuvieron resultados elevados.
Los neonatos con peso al nacer superior a los 2 500 g muestran valores medios de 17-OHP inferiores a los que se determinan en recién nacidos con un peso menor. El percentil 99 calculado para neonatos nacidos con menos de 1 900 gramos fue muy superior a los obtenidos para los otros grupos evaluados.
Influencia de la edad gestacional
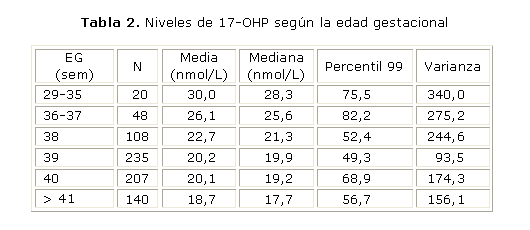
De las 758 muestras estudiadas, 34 presentaron EG inferior a las 37 sem. De ellas 2 muestras (5,7 %) presentaron valores elevados. En el grupo de 724 RN a término, solo 6 muestras (0,8 %) mostraron niveles superiores al nivel de corte (tabla 2).
Aquellos neonatos nacidos antes de las 37 sem de gestación presentan concentraciones medias de 17OHP superiores a las cuantificadas en aquellos nacidos con más de 37 sem de gestación.
Influencia de la edad de toma de muestra
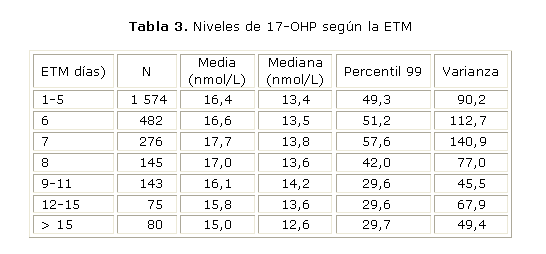
En la tabla 3 se muestran los resultados obtenidos al evaluar la influencia de la edad de toma de muestra (ETM) sobre los niveles de 17-OHP.
Está reportada la marcada influencia de las primeras horas de vida sobre los niveles de 17-OHP medidos en los programas de pesquisa neonatal. Los niveles medios de 17-OHP tienden a normalizarse después de las 48-72 h de vida.
Influencia del género
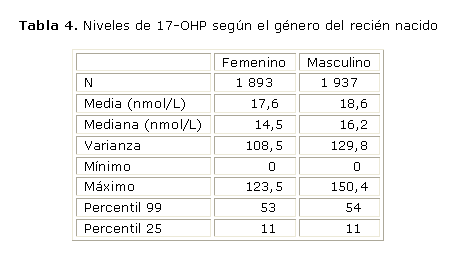
La tabla 4 muestra los valores de 17-OHP obtenidos según el sexo del recién nacido. Los resultados obtenidos muestran que los valores medios en varones fueron estadísticamente superiores a los obtenidos en hembras (T-test for independent simples (p< 0,01). Sin embargo estas diferencias en los niveles de la hormona no implican diferencias en los percentiles para cada uno de los grupos, lo que permitiría trabajar con un mismo nivel de corte según el género del neonato.
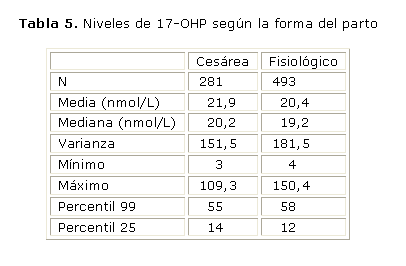
Influencia de la forma del parto
Como se puede apreciar en la tabla 5, en un estudio realizado a 774 RN, los nacidos por cesárea presentaron niveles medios de 17-OHP superiores en aproximadamente 1,5 nmol/L a los nacidos por parto fisiológico.
Estas diferencias no parecen afectar el desarrollo del programa pues en el grupo de nacidos por cesárea se obtuvieron 3 resultados falsos positivos (1,07 %), y en el grupo de nacidos por parto fisiológico, 5 muestras (1,01 %) presentaron valores superiores a los 55 nmol/L.
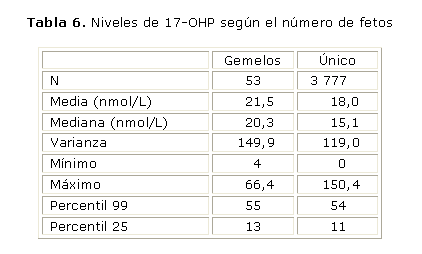
Influencia del número de fetos
La tabla 6 muestra los niveles de concentración de 17-OHP obtenidos al evaluar el número de fetos. Se puede apreciar que existen diferencias entre los valores medios para ambos grupos estudiados, son superiores las concentraciones medias en el grupo de fetos gemelares.
No obstante estas diferencias en las concentraciones medias, no se afecta el percentil 99 calculado para ambas muestras poblacionales. En el caso del estudio en gemelos sería necesario realizar nuevos estudios con un mayor número de muestras que permitan discriminar entre el gemelo 1 y 2.
DISCUSIÓN
Los costos económicos y psicosociales, asociados con los resultados falsos positivos de los programas de pesquisa neonatal de HAC son altos. De esta manera diferentes esquemas de pesquisa han sido estudiados y en muchos casos implementados, los cuales incluyen el ajuste del nivel de corte a la EG, el PN o a la edad de toma de muestra.
Los niveles elevados de 17-OHP en RN prematuros o con bajo peso han sido relacionados con la inmadurez de las enzimas implicadas en la síntesis del cortisol o con la elevada síntesis de esteroides-conjugados que pueden tener reactividad cruzada con los ensayos empleados en la pesquisa. Otros factores que podrían provocar la elevación de los niveles de 17-OHP en estas poblaciones son la inmadurez de los riñones que provoca deficiencias en las funciones excretoras y los altos niveles de ACTH debido al estrés provocado por el parto.
Hoy queda claro que para evitar un número elevado de falsos positivos es necesario ajustar los niveles de corte a estas variables o a la combinación de alguna de ellas.
Este estudio nos ha permitido acercarnos a otros factores como el género del RN, el tipo de parto o el tipo de embarazo y los niveles elevados de 17-OHP. Conocer cómo afectan estos y otros factores la tasa de falsos positivos de los programas, nos permitirá definir estrategias de pesquisa de la HAC que mejoren el valor predictivo positivo de los mismos.
Se concluye que:
- Este estudio demuestra la influencia fundamental de la edad gestacional y el peso al nacer sobre los niveles de 17-OHP medidos en el programa cubano de pesquisa neonatal de la hiperplasia adrenal congénita.
- Los factores anteriores deben tenerse en cuenta al definir los niveles de corte empleados en los programas de pesquisa neonatal.
- Los varones muestran niveles medios de 17-OHP superiores a los obtenidos en hembras.
- Los valores de 17-OHP también se incrementan en los nacidos por cesárea y en los fetos gemelares.
REFERENCIAS BIBLIOGRÁFICAS
1.Torresani T, Gruters A, Scherz R . Neonatal screening for congenital adrenal hyperplasia. Screening. 1994;3:77-84.
2. Cutfield WS, Webster D. Newborn screening for congenital adrenal hyperplasia in New Zealand. J Pediatr. 1995;126:118-21.
3. Carlson AD, Obeid JS, Kanellopoulou N, Wilson RC, New MI. Congenital adrenal hyperplasia: update on prenatal diagnosis. J Steroid Biochem Mol Biol. 1999;69:19-29.
4. Gruñeiro-Papendieck, Prieto L, Chiesa A. Prenatal diagnosis/treatment in families at risk for infants with steroid 21-hydroxylase deficiency (congenital adrenal hyperplasia). J Med Screen. 1998;5:24-6.
5. Pistaccio LG, Gómez FR, Di Carlo CM. Libro de resúmenes III Congreso latinoamericano de Errores Innatos del Metabolismo y Pesquisa Neonatal, Colombia; 2001. p. 67.
6. González EC, Frómeta A, García CM. V Congreso latinoamericano de Errores Innatos del Metabolismo y Pesquisa Neonatal, Costa Rica; 2005. p. 39.
7. Brosnan PG, Brosnan CA, Kemp SF, Jelley DH, Blackett PR, Riley WJ. Effect of newborn screening for congenital adrenal hyperplasia. Arch Pediatr Adolesc Med. 1999;153:1272-8.
8. Esposito M, Levine R, Shalev N. 21-hydroxylase deficiency congenital adrenal hyperplasia. [on line] New York: New York University School of Medicine, 1999.
9. Pico MC. Inmunoensayos enzimáticos. En: Pico MC, Giraldino IG, Otero A, editores. Inmunología experimental. La Habana: Editorial Félix Varela; 1997. p. 199-225.
10. White PC, Speiser PW. Congenital Adrenal Hyperplasia due to 21-Hydroxylase Deficiency. Endocr Rev. 2000;21(3):245-91.
11. Killeen AA. The congenital adrenal hyperplasias [on line]. San Diego: San Diego Conference on Nucleic Acids; 1999.
12. Lee HH, Chao HT, Ng HT, Choo KB. Direct molecular diagnosis of CYP21 mutation in congenital adrenal hyperplasia. J Med Genet. 1996;33:371-5.
13. Maeda M, Arakawa H, Tsuji A, Yamaguami Y, Isoozaki A, Takahashi T, et al. Enzyme-linked immunosorbent assay for 17a-hydroxyprogesterone in dried blood spotted on filter paper. Clin Chem. 1987;33(6):761-4.
14. Mitchell ML, Hermos RJ. Cortisol in dried blood screening specimens from newborns with raised 17a-Hydroxyprogesterone and congenital adrenal hyperplasia. Clin Endocrinol. 1998;48:757-60.
Recibido: 24 de noviembre de 2010.
Aprobado: 10 de febrero de 2011.
Autor para la correspondencia: Dr. Joel Varona Sánchez. Hospital Ginecoobstétrico “Ramón González Coro”. Correo electrónico: joelvarona@infomed.sld.cu