Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol vol.37 no.4 Ciudad de la Habana oct.-dic. 2011
OBSTETRICIA
Frecuencia y factores de riesgo asociados con la aparición de Diabetes Mellitus Gestacional
Frequency and risk factors associated with appearance of gestational diabetes mellitus
Dr. Eduardo Valdés Ramos, Lic. Isandra Blanco Rojas
Hospital Provincial Docente Clínico Quirúrgico "Carlos Manuel de Céspedes". Bayamo. Granma, Cuba.
RESUMEN
Introducción: la Diabetes Mellitus Gestacional (DMG) se asocia a una mayor frecuencia de complicaciones maternas y perinatales.
Objetivo: determinar la frecuencia y los factores de riesgo asociados con la aparición de la DMG.
Métodos: se realizó un estudio analítico retrospectivo de tipo caso control con 639 embarazadas ingresadas en el Hospital "Carlos Manuel de Céspedes" de Bayamo, Granma entre enero del 2009 y junio del 2010. La muestra se seleccionó por el método aleatorio simple: 213 con DMG (casos) y 426 sin DMG (controles). De las historias clínicas de cada uno de los casos seleccionados se obtuvieron datos de las variables sociodemográficas y clínicas estudiadas.
Resultados: la edad media al diagnóstico de DMG fue de 22,29 sem. La prevalencia de DMG en los casos estudiados fue de 3,27 %. La glicemia en ayunas ³ de 4,4 mmol/l se detectó en el 99, 53 % de las pacientes con DMG (p = 0,0000) y la obesidad en el 45,53 % (p = 0,1482). No hubo una asociación significativa entre la edad ³ de 30 años, los antecedentes de Diabetes mellitus en familiares de primer grado y el polihidramnios con el desarrollo de DMG. Los antecedentes obstétricos desfavorables de mayor prevalencia fueron: la mortalidad perinatal (3,28 %, p = 0,0132), seguido de la DMG (2,81 %, p = 0,0035) y las malformaciones congénitas (2,34 %, p = 0,0090).
Conclusiones: la DMG es frecuente en nuestro medio y los factores de riesgo más importantes para su desarrollo son: glicemia en ayunas ³ de 4,4 mmol/l, sobrepeso y obesidad así como los antecedentes obstétricos desfavorables.
Palabras clave: Diabetes mellitus gestacional, obesidad, factores de riesgo.
ABSTRACT
Introduction: The gestational diabetes mellitus (GDM) is associated with a greater frequency of mother and perinatal complications.
Objective: To determine the frequency and the risk factors associated with appearance of the GDM.
Methods: A case-control, retrospective and analytical study was conducted in 639 pregnants admitted in the "Carlos Manuel de Céspedes" Hospital of Bayamo, Gramma province from January, 2009 to June, 2010. Sample was selected by the simple randomized method: 213 cases presenting with GDM (cases) and 426 without it (controls). From the medical records of each case selected authors collected data on the study sociodemographic and clinical variables.
Results: The mean age at GDM diagnosis was of 22.29 weeks. GDM prevalence in study cases was of 3.27 %. The fasting glycemia ³ 4.4 m mol/l was detected in the 99.53 % of GDM patients (p = 0.0000) and the obesity in the 45.53 % (p = 0.1482). There was not significant association between the age ³ 30 years, the family history of first degree diabetes mellitus and the poly-hydramnios with de GDM development. The more prevalent unfavourable obstetric backgrounds were: perinatal mortality (3.28 %, p = 0.0132) followed by GDM (2.81 %, p = 0.0035) and the congenital malformations (2.34 %, p = 0.00090).
Conclusions: The GDM is frequent in our environment and the more significant risk factors for its development were: fasting glycemia ³ 4.4 m mol/l, excess weight and obesity, as well as the unfavourable obstetric backgrounds.
Key words: Gestational diabetes mellitus, obesity, risk factors.
INTRODUCCIÓN
La Diabetes Mellitus Gestacional (DMG) es la alteración del metabolismo de los hidratos de carbono, de severidad variable, que comienza o se reconoce por primera vez durante el embarazo.1 Se ha asociado con una mayor frecuencia de complicaciones maternas y perinatales. Entre las primeras están: una alta incidencia de preeclampsia, índices de operación cesárea más elevados y Diabetes mellitus tipo 2 (DM2) en períodos posteriores al parto; entre las segundas, se señalan: la macrosomía, hipoglucemia, mayor riesgo de obesidad en la infancia y adolescencia, así como Diabetes mellitus (DM) en la edad adulta.2,3
La incidencia poblacional de diabetes gestacional varía aproximadamente entre un 3 y un 10 %, según etnias, criterios diagnósticos y áreas poblacionales estudiadas.4 En los Estados Unidos, son diagnosticados 135 000 nuevos casos por año, teniendo una prevalencia de 1,4 % a 2,8 %, en poblaciones de bajo riesgo y de 3,3 % a 6,1 %, en las de alto riesgo.5 En Cuba, estudios efectuados han informado que la prevalencia es de aproximadamente 4,5 %.6
Se han descrito varios factores de riesgo para el desarrollo de DMG. Entre los más importantes están: edad materna > de 30 años, sobrepeso corporal materno ³ 120 % o IMC ³ 26,0, antecedentes de Diabetes Mellitus (DM) en familiares de primer grado y antecedentes de DMG en embarazos previos. Conocer la prevalencia de estos factores en la población obstétrica de nuestro medio es una herramienta muy importante para la detección precoz de la DMG en la atención primaria de salud. A su vez, el diagnóstico temprano de esta entidad es muy importante, debido a que un buen control metabólico reduce en forma significativa el riesgo de las complicaciones materno-fetales,7,8 y permite detectar tempranamente una población de mujeres con riesgo de contraer DM después de finalizado el embarazo.
Teniendo en cuenta que en la provincia Granma son pocos los estudios que abordan esta problemática, los autores de este trabajo decidieron realizar la presente investigación con la finalidad de determinar la frecuencia de DMG y los factores de riego asociados con su desarrollo en un grupo de gestantes del territorio.
MÉTODOS
Se realizó un estudio analítico retrospectivo de tipo caso control con 639 embarazadas ingresadas en el servicio de ginecobstetricia del Hospital "Carlos Manuel de Céspedes" de Bayamo, en el periodo comprendido entre enero del 2009 hasta junio del 2010.
El universo de estudio estuvo constituido por las 7 215 gestantes ingresadas en el servicio de obstetricia de esta institución durante el período de tiempo estudiado. El tamaño de la muestra se calculó con el paquete estadístico EPIDAT, versión 3.1 y se fijaron los siguientes parámetros: proporción de casos expuesto 6,58 %, proporción de controles expuesto 2 %, una potencia del 80 %, un nivel de confianza 95 %, un OR esperado de 2,277. Se encontró un tamaño de muestra de 639, seleccionados por el método aleatorio simple: 213 con DMG, diagnosticadas según los criterios de la OMS9 (casos) y 426 sin DMG (controles).
Técnicas y procedimientos de obtención de la información
De las historias clínicas (HC) de cada uno de los casos seleccionados se obtuvieron datos sobre los siguientes aspectos: edad, edad al diagnóstico de la DMG (casos), color de la piel, nivel escolar, procedencia, antecedentes de DM en familiares de primer grado, peso, talla, niveles de glicemia en ayunas, presencia de polihidrannios, así como los antecedentes obstétricos de: macrosomía, mortalidad perinatal, DMG y malformaciones congénitas.
Se consideraron antecedentes de DM de primer grado: padre, madre y hermanos. Para evaluar el estado nutricional se utilizó el índice de masa corporal (IMC) que se calculó mediante la siguiente fórmula: peso (Kg) / talla (m2);10 se tuvo en cuenta para la clasificación de las pacientes en bajo peso, normopeso y sobrepeso, los criterios recomendados por el Programa Nacional de Diabetes y Embarazo.11
Se utilizó el valor de la glucemia en ayunas ³ 4,4 mmol/ L (80 mg/dl) como riesgo para desarrollar DMG. Para el diagnóstico de polihidramnios se usaron tanto los criterios clínicos recomendados por el Grupo Nacional de Obstetricia y Ginecología,12 como los estudios ultrasonográficos: cuando la cifra del índice de líquido amniótico precisado por ultrasonido se encuentra por encima del 97 percentil, en relación con la edad gestacional que tiene la gestante en el momento de practicada la exploración ultrasonográfica.13
Para los antecedentes obstétricos desfavorables como: macrosomía, mortalidad perinatal, DMG y malformaciones congénitas, se tuvo en consideración la existencia de diagnósticos o anotaciones médicas argumentadas que afirmaban estas entidades.
Análisis estadístico
Se obtuvieron distribuciones de frecuencia (números y porcentajes) de las variables cualitativas y la media y desviación estándar, para variables cuantitativas. Se usó la regresión logística univariada para analizar la relación entre las variables estudiadas. Se empleó la prueba de Chi cuadrado para probar la hipótesis sobre la relación que pudiera existir entre las variables, y el valor p < 0,05 para la significación estadística. El procesamiento estadístico de los datos obtenidos en las HC revisadas se efectuó con la utilización del programa Epidat 3.1.
RESULTADOS
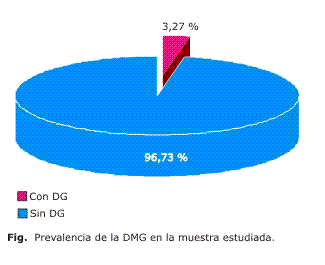
La prevalencia de Diabetes Mellitus Gestacional (DMG) en la población estudiada se observa en la figura. De un total de 7 215 gestantes ingresadas en el Hospital "Carlos Manuel de Céspedes" durante el periodo estudiado, 236 un 3,27 % presentaron DMG.
En la tabla 1 se representan algunas características clínicas y demográficas de la muestra estudiada. La edad media de la muestra fue de 27,31 años. Se encontró una asociación significativa entre vivir en una zona urbana (0,0013) y la DMG. No hubo relación estadísticamente significativa entre la edad, color de la piel y el nivel escolar con la aparición de la DMG. La edad gestacional media al efectuarse el diagnostico de DMG fue de 22,29 sem.
Tabla 1. Características clínicas y demográficas de la muestra estudiada. Relación con la presencia de DMG
| Variables cualitativas | Con DG | Sin DG | Total | Valor | |||||
| n | % | n | % | n % | |||||
| Color de la piel | | | 0,1651 | ||||||
| Blanca | 80 | 37,5 | 167 | 39,2 | 247 | 38,6 | |||
| Negra | 2 | 0,9 | 14 | 3,3 | 16 | 2,5 | |||
| Mestiza | 131 | 61,6 | 245 | 57,5 | 376 | 58,9 | |||
| Escolaridad | | | 0,7388 | ||||||
| Primaria | 70 | 32,8 | 138 | 32,4 | 208 | 48,8 | |||
| Media | 113 | 53,1 | 218 | 51,2 | 331 | 77,7 | |||
| Superior | 30 | 14,1 | 70 | 16,4 | 100 | 23,5 | |||
| Zona urbana | 140 | 65,7 | 223 | 52,3 | 363 | 56,8 | 0,0013 | ||
| Rural | 73 | 34,3 | 203 | 47,7 | 276 | 43,2 | |||
| Edad* | 26.65 | 6,46 | 27,65 | 6,49 | 27,31 | 6,49 | 0,0664 | ||
| EG al diagnóstico de la DMG * | 22,29 | 7,56 | | | | | | ||
* Media y desviación estándar.
Luego se buscó el nivel de influencia de los factores de riesgo asociados al desarrollo de DMG en la serie estudiada, representados en la tabla 2. La glicemia en ayunas ³ de 4,4 mmol/l se presentó en el 99, 53 % de las pacientes con DMG y solo en un 1, 40 % de las no diabéticas (p= 0,0000); por su parte, la obesidad se detectó en el 45,53 % de las mujeres con DMG, mientras en la no diabéticas solo en el 6,10 % (p=0,1482). No hubo una asociación significativa entre la edad e» de 30 años, los antecedentes de DM en familiares de primer grado y el polihidrannios con la aparición de la DMG.
En cuanto a los antecedentes obstétricos desfavorables el de mayor prevalencia fue la mortalidad perinatal (3,28 % p=0,0132), seguido de la DMG (2,81 % p=0,0035) y las malformaciones congénitas (2,34 % (p=0,0090). No se encontró una asociación significativa entre la macrosomía previa y la DMG en esta serie (tabla 3).
DISCUSIÓN
La frecuencia de DMG evidenciada en este estudio (3,27 %) es similar a la reportada por otros autores en nuestro país. Así Muñoz y otros14 estudiaron 87 adolescentes con una edad promedio de 17 años; de ellos el 5,74 % sufrieron una DMG. También Rimbao D y otros15 investigaron 113 adolescentes en el Hospital Ginecobstétrico Universitario "América Arias", de Ciudad de La Habana y demostraron que la frecuencia de la DMG en las adolescentes fue 2,7 %. Los resultados observados en la presente investigación no difieren de las reportadas en países como: España, donde se estima que la prevalencia de esta entidad está entre el 2,5 y el 7,3 % de la población obstétrica general;16 México en el que se reporta un 4,3 %;17 Argentina un 5 %18 y Brasil de 2,4 % a 7,2 %.19
La prevalencia de DMG varía según el criterio diagnóstico utilizado. En el año 1997, la American Diabetes Asociación (ADA) adoptó los criterios de Carpenter y Coustan20 para el diagnóstico de la DMG,21 con puntos de corte más bajos que los establecidos por el National Diabetes Data Group (NDDG) en 1979 para los valores de glucemia en la prueba de sobrecarga oral de 100 g de glucosa (SOG).22 La primera consecuencia de este cambio de criterios fue el aumento en un 50 % de la prevalencia de DMG en la población estadounidense comprobado en un estudio realizado en el año 2002 por Ferrara y otros23 con 26 481 gestantes, en el que compararon la prevalencia de DMG utilizando ambos criterios, y observaron que, si se emplean los criterios propuestos por la NDDG, la prevalencia sería del 3,2 %; y si se usan los de la ADA, del 4,8 %.
En Cuba se utilizan los criterios de la OMS9 para el diagnóstico de la DMG. La búsqueda de esta entidad es prioritaria en el programa materno infantil y se inicia desde la primera consulta de la gestante a la atención primaria de salud; de ahí, que pensamos que el margen de error en la frecuencia de DMG identificada en este grupo de gestantes de la provincia Granma sea mínimo.
La edad gestacional media al diagnóstico de la DMG detectada en la presente investigación (22,29 sem) confirma que es una entidad de la segunda mitad del embarazo. Se considera que durante este periodo se produce un efecto diabetógeno producido por el aumento de hormonas hiperglucemiantes (cortisol, lactógeno placentario, prolactina y progesterona), lo que provoca resistencia a la insulina. Este efecto va aumentando a medida que avanza la gestación. Si la reserva pancreática responde adecuadamente, no habrá alteraciones en el metabolismo de la glucosa; pero si esta reserva está disminuida, aparecerá la DMG.24 En un estudio realizado por Cruz HJ y otros25 con 256 pacientes diabéticas gestacionales, atendidas en el Servicio de Diabetes y Embarazo del Hospital Ginecobstétrico "América Arias" de Ciudad de La Habana durante el período 2003-2006 encontraron que al 58,2 % de las gestantes se les diagnosticó la enfermedad después de las 30 sem.
En la presente investigación fue relevante la asociación de la DMG y las gestantes de procedencia urbana. La urbanización se asocia a un cambio radical del estilo de vida, con un notable aumento del consumo de alimentos ricos en energía y una disminución del gasto de esta, como consecuencia de la menor actividad física. Los índices de urbanización están aumentando en todo el mundo, y se ha pasado de un 37 % de la población mundial residente en zonas urbanas en 1970 a un 45 % en 1994.26
El valor de la glucemia en ayunas ³ 4,4 mmol/L (80 mg/dl), como método de pesquisa fue incorporado en la atención primaria de nuestro país en el año 1999 y ha permitido detectar hasta el 82 % de las diabéticas gestacionales.27 Diferentes autores coinciden en señalar que es uno de los factores de riesgo más fuertemente asociados con el desarrollo de diabetes gestacional, como una expresión de las alteraciones del metabolismo hidrocarbonado presente en estas pacientes.28,29 En la presente investigación este parámetro fue el de más alta prevalencia (99,53 %) y presentó una asociación muy significativa con el desarrollo de la DMG. Resultado similar encontró Casagrandi D y otros30 en un estudio con 60 pacientes con diagnóstico de DMG, atendidas en el Hospital Ginecobstérico "Ramón González Coro" de Cuba, entre 1997 y 1998 en el que la glicemia elevada en ayunas (mayor o igual a 4,4 mmol/L), fue el factor de riesgo más frecuentemente encontrado en ambos grupos de estudio, ya que este antecedente estuvo presente en todas las pacientes estudiadas. Si a estos resultados se añade que la glicemia en ayunas es una prueba sencilla, poco costosa y accesible a toda la población, se puede afirmar que contamos con un estudio muy efectivo para la detección precoz de la DMG.
La relación entre la DM2 y la obesidad es tan estrecha que muchos autores la consideran como un real estado prediabético.31 Estas entidades comparten alteraciones metabólicas como: la resistencia a la insulina, el hiperinsulinismo y una inflamación crónica de bajo grado.32 Se plantea que la obesidad probablemente sea el factor de riesgo más importante para el desarrollo de la DMG,33 y la aparición de complicaciones puede requerir la interacción entre la obesidad materna y la DMG.34
En el presente estudio las mujeres con sobrepeso y obesidad presentaron 1,29 veces más probabilidades de desarrollar DMG que aquellas con peso normal. Estos resultados permiten afirmar que también en la población obstétrica del territorio, la obesidad es un factor importante en la aparición de la DMG. Si se tiene en cuenta, además que el número de personas obesas ha aumentado vertiginosamente y los estudios poblacionales disponibles35 apuntan tendencias crecientes, consideramos que es necesario diseñar estrategias, en la atención primaria de salud, con todas aquellas mujeres en edad reproductiva que presenten sobrepeso u obesidad con la finalidad de que logren un peso lo más cercano posible a la normalidad antes de embarazarse.
Es un hecho conocido desde hace muchos años, que la edad es un factor importante en el riesgo de desarrollar DMG.36 Valls M,37 en un estudio en el Hospital Docente Ginecobstétrico "América Arias" durante el año 2007, encontró un 9,6 % de DMG en mujeres mayores de 40 años y solo un 0,9 % entre aquellas que tenían de 20 a 34 años de edad. También Ronzón-Fernández A,38 en un estudio realizado en el área de Avilés (Asturias), en el año 2003, encontró que la edad fue significativamente mayor en el grupo DMG (media, 33,2 frente a 31,1 años; intervalo de confianza del 95 % de la diferencia de la media, 1,87-2,34; (p = 0,025). En la presente investigación las mujeres de 30 o más años representaron un porcentaje elevado, tanto en el grupo de gestantes con DMG como en aquellas que no presentaron este trastorno, sin que se detectara una asociación estadísticamente significativa entre la edad y la aparición de esta entidad. En este resultado pudiera haber influido la similitud de la edad media del grupo de estudio y control, 26,65 (6,46) y 27,65 (6,49) respectivamente.
Finalmente se analizaron los antecedentes obstétricos adversos. Estos se presentaron en un porcentaje bajo en la muestra estudiada; sin embargo, estadísticamente se asociaron significativamente con la aparición de la DMG. Las mujeres con historia de DMG presentaron 12,08 veces más probabilidad de desarrollar nuevamente esta entidad, que aquellas que no la presentaron. Resultado similar encontraron Varillas C y otros39 en 115 mujeres diabéticas gestacionales controladas en la consulta de Alto Riesgo Obstétrico en el Complejo Hospitalario de Ourense, España entre enero de 2001 y enero de 2004, donde el antecedente de DMG incrementó el riesgo de presentar dicha patología en una gestación posterior a un 20,59 %. Las malformaciones congénitas, mortalidad perinatal inexplicable y la macrosomía también elevaron el riesgo de desarrollar la DMG. De acuerdo a estos resultados se puede afirmar que los antecedentes obstétricos desfavorables, como factores de riesgo, continúan vigentes y la presencia de ellos obliga a la realización de la PTG-O de 28 a 32 sem aunque la embarazada no presente glicemias ³ de 4,4 mmol/l u otros factores de mayor incidencia.
Con los resultados de esta investigación se concluye que la DMG es frecuente en nuestro medio y que los factores de riesgo más importantes para su desarrollo son: la glicemia en ayunas ³ de 4,4 mmol/l, sobrepeso y obesidad, así como los antecedentes obstétricos desfavorables.
REFERENCIAS BIBLIOGRÁFICAS
1. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care. 2002;25 (Suppl 1):55-9.
2. American Diabetes Association. Gestational diabetes mellitus. Diabetes Care. 2004;27(Suppl 1):S88-90.
3. Almirón ME, Gamarra SC, González MS, Issler JR. Diabetes gestacional. Rev Postgr VIa Cátedr Med. 2005;152:23-7.
4. Hollander MH, Paarlberg KM, Huisjes AJ. Gestational diabetes: a review of the current literature and guidelines. Obstet Gynecol Surv. 2007;62(2):125-36.
5. Brody SC, Harris R, Lohr K. Screening for gestational diabetes: a summary of the evidence for the U.S. Preventive Services Task Force. Obstet Gynecol. 2003;101:380-92.
6. Valdés L, Santana O. Diabetes mellitus y gestación. En: Rigol O. Obstetricia y Ginecología. La Habana: Editorial de Ciencias Médicas; 2004. p. 191-7.
7. Terreno A, Venzant M, Reyes IS, Hechavarría AA. Efectos de la diabetes gestacional sobre los resultados perinatales. MEDISAN. 2005;9(2):1-3.
8. López-Quesada E, Prada E. Morbilidad gestacional. Ginecol Obstet Clín. 2005;6(1):8-23.
9. World Health Organization. Definition and classification of diabetes mellitus and complications. Report of WHO consultation. Part 1: Diagnosis and classification of diabetes mellitus. Génova: WHO. Department of Noncommunicable Desease Surveillance; 1999.
10. World Health Organization. Expert Committee Phycal Status. The use and interpretation of anthropometry. Geneva: WHO. Technical Report Serie No 854; 1995.
11. Valdés L, Márquez A, Santana O, Lang J, Rodríguez B. Diabetes y Embarazo. Orientaciones para la Atención Primaria y Secundaria. Hospital Ginecobstétrico Docente "Ramón González Coro" e Instituto Nacional de Endocrinología (Servicio Central de Diabetes y Embarazo), La Habana; 2002.
12. Colectivo de autores. Polihidramnios. En: Colectivo de autores. Manual de diagnóstico y tratamiento en obstetricia y perinatología. La Habana: Editorial Ciencias Médicas; 1997. p. 186-8.
13. Colectivo de autores. Ultrasonido en obstetricia. En: Colectivo de autores. Manual de diagnóstico y tratamiento en obstetricia y perinatología. La Habana: Editorial Ciencias Médicas; 1997. p. 114-25.
14. Muñoz A, Zamarreño W. Comportamiento del embarazo en la adolescencia en 87 pacientes. Rev 16 de abril. 2006;223:1-13.
15. Rimbao Torres G, Cruz Hernández J, Safora Enríquez O, Rodríguez Izquierdo A, Morales Chamizo M, Velasco Boza A. Comportamiento de la diabetes gestacional en el embarazo en la adolescencia. Rev Cubana Med Gen Integr [revista en la Internet]. 2007;23(3).
16. Ricart W, López J, Mozas J. Potential impact of American Diabetes Association (2000) criteria for diagnosis of gestational diabetes mellitus in Spain. Diabetologia. 2005;48:1135-41.
17. Forsbach G, Vázquez J, Álvarez C, Vázquez JG. Diabetes y embarazo en México. Rev Invest Clin. 1998;50(3):227-31.
18. Domenech MI, Manigot DA. Diabetes gestacional. Rev Medicina. 2001;61(2):25-38.
19. Schmidt MI, Duncan BB, Reichelt AJ, Branchtein L, Matos MC, Costa e Forti A, et al. Gestational diabetes mellitus diagnosed with a 2-h 75-g oral glucose tolerance test and adverse pregnancy outcomes. Diabetes Care. 2001;24:1151-5.
20. Carpenter MW, Coustan DR. Criteria for screening tests for gestational diabetes. Am J Obstet Gynecol. 1982;144:768-73.
21. American Diabetes Association. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care. 1997;20:1183-97.
22. National Diabetes Data Group. Classification and diagnosis of diabetes mellitus and other categories of glucose intolerance. Diabetes. 1979;28:1039-57.
23. Ferrara A, Hedderson MM, Quesenberry CP. Prevalence of gestational diabetes mellitus detected by the National Diabetes Data Group or the Carpenter and Coustan plasma glucose thresholds. Diabetes Care. 2002;25:1625-30.
24. Almiron ME, Gamarra SC, González MS, Issler JR. Diabetes gestacional. Rev UNNE. 2005;152:23-7.
25. Cruz H J; Hernández G P; Yanes Q M; Rimbao T G; Lang P J; Márquez G A. Macrosomía neonatal en el embarazo complicado con diabetes. Rev Cubana Med Gen Integr. 2008;24(3).
26. Yusuf S, Reddy S, Ounpuu S, Anand S. Global burden of cardiovascular diseases: part I: general considerations, the epidemiologic transition, risk factors, and impact of urbanization. Circulation. 2001;104:2746-53.
27. Valdés L. La diabetes mellitus gestacional. Rev Cubana Obstet Ginecol. 2010;36(2):1-2.
28. Martin, MC. Diabetes and pregnancy. In: DeCherney AH,Pernoll ML. Current Obstetric and Gynecologic diagnosis and treatment. U.S.A: Appleton and Lange; 1994. p. 996.
29. Complicanze mediche della gravidenza. In: Pescetto S, De Cecis L, Pescorari D, Ragni, N. Manuale di Ginecología e Ostetricia l-Ginecologia. Roma: S.E.U; 1992. p. 234.
30. Casagrandi D, Sanabria AM, Cabrera E, Pérez J. Anticuerpos antiislotes pancreáticos en diabéticas gestacionales: problemas maternos y complicaciones neonatales. Rev Cubana Obstet Ginecol. 2001;27(1):46-52.
31. Schienkiewitz A, Schulze MB, Hoffmann K, Kroke A, Boeing H. Body mass index history and risk of type 2 diabetes: results from the European Prospective Investigation into Cancer and Nutrition (EPIC)-Potsdam Study. Am J Clin Nutr. 2006;84(2):427-33.
32. Salvador J. The debate about metabolic syndrome: a cluster of concepts, perspectives, semantics and research. Obes Metab. 2007;3:1-4.
33. Jensen DM, Damm P, Sorensen B, et al. Clinical impact of mild carbohydrate intolerance in pregnancy: a study of 2904 nondiabetic Danish women with risk factors for gesta tional diabetes mellitus. Am J Obstet Gynecol. 2001;185:413-9.
34. Martínez-Frías ML, Frías JP, Bermejo E. Pre-gestational maternal body mass index predicts an increased risk of congenital malformations in infants of mothers with gestational diabetes. Diabetic Med. 2005;22:775-81.
35. Ogden CL, Carroll MD, Curtin LR, McDowell MA, Tabak CJ, Flegal KM. Prevalence of overweight and obesity in the United States, 1999-2004. JAMA. 2006;295:1549-55.
36. Bendezú G. Gestación en edad avanzada. Ginecología y Obstetricia. 2002;47(3):47.
37. Valls H M; Safora E O; Rodríguez I A; López R J. Comportamiento del embarazo en mujeres mayores de 40 años. Rev Cubana Obstet Ginecol. 2009;35(1).
38. Ronzón-Fernández A, Maza-López A, Maciá- Bobes C, García-Bao C, Gómez-Castro MJ. Incidencia de diabetes mellitus gestacional en el área sanitaria de Avilés (Asturias) en el año 2003. Asociación con la morbilidad maternofetal (estudio preliminar). Aten Primaria. 2006;37:418-9.
39. Varillas C, Blanco S, Couso B, Gastelu-Iturri J, Reboredo R. Diabetes gestacional: su complejidad y repercusión en la evolución del embarazo y salud del recién nacido. Prog Obstet Ginecol. 2005;48:289-96.
Recibido: 9 de julio de 2011.
Aprobado: 24 de julio de 2011.
Eduardo Valdés Ramos. Hospital Provincial Docente Clínico Quirúrgico "Carlos Manuel de Céspedes". Carretera central vía Santiago de Cuba km 2. Bayamo. Granma, Cuba. Correo electrónico: evaldes@grannet.grm.sld.cu