Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol vol.38 no.1 Ciudad de la Habana ene.-mar. 2012
PRESENTACIÓN DE CASO
Toxoplasmosis y embarazo
Toxoplasmosis and pregnancy
Dra. Rita Sánchez Lombana,I MSc. Dra. Martha Patricia Couret Cabrera,I Dra. Doris Ginorio GavitoII, Dr. Alfredo Nodarse Rodríguez,I MSc. Dra. Niobys Sánchez Ramírez, I Dra. Irina Soler Guibert ,I Dra. Ada Ortúzar Chirino,I Dra. Ana Mary Sanabria Arias,I MSc. Dr. Ramón Alberto Peña AbreuI
I Hospital Ginecobstétrico Docente "Ramón González Coro". La Habana, Cuba.
II Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
RESUMEN
Introducción: la toxoplasmosis es una zoonosis que afecta a un tercio de la población mundial. Se asocia con infecciones congénitas y aborto.
Objetivo: describir un caso clínico de una paciente con toxoplasmosis asociada al embarazo.
Métodos: paciente de 36 años de edad que a las 21 sem de embarazo es valorada por el Departamento de Genética Provincial de La Habana por determinación de IgM para toxoplasma positivo. Se le realizan determinaciones de IgG e IgM y reacción en cadena de la polimerasa (PCR) en líquido amniótico para toxoplasma, la cual resultó positiva. Se ofrece asesoramiento genético a la pareja y se comienza tratamiento específico. A las 32 sem ingresa en nuestro servicio con el diagnóstico de amenaza de parto pretérmino. Se realizó cesárea segmento corpórea y esterilización quirúrgica con el diagnóstico de sufrimiento fetal agudo.
Resultados: se obtiene un recién nacido vivo masculino, peso 1 800 g, Apgar 9/9. Se le comienza al recién nacido tratamiento con sulfadiacina, pirimetamina y ácido folínico. Posteriormente se le realizan determinaciones de IgG e IgM los cuales fueron negativos. Se le da alta a los 42 días con 2 520 g de peso y evolución favorable. Valoración por oftalmología al alta. Se orienta seguimiento serológico del recién nacido.
Conclusiones: la tasa de transmisión en la seroconversión se incrementa por semana de edad gestacional, lo cual hace necesario comenzar una terapéutica precoz para evitar las complicaciones y realizar un seguimiento a largo plazo de estos recién nacidos para evaluar el pronóstico de la enfermedad.
Palabras clave: toxoplasmosis, Toxoplasma Gondii, zoonosis, embarazo, amenaza de parto pretérmino, infección congénita.
ABSTRACT
Introduction: The toxoplasmosis is a zoonosis involving a third of world population. It is associated with congenital infections and abortion.
Objective: To describe a clinical case of a patient presenting with toxoplasmosis associated with pregnancy.
Methods: Patient aged 36 who at 21 weeks of pregnancy is assessed by the Provincial Genetics Department of La Habana by determination of IgM for positive toxoplasmosis. IgG and IgM determinations were performed and polymerase chain reaction (PCR) in amniotic fluid for Toxoplasm, which was positive. The couple received genetic advice and started a specific treatment. At 32 weeks is admitted in our service diagnosed with preterm delivery threat. A cesarean section of corporeal segment was carried out as well as surgical sterilization with a diagnosis of acute fetal suffering.
Results: The conception was a male newborn weighing 1 800 g, a 9/9 Apgar scale. The newborn receive treatment with sulfadiazine, pirimetamine and folinic acid. Later, IgE and IgM determinations were made being negatives. She is discharged at 42 days weighing 2 520 g, a favorable evolution and ophthalmic assessment. Serologic follow-up of newborn was prescribed.
Conclusions: Transmission rate in the seroconversion increases by week of gestational age, thus it is necessary to start an early therapy to avoid the complications and to carry out the long-term follow-up of these newborns to assess the disease prognosis.
Key words: toxoplasmosis, Toxoplasma gondii, zoonosis, pregnancy, threat of preterm delivery, congenital infection.
INTRODUCCIÓN
El Toxoplasma Gondii (T. Gondii) es un parásito intracelular obligado, con una amplia distribución mundial, presente en todos los climas, en todas las agrupaciones animales de sangre caliente y en todos los tejidos de esos animales.1 Fue descrito inicialmente en los tejidos del Ctenodoactylus gundi, un roedor del Norte de África por Nicolle y Manceaux en 1908. En ese mismo año, Splendore (1908) en Brasil reportó la identificación de este organismo en los tejidos de un conejo. En 1939 Wolf, Cowen y Paige fueron los primeros en identificar de forma concluyente el Toxoplasma Gondii (T. Gondii) como causa de enfermedad humana. Las formas quísticas fueron reconocidas por Frenkel y Friedlander (1951), pero no fue hasta 1960 y 1970 que el parásito se identificó como un coccidio.2 Aproximadamente 5/1000 mujeres embarazadas no inmunes pueden adquirir infección por toxoplasma, con un riesgo de un 10 100 % de transmisión al recién nacido (RN). Durante el embarazo la infección puede diseminarse al feto a través de la placenta y producirle crecimiento intrauterino restringido, muerte fetal, retraso mental, defectos oculares y ceguera.3
MÉTODOS
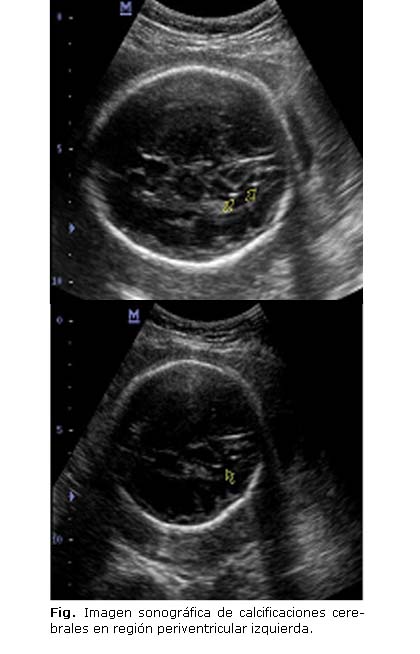
Gestante de 36 años de edad con antecedentes de asma bronquial para la cual llevó tratamiento con esteroides previo al embarazo e historia obstétrica de G8 P3, un parto eutócico de 37 sem, 2 partos inmaduros, rotura prematura de membranas (A4 3 provocados y 1 espontáneo), que a las 21 sem de edad gestacional acude al Departamento de Genética Provincial de La Habana remitida de su área de salud para consulta de evaluación de riesgo por determinación de IgM para Toxoplasma positivo. Ese día se le realiza ultrasonido (US) genético prenatal con biometría para 20 sem de gestación, y marcadores de aberraciones cromosómicas y de sepsis fetal negativos. Se indica (US) evolutivo y nueva determinación de inmunoglobulinas específicas para toxoplasma (IgG e IgM) en suero materno. A las 26 sem se le realiza (US) donde no se observan anomalías estructurales ni marcadores de infección congénita. A las 29 sem se le realiza (US) evolutivo con biometría acorde con la edad gestacional y se observan pequeñas imágenes ecogénicas en región periventricular de ventrículo lateral izquierdo sugestivo de calcificaciones cerebrales, resto de las estructuras cerebrales y fetales normales. Se ofrece asesoramiento genético (AG) y se brinda opción de estudio de toxoplasma por técnica de PCR en líquido amniótico (LA). La pareja acepta el proceder y se le realiza amniocentesis al día siguiente, se envía la muestra al laboratorio de parasitología del Instituto "Pedro Kourí" (IPK). El resultado de la PCR fue positivo. A las 31 sem de gestación se le realiza otro ultrasonido (US) donde se observan imágenes sugestivas de calcificaciones cerebrales en región periventricular izquierda. Se discute el caso en colectivo y se ofrece asesoramiento genético (AG) a la pareja teniendo en cuenta los hallazgos encontrados (Fig.).
A las 32 sem de gestación ingresa en el Servicio de Medicina Materno Fetal del Hospital Ginecobstétrico "Ramón González Coro" en La Habana, por modificaciones cervicales y contracciones uterinas dolorosas. Al ingreso se le realiza una sonografía transvaginal donde se constata un cérvix funcional de 17 mm, con un orificio cervical interno (OCI) (abierto) 16 mm, tunelizado las dos terceras partes y presentación pelviana que apoya en el cérvix.
Examen físico:
- Mucosas húmedas y normocoloreadas.
- Temperatura: 36 ºC.
- Aparato respiratorio:
Murmullo vesicular conservado.
No estertores roncos ni sibilantes.
Frecuencia respiratoria: 20/min.
- Aparato cardiovascular:
Ruidos cardíacos rítmicos y bien golpeados.
No se auscultan soplos.
Tensión arterial miembros superiores: 120/70
Frecuencia cardiaca central (FCC): 80/min
Pulso radial: 80/min
- Abdomen:
Altura uterina: 35 cm.
Presentación pelviana.
Dorso derecho.
Frecuencia cardiaca fetal: 149/136/140 por minuto.
Dinámica uterina: 2/10'/20''.
Tono uterino normal.
Tacto vaginal V: Cérvix corto central.
Espéculo: orificio cervical externo (OCE) que impresiona entreabierto. No se constata salida de líquido amniótico (LA).
- Tejido celular subcutáneo (TCS): No infiltrado.
- Exámenes complementarios:
Hb: 9,2 g/l: (anemia moderada).
Hto: 29,2 % (anemia moderada).
Serología: no reactiva.
Leucocitos: 7,9x103 /l.
VIH: negativo.
Plaquetas: 187x103 /l.
Linfocitos: 24,3 %.
Neutrófilos: 67,7 %.
Monocitos: 8,0 %.
Eritrosedimentación: 83 mm.
Urocultivo: negativo.
Proteína C Reactiva: negativa.
Lámina periférica: hematíes normocíticos-normocrómicos, leucocitos normales.
Se comienza tocolisis oral con nifedipino e inducción de la maduración pulmonar fetal con betnazol profilaxis antibiótica contra estreptococo b hemolítico según protocolo del servicio para la amenaza de parto pretérmino. Se logra detener temporalmente. Se vigila la aparición de signos clínicos de corioamnionitis, y se realiza perfil de sepsis periódicamente
A los 3 días la paciente comienza en fase activa del trabajo de parto y se procede a monitorización fetal electrónica resultando patológica. Se realiza cesárea segmento corpórea y esterilización quirúrgica con el diagnóstico de sufrimiento fetal agudo, se obtuvo un recién nacido (RN) vivo, masculino, de 1 800 g de peso, y Apgar 9/9. La placenta se envió para biopsia, resultando corioamnionitis ligera. Se inició tratamiento al RN con sulfadiacina 100 mg/kg/día y pirimetamina 1mg/kg/día durante 7 días y ácido folínico. Perfil de sepsis negativo. Títulos de IgG e IgM negativos.
Alta a los 42 días con (RN) de 2 520 g de peso y evolución favorable. Valoración por oftalmología al alta de forma ambulatoria. Se orienta seguimiento serológico del RN.
DISCUSIÓN
El Toxoplasma Gondii (T. Gondii) es un parásito protozoario que infesta a un tercio de la población mundial. La infestación se adquiere principalmente por la ingestión de comida y de agua contaminadas por los oocystos eliminados por los gatos o la ingestión de carne cruda que contenga los quistes. Este parásito protozoario tiene 3 formas de vida: una considerada la forma de resistencia interior o quiste; la otra llamada forma de resistencia en el medio exterior u ooquiste; y los taquizoíto o trofozoítos que están relacionados con la forma proliferativa, en la fase aguda de la enfermedad. La forma infectante es el ooquiste presente en la materia fecal de gatos y otros félidos.4
Desde el punto de vista clínico en la mujer embarazada, en más del 90 % de los casos cursa de forma asintomática. La frecuencia de transmisión vertical se incrementa con la edad gestacional. Se estima que la tasa de transmisión al feto es del 15 % si la infección materna es adquirida durante el primer trimestre, 30 % durante el segundo y 60 % en el tercero.4 La transmisión de la infección al feto a partir de una mujer con infección crónica es muy poco probable, pero puede ocurrir en mujeres con disturbios inmunológicos, como mujeres con SIDA, Linfoma de Hodgkin, o Lupus eritematoso sistémico.4,5 La reinfección con Toxoplasma Gondii (T. Gondii) es excepcional pero puede transmitirse al feto cuando esta ocurre durante el embarazo.6 No podemos descartar que esta paciente estuviera infectada con anterioridad al embarazo y se hubiera reinfectado debido a que llevaba tratamiento con esteroides meses antes, por presentar crisis de asma bronquial, lo cual produjo una depresión de su sistema inmune. La protección del huésped frente a T. Gondii resulta en una respuesta inmune mediada por células que incluyen células inflamatorias, linfocitos y macrófagos, y caracterizada como una célula tipo 1 (Th1) - respuesta inmune con producción de interferón (IFN)-y, factor de necrosis tumoral alfa (TNF) - e interleukina(IL)-1 b. Los macrófagos activados por IFN-y inhiben la replicación del parásito a través de un número de mecanismos microbicidas potentes tales como el oxidativo y no oxidativos, así como también la inducción por IFN-y de indoleamina 2,3-dioxigenasa que degrada el triptófano, el cual se requiere para la replicación del T. Gondii. Barbosa y otros demostraron que las citoquinas antiinflamatorias como IL-10 y TGF-ß1 están involucradas en el incremento de la susceptibilidad para la infección a T. Gondii. Estos descubrimientos soportan la hipótesis de que estas citoquinas también pueden facilitar la transmisión del parásito a los tejidos fetales.7 La presencia de inmunoglobulina M, anticuerpos IgM, se reconoce como sugestivo de infección aguda. Sin embargo, estos anticuerpos pueden permanecer detectables hasta 12 años. La inmunoglobulina G (IgG) son indicativos de fase aguda solo si sus títulos aumentan o son de baja avidez.8 Los métodos moleculares juegan un papel importante en el diagnóstico microbiológico de las enfermedades infecciosas debido a su alta especificidad y sensibilidad. Entre estos, la PCR es ahora reconocida como una herramienta diagnóstica esencial para la toxoplasmosis congénita.9 Foulon y otros demostraron que la PCR en el líquido amniótico (LA) tuvo un alto nivel de sensibilidad (81 %) y también un nivel alto de especificidad (96 %).10 En esta paciente este método fue de gran utilidad para el diagnóstico, ya que corroboró este, puesto que la presencia de titulaciones IgM e IgG positivas pudiera estar en relación con una infección antigua a T. Gondii.
El tratamiento medicamentoso para la toxoplasmosis por mucho tiempo ha girado alrededor de supresores de metabolismo del nucleótido del parásito, específicamente la pirimetamina y las sulfas que inhiben la reductasa del dihidrofolato y dihidropteroato sintetasa respectivamente.11 La terapéutica más comúnmente utilizada, y probablemente la más efectiva, es la combinación de pirimetamina con sulfadiacina y el ácido folínico.12 Sin embargo, otras terapéuticas se han utilizado, tales como la espiramicina, clindamicina, claritromicina, azitromicina o atovaquona.13 Otros autores utilizan la espiramicina asociada a las sulfas debido a los efectos teratogénicos potenciales de la pirimetamina, sin embargo esta se asocia a la sulfadiacina cuando existe diagnóstico de infección prenatal.14
A esta paciente se le indicó pirimetamina 50-200 mg/día + sulfadiacina 250-1000 mg C/6h por 1-2 días, seguido de pirimetamina 25-50 mg/día más sulfadiacina 125-500 mg cada 6 h por 2-4 sem. Consideramos que este recién nacido estuvo infectado, pero gracias a la terapéutica utilizada, se evitaron complicaciones y se redujo la severidad de la enfermedad y las manifestaciones de infecciones como la meningitis y el anticuerpo de suero IgM para T. Gondii en el recién nacido no estuvieron presentes. No obstante, se requiere un seguimiento periódico y a largo plazo de este recién nacido, teniendo en cuenta que las titulaciones de IgM e IgG pudieran aparecer tardíamente. Berrébi y otros estudiaron 676 mujeres con seroconversión de toxoplasmosis durante el embarazo, incluyendo 5 mujeres con embarazo gemelar, para un total de 681 fetos. Este autor encontró que las lesiones de coriorretinitis habían aparecido en más del 85 % de los niños a la edad de 5 años, y concluyó que un prolongado seguimiento de al menos 10 años se hace necesario para evaluar el pronóstico de los niños con toxoplasmosis congénita.15
Se concluye que la tasa de transmisión en la seroconversión se incrementa por semana de edad gestacional, lo cual hace necesario comenzar una terapéutica precoz para evitar las complicaciones y debe realizarse un seguimiento a largo plazo de estos RN para evaluar el pronóstico de la enfermedad.
REFERENCIAS BIBLIOGRÁFICAS
1. Ocampo Lina M, Duarte-Gandica I. A model of congenital toxoplasmosis transmission dynamics. Rev salud pública [serial on the Internet]. 2010;12(2). Disponible en: http://www.scielosp.org/scielo.php?script=sci_arttext&pid=S0124 -00642010000200015&lng=en
2. Weiss L DJ. Toxoplasmosis: a history of clinical observations. Int J Parasitol. 2009 July 1;39(8):895-901.
3. Kravetz J. Congenital toxoplasmosis. Yale University School of Medicine. Yale University, West Haven, USA. Published online 2008 March 27. PubMed Central. 2008 Disponible en: http://linkinghub.elsevier.com/retrieve/pii/S0929-693X(11)00183-7
4. Sosa Díaz R, Sosa Díaz J, Jordán M, González G. Toxoplasmosis Congénita. Aspectos a tener en cuenta. Facultad de Ciencias Médicas "Juan Guiteras Gener". Matanzas. Revista Médica Electrónica 2006;28(3). Disponible en: http://www.revmatanzas.sld.cu/revista%20medica/ano%202006/vol3%202006/tema12.htm
5. Montoya JG, Remington JS. Management of Toxoplasma gondii infection during pregnancy.Clin Infect Dis. 2008 Aug 15;47(4):554-66. Disponible en: http://cid.oxfordjournals.org/content/47/4/554.long
6. Valdés V, Legagneur H, Watrin V, Paris L, Hascoët JM. Congenital toxoplasmosis due to maternal reinfection during pregnancy. Arch Pediatr. 2011 Jul; 18(7):761-63. Disponible en: http://linkinghub.elsevier.com/retrieve/pii/S0929-693X(11)00183-7
7. Barbosa B, Silva D, Costa I, Mineo J, Ferro E. BeWo trophoblast cell susceptibility to Toxoplasma gondii is increased by interferon-ã, interleukin-10 and transforming growth factor-â1. Clin Exp Immunol. 2008 March;151(3):536-45.
8.Cañedo Solares I, Ortiz Alegría LB, Figueroa Damián R, Bustos Bahena ML, González Henkel H, Calderón Segura E, et al. Toxoplasmosis in pregnancy: determination of IgM, IgG and avidity in filter paper-embedded blood. J Perinatol. 2009 Oct;29(10):668-72. Disponible en: http://www.nature.com/jp/journal/v29/n10/full/jp200979a.html
9. Year H, Filisetti D, P. Bastien P, Ancelle T, Thulliez P, Delhaes L: Multicenter Comparative Evaluation of Five Commercial Methods for Toxoplasma DNA Extraction from Amniotic Fluid. J Clin Microbiol. 2009 December;47(12):3881-6.
10.Foulon W, Pinon JM, Stary-Pedersen B, Pollak A, Lappalainen M, Decoster A, et al. Prenatal diagnosis of congenital toxoplasmosis: a multicenter evaluation of different diagnostic parameters.Am J Obstet Gynecol. 1999 Oct;181(4):843-7. Disponible en: http://preview.ncbi.nlm.nih.gov/pubmed/10521739
11. Boothroyd J. Toxoplasma gondii: 25 years and 25 major advances for the field. Department of Microbiology and Immunology, Stanford University School of Medicine, Stanford CA 94305-5124, USA. Int J Parasitol. 2009 July 1;39(8):935-46.
12. Montoya JG, Liesenfeld O. Toxoplasmosis. Department of Medicine and Division of Infectious Diseases and Geographic Medicine, Stanford University School of Medicine, Stanford, CA, USA. The Lancet 2004 Jun 12;363(9425):1965-76.
13. Rima McLeod R, Francois Kieffer F, Mari Sautter M, Hosten T, Pelloux H. Why prevent, diagnose and treat congenital toxoplasmosis? Mem Inst Oswaldo Cruz. 2009 March;104(2):320-44.
14. Valentini P, Annunziata M, Angelone D, Masini L, De Santis M, Ranno O, et al. Role of spiramycin/cotrimoxazole association in the mother-to-child transmission of toxoplasmosis infection in pregnancy. European Journal Of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology [serial on the Internet]. (2009 Mar), [cited August 15 2011];28(3):297-300. Disponible en: MEDLINE with Full Text. Available at: http://search.ebscohost.co/login.aspx?directm=true&db=mnh&AN=18716804&lang=es&site=ehost-live
15. Berrebi A, Assouline C, Bessières M-H. Long-term outcome of children with congenital toxoplasmosis. Am J Obstet Gynecol. 2010;203(552):1-6.
Recibido: 2 de octubre de 2011.
Aprobado: 17 de octubre de 2011.
Rita Sánchez Lombana. Hospital Ginecobstétrico Docente Ramón González Coro. Calle 21 y 4. Vedado. La Habana, Cuba. Correo electrónico: rlombana@infomed.sld.cu