Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol vol.38 no.2 Ciudad de la Habana abr.-jun. 2012
GINECOLOGÍA Y SALUD REPRODUCTIVA
Aplicación Intralesional del Interferón alfa 2bHr cubano (Heberon Alfa R®) en el tratamiento de las verrugas genitales
Intralesion application of the Cuban 2bHr Alfa-Interferon (Heberon Alfa R®) in the treatment of genital warts
MSc. Dra. Idania Baladrón Castrillo,I Lic. Zaida Barbón Gassó,II Dra. Ana Margarita Solares Asteasuainzarra,II MSc. Carmen Valenzuela Silva,I Lic. Elizeth García Iglesias,I MSc. Dra. Angela Martínez Martínez-PinilloII
I Centro de Ingeniería Genética y Biotecnología. La Habana, Cuba.
II Hospital Ginecobstétrico "Ramón González Coro". La Habana, Cuba.
RESUMEN
Introducción: la condilomatosis genital es la expresión clínica más frecuente de del virus del papiloma humano. De las alternativas de tratamiento existentes, no hay una de elección y absolutamente eficaz.
Objetivo: describir la seguridad y el efecto del Interferón alfa recombinante, en el tratamiento de las verrugas genitales.
Métodos: se incluyeron 216 mujeres y 111 hombres en un estudio cuasiexperimental. El producto se aplicó en la base de las verrugas a la dosis de 10 millones de unidades internacionales, semanalmente durante 8-16 semanas. Los pacientes fueron atendidos en el Hospital "Ramón González Coro" de La Habana de marzo del 2009 a junio del 2011. Se reportaron los eventos adversos en cada aplicación, estimándose su distribución de frecuencias. Se evaluó la respuesta objetiva de acuerdo al porcentaje de reducción de la sumatoria de los dímetros mayores a las 4, 8 y 16 semanas después de la aplicación. La recurrencia se evaluó a los 24 meses mediante la curva de Kaplan-Meier.
Resultados: se observó respuesta al tratamiento en el 81,5 % de los pacientes. Más del 60 % tuvieron respuesta completa, de los cuales solo el 11,1% resultaron recurrentes. Los eventos adversos más frecuentes fueron: fiebre, cefalea y escalofríos de intensidad leve o moderada.
Conclusiones: la aplicación perilesional de interferón puede considerarse una alternativa segura y eficaz en el tratamiento de las verrugas genitales.
Palabras clave: interferón, verrugas genitales, condilomas acuminados, papilomavirus, eventos adversos, salud reproductiva.
ABSTRACT
Introduction: the genital condyloma is the more frequent clinical expression or the human papilloma virus. From the available alternative of treatment there is not one of election and totally effective.
Objective: to describe the safety and the effect of recombinant alfa-Interferon in treatment of genital warts.
Methods: a quasi-experimental study was conducted in 216 women and in 111 men. The above mentioned Interferon was applied in the basement of warts at a dose of 10 millions of international units weekly during 8-16 weeks. Patients were seen in the "Ramón González Coro" Gynecology and Obstetrics Hospital of La Habana from March, 2009 to June, 2011. In each application the adverse events were reported, estimating its frequency distribution. The objective response was assessed according to the percentage of reduction of the sum of the great diameters at 4, 8 and 16 weeks after the application. Recurrence was assessed at 24 months using the Kaplan-Meier curve.
Results: there was response to treatment in the 81.5 % of patients. More than 60 % had a total response where only the 11.1 % were recurrent. The more frequent adverse events were: fever, headache and chivers of slight or moderate intensity.
Conclusions: the application of Interferon around injury may be considered an safe and effective alternative in treatment of genital warts.
Key words: Interferon, genital warts, acuminatum condyloma, papillomavirus, adverse events, reproductive health.
INTRODUCCIÓN
El virus del papiloma humano (VPH) es uno de los principales virus transmitidos por vía sexual. Cada uno de sus más de 230 subtipos diferentes es capaz de infectar a las células epiteliales del tracto genital humano y otras áreas de la economía, tales como la conjuntiva, la piel especialmente de manos y pies, la boca, y la orofaringe.1,2 Los subtipos 6 y 11 se encuentran sobre todo en condilomas acuminados y son de bajo riesgo oncogénico.3 Los tipos 16 y 18 se han identificado como de alto riesgo de oncogenicidad y además el 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82 y de riesgo probable el 26, 53y 66. Ellos constituyen el agente etiológico fundamental del cáncer cervical.4,5
Las verrugas genitales (también llamadas condilomas acuminados), si bien no tienen una implicación directa en la supervivencia, generan múltiples molestias. La inflamación local, fisuras, prurito, ardor y fetidez de las lesiones, así como secreción por infecciones locales sobreañadidas y deformidades genitales tienen un impacto en la vida sexual de quienes las padecen. Los pacientes, en su mayoría jóvenes, tienen habitualmente sentimientos de ansiedad, culpa, pérdida de la autoestima, temores con relación a los riesgos de cáncer genital y su fertilidad que repercuten en su calidad de vida desde el punto de vista psicológico, social y familiar.6
Aunque las verrugas genitales son la manifestación más conocida, del VPH no es la más frecuente; las formas subclínicas solo demostrables por colposcopía o vulvoscopía lo son mucho más.7-9
En la actualidad, el diagnóstico de las diferentes formas clínicas del VPH sigue estando basado en la tríada clásica: examen clínico-colposcópico, citología y biopsia. El examen clínico permite el diagnóstico de la enfermedad clínica (verrugas genitales papilares, papulares o maculares). Con el uso del ácido acético del 4 % al 6 %, unos minutos previos a la inspección y la exploración exhaustiva con el colposcopio se pueden visualizar las lesiones a gran aumento y detectarse lesiones subclínicas (epitelios acetoblancos).
La citología ha jugado un rol en la pesquisa de las lesiones intraepiteliales del cuello uterino, pero es de escasa utilidad en la condilomatosis genital. La histología aunque es poco usada para la confirmación diagnóstica de las verrugas genitales, es de vital importancia en el diagnóstico definitivo de las lesiones intraepiteliales e invasivas de cualquier localización. La sospecha de una lesión de este tipo, en la base de la lesión condilomatosa obliga al especialista a realizar biopsias de la zona.
Una variedad de tratamientos se encuentran disponibles para las verrugas genitales. El interferón alfa 2b Humano recombinante (IFN-alfa 2b Hr) y la podofilina han demostrado su efectividad y seguridad a través de ensayos clínicos aleatorizados y controlados con placebo.10-14
Otros tratamientos como la cirugía con láser, la electrocauterización, la escisión quirúrgica, la crioterapia y el empleo de resinas, sustancias cáusticas y químicas, han sido muy empleados y con algunos resultados efectivos, pero con limitaciones en lograr un intervalo libre de enfermedad prolongado y por los eventos adversos locales que generan.
Es bien conocido que la podofilotoxina reporta recurrencias frecuentes de las lesiones tratadas. El 5-fluorouracilo (5FU) tópico, tiene un alto riesgo de ulceraciones. Los tratamientos quirúrgicos, la electrocoagulación, la crioterapia con nitrógeno, el ácido tricloroacético y el láser-terapia reportan eventos propios de la lisis tisular, de gran incomodidad, y en ocasiones de retracciones y mutilaciones del aparato genital.15,16
El a -IFN con su efecto antifibrótico viene a enmendar en no pocas situaciones las consecuencias de la fibrosis provocada por aplicaciones de cáusticos y tratamientos destructivos locales. Su acción antiviral e inmunomoduladora permite además intervenir en la génesis del proceso en cuestión16 o que se evidencia en los resultados de ensayos clínicos.17-20
En la década del 90 del pasado siglo se publicaron resultados convincentes de la eficacia del IFN-alfa 2b Hr en el tratamiento de la condilomatosis genital, estudios recientes también avalan su uso,21-27 sin embargo, algunas guías de tratamiento actuales no lo recomiendan como tratamiento de primera línea sino cuando fallan tratamientos previos, alegándose limitados resultados de eficacia, eventos adversos severos y limitaciones económicas.28,29
Se hace necesario evidenciar también nuestros resultados de eficacia y seguridad en el uso clínico cotidiano del IFN-alfa 2b Hr cubano (Heberon Alfa R®). Este producto registrado en Cuba por la autoridad reguladora nacional de medicamentos, el Centro de control estatal de medicamentos (CECMED), ha sido estudiado en ensayo clínico de bioequivalencia con el Viraferon® de la Schering-Plough, Irlandesa) con resultados de seguridad, farmacocinética y farmacodinamia similares para ambas formulaciones.30
Se efectuó este estudio como parte de la farmacovigilancia poscomercialización del producto en la población atendida en nuestra Institución. Estas experiencias pudieran contribuir en la generalización de su uso dentro y fuera de Cuba, permitiendo así, que un mayor número de pacientes se beneficie de este logro de la ciencia y la salud cubanas.
MÉTODOS
Tipo de estudio y pacientes
Se realizó un estudio cuasiexperimental de la aplicación del IFN-alfa 2b Hr, producido en el Centro de Ingeniería Genética y Biotecnología de La Habana, Cuba. Este producto se presenta en bulbos de 10 millones de unidades internacionales (MUI) en 1 mL, (Heberon Alfa R®) y se conserva en a temperatura de 2 a 8 oC.
Con la aprobación del Comité de revisión y ética, se incluyeron 216 del sexo femenino y 111 del sexo masculino que asistieron al Hospital "Ramón González Coro" de La Habana de marzo del 2009 a junio del 2011, con diagnóstico clínico-colposcópico de verrugas genitales.
Criterios de selección
Fueron incluidos pacientes de ambos sexos con diagnóstico clínico de verrugas genitales con su consentimiento informado y del tutor en los casos de dos niñas de 3 y 6 años respectivamente. Fueron seleccionadas las lesiones de tipo papilar, papular y/o macular localizadas: en genitales, región perigenital y perianal, y excluidas las de cavidades (uretra, vejiga, recto, vagina y cérvix). No se incluyeron pacientes con patologías crónicas no compensadas o antecedentes de haber presentado alergia al IFN-alfa 2b Hr o eventos de carácter grave en alguna aplicación previa del mismo.
Tratamiento
El tratamiento consistió en la aplicación intralesional de 10 MUI de Heberon Alfa R® (1bbo-1 mL) en un sitio de punción único, en la base de las lesiones mayores. Se evitó la aplicación en las zonas más sensibles, tales como los márgenes de los orificios uretrales, el clítoris y el glande.
El producto se aplicó una vez por semana por 8 sem en un primer ciclo y en caso de respuesta parcial se continuó con un segundo ciclo de igual duración. Las pacientes con progresión después del primer ciclo o respuesta parcial un mes después del segundo ciclo, fueron tratadas mediante radiocirugía de alta frecuencia.
En dos casos tratados de condilomatosis en la infancia (dos niñas de 3 y 6 años respectivamente), el producto se administró a la dosis 2 MUI en cada aplicación semanal, por 8 sem. El sitio de punción fue cuidadosamente seleccionado en la zona más cercana a la lesión mayor (localizadas en introito vaginal), en la interfase piel-mucosa.
Los eventos adversos fueron tratados con antipiréticos y analgésicos (dipirona o paracetamol).
Evaluación de las lesiones condilomatosas
Se aplicó ácido acético al 6 % durante 6 min en la región púbica, genital, perianal y perigenital. Se tomaron imágenes digitales de las zonas de lesiones mediante videocolposcopio, que permitió además de la confirmación diagnóstica de lesiones pequeñas según su evaluación morfológica. Las imágenes capturadas se procesaron con software (MADIP V 3.1), validado en el país para la evaluación de imágenes digitales, se efectuó conteo de las lesiones y la medición de los diámetros menores y mayores de cada lesión o grupo confluente de lesiones. Se calculó la suma de los diámetros menores (sdm) y suma de los diámetros mayores (SDM).
Se consideró como variable principal la "Respuesta objetiva al tratamiento" definida como: respuesta completa (RC) la desaparición total de las verrugas; respuesta parcial (RP), cuando la reducción de SDM en al menos un 30 %; progresión (P), cuando SDM aumentó en al menos un 25 %; enfermedad estable (EE), el aumento de SDM resultó inferior al 25 %, o cuando su disminución no alcanzó el 30 %. Resultaron pacientes respondedores los evaluados con RP y RC, no respondedores a los evaluados con EE y P.
Las evaluaciones de eficacia se efectuaron 4 sem después de concluido del último ciclo de tratamiento .Se dio seguimiento hasta los 24 meses después de haberse obtenido la respuesta completa (RC) para detectar los episodios de recidivas.
Evaluación de la seguridad del producto
Los eventos reportados fueron clasificados como locales a los ocurridos en el sitio de aplicación y sistémicos a los síntomas o signos generales no localizados en dicho sitio. Para definir el grado de intensidad (Grado I: evento leve, Grado II: moderado, Grado III severo, Grado IV: que pone en peligro la vida, Grado V: muerte por evento adverso), se utilizó la clasificación Cancer therapy Evaluation Program, Common Terminology criteria for Adverse events, Version 3.0.31
Análisis estadístico
Con las variables demográficas y de base cualitativas se estimaron las distribuciones de frecuencia y con las cuantitativas se estimaron como medidas de tendencia central y dispersión, la media, mediana, desviación estándar, rango intercuartílico y valores mínimos y máximos. Con las variables cuantitativas de efecto, (número y tamaño de las lesiones) se verificaron los supuestos de normalidad (prueba de Shapiro-Wilk) y de homogeneidad de varianzas (prueba de Levene) y debido a su no cumplimiento, los análisis pareados inicio-final se realizaron usando la prueba no paramétrica de rangos de Wilcoxon.
Se estimó la distribución de frecuencias de la variable principal (respuesta objetiva al tratamiento), así como los intervalos de confianza al 95 % desde el punto de vista bayesiano.
Con los casos que tenían al menos una evaluación después de obtener respuesta completa (RC), se evaluó la ocurrencia de recaídas y el tiempo estimado de recaída usando la curva de Kaplan-Meier. Para cada evento adverso se estimó la distribución de frecuencias.32
RESULTADOS
Disponibilidad de los datos
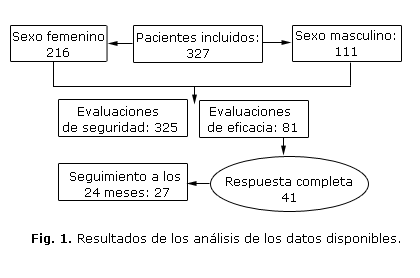
Se presentan los resultados de los análisis de los datos disponibles en los cuadernos de registro. Ningún paciente abandonó el tratamiento. Sin embargo 244 dejaron de asistir a la evaluación de las 4 sem después del último ciclo. Se ausentaron 14 pacientes de los previstos en la evaluación de 24 meses (Fig. 1).
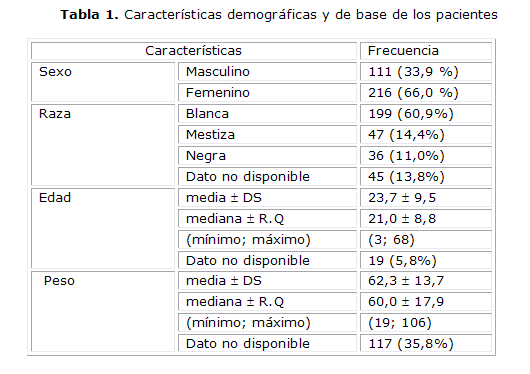
De los pacientes incluidos más del 60 % eran mujeres. Prevaleció la raza blanca. El rango de edades fue amplio y aunque la mayoría estaba en edades comprendidas entre 18 y 22 años, se incluyeron 2 niñas de 3 y 6 años respectivamente y 4 pacientes de más de 50 años (tabla 1).
En la tabla 2 podemos apreciar que el número de lesiones iniciales en cada paciente tuvo una variabilidad importante, observándose desde una lesión hasta 80 lesiones clínicas en un solo paciente. Esta variable mostró una reducción significativa al final del tratamiento, con una reducción de la media de 9,2 a 2,9. Igualmente la sumatoria de los diámetros mayores (SDM) de las lesiones iniciales estaba en un rango amplio de 5 a 363 mm, con una media de 42,5, que se reduce a 9,9 al final del tratamiento.
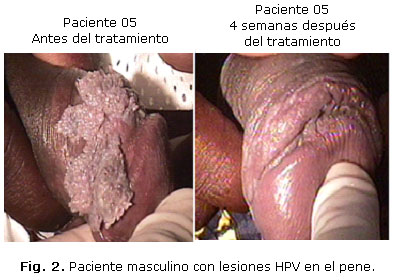
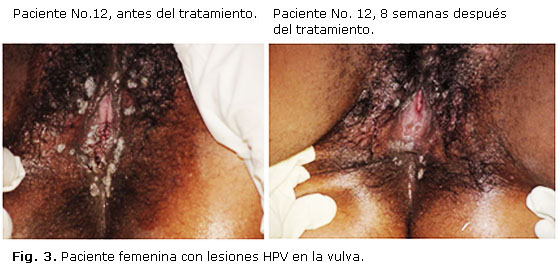
Esta reducción resultó significativa no solo desde el punto de vista estadístico sino también desde el punto de vista clínico, tal y como se muestra en las figuras 2 y 3.
La respuesta objetiva al tratamiento (respuesta completa + respuesta parcial) (RC + RP) se evidenció en más del 80 % de los pacientes tratados. Poco más de la mitad de los pacientes tuvo de respuesta completa (RC), es decir, desaparición total de las lesiones iniciales.
Solo ocurrió progresión en 3 casos (3,7 %) y se mantuvieron estables las lesiones de 12 pacientes.
La probabilidad media estimada de respuesta objetiva fue de 0,81 aproximadamente y con una confianza del 95 %, de manera que se puede esperar que se logren resultados similares en más del 70 % de los casos que elijan esta opción terapéutica (tabla 2).
No se detectaron dependencias significativas entre la respuesta para con el sexo y la edad (tabla 3).
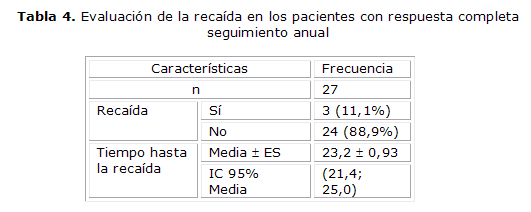
En la tabla 4 podemos observar que de los 41 pacientes que tuvieron respuesta completa, 14 abandonaron las consultas de seguimiento trimestrales hasta el año, previstas en el estudio. Solo 27 pacientes acudieron al menos a la evaluación anual después de la RC. En esta evaluación fueron interrogados y examinados para detectar la ocurrencia de lesiones recurrentes, 24 (88,9 %) se mantuvo sin recaída. En los pacientes que presentaron episodios de recurrencia se estimó el intervalo libre de enfermedad (tiempo transcurrido desde finalizado el tratamiento hasta la ocurrencia de la enfermedad) y resultó de 23,2 meses como promedio (superior a los 20 meses con una confianza del 95 %).
Un comentario particular lo merece el resultado del tratamiento en las dos niñas de 3 y 6 años respectivamente incluidas en el estudio. A los 7 días de la primera aplicación del producto a la dosis de 2 MUI, se obtuvo apreció una reducción considerable de las lesiones (respuesta parcial) y solo fue necesario un total de 8 aplicaciones para obtener respuesta completa. Durante la etapa de seguimiento en la que se cumplieron totalmente las evaluaciones trimestrales previstas hasta los 24 meses, no se presentaron episodios de recurrencias.
En la tabla 5 se muestra la frecuencia de eventos adversos que se presentaron en los 325 pacientes de los que se disponen datos de seguridad del producto. El total de eventos reportados durante los tratamientos fue de 6804. La fiebre y la cefalea fueron los más frecuentes, solo alrededor del 1% de las ocasiones se presentaron con carácter moderado, con cierta limitación en la actividad habitual de los pacientes, siendo necesaria la medicación con antipiréticos y analgésicos respectivamente. En ningún caso fue necesario detener el tratamiento por evento adverso. No se presentaron eventos adversos graves.
Tabla 5. Frecuencia de Eventos Adversos reportados en todas las aplicaciones del producto
| Eventos adversos Sistémicos | Intensidad* | Resultado** | Total | |||
| Leve | Moderada | Recuperado | Mejorado | Persiste | | |
| Fiebre | 1916 (98,4 %) | 21 (1,1 %) | 1932 (99,2 %) | 1 (0,1 %) | | 1948 |
| Cefalea | 1692 (98,5 %) | 14 (0,8 %) | 1698 (98,8 %) | 3 (0,2 %) | | 1718 |
| Escalofríos | 671 (99,7 %) | - | 670 (99,6 %) | 1 (0,1 %) | | 673 |
| Mialgias | 633 (99,8 %) | 1 (0,1 %) | 631 (99,5 %) | - | | 634 |
| Temblores | 536 (99,1 %) | 1 (0,2 %) | 538 (99,4 %) | - | | 541 |
| Náuseas | 179 (99,4 %) | 1 (0,6 %) | 179 (99,4 %) | 1 (0,6 %) | | 180 |
| Vómitos | 120 (99,2 %) | 1 (0,8 %) | 119 (98,3 %) | 2 (1,7 %) | | 121 |
| Trombocitopenia | 47 (100,0 %) | - | 46 (97,9 %) | - | | 47 |
| Astenia | 42 (97,7 %) | | 43 (100,0 %) | | | 43 |
| Artralgia | 37 (97,4 %) | 1 (2,6 %) | 37 (97,4 %) | - | | 38 |
| Calambres | 25 (100,0 %) | - | 25 (100,0 %) | - | | 25 |
| Diarreas | 21 (100,0 %) | - | 21 (100,0 %) | - | | 21 |
| Pérdida de peso | 10 (100,0 %) | - | 10 (100,0 %) | - | | 10 |
| Mareos | 9 (100,0 %) | - | 8 (88,9 %) | - | | 9 |
| Rubor | 5 (100,0 %) | - | 5 (100,0 %) | - | | 5 |
| Metrorragia | 1 (25,0 %) | 3 (75,0 %) | 4 (100,0 %) | - | | 4 |
| Decaimiento | 4 (100,0 %) | - | 4 (100,0 %) | - | | 4 |
| Anemia | 3 (100,0 %) | - | 3 (100,0 %) | - | | 3 |
| Depresión | 3 (100,0 %) | - | 3 (100,0 %) | - | | 3 |
| Leucopenia | 2 (100,0 %) | - | 2 (100,0 %) | - | | 2 |
| Sequedad bucal | 2 (100,0 %) | - | 2 (100,0 %) | - | | 2 |
| Alopecia | 2 (100,0 %) | - | 1 (50,0 %) | 1 (50,0 %) | | 2 |
| Taquicardia | 1 (100,0 %) | - | 1 (100,0 %) | - | | 1 |
| Anorexia | 1 (100,0 %) | - | 1 (100,0 %) | - | | 1 |
| Hipertensión | 1 (100,0 %) | - | 1 (100,0 %) | - | | 1 |
| Fotofobia | 1 (100,0 %) | - | 1 (100,0 %) | - | | 1 |
| Hipertiroidismo | 1 (100,0 %) | - | - | - | 1 (100,0 %) | - |
| Eventos adversos Locales | Intensidad | Resultado | Total | |||
| Leve | Moderada | Recuperado | Mejorado | Persiste | | |
| Dolor | 152 (100,0 %) | - | 152 (100,0 %) | - | | 152 |
| Ardor | 25 (100,0 %) | - | 25 (100,0 %) | - | | 25 |
| Dolor perineal | 4 (100,0 %) | - | 3 (75,0 %) | - | | 4 |
| úlcera en el sitio | 1 (100,0 %) | - | 2 (100,0 %) | - | | 1 |
| Total | 6150 (90,4 %) | 39 (0,6 %) | 6170 (90,7 %) | 6 (0,1 %) | 1 (0,01 %) | 6804 |
| * Dato no disponible Clasificación de intensidad de la fiebre en 11 pacientes y los escalofríos en 2 pacientes ** Dato no disponible: Clasificación del resultado del evento fiebre en 15 pacientes y de los escalofríos en 1 paciente | ||||||
Algunos eventos que se reportaron con menor frecuencia (menos de 3 reportes) tales como: depresión, sequedad bucal, alopecia e hipertiroidismo, correspondieron a pacientes que recibieron 16 aplicaciones del producto, por lo que pudieran tener una relación con la dosis total recibida del producto y el tiempo de aplicación del mismo.
El dolor en el sitio de aplicación del producto se reportó en 152 ocasiones, siempre de intensidad leve y recuperada en pocos minutos. No fue preciso interrumpir el tratamiento, ni se presentaron abandonos de tratamiento por eventos de carácter local.
Todos los eventos observados se recuperaron luego de un mes de terminado el tratamiento, con excepción del cuadro de hipertiroidismo señalado. De este paciente no se obtuvo información a más largo plazo por lo que no conocemos de su recuperación después de la evaluación mensual postratamiento.
En las dos niñas tratadas en esta serie, no se reportaron eventos de carácter sistémico, solo ardor en el sitio de aplicación, bien tolerado, sin necesidad de medicación ni de interrupción de tratamiento.
DISCUSIÓN
Aunque no ha sido posible obtener la totalidad de los datos primarios, tal y como se ha referido en la descripción de las tablas de resultados, no todos los pacientes se han presentado a las citas de evaluación previstas en el seguimiento, lo que limita su validez interna, no obstante los resultados obtenidos revisten una importancia especial.
Un ensayo clínico a ciegas, aleatorizado y controlado hubiera brindado un nivel superior de evidencias, sin embargo el hecho de que los datos de eficacia y de seguridad de la aplicación del producto se han obtenido en el escenario de su uso en la práctica médica habitual, con mínimas restricciones de selección incrementa su validez externa.
El hecho de que más del 80 % de los pacientes tratados en nuestra serie hayan mostrado evidencias de respuesta objetiva al tratamiento, nos parece muy alentador puesto que esta cifra es muy superior a lo reportado históricamente como regresiones espontáneas en el curso natural de la enfermedad e incluso similar con lo reportado por los tratamientos quirúrgicos.33,34
Por otro lado, la subjetividad de las evaluaciones propias de un estudio abierto, son minimizadas en nuestra investigación al evaluar las lesiones en imágenes digitales. La morfología y observación a primera mirada de las imágenes presentadas no dejan lugar a dudas. De mayor impacto aún es la morfometría realizada con software validado para tales acciones.
Un escaso número de episodios recurrentes se encontró en este estudio (11 %) lo cual dista de forma significativa de lo que se reporta para esta patología (recaídas antes de los 3 meses de terminado el tratamiento en al menos el 30 % de los pacientes). La alta probabilidad de respuesta que se ha estimado para los pacientes que reciben este tipo de terapéutica son solo comparables con las que se reportan para el imiquimod especialmente en la prevención de las recidivas. Algunos estudios publicados sobre el uso de la podofilina y el imiquimod reportan resultados inferiores (58 % de respuesta) en lesiones de dimensiones mucho más limitadas y con mayores eventos da carácter local.33-37
Los resultados obtenidos son esperados y tiene una explicación biológica conocida ya que la administración del IFN conduce a una eliminación de las lesiones causadas por el virus y a un aclaramiento de las partículas virales, aún en casos de infecciones latentes. Entre los factores que influyen en la eficacia del tratamiento con IFN, se plantean los niveles de expresión de los oncogenes del VPH, la regulación que sobre la producción y el sistema de señalización de los interferones ejercen las proteínas virales, las complejas interacciones entre las oncoproteínas virales y los factores celulares, que afectan la expresión y función de los genes virales y del hospedero, y la ocurrencia de mutaciones en las células infectadas, originando especies que afectan la vigilancia celular y los mecanismos que regulan la infección por el virus.
Hasta la fecha, se considera que ninguna de las alternativas terapéuticas logra una cura total o erradicación de las recurrencias, la principal virtud de los diferentes productos empleados es la de extender lo más posible el intervalo libre de lesiones en el individuo. Mediante sus acciones antivirales, antiproliferativas e inmunomoduladoras, el IFN alfa ha mostrado que puede conducir en corto plazo a la erradicación completa de las lesiones en los pacientes, y a largo plazo al aclaramiento de las partículas virales, eliminando de manera sostenida la posibilidad de reaparición de las mismas.38-44 Estas afirmaciones son consistentes con lo observado en nuestro reporte.
Teniendo en cuenta que fueron incluidos pacientes con un rango extremadamente amplio de dimensiones de las lesiones iniciales con un máximo de SDM de 363, se considera un resultado clínicamente relevante dada la significativa reducción de las áreas de lesiones iniciales. Esto permite reducir las molestias propias de los tratamientos ablativos aún cuando sea necesario optar por ellos en segunda línea terapéutica, al limitarse su intervención solo a la pequeña área de lesiones persistentes.
En la evaluación de seguridad del producto también se evidencian las desventajas y ventajas de este tipo de estudio. Puesto que no se recogió el dato sobre la severidad y el resultado de algunos reportes de los eventos fiebre y escalofríos, se pudiera afectar en alguna medida la apreciación de los resultados globales. En cambio se ha obtenido información sobre eventos de menor frecuencia que se presentan solo en escasas ocasiones. Esto permite conocer mejor el perfil de seguridad del producto en poblaciones no restringidas a los criterios selectivos de los ensayos clínicos.
Aún cuando se han presentado eventos adversos de carácter sistémico en la totalidad de los pacientes, consideramos que la aplicación intralesional del producto no ofrece mayores riesgos que otras vías de administración y no provoca eventos locales que impidan la actividad de los pacientes.
En este sentido, el tratamiento con IFN tiene un impacto favorable en la salud reproductiva, sexual y psicológica de los pacientes al evitar laceraciones, abrasiones y retracciones en esta zona tan sensible y que son frecuentes en los tratamientos destructivos locales.
Las nuevas vacunas profilácticas son tratamientos de mayor difusión en los últimos tiempos, tienen reconocidos resultados que resultarán en el futuro una magnífica forma de prevención primaria de la infección del VPH y por tanto de los condilomas acuminados, de estar disponibles para toda la población de riesgo.44 Hasta entonces, tenemos mucho que hacer para tratar a nuestros pacientes con las opciones menos mutilantes y dolorosas en esta área de tan elevada sensibilidad.
El Heberon Alfa R® ha resultado un tratamiento con beneficios indudables para la población estudiada con un elevado porcentaje de respuesta y un buen perfil de seguridad. Aunque se requieren de estudios comparados con otros tratamientos para demostrar su eficacia, nuestros resultados avalan su uso como una opción de tratamiento de primera línea en pacientes seleccionados.
REFERENCIAS BIBLIOGRÁFICAS
1. Shiffman MH, Brinton LA. The Epidemiology of Cervical carcinogenesis. Cancer 1995;76:1888-1901.
2. Sherman ME, Kurman RJ. Intraepithelial carcinoma of the cervix: reflections on half a century of progress. Cancer. 1998;83:2243-6.
3. Costa LJ, Silveira FR, Batista JM, Birman EG. Human papilloma virus—its association with epithelial proliferative lesions. Braz Dent J. 1994;5(1):5-10.
4. Munoz N, Bosch X, de Sanjose S., Herrero R, Castellsague X, Shah KV. Epidemiologic Classification of Human Papillomavirus Types Associated with Cervical Cancer. N Engl J Med. 2003;348:518-27.
5. American Cancer Society. Cancer Facts and figures 2007. Atlanta.American Cancer Society;2007.
6. Von Krogh G, Lacey CJN, Gross G, Barrasso R, Schneider A. European course on HPV associated pathology: guidelines for primary care physicians for the diagnosis and management of anogenital warts. Sex Transm Inf. 2000;76;162-8.
7. Guidelines for the Medical Management of Genital HPV and/or Genital Warts in Australia and New Zaeland. 4th Edition-2004. Viral Sexually Transmitted Infection Education Foundation;2004.
8. Bylaite M, Ruzicka T. Pearly Penile Papules. N Engl J Med. 2007;357(7).
9. Nicolas Kluger, Olivier Dereure. Penile Papules. N Engl J Med. 2009;360(13).
10. Chih-Chieh Chan, Hsien-Ching Chiu. Vestibular Papillomatosis. N Engl J Med. 2008;358(14).
11. Reichman RC, Oakes D, Bonnez W. Treatment of Condyloma acuminatum with three different interferons administered intralesionally: a double-blind, placebo-controlled trial. Ann Intern Med. 1988;108:675-9.
12. Eron LJ, Juhson F, Tucker S. Interferon therapy for condylomata acuminata. N Engl J Med. 1986;315:1059-64.
13. Deuñas L, Alcantud V, Alvarez F. Use of Interferon-a in laryngeal papillomatosis: eight years of the Cuban national programme. The Journal of Laryngology and Otology. 1997;111:134-40.
14. Sagaró B, Selman-Houssein E, Martínez R. Uso del Interferón leucocitario humano en las verrugas plantares. Interferón y Biotecnología 1988;5 (1):59-65.
15. Hagensee ME. Infection with human papillomavirus: update on Epidemiology, Diagnosis, and Treatment. Curr Infect Dis Rep. 2000 Feb;2 (1):18-24.
16. Severson J, Evans TY, Lee P, Chan Ts T, Arany I, Tyring SK. Human Papillomavirus infections: Epidemiology, Pathogenesis, and therapy. J Cutan Med Surg. 2001 Jan;5 (1):43-60.
17. Reichel RP, Fitz R, Neumann R, Pohl-Markl H, Pichler E, Hoffer Z. Clinical study with recombinant interferon gamma versus interferon alpha-2c in patients with condylomata acuminate. Int J STD AIDS. 1992;3(5):350-4.
18. Höpel RM, Sandbichler M, Zelger BW, Conrad FG, Fritsch PO. Adjuvant treatment of recalcitrant genitoanal warts with systemic recombinant interferon-alpha-2c. Acta Derm Venereol. 1992;72 (5): 383-6.
19. Itri L M. The interferons. Cancer. 1992;70 (4 Suppl):940-5.
20. Basso P, Verdi F. Beta interferon therapy of HPV infections of the female genital tract. Minerva Ginecol. 1992;44 (4):181-4.
21. Davis BE, Noble MJ. Initial experience with combined interferon-alpha 2B and carbon dioxide laser for the treatment of condylomata acuminata. J Urol. 1992;147 (3):627-9.
22. Reid R, Greenberg MD, Pizzuti DJ, Omoto KH, Rutledge LH, Soo W. Superficial laser vulvectomy. V. Surgical debulking is enhanced by adjuvant systemic interferon. Am J Obstet Gynecol. 1992;166(3):815-20.
23. Fierlbeck G, Rassner G, Pfister H. Condylomata acuminata in children-detection of HPV 6/11 and 2. Local therapy with interferon-beta hydrogel. Hautarzt. 1992;43(3):148-51.
24. Resta L, Troia M, Russo S, Colucci GA, Sabatini R, Loiudice L, et al. Variations of lymphocyte sub-populations in vulvar condylomata during therapy with beta-interferon. Eur J Gynaecol Oncol. 1992, 13 (5):440-4
25. Zwiorek L, Schmidt-Rhode P, Goerke K, Schulz KD. Condylomata acuminata and associated infections—possibilities for therapy with interferon. Zentralbl Gynakol. 1992;114(8):409-13.
26. Backe J, Roos T, Kaesemann H, Martius J, Ott M. Local therapy and adjuvant interferon therapy in genital papilloma virus infections. Gynakol Geburtshilfliche Rundsch. 1995;35 (2):79-84.
27. Mistrangelo M, Cornaglia S, Pizzio M, Rimonda R, Gavello G, Dal Conte I, Mussa A. Immunostimulation to reduce recurrence after surgery for anal condyloma acuminata: a prospective randomized controlled trial. Colorectal Dis;2009.
28. Guías para el tratamiento de las infecciones de transmisión sexual. Ginebra, Suiza: Catalogación por la Biblioteca de la OMS;2001.
29. Guías de Buena Práctica Clínica en infecciones víricas dermatológicas. Organización Medica Colegial de España .OMC. Editorial Internacional Marketing and comunication, S.A;2011.
30. García-García I, González-Delgado CA, Valenzuela-Silva C, Hernández-Bernal F, Ferrero-Bibilonia J, Soto-Hernández R, et al. Bioequivalence of Two Recombinant Interferon á-2b Liquid Formulations in Healthy Male Volunteers. Drugs R D. 2004;5 (5):271-80.
31. Cancer therapy Evaluation Program, Common Terminology criteria for Adverse events, Version 3.0, DCTD,NCI,NIH,DHHS, Marcg 31, 2003. Publish Date: June 10, 2003. Disponible en: http://www.ctep.cancer.gov
32. Armitage P, Berry G. Estadística para la Investigación Biomédica. Barcelona: Doyma,;1992.
33. Szeimies RM, Schleyer V, Moll I, Stocker M, Landthaler M, Karrer S. Adjuvant photodynamic therapy does not prevent recurrence of condylomata acuminata after carbon dioxide laser ablation-A phase III, prospective, randomized, bicentric, double-blind study. Dermatol Surg. 2009;35(5):757-64.
34. Szeimies, Rolf-Markus. Adjuvant photodynamic therapy does not prevent recurrence of condylomata acuminata after carbon dioxide laser ablation-A phase III, prospective, randomized, bicentric, double-blind study. Dermatol Surg. 2009;35 (5):757-64.
35. Yan, Jun, Chen, Sheng-Li, Wang, Hai-Na, et al. Meta-analysis of 5 % imiquimod and 0.5 % podophyllotoxin in the treatment of condylomata acuminate. Dermatology. 2006;213(3):218-23.
36. Cortés JR, Arratia J, Martínez R, Gómez L. Extensive condyloma acuminata of the penis successfully treated with 5% imiquimod cream. Actas Urol Esp. 2007;31 (3):276-8.
37. Herrera S, Correa LA, Wolff JC, Gaviria A, Tyring SK, Sanclemente G. Effect of imiquimod in anogenital warts from HIV-positive men. J Clin Virol. 2007;39(3):210-4.
38. Campaner AB, Santos RE, Galvão MA, Longo B, Geni W, Aoki, T. Effectiveness of imiquimod 5% cream for treatment of extensive anogenital warts in a seven-year-old child. Pediatr Infect Dis J. 2007;26(3):265-6.
39. Garland SM, Waddell R, Mindel A, Denham IM, McCloskey JC. An open-label phase II pilot study investigating the optimal duration of imiquimod 5 % cream for the treatment of external genital warts in women. Int J STD AIDS. 2006;17(7):448-52.
40. Lauta VM. Update on the use of interferons in clinical practice. Clin Ter. 1995 Jun-Jul;146(6-7):393-448.
41. Scheinfeld, Noah, Lehman, Daniel S. An evidence-based review of medical and surgical treatments of genital warts. Dermatol Online J. 2006;12(3):5.
42. Ralph P, Insinga, Erik J. Dasbach, and Evan R. Myers. The Health and Economic Burdenof Genital Warts in a Set of Private Health Plans in the United States. Burden of Genital Warts • CID. 2003:36.
43. Kodner CM, Nasraty S. Management of genital warts. Am Fam Physician. 2004;70(12):2335-42.
44. De Jong A, ONeill T, Khanb AY, Kwappenberg KMC, Chisholm SE, Whittle NR, et al. Enhancement of human papilomavirus (HPV) type 16 E6 and E7-specific T-cel immunity in healthy volunteers through vaccination with TA-CIN, an HPV 16 L2E7E6 fusion protein vaccine. Vaccine. 2002;20:356-64.
Recibido: 15 de enero de 2012.
Aprobado: 30 de enero de 2012.
Idania Baladrón Castrillo. Centro de Ingeniería Genética y Biotecnología. Avenida 31 e/ 158 y 190, Cubanacán, Playa. La Habana, Cuba. CP: 10600. Teléfonos: 208 7379; 208 7674. Correo electrónico: idania.baladron@cigb.edu.cu idania.baladron@infomed.sld.cu