Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol vol.39 no.4 Ciudad de la Habana oct.-dic. 2013
OBSTETRICIA
Morbilidad y mortalidad neonatal en pacientes con rotura prematura de membranas pretérmino
Neonatal morbidity and mortality in patients with premature rupture of membranes
MSc. Niobys Sánchez Ramírez, MSc. Alfredo Nodarse Rodríguez, MSc. Ana Mary Sanabria Arias, MSc. Ada Octúzar Chirino, MSc. Martha Patricia Couret Cabrera, MSc. Dayamí Díaz Garrido
Hospital Ginecoobstétrico "Ramón González Coro". La Habana, Cuba.
RESUMEN
Introducción: según la Organización Mundial de la Salud, aproximadamente el 40 % de los partos prematuros están precedidos de ruptura prematura de membranas.
Objetivo: identificar la morbilidad y mortalidad neonatal de las pacientes que presentaron rotura prematura de membranas pretérmino entre las 28,0 y 32,6 sem en el Hospital Ginecoobstétrico "Ramón González Coro".
Métodos: se realizó un estudio descriptivo retrospectivo de 45 gestantes con rotura prematura de membranas pretérmino, entre las 28,0 y 32,6 sem de edad gestacional, que ingresaron en el Hospital Ginecobstétrico Ramón González Coro, entre enero de 2006 y diciembre de 2008. Se utilizó el porcentaje, las frecuencias, datos de contingencia y medias. La información fue procesada en el paquete estadístico SPSS 11.5.
Resultados: el 48,9 % pesó menos de 1 500 g; el 22,0 % presentó síndrome de distrés respiratorio y enfermedad de membrana hialina; el 60,0 % de los que continuaron con una conducta expectante por más de 8 días luego de culminado el tratamiento antimicrobiano tuvieron sepsis neonatal; el 50,0 % presentó enfermedad de membrana hialina luego de 8 días de administrados los inductores de la madurez pulmonar fetal; todos los fallecidos pesaron menos de 1 500 g.
Conclusiones: aproximadamente la mitad de los recién nacidos tuvo un peso inferior a los 1 500 g. La enfermedad de membrana hialina y la sepsis neonatal fueron las complicaciones más frecuentes. Predominó la enfermedad de membrana hialina en los que concluyeron la terapia esteroidea por más de 8 días. La mortalidad neonatal fue significativa en los recién nacidos con peso inferior a 1 500 g.
Palabras clave: morbilidad neonatal, mortalidad neonatal, rotura prematura de membranas, parto pretérmino, membrana hialina, corioamnionitis, inductores de la madurez pulmonar.
ABSTRACT
Introduction: according to the World Health Organization, approximately 40 % of preterm births are preceded by premature rupture of membranes.
Objective: to identify neonatal morbidity and mortality in patients who had premature rupture of membranes between 28.0 and 32.6 weeks at Ramón González Coro Maternity Hospital.
Methods: a retrospective study was conducted in 45 pregnant women with preterm premature rupture of membranes between 28.0 and 32.6 wk gestational age, they were admitted to Ramón González Coro Maternity Hospital, from January 2006 to December 2008. Percentage, frequencies, and average data contingency were estimated. The information was processed using SPSS 11.5.
Results: 48.9 % weighed less than 1 500 g, 22.0 % had respiratory distress syndrome and hyaline membrane disease, 60.0 % of those who continued with watchful approach for more than 8 days after completed antimicrobial treatment, had neonatal sepsis, 50.0 % had hyaline membrane disease after 8 days receiving inducers of fetal lung maturity, all dead cases weighed less than 1 500 g.
Conclusions: about half of these infants weighing less than 1 500 g. Hyaline membrane disease and neonatal sepsis were the most common complications. Hyaline membrane disease was predominant in those who completed steroid therapy for more than eight days. Neonatal mortality was significant in infants weighing less than 1 500 g.
Keywords: neonatal morbidity, neonatal mortality, premature rupture of membranes, preterm delivery, hyaline membrane, chorioamnionitis, inducing lung maturity.
INTRODUCCIÓN
A partir de los datos aportados por la Organización Mundial de la Salud (OMS), con las tasas actuales de prematuridad se esperan cerca de 14 000 000 de partos pretérmino al año. La tasa de prematuridad en Europa es bastante homogénea, situándose entre 7 y 8 %, y dicha tasa va en constante aumento de forma generalizada en todos los países.1-3
Aproximadamente el 40 % de los partos prematuros están precedidos de dinámica uterina, un 40 % precedidos de ruptura prematura de membranas y un 20 % ocurren como consecuencia de una indicación médica u obstétrica de finalización de gestación.
La incidencia de la rotura prematura de membranas (RPM) varía entre 1,6 % y 21,0 %, con un promedio de 10 % de incidencia en los embarazos. Un 80 % de los casos ocurre después de las 37 sem (rotura prematura de membranas a término), en tanto que el 20 % restante se presenta en embarazos pretérmino. Este último grupo contribuye con un tercio de los casos de partos prematuros espontáneos y produce un importante impacto en la morbilidad y mortalidad neonatal, atribuyéndosele un 10 % del total de las muertes perinatales.
La rotura prematura de membranas (RPM) también se asocia a un aumento de la morbilidad materna, debido a un significativo incremento en la incidencia de corioamnionitis clínica e infección puerperal. El término latencia se refiere al tiempo que transcurre entre la ruptura y la terminación del embarazo. Así, el período de latencia y la edad gestacional determinan el pronóstico y consecuentemente el manejo de la enfermedad de acuerdo a la posibilidad o no de terminación del embarazo.
Su incidencia es muy variable y depende en gran parte de la situación socioeconómica de la embarazada debido a la menor probabilidad de recibir cuidados médicos prenatales adecuados.
El objetivo que prima en el manejo de pacientes con RPM es la obtención de un balance razonable entre sus dos complicaciones más importantes: la prematuridad y la prevención de la infección perinatal y materna. Debido a esto, el manejo para las pacientes es muy debatido. La conducta conservadora implica la vigilancia estrecha de la madre y el feto hasta el inicio del trabajo de parto o la aparición de corioamnionitis.
Se ha demostrado que la permanencia intrauterina a pesar de la RPM, beneficia mucho al feto, permitiendo la maduración de órganos, que se encuentran en una etapa crítica del desarrollo.
Nuevas evidencias sugieren que la rotura prematura de membranas es un proceso multifactorial en el que se incluyen procesos bioquímicos, biológicos y fisiológicos.
Varias condiciones clínicas ocurridas en embarazos anteriores o durante el embarazo actual colocan a una paciente en una situación de mayor riesgo de presentar RPM.
MÉTODOS
Se realizó un estudio descriptivo retrospectivo de tipo transversal de 45 gestantes con rotura prematura de membranas pretérmino entre las 28,0 y 32,6 sem de edad gestacional, que ingresaron en el Hospital Ginecobstétrico "Ramón González Coro", en el período comprendido entre enero de 2006 y diciembre de 2008.
La información se recogió en una planilla y se creó una base de datos en Microsoft Excel 2007 del paquete de Microsoft Office para su almacenamiento y posterior procesamiento. Se empleó la estadística descriptiva para hacer una caracterización general de la muestra en estudio. Se utilizó el porcentaje, las frecuencias, datos de contingencia y medias. La información fue procesada en el paquete estadístico SPSS 11.5.
El estudio se efectuó conforme a las reglamentaciones y principios éticos existentes para la investigación en humanos y los estudios clínicos.
RESULTADOS
La tabla 1 muestra la distribución de las pacientes según el peso del recién nacido. Se observó que el 48,9 % de los recién nacidos tuvo pesos inferiores a 1 500 g. El 42,2 % pesó entre 1 501 y 2 499 g de peso y solo 4 recién nacidos pesaron más de 2 500 g (8,9 %).
En relación con las complicaciones del recién nacido, se observó que el síndrome de distrés respiratorio (SDR) y la enfermedad de rembrana hialina (EMH), se distribuyeron en un 22 % respectivamente, seguido por el grupo de las otras complicaciones que incluyeron hemorragia intraventricular, enteritis, onfalitis, hipertensión pulmonar y anemia con 16 recién nacidos para un 35,6 % de la muestra estudiada. Del total de recién nacidos, 33 de ellos (73 %) no presentó sepsis de ningún tipo y 12 recién nacidos (26,6 %), divididas en precoz y adquirida con 6 pacientes respectivamente (13,3 %), fueron los que la presentaron. Un recién nacido puede haber presentado más de una de las complicaciones descritas anteriormente (tabla 2).
La tabla 3 muestra la distribución de las pacientes según el tiempo transcurrido desde el inicio de la terapia antimicrobiana y la presencia de sepsis. Se observó que de un total de 27 casos (60 %), los que sobrepasaron los 8 días de concluir la terapia antibiótica, fueron los de mayor incidencia de sepsis neonatal. Se comportó de la siguiente forma: 4 recién nacidos presentaron sepsis precoz y en otros 4 fue adquirida para un 66,6 % respectivamente. En el grupo comprendido entre los días 2 y 3 de haber comenzado el tratamiento antimicrobiano, se presentó 1 caso como sepsis precoz y otro como sepsis adquirida para un 16,7 % respectivamente. En los grupos de menos de 1 día y de 4 a 7 días de iniciada la terapia antimicrobiana hubo 1 caso de sepsis neonatal que representó el 16,7 % para cada grupo.
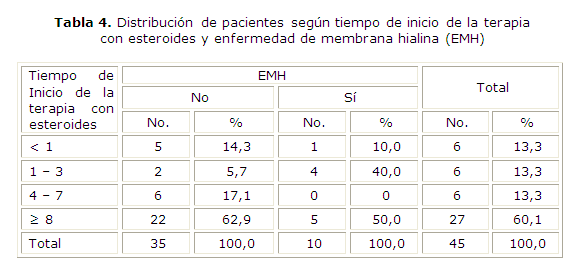
El 50 % de los recién nacidos presentó EMH a los 8 días de haberse administrado los inductores de la madurez pulmonar fetal. El 40 % presentó dicha afección cuando el inicio de la terapéutica había ocurrido entre 1 y 3 días previos al nacimiento, y cuando la terapéutica se había iniciado apenas 24 h antes, se observó 1 caso (10 %). No se presentó ningún caso cuando la terapéutica se inició entre los 4 y 7 días (tabla 4).
En cuanto a la mortalidad, se observó que la totalidad de los fallecidos pesó menos de 1 500 g, con una edad gestacional inferior a las 31 sem, sin correspondencia entre la manifestación clínica fundamental de los recién nacidos y los resultados de la Anatomía Patológica (tabla 5).
DISCUSIÓN
La literatura señala que una cuarta parte de prematuros nacerá con menos de 32 sem, es decir, con un peso inferior a 1 500 g. Es en este último grupo es donde se concentra la mayor morbilidad y mortalidad.3
La mayoría de las enfermedades asociadas a la prematuridad son consecuencias de la inmadurez de una gran variedad de sistemas y órganos.
El anuario estadístico del año 2009 emitido por el MINSAP coloca a los trastornos relacionados con la duración de la gestación y el crecimiento fetal en el decimoprimer lugar, dentro de las principales causas de muerte en menores de 1 año con una tasa de 0,1 por cada 1 000 nacidos vivos. Pero otras afecciones frecuentemente relacionadas con el parto pretérmino se encuentran dentro de los primeros 10 lugares entre ellos la membrana hialina, la hemorragia no traumática y las septicemias.4
Durante el proceso de parto o antes, si se rompen las cubiertas ovulares el feto o recién nacido queda bruscamente expuesto a una gran variedad de agentes microbianos presentes en el canal del parto que son potencialmente patógenos. Aún reconociendo que la incidencia de infección bacteriana es baja (0,5 a 5/1 000 recién nacidos vivos) un considerable porcentaje de todos los recién nacidos ha ingresado en una unidad neonatal y evaluado para descartar un posible proceso infeccioso. Además, en el caso de una infección cierta, si no se inicia el tratamiento en los primeros estadios, esta puede progresar rápidamente provocando efectos devastadores e incluso la muerte del neonato. Este hecho es más notable en casos de los recién nacidos pretérmino, por la inmadurez de todos los procesos inmunitarios y menor paso transplacentario de IgG materna; por ello en la mayoría de los casos cuando un recién nacido pretérmino presenta signos de enfermedad, suele acabar recibiendo tratamiento antibiótico al menos hasta descartar la etiología infecciosa de la enfermedad que presenta.5
La profilaxis antibiótica ha demostrado retrasar el parto, disminuir el número de infecciones maternas, infecciones neonatales, distrés respiratorio, secuelas neurológicas mayores y la mortalidad antenatal y neonatal. Por todas estas razones se recomienda su uso profiláctico en el tratamiento expectante en la RPM pretérmino.6
Analizando la distribución de frecuencia de esta casuística, un poco más de una cuarta parte de los casos presentó sepsis neonatal, fue la primera causa de morbilidad en el grupo estudiado; resultados similares publica una universidad de Canadá, que reportaron alrededor de 20 % de complicaciones sépticas neonatales, que al hacer la regresión logística multivariable en 1 296 casos, las variables de la inflamación fetal se distribuyeron con un Odds Ratio entre 2,6 y 5,6 para enteritis necrotizante, enfermedad infecciosa pulmonar, síndrome de distrés respiratorio, entre otras, sin embargo, no hubo correlación con deficiencias en el puntaje de Apgar a los 5 min.7,8
En un estudio9 con un diseño similar a este, donde la mayor frecuencia de peso de los recién nacidos fue la de menos de 1 500 g, hubo una elevada incidencia de infección microbiana de la cavidad amniótica (53 %) y los recién nacidos presentaron mayor frecuencia de bronconeumonía, como primera causa de infección neonatal, dando como punto de corte de mayor riesgo de resultado neonatal adverso, las 30 sem de edad gestacional, con una sensibilidad de un 82,5 %, una especificidad de un 85 %, valor predictivo de un 82, 5 % y un valor predictivo negativo de 85 %.
Goldenberg y otros evaluaron la frecuencia de infecciones con Ureaplasma urealyticum y Mycoplasma hominis en pretérminos nacidos entre las 23-32 sem de edad gestacional y determinaron su asociación con varias condiciones obstétricas, marcadores de inflamación placentaria y resultados neonatales, y determinaron que las infecciones por estos gérmenes estaban fuertemente asociadas con el síndrome de respuesta inflamatoria sistémica (SRIS) neonatal, y probablemente, displasia broncopulmonar.10
Es conocida la mayor incidencia de septicemia bacteriana perinatal en el grupo de recién nacidos pretérminos y se ha llegado a afirmar que el 25 % de los partos prematuros lo son secundariamente a la colonización microbiana de las cubiertas ovulares. Es infrecuente la observación de un feto muerto intraútero como consecuencia de una infección bacteriana. Cuando la corioamnionitis y la infección fetal son tan graves como para comprometer la viabilidad del feto, se desencadena prácticamente siempre el parto antes de llegar al óbito fetal, puede ser tan importante la afectación del recién nacido que la muerte pudiera ocurrir al cabo de pocos minutos u horas del nacimiento.
Las interleuquinas son proteínas que pueden ser producidas por casi cualquier célula pero básicamente las producen las células del sistema inmune. Pueden agruparse en proinflamatorias tales como la interleuquina 6 (IL-6), IL-1, factor de necrosis tumoral alfa (FNTa ), inmunomoduladoras como el interferón gamma (INFg), las quimioquinas como la IL-8 y existen además las inhibidoras como la IL-10 y el factor de crecimiento transformante beta (TGFb). Se ha constatado que estas proteínas están elevadas en el líquido amniótico de gestantes con dinámica uterina de origen idiopático, sugiriendo así la existencia de una infección subclínica.11-13
Estudios similares muestran el impacto del valor predictivo de la interleuquina 6 (IL 6) y mensuraciones del timo, y se observa que existe una asociación entre la involución del timo, componentes inmunológicos, rotura prematura de membranas en embarazos pretérmino y síndrome de respuesta inflamatoria fetal.14 DO El-Haieg y otros estudiaron 56 mujeres con RPM pretérmino, de ellas el 54 % desarrolló corioamnionitis, 23 % presentó funisitis y los niveles de interleuquina 6 fueron mayores de 11 pg./ml en el 52 % de las pacientes y mayor de 18 pg./ml en el 41 %. Un timo pequeño se asoció con más frecuencia con fetos masculinos, acortamiento del período de latencia, niveles elevados de IL 6, alta frecuencia de funisitis y corioamnionitis.14
Por otra parte la incidencia de infección nosocomial es baja en las unidades de observación (0,3 -1,7 %) y suelen ser generalmente infecciones cutáneas. En este trabajo la sepsis adquirida está alrededor del 13,3 %, que no coincide con el dato anterior debido a que los recién nacidos pretérmino en este período van a unidades de cuidados intensivos; lo que sí está demostrado es que la tasa de infección es variable (20-40 %) dependiendo fundamentalmente del grado de inmadurez y el tipo de patologías de los pacientes atendidos.
La enfermedad de membrana hialina (EMH) y el síndrome de distrés respiratorio (SDR) son las complicaciones neonatales que predominaron en este estudio. La inmadurez del recién nacido prematuro afecta a todas las estructuras del pulmón, a las de la pared torácica, esqueleto y musculatura y al control del proceso respiratorio y parte del sistema nervioso central.
En los trabajos nacionales, Ganfong15 obtuvo resultados similares a los nuestros en relación con la sepsis y síndrome de distrés respiratorio.
En concordancia con este estudio, Waters y otros estudiaron la RPM cerca del límite de la viabilidad fetal y observaron que las complicaciones respiratorias fueron más frecuentes con una incidencia de 66 % de SDR. También fueron más frecuentes la displasia broncopulmonar y la sepsis.16
En los años 80 comenzaron estudios en los que se intentó el tratamiento con antibióticos para prevenir la infección intraamniótica y las complicaciones maternas y fetales en pacientes con R.P.M. En 1995 Mercer17 publicó en la revista Lancet seguido de Egarter18 y otros, que hicieron que la Cochrane, el ACOG y los protocolos de la Sociedad Española de Ginecología y Obstetricia (SEGO), recomendaran la utilización de los antibióticos en partos pretérmino para conseguir retrasar el parto, evitar la corioamnionitis y la sepsis neonatal. Ha sido motivo de debate qué antibiótico utilizar y por cuánto tiempo.
En este estudio la mayor morbilidad por sepsis connatal estuvo en relación con aquellas pacientes en las que el parto se produjo 8 días después de finalizada la terapéutica antibiótica (66,6 %-4 casos). De igual forma se comportó la sepsis adquirida.
Autores cubanos, concluyen que el uso combinado de antibióticos favorece el resultado final para los casos con rotura prematura de membranas y prematuridad.19
En el registro especializado de ensayos controlados del Grupo Cochrane de Embarazo y Parto (Cochrane Pregnancy and Childbirth Group, octubre de 2001), el Registro Cochrane de Ensayos Controlados (Cochrane Controlled Trials Register) (La Cochrane Library, Número 4, 2001) no se mostraron diferencias estadísticamente significativas para los resultados de morbilidad neonatal.20
El síndrome de dificultad respiratoria (SDR), es la causa principal de la morbimortalidad neonatal temprana y aumenta significativamente los altos costos de los cuidados intensivos neonatales. De forma similar se comporta la EMH, consecuencia de una producción inadecuada de surfactante, sin el cual los pulmones no son estables y las bajas presiones causan colapso al final de la expiración. El 30 % de los casos con distress respiratorio, tal y como describe la literatura, ocurrió cuando la terapia con esteroides no había sobrepasado las 24 h, los estudios coinciden que el efecto beneficioso comienza a partir de las 48 h.21
En el más reciente meta análisis de Cochrane22 el rango (Odds Ratio) secundario a corticoides prenatales fue 0,53 (95 % CI: 044,063). También disminuyó significativamente el riesgo de hemorragia intraventricular, mortalidad neonatal y necesidad de terapia con surfactante. Estudios de seguimiento en niños que habían participado en estudios randomizados controlados donde se le había administrado un único curso de esteroides, no demostraron efectos adversos.
Como se expone en la tabla 5, en la mortalidad de los recién nacidos predominaron aquellos con un peso inferior a 1 500 g, lo que se corresponde con lo descrito en la literatura para este grupo de peso, mucho más cuando está asociado a edades gestacionales inferiores a las 30 sem, tiempo en que son afectados por patologías directamente relacionadas con la prematuridad. Sin embargo, si analizamos los resultados de las biopsias, existe poca correspondencia con el cuadro clínico que predominó, aunque por la patología que analizamos, el riesgo de infección, como causa de mortalidad, especialmente en recién nacidos que requieren cuidados intensivos neonatales, se eleva grandemente.23
Rocha y otros revisaron las historias clínicas y las necropsias de 40 recién nacidos fallecidos producto de gestaciones £ 37 sem en un período de 9 años (entre 1997 y 2005) y encontraron EMH en el diagnóstico histológico en el 73 % de los casos. En el 43 % hubo correspondencia entre el diagnóstico histológico y el diagnóstico clínico (incluyendo aquellos con displasia broncopulmonar); en el 27,5 % de los casos no se confirmó el diagnóstico de enfermedad de membrana hialina.24
Se concluye que aproximadamente la mitad de los recién nacidos tuvo un peso inferior a los 1 500 g. La enfermedad de membrana hialina y la sepsis neonatal fueron las complicaciones más frecuentes. La mayor cantidad de recién nacidos que presentaron sepsis al nacer fueron los que recibieron terapia antibiótica y la habían culminado en un período mayor de 8 días antes del parto.
Predominó la enfermedad de membrana hialina en los que concluyeron la terapia esteroidea por más de 8 días. La mortalidad neonatal fue significativa en los recién nacidos con peso inferior a 1 500 g.
REFERENCIAS BIBLIOGRÁFICAS
1. Kollée L, Cuttini M, Delmas D, Papiernik E, Ouden A, Agostino R, et al. The MOSAIC Research group. Obstetric interventions for babies born before 28 weeks of gestation in Europe: results of the MOSAIC study. BJOG. 2009;116:148-91.
2. Azpurua H, Dulay A, Buhimschi I, Bahtiyar M, Funai E, Abdel-Razeq S, et al. Fetal renal artery impedance as assessed by Doppler ultrasound in pregnancies complicated by intraamniotic inflammation and preterm birth. Am J Obstet Gynecol. 2009;200:203.e1-203.e11.
3. Romero Arauz F, Martínez Chéquer JC, García Alonso López A, Jurado Hernández VH, Ayala Méndez JA. Factores sociodemográficos y obstétricos asociados con rotura prematura de membranas. Ginecol Obstet Mex. 2008;76(8):468-75.
4. Ministerio de Salud Pública. Dirección nacional de registros médicos y estadísticas de salud. Anuario estadístico de salud 2009. Cuadro 45. Principales causas de muerte en menores de un año por componentes. (Según lista cubana abreviada 28 de mortalidad infantil). La Habana: MINSAP; 2009. p. 63.
5. Cabero L, Ingermarsson I. Parto prematuro. Aspectos de géneros del nacimiento pretérmino. Ed Med Panamericana S.A. 2004;30(5):47-51.
6. Ochoa A, Pérez J. Amenaza de parto prematuro. Rotura prematura de membranas. Corioamnionitis. An Sist Sanit Navar. 2009;32 (Supl. 1):105-19.
7. Pacora P, Chaiworapongsa T, Maymon E, Kim YM, Gomez R, Yoon BH, et al. Funisitis and chorionic vasculitis: the histological counterpart of the fetal inflammatory response syndrome. J Matern Fetal Neonatal Med. 2002;11:18-25.
8. Wu YW, Escobar GJ, K, Grether JK, Croen LA, Greene JD, Newman TB. Chorioamnionitis and cerebral palsy in term and near- term infants. JAMA 2003;290:2677-84.
9. Saavedra S, Valdés J, Bardales J, Essien E. Morbimortalidad perinatal de la rotura prematura de membrana en el embarazo pretérmino. Clin Invest Gin Obst. 2006;33(3):102-6.
10. Goldenberg R, Andrews W, Goepfert A, Faye-Petersen O, Cliver S, Carlo W, et al. The Alabama Preterm Birth Study: Umbilical cord blood Ureaplasma urealyticum and Mycoplasma hominis cultures in very preterm newborn infants. Am J Obstet Gynecol. 2008;198:43.e1-43.e5.
11. Marcell L, González V. Relación de las citoquinas proinflamatorias con la corioamnionitis subclínica y el parto pretérmino. Rev Cubana Obstet Ginecol. 2011;37(4):562-76.
12. Wei S, Fraser W, Luo Z. Inflammatory Cytokines and Spontaneous Preterm Birth in Asymptomatic Women. Am Col Obstet Gynecol. 2010;116(2):393-01.
13. Yang Q, El Sayed Y, Shaw G, Fu J, Schilling J, Madan A. Second-Trimester Serum Cytokines in Women Who Develop Spontaneous Preterm Labor at Less than 28 Weeks' Gestation versus Term Labor. Am J Perinatol. 2010;27(1):31-6.
14. El-Haieg D, Zidan A, El-Nemr M. The relationship between sonographic fetal thymus size and the components of the systemic fetal inflammatory response syndrome in women with preterm prelabour rupture of membranes. BJOG [serie en Internet]. 2008 [citado 26 May 2013];115:836-41. Disponible en: www.blackwellpublishing.com/bjog
15. Ganfong Elías, Andino AN, Simonó Bell NM, González Pérez JM, Ferreiro Fernández L, Díaz Pérez MC. Influencia de la rotura prematura de membranas en algunos resultados perinatales. Rev Cubana Obstet Ginecol. 2007;33(2).
16. Waters Thaddeus P, MD, Mercer Brian M, MD. The management of preterm premature ruptures of the membranes near the limit of fetal viability. Am J Obst Gynecol. [serie en Internet]. 2009 [citado 26 de mayo 2013]:230-40. Disponible en: http://www.AJOG.org
17. Mercer MB. Preterm rupture of the membranes. Obstet Gynecol. 2003;101:178-93.
18. Christian Egarter, Harald Leitich, Hermann Karas, Friedrich Wieser, Peter Husslein, Alexandra Kaiderb, et al. Antibiotic treatment in preterm premature rupture of membranes and neonatal morbility: A Meta analyzes. Am J Obst Gynecol. 1996;174:587-97.
19. Martínez Camilo V, Álvarez Ponce V. Uso de antimicrobianos en pacientes con rotura prematura de membranas y embarazo pretérmino. Rev Cubana Obstet Ginecol. 2002;28(2): 12-8.
20. Flenady V, King J. Antibióticos para la rotura prematura de membranas antes del parto a término o cerca del término. Biblioteca Cochrane Plus. 2007 [citado 26 de enero 2013];4. Oxford, Update Software Ltd. Disponible en: http://www.update-software.com
21. Pallas CR, de la Cruz J, Medina MC. Apoyo al desarrollo de los niños nacidos demasiado pequeños, demasiado pronto. Diez años de observación e investigación clínica en el contexto de un programa de seguimiento. Documento 56/2000. Madrid: Real Patronato de Prevención y de Atención a Personas con Minusvalías; 2001.
22. Kenyon S, Boulvain M, Neilson J. Antibióticos para la rotura prematura de membranas. En: La Biblioteca Cochrane Plus. 2007 [citado 15 de diciembre 2013];(4). Oxford. Update Software Ltd. Disponible en: http://www.update-software.com
23. Cunningham F. Management of Preterm Ruptured Membranes and Preterm Labor. Williams Obstetrics. The McGraw-Hill Companies. 22e; 2006 [citado 4 de enero 2013]. Disponible en: http://www.accessmedicine.com/popup.aspx?aID=732011&print=yes
24. Rocha G, Rodrigues M, Guimaraes H. Respiratory distress syndrome of the preterm neonate-placenta and necropsy as witnesses. J Matern Fetal Neonatal Med. 2011;24(1):148-51.
Recibido: 20 de agosto de 2013.
Aprobado: 5 de septiembre de 2013.
Niobys Sánchez Ramírez. Hospital Ginecoobstétrico "Ramón González Coro". Calle 21 y 4. El Vedado. La Habana, Cuba. Correo electrónico: niobysanchez@infomed.sld.cu