Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol vol.40 no.1 Ciudad de la Habana ene.-mar. 2014
REVISIÓN BILIOGRÁFICA
Infección por Chlamydia trachomatis como cofactor en la etiología del cáncer cervical
Chlamydia trachomatis: a cofactor in the etiology of cervical cancer
MSc. Maydelín Frontela Noda,I MSc. Yoima Rodríguez Marín,II MSc. María de los Ángeles Ríos Hernández,I MSc. Maite Hernández MenéndezI
I Instituto Nacional de Oncología y Radiobiología (INOR). La Habana, Cuba.
II Instituto Nacional de Endocrinología (INEN). La Habana, Cuba.
RESUMEN
Se ha demostrado que la infección por el virus del papiloma humano es una condición necesaria pero no suficiente para el desarrollo del cáncer de cuello de útero, ya que solo un pequeño número de las mujeres expuestas progresan a neoplasia cervical. El objetivo de este estudio fue revisar la literatura científica reciente acerca del papel de Chlamydia trachomatis como cofactor en el establecimiento del virus del papiloma humano y en el desarrollo del cáncer de cuello de útero. Entre los cofactores propuestos se incluyen otras infecciones de transmisión sexual, hábito de fumar, hormonas, deficiencias nutricionales, obesidad y respuesta genético-inmunológica del individuo. Chlamydia trachomatis es la más común de las infecciones de transmisión sexual de origen bacteriano y se ha asociado con el desarrollo del cáncer de cuello de útero en muchos estudios poblacionales y de casos y controles. Sin embargo, todavía es necesario esclarecer algunos aspectos de la relación causa-efecto entre la infección por Chlamydia trachomatis, la persistencia del virus del papiloma humano y la progresión a cáncer. La prevención de la infección por Chlamydia trachomatis puede ser importante en la reducción de este tipo de neoplasia, fundamentalmente en mujeres jóvenes.
Palabras clave: Chlamydia trachomatis, cáncer de cuello de útero (CCU), virus del papiloma humano (VPH).
ABSTRACT
It has been shown that human papillomavirus presence is a necessary condition for the development of cervical cancer. However, it is not sufficient and only a small number of exposed women will progress to cervical neoplasia. Proposed cofactors include other sexually transmitted infections, smoking habit, hormones, nutritional deficiencies, obesity and host genetic/immunologic responses. Chlamydia trachomatis is the most common bacterial sexually transmitted infection and it has been associated with the development of cervical cancer in many case-controlled and population based studies. However, it is still necessary to elucidate some aspects of cause/effect relationship between Chlamydia trachomatis infection, human papillomavirus persistence and progression to cervical cancer. This article aims to review the current scientific literature upon the role of Chlamydia trachomatis as a cofactor in the development of invasive cervical cancer and HPV establishment. Prophylaxis against Chlamydia trachomatis could be important in reducing the incidence of cervical cancer, mainly in young women.
Key words: Chlamydia trachomatis, cervical cancer, human papillomavirus (HPV).
INTRODUCCIÓN
El cáncer de cuello de útero (CCU) es la tercera neoplasia más frecuente que afecta al sexo femenino a nivel mundial, mientras que en países en vías de desarrollo su tasa de incidencia se sitúa en el 1er. lugar con una alta mortalidad y una elevada cantidad de años de vida perdidos.1,2 En Cuba, ocupa el 5to. lugar en mortalidad y el 4to. en incidencia, según datos publicados en el Anuario Estadístico de Salud Pública.3
En Cuba existe un Programa de detección del cáncer cérvicouterino4 que brinda una amplia cobertura mediante la prueba de detección Papanicolaou,5 que se realiza con una frecuencia trienal en las mujeres mayores de 25 años. Sin embargo, a pesar de la utilidad de esta estrategia para la pesquisa, la morbilidad y mortalidad debida a este tipo de neoplasia continúan siendo elevadas.6
Algunos estudios previos han identificado los principales factores de riesgo del CCU, entre ellos, la multiparidad por la vía vaginal (5 o más partos), historia de múltiples parejas sexuales y edades tempranas de inicio de las relaciones sexuales,7,8 así como la presencia de infecciones de transmisión sexual. Múltiples evidencias epidemiológicas han permitido progresar en la comprensión de la etiología del CCU y han establecido su etiología viral, reconociéndose al virus del papiloma humano (VPH) como el principal agente causal de dicha enfermedad.9
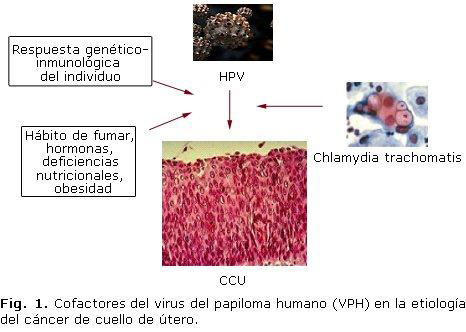
Sin embargo, la infección por el VPH es una condición necesaria pero no suficiente para el desarrollo del CCU, ya que solo una pequeña proporción de mujeres infectadas con el virus progresan a CCU, lo que permite inferir que deben existir otros cofactores que participen en el proceso de carcinogénesis. Entre los más importantes se encuentran el hábito de fumar, las hormonas, las deficiencias nutricionales, la respuesta genético-inmunológica del individuo, así como la presencia de otras ITS, como la infección por Chlamydia trachomatis y por el Virus del Herpes Simple.10-12 Recientemente, se ha incluido a la obesidad entre los posibles cofactores que contribuyen al desarrollo de la enfermedad (figura 1).13
Este artículo tiene el objetivo de revisar la literatura científica reciente acerca del papel de la infección por Chlamydia trachomatis como un cofactor en el establecimiento del VPH y el desarrollo del CCU.
DESARROLLO
VPH y cáncer cervical
El VPH es un virus epiteliotrópico, asociado a la aparición de lesiones benignas, premalignas y malignas de diferentes localizaciones corporales. Está compuesto por un ADN bicatenario circular, no encapsulado. Su genoma mide alrededor de 8 000 pb, formado por una región controladora, 8 genes que codifican 6 proteínas tempranas (E del inglés early) y 2 tardías (L del inglés late). Las proteínas L1 y L2 son estructurales, formando la cápside viral, siendo la L1 la que aparece en mayor proporción. Las proteínas E1, E2, E4, son las encargadas del ciclo de vida del virus, mientras que las proteínas E5, E6 y E7 están asociadas con la transformación de las células del hospedero.
En la actualidad se conocen alrededor de 126 genotipos diferentes del VPH, de los cuales 40 infectan el tracto anogenital de ambos sexos. La clasificación de estos virus como de alto y bajo riesgo de desarrollar cáncer, se basa en la capacidad transformante de sus proteínas E6 y E7. Entre los de alto riesgo se agrupan los VPH 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82, los genotipos 16 y 18 son los más frecuentes, responsables del 70 % de los tumores epiteliales del cérvix. Los de bajo riesgo están asociados a la verruga genital, infección de transmisión sexual más difundida a nivel mundial, siendo los más representativos del grupo los VPH 6 y 11.14-16
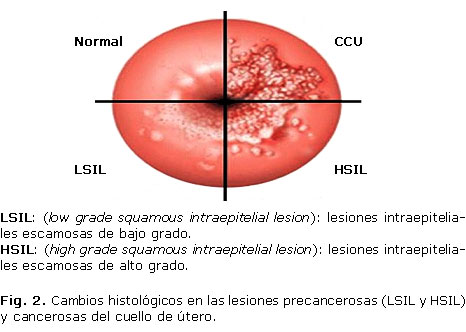
La etiología y la historia natural del cáncer cervical es compleja, más del 80 % de las mujeres infectadas con VPH pueden eliminar la infección espontáneamente, y aquellas con lesiones intraepiteliales escamosas de bajo grado (LSIL, por sus siglas en inglés) o neoplasias intraepiteliales cervicales grado 1 (NIC 1) pueden retornar al estado normal, lo que demuestra que esta infección sola es insuficiente para causar cáncer cervical.17,18 El desarrollo de las lesiones intraepiteliales escamosas de alto grado (HSIL, por sus siglas en inglés) o neoplasias intraepiteliales cervicales grados 2 y 3 (NIC 2 y 3) (figura 2), requiere de la persistencia del VPH y de la progresión de los cambios en las células epiteliales.19,20
Normalmente los VPH se encuentran en forma episomal en las lesiones del cérvix, sin embargo, los genotipos de alto riesgo tienden a integrarse en el genoma del hospedero, es esta una condición indispensable para que ocurra la carcinogénesis. Durante el mecanismo de integración viral ocurre la pérdida de las proteínas E1 y E2, las cuales regulan la expresión de los diferentes genes del virus y de esta forma se induce una producción descontrolada de las proteínas oncogénicas E6 y E7, que se consideran las promotoras del cáncer cervical.5 La presencia de ambas proteínas es necesaria para inducir y mantener la transformación de las células infectadas, interfiriendo con el control del ciclo celular y la apoptosis. Se han planteado diversos mecanismos por medio de los cuales actúan estas proteínas, ejemplo de ello son la inactivación de genes supresores de tumor (p53, Rb),21 activación de los oncogenes H-ras,22 c-myc,23 inducción de inestabilidad cromosómica y actividad telomerasa, entre otros.24
Las infecciones con VPH de bajo riesgo (VPH 6 y 11) usualmente son eliminadas espontáneamente mediante una respuesta inmune celular acoplada con la respuesta de anticuerpos contra la proteína L1. Por otra parte, las infecciones con VPH de alto riesgo (VPH 16 y 18), son las que contribuyen en mayor medida a la persistencia de la infección en el 10-20 % de los casos y al aumento del riesgo de progresión a NIC 2 o 3. Estas lesiones son inestables genéticamente con un elevado riesgo de progresión (30-40 %) a CCU.25
Chlamydia trachomatis y cáncer cervical
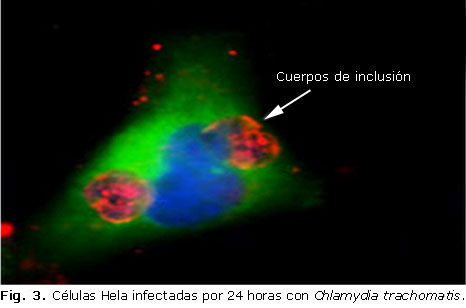
Chlamydia trachomatis es una bacteria de vida intracelular obligada que infecta las células epiteliales humanas del tejido ocular y del tracto genital (Fig. 3). (Esta figura está disponible en: http://www.pasteur.fr/ip/easysite/pasteur/en/research/scientific-departments/cell-biology-and-infection/units-and-groups/biology-of-cell-interactions/research-interests). Es una de las ITS más comunes en el mundo, con un estimado de 92 millones de nuevos casos cada año.26 Generalmente, no produce síntomas pero puede dejar secuelas severas que incluyen enfermedad pélvica inflamatoria, embarazo ectópico, infertilidad e infecciones perinatales.27,28 Como muchos patógenos intracelulares obligados, Chlamydia trachomatis persiste en el huésped después de desarrollar la respuesta inmune, por lo tanto, puede producir infección crónica. En la respuesta inmunológica a la infección por Chlamydia trachomatis participan los componentes del sistema inmune innato tales como macrófagos, células asesinas naturales (NK, por sus siglas en inglés), células dendríticas y neutrófilos, receptores de tipo Toll (TLR, por sus siglas en inglés); citocinas proinflamatorias como interleucina 1, interleucina-6, factor de necrosis tumoral y factor estimulante de colonias de granulocitos y macrófagos. Además, esta infección puede inducir tanto una respuesta protectora como patológica en el hospedero que depende del balance entre la inmunidad mediada por células T auxiliadoras tipo 1 (Th1, por sus siglas en inglés) y células T auxiliadoras tipo 2 (Th2, por sus siglas en inglés). Se ha demostrado que si se potencia una respuesta inmune Th1 se genera protección contra la infección crónica. Sin embargo, la respuesta patológica mediada por células Th2 contra Chlamydia trachomatis puede conducir a la inflamación crónica que causa el daño tisular.29
Además, la inmunidad protectora a la reinfección es relativamente débil, cepa-específica, y requiere de un largo periodo de tiempo para adquirirla. Por tanto, la persistencia y la reinfección son características de la interacción patógeno-huésped. Es muy importante señalar que los mecanismos de patogénesis de la enfermedad también están determinados por las propiedades del genoma del hospedero, porque muchas variantes alélicas de este han sido correlacionadas con diferencias en la inmunobiología de la infección por Chlamydia trachomatis. La mayoría de los polimorfismos identificados se ubican en el loci de la defensa inmunológica determinando la resistencia o la susceptibilidad a la infección en cada individuo.11
Desde la década del 70 se han realizado observaciones clínicas que indican que la infección por Chlamydia trachomatis está asociada con la atipia30 y la neoplasia cervical,31 lo cual se demostró posteriormente tanto en estudios seroepidemiológicos prospectivos32 como en estudios retrospectivos basados en la técnica de reacción en cadena de la polimerasa (PCR, por sus siglas en inglés).33,34 Los estudios seroepidemiológicos también han demostrado que la asociación es serovar específica. Los serotipos G, I, D y B muestran una mayor asociación al carcinoma cervical que otros serotipos. Además, la respuesta de anticuerpos contra la proteína de shock térmico 60 (HSP60, por sus siglas en inglés) de esta bacteria ha sido considerada como un marcador de persistencia de la infección. De acuerdo a esto, los anticuerpos contra esta proteína fueron asociados con un mayor riesgo de carcinoma cervical de células escamosas, especialmente entre aquellas mujeres con un largo período de tiempo entre la adquisición de la infección por Chlamydia trachomatis y el diagnóstico de cáncer cervical.35
El interés en la infección genital por Chlamydia trachomatis como un factor etiológico potencial para CCU está relacionado con su naturaleza asintomática, la persistencia de la infección si no es tratada y la inducción de metaplasia31 e inflamación crónica.34
La patogénesis de la infección por Chlamydia trachomatis en las LSIL se desconoce, pero se sospecha que mediante su mecanismo de inducción de metaplasia cervical puede proporcionar las células blanco para la adquisición del VPH.34,36 Por otra parte, esta puede causar alteraciones inmunológicas locales que pueden interferir con la vigilancia inmunológica de la infección persistente por diferentes tipos de VPH.37 Estas dos alternativas son apoyadas por estudios de cohorte que demuestran que la infección por Chlamydia trachomatis es un factor de riesgo tanto para la infección primaria como para la infección persistente por VPH.26,38 En un estudio realizado utilizando el grupo control de un ensayo clínico para evaluar la vacuna tetravalente de los VPH 6/11/16/18, se incluyeron 8 441 mujeres sanas de 15 a 26 años. A dichas mujeres se les realizó una prueba de Papanicolau y un análisis para la detección de Chlamydia trachomatis al inicio y cada 12 meses durante 4 años. Se demostró que las mujeres con Chlamydia trachomatis al momento de su incorporación al estudio, desarrollaron HSIL con una probabilidad dos veces mayor que aquellas que no padecían la infección.39
Otros estudios de laboratorio han demostrado que esta bacteria tiene una actividad citotóxica a través de mediadores de la respuesta inflamatoria posiblemente debido a la sobreexpresión de citoquinas40 o a la alteración de la adhesión célula-célula y de los patrones de diferenciación celular que predisponen al epitelio cervical a la infección por VPH.41
Por otra parte, una investigación reciente demostró mediante experimentos en modelos in vivo, que la infección persistente por Chlamydia trachomatis disminuyó en 4,7 veces la expresión del gen supresor de tumor caveolin-1 y aumentó en 2,1 veces la expresión del oncogen c-myc.42 La modulación de la expresión de estos genes puede constituir uno de los muchos cofactores que contribuyen a los cambios neoplásicos intraepiteliales en las células cervicales metaplásicas. El VPH modula la expresión de estos genes en la misma forma43 por lo que pudiera pensarse que ambas infecciones tienen una vía oncogénica común en el tejido cervical. Por otra parte, se han obtenido evidencias que indican que la Chlamydia trachomatis puede inhibir la apoptosis durante la infección persistente,44 mediante mecanismos específicos que involucran el bloqueo de la liberación de la citocromo c mitocondrial y la activación de caspasa.45 Posteriormente, se ha asociado a la HPS60 con el efecto antiapoptótico que conduce a la proliferación incontrolada y finalmente a la transformación neoplásica.46 La asociación entre estos dos agentes parece estar más relacionada con una potenciación mutua que con el hecho de que comparten una ruta de transmisión común.47,48
No obstante estas evidencias, existen un grupo de estudios que no encuentran asociación entre la infección por Chlamydia trachomatis y el cáncer cervical.49-51 En ellos se recomienda realizar estudios de cohorte con mayor número de muestras y con períodos de seguimiento más largos para demostrar si realmente la adquisición de Chlamydia trachomatis causa la carcinogénesis cervical. Sin embargo, en el año 2010 se publicó un metanálisis de los estudios longitudinales realizados, en el que se sustenta la asociación entre la infección por Chlamydia trachomatis y la neoplasia cervical,52 aunque aún se requiere demostrar la asociación entre esta infección y la aparición de NIC 2 y 3, el precursor inmediato del cáncer.
En conclusión, aunque algunos autores recomiendan la realización de estudios más rigurosos para corroborar la contribución de la infección por Chlamydia trachomatis a la carcinogénesis cervical, cada vez se obtiene mayor evidencia que permite demostrar que la infección por Chlamydia trachomatis actúa como un cofactor de la infección por VPH en el desarrollo del CCU. Se estima que esta bacteria puede estar presente en el 20 % de los casos con neoplasia cervical.53,54 Esto revela la necesidad de prevenir las infecciones por VPH y Chlamydia trachomatis mediante programas de pesquisa y educación sanitaria, así como mediante la vacunación en el caso del VPH, lo que contribuirá a reducir o erradicar la neoplasia cervical, principalmente en mujeres jóvenes.
REFERENCIAS BIBLIOGRÁFICAS
1. Forman D, de Martel C, Lacey CJ, Soerjomataram I, Lortet-Tieulent J, Bruni L, et al. Global burden of human papillomavirus and related diseases. Vaccine. 2012 Nov 20;30 Suppl 5:F12-23.
2. Smith JS, Lindsay L, Hoots B, Keys J, Franceschi S, Winer R, et al. Human papillomavirus type distribution in invasive cervical cancer and high-grade cervical lesions: A meta-analysis update. Int J Cancer. 2007;13:621-32.
3. Ministerio de Salud Pública. Anuario estadístico de salud. Dirección Nacional de Registros médicos y estadísticas de salud. La Habana: MINSAP; 2012. p. 68-107.
4. Colectivo de autores. Programa Nacional de Diagnóstico Precoz del Cáncer Cérvicouterino. La Habana: MINSAP; 2001.
5. Papanicolaou GN, Traut HF. The diagnostic value of vaginal smears in carcinoma of the uterus. American Journal of Obstetrics and Gynecology. 1941;42:193.
6. Colectivo de autores. Revisión del Programa Nacional de Diagnóstico Precoz del Cáncer Cérvicouterino. Unidad independiente para el control del cáncer. La Habana: MINSAP. 2011.
7. Natphopsuk S, Settheetham-Ishida W, Sinawat S, Pientong C, Yuenyao P, Ishida T. Risk factors for cervical cancer in northeastern Thailand: detailed analyses of sexual and smoking behavior. Asian Pac J Cancer Prev. 2012;13(11):5489-95.
8. Remschmidt C, Kaufmann AM, Hagemann I, Vartazarova E, Wichmann O, Deleré Y. Risk factors for cervical human papillomavirus infection and high-grade intraepithelial lesion in women aged 20 to 31 years in Germany. Int J Gynecol Cancer 2013;23(3):519-26.
9. Bosch FX, Lorincz A, Munoz N, Meijer CJ, Shah KV. The causal relation between human papillomavirus and cervical cancer. J Clin Pathol. 2002;55:244-65.
10. Fonseca-Moutinho JA. Smoking and cervical cancer. ISRN Obstet Gynecol; 2011:8476-84.
11. Brunham RC, Rekart ML. Considerations on Chlamydia trachomatis disease expression. FEMS Immunol Med Microbiol. 2009;55:162-6.
12. Smith JS, Muñoz N, Herrero R. Evidence for Chlamydia trachomatis as a Human papillomavirus cofactor in the etiology of invasive cervical cancer in Brazil and Philippines. J Infect Dis. 2002;185:324-31.
13. Maruthur NM, Bolen SD, Brancati FL, Clark JM. The association of obesity and cervical cancer screening: a systematic review and meta-analysis. Obesity (Silver Spring). 2009;17(2):375-81.
14. Bodily J, Laimins LA. Persistence of human papillomavirus infection: keys to malignant progression. Trends Microbiol. 2011;19(1):33-9.
15. Brinton L, Schiffman M. Epidemiology of gynecologic cancers. In: Barakat R, Markman M, Randall M, eds. Principles and Practice of Gynecologic Oncology. 5th edn. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins; 2009.
16. Wright T. Pathogenesis and diagnosis of preinvasive lesions of the lower genital tract. In: Barakat R, Markman M, Randall M, eds. Principles and Practice of Gynecologic Oncology. 5th edn. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins; 2009.
17. Castle PE, Schiffman M, Herrero R, Hildesheim A, Rodriguez AC, Bratti MC, et al. A prospective study of age trends in cervical human papillomavirus acquisition and persistence in Guanacaste, Costa Rica. J Infect Dis. 2005;191(11):1808-16.
18. Hildesheim A, Schiffman MH, Gravitt PE, Glass AG, Greer CE, Zhang T, et al. Persistence of type-specific human papillomavirus infection among cytologically normal women. J Infect Dis. 1994;169(2):235-40.
19. Furumoto H, Irahara M. Human papillomavirus (HPV) and cervical cancer. J Med Invest. 2002;49(3-4):124-33.
20. Sharma A, Pratap M, Sawhney VM, Khan IU, Bhambhani S, Mitra AB. Frequent amplification of CerbB2(Her-2/Neu) oncogen in cervical carcinomas as detected by non-fluorescence in situ hybridization technique on paraffin sections. Oncology. 1999;56(1):83-7.
21. Koutsky L. The epidemiology behind the HPV vaccine discovery. Annual Epidemiology. 2009;19:239-44.
22. Landro ME, Dalbert D, Picconi MA, Cúneo N, González J, Vornetti S, et al. Human papillomavirus and mutated H-ras oncogene in cervical carcinomas and pathological negative pelvic lymph nodes: a retrospective follow-up. J Med Virol. 2008;80(4):694-701.
23. Pérez-Sayáns M, Suárez-Peñaranda JM, Pilar GD, Barros-Angueira F, Gándara-Rey JM, García-García A. What real influence does the proto-oncogene c-myc have in OSCC behavior? Oral Oncol. 2011;47(8):688-92.
24. Steenbergen RDM, de Wilde J, Wilting SM, Brink ATP, Snijders PJF, Meijer CJLM. HPV-mediated transformation of the anogenital tract. Review. Journal of Clinical Virology. 2005;32S:S25S33.
25. Simonetti AC, Melo JHL, De'Souza PRE, Bruneska D, Filho JLDL. Immunological's host profile for HPV and Chlamydia trachomatis, a cervical cancer cofactor. Microbes and Infection. 2009;11:435-42.
26. World Health Organization. Sexually transmitted diseases. Department of Reproductive Health and Research, World Health Organization. Research on Reproductive Health at WHO. Biennial Report 2000-2001. Chapter 3: Preventing reproductive tract infections. Geneva: WHO; 2002. p. 31-36.
27. Stamm WE. Chlamydia trachomatis infections of the adult. In: Holmes KK, Sparling PF, Stamm WE, editors. Sexually transmitted diseases. New York: Mc Graw-Hill Medical; 2008. p. 575-94.
28. Stamm WE. Chlamydia trachomatis-the persistent pathogen: Thomas Parran Award Lecture. Sex Transm Dis. 2001;28(12):684-9.
29. Agrawal T, Vats V, Salhan S, Mittal A. The mucosal immune response to Chlamydia trachomatis infection of the reproductive tract in women. Journal of Reproductive Immunology. 2009;83:173-8.
30. Paavonen J, Vesterinen E, Meyer B, Saikku P, Suni J, Purola E, et al. Genital Chlamydia trachomatis infections in patients with cervical atypia. Obstet Gynecol. 1979;54:289-91.
31. Schacher J, Hill EC, King EB, Coleman UR, Jones P, Meyer KF. Chlamydial infection in woman with cervical dysplasia. Am J Obstet Gynecol. 1975;123(7):753-7.
32. Koskela P, Anttila T, Björge T, Brunsvig A, Dillner J, Hakama M, et al. Chlamydia trachomatis infection and invasive cervical cancer. Int J Cancer. 2000;85:35-9.
33. Wallin KL, Wiklund F, Luostarinen T. A population-based prospective study of Chlamydia trachomatis infection and cervical carcinoma. Int J Cancer. 2002;101:371e4.
34. Quint KD, de Koning MN, Geraets DT. Comprehensive analysis of HumanPapillomavirus and Chlamydia trachomatis in in-situ and invasive cervical adenocarcinoma. Gynecol Oncol. 2009;114:390e4.
35. Paavonen J, Karunakaran KP, Noguchi Y, Anttila T, Bloigu A, Dillner J, et al. Serum antibody response to the heat shock protein 60 of Chlamydia trachomatis in women with developing cervical cancer. Am J Obstet Gynecol. 2003;189:1287-92.
36. Paavonen J, Purola E. Cytological findings in cervical chlamydial infection. Med Biol. 1980;58(3):174-8.
37. Agrawal T, Vats V, Wallace PK Salhan S, Mittal A. Role of cervical dendritic cell subsets, co-stimulatory molecules, cytokine secretion profile and beta-estradiol in development of sequalae to Chlamydia trachomatis infection. Reprod Biol Endocrinol. 2008;6:46.
38. Velicer C, Zhu X, Vuocolo S, Liaw KL, Saah A. Prevalence and incidence of HPV genital infection in women. Sex Transm Dis. 2009;36(11):696-703.
39. Lehtinen M, Ault KA, Lyytikainen E, Dillner J, Garland SM, Ferris DG, et al. Chlamydia trachomatis infection and risk of cervical intraepithelial neoplasia. Sex Transm Infect. 2011;87(5):372-6.
40. Hafner L, Beagley K, Timms P. Chlamydia trachomatis infection: host immune responses and potential vaccines. Mucosal Immunology 2008;1(2):116-30.
41. Smith JS, Bosetti C, Muñoz N, Herrero R, Bosch FX, Eluf-Neto J, et al. Chlamydia trachomatis and invasive cervical cancer: a pooled analysis of the IARC multicentric case-control study. Int J Cancer. 2004;111(3):431-9.
42. Silins I, Ryd W, Strand A, Wadell G, Törnberg S, Hansson BG, et al. Chlamydia trachomatis infection and persistence of human papillomavirus. Int J Cancer 2005;116(1):110-15.
43. Luostarinen T, Lehtinen M, Bjorge T, Abeler V, Hakama M, Hallmans G, et al. Joint effects of different human papillomaviruses and Chlamydia trachomatis infections on risk of squamous cell carcinoma of the cervix uteri. Eur J Cancer. 2004;40(7):1058-65.
44. Belland RJ, Scidmore MA, Crane DD, Hogan DM, Whitmire W, McClarty G, et al. Chlamydia trachomatis cytotoxicity associatted with complete and partial cytotoxin genes. Proc Natl Acad Sci USA. 2001;98(24):13984-9.
45. Chiarini F, Pisani S, Gallinelli C, Papi E, Seganti L, Degener AM, et al. Simultaneous detection of HPV and other sexually transmitted agents in chronic urethritis. Minerva Urol Nefrol. 1998;50(4):225-31.
46. Prozialeck WC, Fay MJ, Lamar PC, Pearson CA, Sigar I, Ramsey KH. Chlamydia trachomatis disrupts N-cadherin-dependet cell-cell junctions and sequesters beta-catenin in human cervical epithelial cells. Infect Immunol. 2002;70(5):2605-13.
47. Schlott T, Eiffert H, Bohne W, Landgrebe J, Brunner E, Spielbauer B, et al. Chlamydia trachomatis modulates expression of tumor suppressor gene caveolin-1 and oncogen C-myc in the transformation zone of non-neoplastic cervical tissue. Gynecol Oncol. 2005;98(3):409-19.
48. Al Moustafa AE, Foulkers WD, Benlimame N, Wong A, Yen L, Bergeron J, et al. E6/E7 proteins of HPV type 16 and ErbB-2 cooperaye to induce neoplastic transformation of primary normal oral epithelial cells. Oncogene. 2004;23(2):350-8.
49. Safaeian M, Quint K, Schiffman M, Rodriguez AC, Wacholder S, Herrero R, et al. Chlamydia trachomatis and Risk of Prevalent and Incident Cervical Premalignancy in a Population-Based Cohort. J Natl Cancer Inst 2010;102:1794-1804.
50. Lihtinen M, Ault KA, Lyytikaainen E, Dillner J, Garland SM, Ferris DG, et al. Chlamydia trachomatis infection and risk of cervical intraepithelial neoplasia. Sex Transm Infect. 2011;87(5):372-6.
51. Bhatla N, Puri K, Joseph E, Kriplani A, Iyer VK, Sreenicas V. Association of Chlamydia trachomatis infection with human papillomavirus (HPV) and cervical intraepithelial neoplasia A pilot study. Indian J Med Res. 2013;137:533-9.
52. Lehtinen M, Lyytikä i nen E, Koskela P, Surcel H-M, Paavonen J. Chlamydia trachomatis and risk for cervical neoplasia-a meta-analysis of longitudinal studies. Proceedings of the Twelfth International Symposium on Human Chlamydial Infections, International Chlamydia Symposium, Salzburg, Austria, 20-25 June 2010. Abstract. p. 445-8.
53. Paavonen J. Chlamydia trachomatis infections of the female genital tract: State of the art. Annals of Medicine. 2012;44:18-28.
54. Vaccarella S, Lortet-Tieulent J, Plummer M, Franceschi S, Bray F. Worldwide trends in cervical cancer incidence: Impact of screening against changes in disease risk factors. Eur J Cancer. 2013 Jun 7.
Recibido: 25 de septiembre de 2013.
Aprobado: 9 de octubre de 2013.
Maydelín Frontela Noda. Instituto Nacional de Oncología y Radiobiología (INOR). Calle 29 y F. El Vedado. La Habana, Cuba. CP 10400. Correo electrónico: maydefrontela@infomed.sld.cu