Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión On-line ISSN 1561-3062
Rev Cubana Obstet Ginecol vol.42 no.2 Ciudad de la Habana abr.-jun. 2016
OBSTETRICIA Y PERINATOLOGÍA
La multiparidad como factor de riesgo de diabetes mellitus gestacional
Multiparity as a Risk Factor for Gestational Diabetes Mellitus
Anny Huillca-Briceño
Universidad Peruana de Ciencias Aplicadas. Perú
RESUMEN
Introducción: se estima que en Perú la prevalencia de Diabetes Mellitus es de 7 % y uno de cada 100 de estos casos es de tipo gestacional. Un reporte previo menciona que la Diabetes Mellitus Gestacional afecta al 4 % de las gestantes peruanas.
Objetivo: determinar los factores de riesgo potenciales para desarrollar diabetes mellitus gestacional.
Métodos: estudio de casos y controles realizado en el Hospital "Alberto Sabogal" mediante recolección de historias clínicas desde 2009 hasta 2014. Se define como caso las gestantes con diagnóstico de diabetes mellitus gestacional mediante una prueba de tolerancia oral a la glucosa, previa glucosa en ayunas anormal y control a la gestante sin valores indicativos de diabetes mellitus gestacional. Las variables de interés fueron paridad, antecedente de cesáreas, abortos y recién nacido con mayor peso. Los modelos de regresión logística fueron calculados para estimar odd ratios e intervalos de confianza al 95 %.
Resultados: se incluyeron 84 casos y 336 controles. En el modelo multivariado, la multiparidad incrementó el riesgo de diabetes mellitus gestacional (OR= 3,54; IC 95 % 1,55 - 8,14). También hubo antecedente de abortos, a partir del segundo (OR= 3,40, IC 95 % 1,55-7,44) y cesáreas previas (una cesárea OR= 3,5 IC 95 % 1,89-6,47 y más de dos cesáreas OR= 8,35 IC 95 % 3,50-19,95). La multiparidad, dos o más abortos y mayor número de cesáreas son factores de riesgo para diabetes mellitus gestacional.
Conclusiones: el presente estudio describe la asociación de la diabetes mellitus gestacional con algunos antecedentes obstétricos como la multiparidad, el antecedente de cesáreas y/o abortos. Por esta razón, se recomienda implementar medidas de prevención e identificación de gestantes con signos de alarma de diabetes mellitus gestacional para realizar un diagnóstico temprano, así como el seguimiento de estas pacientes en el posparto.
Palabras clave: diabetes gestacional; paridad; cesárea; prueba de tolerancia a la glucosa; macrosomía fetal.
ABSTRACT
Introduction: the prevalence of diabetes mellitus is estimated to be 7% in Peru. One in 100 of these cases is gestational type. A previous report said gestetional diabetes mellitus affects 4% of Peruvian pregnant.
Objectives: identify risk factors for gestational diabetes mellitus (GDM).
Methods: acase-control study was performed in Alberto Sabogal Hospital, collecting medical records from 2009 to 2014. 84 cases and 336 controls were included. A case was defined as a pregnant women diagnosed with GDM by an oral glucose tolerance test (OGTT) after an abnormal fasting glucose and control was defined as a pregnant women without GDM indicative values. The study outcome was GDM. The variables of interest were multiparity, previous cesarean section, abortions, newborn with the greatest weight. Logistic regression were used to calculate the odds ratio (OR) and a confidence interval of 95% (IC95%).
Conclusions: this study describes the association of gestational diabetes mellitus with some obstetrical history as multiparity, history of caesarean sections and / or abortions. For this reason, it is recommended to implement prevention and identification of pregnant women with warning signs of gestational diabetes mellitus for early diagnosis and monitoring of these patients in the postpartum period.
Keywords: gestational diabetes; parity; cesarean section; glucose tolerance test; fetal macrosomia.
INTRODUCCIÓN
Se estima que en Perú la prevalencia de Diabetes Mellitus (DM) es de 7 %1 y uno de cada 100 de estos casos es de tipo gestacional. 2 Un reporte previo menciona que la Diabetes Mellitus Gestacional (DMG) afecta al 4 % de las gestantes peruanas.3 En un metaanálisis previo se encontró una prevalencia de DMG de 3,4 %.4 Se han registrado 200,000 por año en Estados Unidos que aumentan la morbimortalidad materno fetal.5-7 Por ejemplo, estudios como HAPO y otros, describen un mayor número de cesáreas y óbitos fetales atribuibles a DMG, la macrosomía neonatal es una de las complicaciones más frecuentes.6,8-10
Diversos factores incrementan el riesgo de desarrollar DMG:11 la paridad, el antecedente de aborto y el antecedente familiar de diabetes mellitus se encuentran dentro del grupo más importante.4 En el caso de la multiparidad, la información encontrada es controversial, dado que algunos estudios como Di Cianni la asocian a menor riesgo,12 mientras que en otros estudios a mayor riesgo.13,14,15 Sin embargo, una revisión sistemática menciona que las grandes multíparas tienen más riesgo de presentar obesidad y DMG.16 El objetivo del presente estudio fue determinar los factores de riesgo potenciales para desarrollar diabetes mellitus gestacional incluyendo antecedentes obstétricos como cesáreas previas, abortos previos y paridad.
MÉTODOS
Se realizó un estudio de casos y controles no pareados en un ratio 1:4, en base a información recolectada de Historias Clínicas y de la Historia Clínica Perinatal (CLAP) del Hospital "Alberto Sabogal", Callao, Perú. Este hospital de nivel IV atendió 16 605 partos y 16 763 nacimientos en el año 2013, a donde se derivan los embarazos de alto riesgo obstétrico por ser un hospital de mayor capacidad resolutiva. 17
Los casos se seleccionaron de los registros e historias clínicas de gestantes atendidas o referidas al Hospital "Alberto Sabogal" de los últimos cinco años (2009-2014) con controles prenatales iniciados durante el primer trimestre y con al menos un control en cada trimestre en el Servicio de Ginecoobstetricia. Solo se seleccionaron las gestantes con el diagnóstico confirmado de diabetes mellitus gestacional.
La variable resultado del estudio fue DMG, definida como aquella diagnosticada después de las 24 semanas de embarazo, mediante una prueba de glucosa en ayunas. Como el valor encontrado fue ≥ 126 mg/dl, el diagnóstico se confirmó mediante una prueba de tolerancia oral a la glucosa (PTOG), ambos registrados en las historias clínicas revisadas. La prueba se realiza en un estado de ayunas de 8 a 14 horas (con un consumo mínimo de 150 g de carbohidratos en la dieta, en los últimos 3 días). Esta consiste en una muestra rápida de glucosa en sangre (inmediatamente después), a la hora y a las dos horas después de la ingesta de una solución con 75 g de glucosa. La prueba fue considerada positiva si se encontraba al menos un valor anormal (rápido > 92 mg/dl, 1hr > 180 mg/dl o 2hr > 153 mg/dl).18,19
Los controles fueron seleccionados de los mismos registros e historias clínicas del Hospital Alberto Sabogal, ordenados por fecha de atención, de donde se seleccionaron los casos y en igual periodo de tiempo (5 años) en una razón de 4 controles consecutivos cada vez que se seleccionaba un caso.
Se definió como control, a aquellas gestantes con historia clínica en el mismo servicio que habían iniciado el control prenatal durante el primer trimestre con al menos uno en cada trimestre y que, al realizarse una prueba de glucosa en ayunas a partir de las 24 semanas de embarazo, esta fue normal cuando el valor era menor de 126mg/dl descartando el diagnóstico de DMG sólo con ese resultado.
Se excluyó de ambos grupos del estudio (casos y controles) a las gestantes con antecedente de infección por VIH y a las gestantes con embarazo múltiple.
La variable de exposición de interés fue paridad, definida como el número de partos registrados hasta la fecha sin incluir el embarazo actual. Esta se categorizó como nulípara, gestante con un parto, gestante con 2 partos o multípara (3 o más partos).11 Otras variables de exposición incluidas fueron: antecedentes obstétricos incluyendo cesáreas previas (0, 1 y más de dos); el número de gestaciones previas (primigesta, segundigesta, o multigesta, es decir más de tres gestaciones); antecedente de abortos (0, 1 y 2+), y recién nacido de mayor peso previo al embarazo actual (<4000 o ≥4000 gramos).
Algunas variables fueron consideradas como potenciales confusores como la edad (<35 y ≥35), estado civil (soltera y con pareja), antecedente familiar de DM (si/no) y antecedente familiar de HA (sí/no). Las variables analizadas se escogieron por investigaciones previas que evaluaban su asociación a DMG.
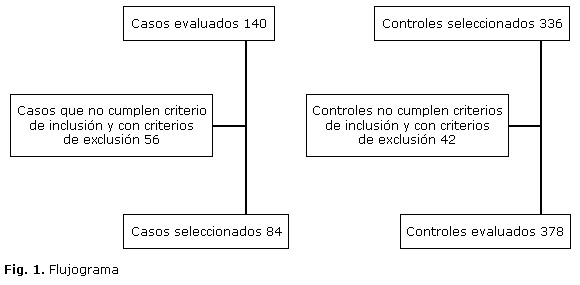
La muestra se tomó con una potencia de 80 % y un nivel de significancia del 5 %, basado en una proporción de casos (DMG) expuestos a paridad de 54,4 % y una proporción de controles expuestos de 37,2 % a la variable paridad de acuerdo a un estudio previo.13 El resultado fue una muestra mínima total de 405, compuesto por 81 casos y 324 controles, en una relación de 1:4 (Fig. 1).
Los datos fueron ingresados en una ficha de recolección de datos elaboradas por las mismas investigadoras en el programa Microsoft Excel 2010®, a través de un proceso de doble digitación. El análisis de datos se realizó a través del paquete estadístico STATA 11.0 para Windows (STATA Corp LP, College Station, TX, US). (Fig. 2a) (Fig. 2b)
Primero se realizó un análisis descriptivo de la población estudiada comparando casos y controles. Para el análisis bivariado, algunas variables numéricas fueron categorizadas y comparadas con la prueba de chi cuadrado o la prueba exacta de Fisher, según fuera el caso.
Se realizó regresión logística para evaluar la asociación entre las exposiciones de interés y DMG. Se obtuvieron valores de Odds Ratio (OR) e intervalos de confianza al 95% (IC95%) que fueron ajustados (aOR) por potenciales confusores, es decir, se realizó el análisis de cada variable de forma individual ajustada a las variables confusoras en base a otros estudios realizados.
Este estudio ha sido aprobado por el Comité de Ética de la Universidad Peruana de Ciencias Aplicadas, Lima, Perú, y el Comité Académico del Hospital Alberto Sabogal. Se realizó una revisión de historias clínicas sin usar información personal de las pacientes (identificadores personales).
RESULTADOS
Se incluyeron 84 casos y 336 controles. La media de edad de los casos fue de 30 (DE: 6,6) años y de los controles de 34 (DE: 4,9) años. Se encontró diferencia estadísticamente significativa en la edad y en el antecedente familiar de DM e HTA entre casos y controles (tabla 1).
Tabla 1. Características demográficas de los casos y controles
| 0,001* | ||||
| Edad | Casos (%) | Control (%) | ||
| <35 años | 44 (52,38 | 241 (71,73) | ||
| ≥35 años | 40 (47,62) | 95 (28,27) | ||
| Estado civil | 0,061* | |||
| Soltera | 10 (11,90) | 70 (20,90) | ||
| Con pareja | 74 (88,10) | 265 (79,10) | ||
| Antecedente familiar de DM | < 0,001* | |||
| No | 40 (47,62) | 250 (74,4) | ||
| Sí | 44 (52,38) | 86 (25,6) | ||
| Antecedente familiar de HTA | 0,024* | |||
| No | 51 (60,71) | 246 (73,21) | ||
| Sí | 33 (39,29) | 90 (26,79) | ||
*Prueba chi cuadrado.
**Test exacto de Fisher
Cuando se realizó el análisis comparativo de los antecedentes ginecoobstétricos, se encontró asociación entre DMG y un mayor número de partos (p< 0,001), número de cesáreas previas al embarazo actual (p< 0,001), antecedente de un recién nacido previo macrosómico (p< 0,001) y abortos previos (p= 0,001) (tabla 2).
Tabla 2. Características ginecobstétricas de casos y controles
| Paridad | Casos N= 84 (%) | Control N= 336 (%) | < 0,001* |
| 0 partos | 15 (17,86) | 102 (30,36) | - |
| 1 Parto | 25 (29,76) | 108 (32,14) | - |
| 2 Partos | 21 (25,00) | 91 (27,08) | - |
| 3+ partos | 23 (27,38) | 35 (10,42) | - |
| Número de gestaciones | 0,070* | ||
| Primigesta | 10 (12,35) | 77 (22,92) | - |
| Segundigesta | 24 (29,63) | 103 (30,65) | - |
| 3+ gestaciones | 47 (58,02) | 156 (46,43) | - |
| Cesáreas | < 0,001** | ||
| 0 cesáreas | 42 (50,0) | 277 (82,44) | - |
| 1 cesárea | 26 (30,95) | 47 (13,99) | - |
| 2+ cesáreas | 16 (19,05) | 12 (3,57) | - |
| RN mayor peso | <0,001* | ||
| Eutrófico | 68 (80,95) | 320 (95,24) | - |
| Macrosómico | 16 (19,05) | 16 (4,76) | - |
| Ganancia de peso | 0,226** | ||
| Normal | 1 (14,29) | 11 (35,48) | - |
| Baja ganancia | 3 (42,86) | 5 (16,13) | - |
| Alta ganancia | 3 (42,86) | 15 (48,39) | - |
| Abortos previos | 0,001* | ||
| 0 abortos | 49 (58,33 %) | 232 (69,05 %) | - |
| 1 abortos | 19 (22,62 %) | 83 (24,70 %) | - |
| 2+ abortos | 16 (19,05 %) | 21 (6,25 %) | - |
*Prueba chi cuadrado **Test exacto de Fisher
En el modelo multivariable, las gestantes multíparas presentaron mayor probabilidad de DMG comparado con las gestantes nulíparas (tabla 3). Dentro de los otros factores, el antecedente de cesáreas previas y la historia de abortos previos estuvieron asociados a mayor probabilidad de presentar DMG. El antecedente de RN de mayor peso macrosómico con un promedio de 3647 g (DE: 484,9 g) en casos y 3425 g (DE: 763,7 g) en controles, también se encuentra asociado a DMG (Detalles presentados en la tabla 3).
Tabla 3. Factores asociados a diabetes mellitus gestacional
| OR | IC 95 % | AOR | IC 95 % | |
| Paridad | ||||
| Nuliparidad | 1 (Ref) | 1 (Ref) | ||
| 1 Parto | 1,57 | 0,79 - 3.15 | 1,50 | 0,72 - 3,11 |
| 2 Partos | 1,57 | 0,76 - 3,22 | 1,14 | 0,53 - 2,48 |
| Multiparidad | 4,47 | 2,10 - 9,51 | 3,54 | 1,55 - 8,14 |
| Cesáreas | ||||
| 0 cesáreas | 1 (Ref) | 1 (Ref) | ||
| 1 cesárea | 3,65 | 2,05 - 6,51 | 3,50 | 1,89 - 6,47 |
| 2+ cesáreas | 8,79 | 3,89 - 19,88 | 8,35 | 3,50 - 19,95 |
| RN mayor peso | ||||
| Eutrófico | 1 (Ref) | 1 (Ref) | ||
| Macrosómico | 4,71 | 2,24 - 9,87 | 4,24 | 1,94 - 9,29 |
| Gestaciones | ||||
| Primigesta | 1 (Ref) | 1 (Ref) | ||
| Segundigesta | 1,79 | 0,81 - 3,97 | 1,47 | 0,64 - 3,36 |
| 3+ gestaciones | 2,32 | 1,11 - 4,84 | 1,56 | 0,71 - 3,43 |
| Abortos | ||||
| 0 Aborto | 1 (Ref) | 1 (Ref) | ||
| 1 Aborto | 1,08 | 0,60 - 1,95 | 0,92 | 0,50 - 1,73 |
| 2+ Abortos | 3,61 | 1,76 - 7,41 | 3,40 | 1,55 - 7,44 |
Ajustado por edad, Estado Civil, Antecedente familiar
DM y Antecedente familiar HTA.
DISCUSIÓN
Cualquier estado que aumente la resistencia a la insulina de manera crónica o repetida predispone a desarrollar diabetes mellitus gestacional, un ejemplo de ello es la multiparidad debido a que el embarazo es un estado diabetogénico.20 El presente estudio encontró que hay tres veces más probabilidad de presentar DMG en una gestante multípara comparado a una nulípara. Seghieri y col mencionan que existe asociación entre paridad y DMG, pero que esta asociación también se vincula al sobrepeso pregestacional y la ganancia de este progresivamente en cada gestación.21 En una serie de estudios, entre ellos Khan y col. existe una revisión sistemática y una asociación estadísticamente significativa entre multiparidad y DMG.12,13,14 Por otra parte, en un estudio realizado en Australia, se revisaron casos desde 1995 hasta el 2005 y se encontró que la multiparidad es un factor protector para la DMG. Además, se menciona que este factor protector aumenta con el número de hijos que tiene la madre.23 En el estudio en mención se explica que existen otros factores asociados como la obesidad que generan resistencia a la insulina y a su vez infertilidad, por lo que hay casos de nuliparidad asociados a DMG que podrían explicar sus resultados.22,23 Por otra parte, en un estudio peruano realizado en el 2009 no se encontró asociación entre la variable descrita y DMG.11 Sin embargo, no especifica cómo calcularon su tamaño muestral por lo que no se puede saber si es suficiente.
Dentro del análisis multivariable, el antecedente de abortos previos ha demostrado asociación significativa para el desarrollo de diabetes mellitus gestacional, incrementando la probabilidad de desarrollar esta enfermedad en tres veces. Asimismo, otros estudios, que incluyen un metaanálisis, encuentran asociación entre antecedentes de abortos y DMG.4,9,24 Esta asociación se puede explicar porque el embarazo, es un estado diabetogénico que aumenta el riesgo de DMG.19 En el presente estudio, así como en otros estudios realizados previamente, se ha encontrado asociación significativa entre el antecedente de macrosomía y DMG, lo cual incrementa el riesgo cuatro veces. 14,15,24
Existen otras variables consideradas potencialmente confusoras en este estudio como el nivel socioeconómico y años de educación que no pudieron ser medidos por no estar registrado en la fuente de obtención de datos. Al ser todas pacientes del Seguro Social (EsSalud), estas o sus parejas reciben un ingreso monetario fijo al estar laborando, siendo un sesgo de selección.
Al ser el diseño del estudio de tipo retrospectivo, algunos datos de las historias clínicas no fueron registrados o no pudieron ser verificados. Sin embargo, se espera que esto ocurra en casos y en controles en la misma magnitud (mala clasificación no diferenciada), que no afectaría los resultados del estudio, en todo caso subestimaría el valor real del OR obtenido.
La prueba de tolerancia oral a la glucosa no es aplicada a ambos grupos, solo a los casos. Al descartar el diagnóstico de DMG con el resultado de una prueba de glucosa en ayunas existe el riesgo de clasificar mal un caso en el grupo control. Sin embargo, el uso de la PTOG para confirmar el diagnóstico DMG incrementa el VPP lo que hace más adecuada la selección los casos (25).
El presente estudio describe asociación entre DMG con algunos antecedentes obstétricos como la multiparidad, el antecedente de cesáreas y/o abortos. Por esta razón, se recomienda implementar medidas de prevención e identificación de gestantes con signos de alarma de DMG para realizar un diagnóstico temprano, así como el seguimiento de estas pacientes en el postparto.
Conflicto de intereses
El autor no declara tener conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Seclen SN, Rosas ME, Arias AJ, Huayta E, Medina CA. Prevalence of diabetes and impaired fasting glucose in Peru: report from PERUDIAB, a national urban population based longitudinal study. BMJ Open Diabetes Research and Care. 2015;3:e000110.
2. Revilla L. Situación de la vigilancia de diabetes en el Perú, al I semestre de 2013. 2013;22(39):825-8.
3. EsSALUD. Seguro Social de Salud del Perú [Internet]. Disponible en: http://www.essalud.gob.pe/2012/11/14/diabetes-mellitus-afecta-al-4-de-gestantes-en-el-peru/
4. Jafari-Shobeiri M, Ghojazadeh M, Azami-Aghdash S, Naghavi-Behzad M, Piri R, Pourali-Akbar Y, et al. Prevalence and Risk Factors of Gestational Diabetes in Iran: A Systematic Review and Meta-Analysis. Iran J Public Health. 2015;44(8):1036-44.
5. American Diabetes Association. Gestational Diabetes Mellitus. Definition, detection, and diagnosis. Diabetes care. 2003;26(1):S103-S5.
6. The HAPO. Study Cooperative Research Group. Hyperglycemia and Adverse Pregnancy Outcomes. N Engl J Med. 2008;358:1991-2002.
7. Kampmann U, Madsen LR, Skajaa GO, Iversen DS, Moeller N, Ovesen P. Gestational diabetes: A clinical update. World J Diabetes. 2015;6(8):1065-72.
8. Wendland EM, Torloni MR, Falavigna M, Trujillo J, Dode MA, Campos MA, et al. Gestational diabetes and pregnancy outcomes - a systematic review of the World Health Organization (WHO) and the International Association of Diabetes in Pregnancy Study Groups (IADPSG) diagnostic criteria. BMC Pregnancy and Childbirth. 2012;12:23.
9. Bener A, Saleh N, Al-Hamaq A. Prevalence of gestational diabetes and associated maternal and neonatal complications in a fast-developing community: global comparisons. International Journal of Women's Health. 2011;3:367-73.
10. Schmidt M, Duncan BB, Reichelt AJ, Branchtein L, Matos MC, Costa e Forti A, et al. Gestational Diabetes Mellitus Diagnosed With a 2-h 75-g Oral Glucose Tolerance Test and Adverse Pregnancy Outcomes. Diabetes Care. 2001;24(7):1151-5.
11. Ylave G, Gutarra RB. Diabetes mellitus gestacional. Experiencia en el Hospital militar central. Rev Per Ginecol Obstet. 2009;55:135-42.
12. Di Cianni G, Volpe L, Lencioni C, Miccoli R, Cuccuru I, Ghio A, et al. Prevalence and risk factors for gestational diabetes assessed by universal screening. Diabetes Res Clin Pract. 2003;62(2):131-7.
13. Khan R, Ali K, Khan Z. Socio-demographic risk factors of Gestational Diabetes Mellitus. Pak J Med Sci. 2013;29(3):843-6.
14. Keshavarz M, Cheung NW, Babaee GR, Moghadam HK, Ajami ME, Shariati M. Gestational diabetes in Iran: incidence, risk factors and pregnancy outcomes. Diabetes Res Clin Pract. 2005;69:279-86.
15. Campo-Campo MN, Posada-Estrada G, Betancur-Bermúdez LC, Jaramillo-Quiceno DM. Factores de riesgo para diabetes gestacional en población obstétrica en tres instituciones de Medellín, Colombia. Estudio de casos y controles. Rev Colomb Obstet Ginecol. 2012;63:114-8.
16. Yves J, Katrien V, Sanne V. A Systematic Review of Grand Multiparity. Current Women's Health Reviews. 2006;2(1):25-32.
17. ESSALUD. Seguro Social de Salud del Perú [Internet]. Estadística Institucional. EsSalud en Cifras: Informativo Mensual 2013. [citado 2015 jul 12]. Disponible en: http://www.essalud.gob.pe/estadistica-institucional/
18. American Diabetes Association. Diagnosis and Classification of Diabetes Mellitus. Diabetes care. 2013;36(1):67-74.
19. American Diabetes Association. Standards of Medical Care in Diabetes-2013. Diabetes Care. 2013;36(1):11-66.
20. Buchanan TA, Xiang AH. Gestational diabetes mellitus. J Clin Invest. 2005;115(3):485-91.
21. Seghieri G, De Bellis A, Anichini R, Alviggi L, Franconi F, Breschi MC. Does parity increase insulin resistance during pregnancy? DiabeticMed. 2005;22(11):1574-80.
22. Anna V, van der Ploeg HP, Cheung NW, Huxley RR, Bauman AE. Sociodemographic correlates of the increasing trend in prevalence of gestational diabetes mellitus in a large population of women between 1995 and 2005. Diabetes Care. 2008;31(12):2288-93.
23. Santillana E, Ávila F. Infertilidad e insulinorresistencia. Arch Inv Mat Inf. 2009;I(3):118-22.
24. Soheilykhah S, Mogibian M, Rahimi-Saghand S, Rashidi M, Soheilykhah S, Piroz M. Incidence of gestational diabetes mellitus in pregnant women. Iranian Journal of Reproductive Medicine. 2010;8(1):24-8.
25. Buchanan TA, Xiang AH, Page KA. Gestational Diabetes Mellitus: Risks and Management during and after Pregnancy. Nat Rev Endocrinol. 2012;8(11):639-49.
Recibido: 12 noviembre 2015.
Aprobado: 22 enero 2016.