Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Militar
versión On-line ISSN 1561-3046
Rev Cub Med Mil v.30 n.1 Ciudad de la Habana ene.-mar. 2001
Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto"
Radicales libres en la biomedicina y estrés oxidativo
1er. Tte. José Miguel Rodríguez Perón,1 Tte. Cor. José Rogelio Menéndez López2 y 1er. Tte. Yoel Trujillo López 2
Resumen
La participación de los radicales libres en un número creciente de afecciones de gran interés médico-social, hace que el tema merezca un tratamiento diferenciado. Se presentan los aspectos conceptuales vinculados con los mecanismos de generación de las formas de los radicales libres y su consecuencia a nivel molecular por su acción en lípidos, proteínas y ácidos nucleicos. Se trata la expresión de estos desde el punto de vista patogénico, vinculado con la generación de biomoléculas mediadoras de su acción y repercusión celular; así como el sistema de defensa antioxidante de que dispone el organismo para su protección. Se define el estrés oxidativo y los métodos para medir el daño oxidativo que se disponen en la actualidad, y paralelamente se da a conocer de manera elemental algunos de los antioxidantes, su mecanismo de acción y función preventiva en diversas enfermedades.
DeCS: RADICALES LIBRES/toxicidad; ESTRES OXIDATIVO; ANTIOXIDANTES; MITOCONDRIA.
En los anales de la historia de la medicina, pocos eventos han tenido el impacto tan profundo y matizado con respuestas polifacéticas como el ocurrido a consecuencia del conocimiento de los radicales libres (RL) per se y de su influencia variable en los seres vivos.
En un principio las reacciones en que participan los RL estuvieron fuera del ámbito de la medicina y la biología, pero fueron bien conocidas por los profesionales interesados en el campo de la destrucción por radiaciones, preservación de alimentos, combustión y la industria del hule y la pintura.
En este vasto terreno que hasta ayer fuera patrimonio de los químicos, biólogos y físicos, la medicina se ha introducido con pasos firmes, con un permanente aumento de profesionales de la salud interesados por los fenómenos de oxidación celular.1 Desde la década de los 70 se ha producido una verdadera eclosión en las áreas de investigación y la clínica relativas a los RL y los antioxidantes.
El presente trabajo abarca de forma sintética una información básica disponible con respecto a la función de los RL y sistema de defensa antioxidante en el organismo y su vinculación con numerosas enfermedades en las cuales ejercen un rol protagónico; así como la definición de estrés oxidativo y los métodos para medir el daño oxidativo que se dispone en la actualidad. También de manera elemental dar a conocer algunos de los antioxidantes, su mecanismo de acción y papel preventivo en diversas enfermedades.
Se consideran RL aquellas moléculas que en su estructura atómica presentan un electrón desapareado o impar en el orbital externo, dándole una configuración espacial que genera una alta inestabilidad. Es una entidad química que contrario a la normal tendencia espontánea de los electrones localizados en los átomos y moléculas a la formación de parejas es desapareado. Esto lo hace muy inestable, extraordinariamente reactivo y de vida efímera, con una enorme capacidad para combinarse inespecíficamente en la mayoría de los casos, así como con la diversidad de moléculas integrantes de estructura celular: carbohidratos, lípidos, proteínas, ácidos nucleicos y derivados de cada uno de ellos.2
Los RL son elaborados continuamente como un producto del metabolismo normal de cada célula e inactivados por un conjunto de mecanismos (unos enzimáticos y otros de atrapamiento). Son componentes normales de células y tejidos, existiendo una poza de RL particular en cada estirpe celular y en algunos tipos celulares permiten la mejor adaptación a su habitat. Al elevarse o disminuir las concentraciones fisiológicas de las especies reactivas de oxígeno (EROS) puede acarrear importantes alteraciones funcionales. La aterosclerosis, el envejecimiento y el cáncer por citar algunos ejemplos, son un tercio de la enorme lista de problemas fisiológicos y padecimientos que de alguna manera se asocia con una elevada poza hística de RL.3,4
El oxígeno molecular (O2) es fundamentalmente birradical ya que tiene 2 electrones no apareados en su orbital externo, ambos con el mismo giro paralelo, impidiendo que capte 2 electrones simultáneamente en las reacciones que interviene. El oxígeno solo puede intervenir en reacciones univalente y aceptar los electrones de uno en uno.
La mayor parte del oxígeno utilizado por el organismo humano es reducido a agua por acción del complejo citocromo-oxidasa (citocromo A+a3) de la cadena respiratoria mitocondrial, según la reacción global siguiente:
O2 + 4H + 4E ® 2H2O
Por razones anteriores, la reacción se hace en 4 pasos univalentes:
e- e+ + 2H+ e+ + H+ e- + H+
O2® O2-® H2O2® OH- + H2O ® H2O
e- = electrón
H+ = hidrogeniones
O2- = radical anión superóxido
H2O2 = peróxido de hidrógeno
OH = radical hidroxilo
H2O = agua
Estos intermediarios señalados quedan unidos al sitio activo de la citocro-mo-oxidasa y no difunden al resto de la célula en condiciones normales. En la molécula de O2 se generan por su reducción parcial las especies reactivas siguientes:5,6
O2- = anión superóxido
OH = radical hidroxilo
H2O2 = peróxido de hidrógeno
* O2 = oxígeno singlete
El peróxido de hidrógeno (H2O2) no es estrictamente un RL pero por su capacidad de generar el OH- en presencia de metales como el hierro, se le incorpora como tal.
La sangre, fluido biológico compuesto por eritrocitos, leucocitos y plaquetas como elementos celulares, cumple entre otras funciones la de transportar el oxígeno desde los pulmones hasta los tejidos, y es aquí donde este actúa como sustrato en diversas reacciones bioquímicas intracelulares y como resultado se desencadena una gran producción de H 2O2 y superóxido, entre otras EROS.
Fuentes biológicas de RL
La mitocondria constituye la fuente principal de RL. Este fenómeno se efectúa a nivel de la cadena de transporte de electrones, que es la última etapa de producción de protones de alta energía, y cuyo pasaje a través de la membrana interna mitocondrial genera un gradiente eléctrico que aporta la energía necesaria para formar el ATP o adenosina trifosfato.
En este proceso de fosforilación oxidativa el oxígeno actúa como aceptor final de electrones, adquiriendo en más del 95 % de estas reacciones un total de 4 electrones de moléculas con producción de 2 moléculas de agua. Una consecuencia directa de este proceso es que entre los nutrientes iniciales y la generación de energía al final del proceso, se forman varias moléculas con diferente grado de oxidación. Algunas de ellas puede entregar 1 ó 2 electrones al oxígeno y producir intermediarios parcialmente reducidos que son los RL.7
Otras fuentes son las peroxisomas, organelas del citosol muy ricas en oxidasas y que generan H2O2, el cual es depurado por enzimas específicas (catalasas) y transformado en agua.
Los leucocitos polimorfonucleares constituyen una fuente importante, cuando se activan por diversas proteínas que actúan específicamente sobre ellos (complemento, interleukinas, etc). Los leucocitos poseen en sus membranas la enzima NADPH oxidasa generadora de O2 que en presencia de hierro se transforma en el altamente tóxico OH-. Esta situación se da particularmente en los procesos inflamatorios.8
La enzima xantina deshidrogenasa predomina en los endotelios, normalmente depura las xantinas (isquemia, estimulación del Ca+Times" SIZE="2">, etc), genera O2-.
Se puede apreciar, por lo tanto, que los RL se forman en condiciones fisiológicas en proporciones controlables por los mecanismos defensivos celulares. En situación patológica esta producción se incrementa sustancialmente, ingresándose al estado de estrés oxidativo.
Los factores que llevan a esta situación son:
- Químicos: aumento de metales pesados, xenobióticos, componentes del tabaco.
- Drogas: adriamicina.
- Físicos: radiaciones ultravioleta, hiperoxia.
- Orgánicos y metabólicos: dieta hipercalórica, dieta insuficiente en an-tioxidantes, diabetes, procesos inflamatorios y traumatismos, fenómenos de isquemia - reperfusión y ejercicios extenuantes.
Toxicidad de los RL
En 1954 una investigadora argentina, Rebeca Gerschman, sugirió por primera vez que los RL eran agentes tóxicos y generadores de enfermedades.9
Por la alta inestabilidad atómica de los RL colisionan con una biomolécula y le sustraen un electrón, oxidándola, perdiendo de esta manera su función específica en la célula. Si se trata de los lípidos (ácidos grasos polinsaturados), se dañan las estructuras ricas en ellas como las membranas celulares y las lipoproteínas. En las primeras se altera la permeabilidad conduciendo al edema y la muerte celular y en la segunda, la oxidación de la LDL, génesis de la placa ateromatosa.
Las características de la oxidación lipídica por los RL, tratan de una reacción en cadena en la que el ácido graso al oxidarse, se convierte en radical de ácido graso con capacidad de oxidar a otra molécula vecina.
Este proceso es conocido como perioxidación lipídica, genera numerosos subproductos, muchos de ellos como el malondialdehído (MDA), cuya determinación en tejidos, plasma u orina es uno de los métodos de evaluar el estrés oxidativo.
En caso de las proteínas se oxidan preferentemente los aminoácidos (fenilalani-na, tirosina, triptofano, histidina y metionina) y como consecuencia se forman entrecruzamientos de cadenas peptídicas, fragmentación de la proteína y formación de grupos carbonilos e impiden el normal desarrollo de sus funciones (transportadores iónicos de membranas, receptores y mensajeros celulares, enzimas que regulan el metabolismo celular, etc).10
Otra molécula que es dañada por los RL es el ADN; el daño a los ácidos nucleicos produce bases modificadas, lo que tiene serias consecuencias en el desarrollo de mutaciones y carcinogénesis por una parte, o la pérdida de expresión por daño al gen específico.
El daño a biomoléculas que determinan los RL se haya implicado en la génesis o exacerbación de numerosos procesos:
Aparato cardiovascular: aterosclerosis, infarto del miocardio, cirugía cardíaca, diabetes, cardiopatía alcohólica.
Sistema neurológico: enfermedad de Parkinson, Alzheimer, neuropatía alcohólica, hiperoxia, isquemia o infarto cerebral, traumatismos craneales.
Aparato ocular: cataratas, daño degenerativo de la retina, fibroplasia retrolental.
Aparato respiratorio: distrés respiratorio (síndrome de dificultad respiratoria del adulto), tabaquismo, cáncer de pulmón, enfisema.
SOMA: artritis reumatoidea.
Riñón: síndrome autoinmune, nefrotoxicidad por metales.
Sistemas de defensa biológica contra los RL
La vida en presencia del oxígeno molecular exige contar con una batería múltiple de defensa contra los diversos RL de oxígeno, que por un lado tiendan a impedir su formación y por otro, los neutralicen una vez formados. Estas defensas se efectúan en 5 niveles:
Primer nivel: consiste en editar la reducción univalente del oxígeno mediante sistemas enzimáticos capaces de efectuar la reducción tetravalente consecutiva sin liberar los intermediarios parcialmente reducidos. Esto lo logra con gran eficiencia el sistema citocromo-oxidasa de la cadena respiratoria mitocondrial responsable de más del 90 % de la reducción del oxígeno en el organismo humano.
Segundo nivel: lo constituyen enzimas especializadas en captar el radical anión superóxido (O2-Tercer nivel: dado por un grupo de enzimas especializadas en neutralizar el peróxido de hidrógeno. Entre ellas está la catalasa, que se encuentra en los peroxisomas y que catalizan la reacción de dismutación siguiente:14-17
H2O2 + H2O ® 2H2O + O2
También en los mamíferos, la glutatión-peroxidasa (enzima citoplasmática que contiene selenio), es la más importante y cataliza la reacción siguiente:18
(Glutatión-peroxidasa)
2GSH + H2O2 ® GSSG + 2H2O
GSH=glutatión reducido
GSSG = glutatión oxidado
Cuarto nivel: aquí el radical hidroxilo producido en el ciclo de Haber-Weiss puede ser neutralizado por la vitamina E o alfa-tocoferol, que es un antioxidante efectivo y que por su hidrofobicidad se encuentra en las membranas biológicas donde su protección es particularmente importante. También la vitamina C o ácido ascórbico es un agente reductor o donador de electrones y reacciona rápidamente con el radical OH-Quinto nivel: una vez producido el daño molecular, existe un quinto nivel de defensa que consiste en la reparación. Está demostrado que los RL son capaces de provocar rupturas de la cadena de DNA y aun de inducir mutagénesis, pero existen mecanismos enzimáticos de reparación que permiten restablecer la información genética.19-22
Sistemas de defensas antioxidantes
Halliwelldefine como antioxidante a toda sustancia que hallándose presente a bajas concentraciones con respecto a las de un sustrato oxidable (biomolécula), retarda o previene la oxidación de dicho sustrato.
El antioxidante al colisionar con el RL le cede un electrón oxidándose a su vez y transformándose en un RL débil no tóxico y que en algunos casos como la vitamina E, puede regenerarse a su forma primitiva por la acción de otros antioxidantes. No todos los antioxidantes actúan de esta manera, los llamados enzimáticos catalizan o aceleran reacciones químicas que utilizan sustratos que a su vez reaccionan con los RL.
De las numerosas clasificaciones de los antioxidantes, se recomienda adoptar la que los divide en: exógenos o antioxidantes que ingresan a través de la cadena alimentaria y endógenos que son sintetizados por la célula (fig).
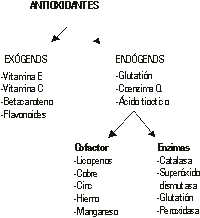
Fig. Clasificación de los antioxidantes.
Cada antioxidante posee una afinidad hacia un determinado RL o hacia varios. La vitamina E, el betacaroteno y el licopeno actúan en el medio liposoluble de la célula y su absorción y transporte se hallan muy vinculados con el de los lípidos. La vitamina E es considerada el más importante protector de las moléculas lipídicas.
Vitamina C:23 neutraliza el oxígeno singlete, captura radicales hidroxilos, captura anión hiperóxidos y regenera la forma oxidada de vitamina E.
Vitamina E: neutraliza el oxígeno singlete, captura radicales libres hidroxilos, neutraliza peróxidos y captura anión superóxido.
Betacaroteno: neutraliza el oxígeno singlete.
Es necesaria la incorporación al organismo de ciertos oligoelementos como el cobre, hierro, cinc, selenio y manganeso, pues forman parte del núcleo activo de las enzimas antioxidantes.
La deficiencia de antioxidantes en el organismo puede obedecer entre otras razones a:
- Dieta deficiente en antioxidantes.
- Enfermedades que reducen la absorción de antioxidantes de la dieta (ej. enfermedad de Cronh).
- Nutrición estrictamente parenteral.
- Diálisis renal.
Antioxidantes en la prevención de enfermedades
Antioxidantes y enfermedad cardio-vascular: la enfermedad cardio-vascular secundaria al proceso conocido como aterosclerosis constituye la primera causa de mortalidad e invalidez en la cuarta década de la vida. La modificación oxidativa de las lipoproteínas, particularmente las lipoproteínas de baja densidad (LDL) por los RL, sería uno de los mecanismos básicos de la aterogénesis. El colesterol y los fosfolípidos de las LDL se encuentran protegidos de la oxidación por varios agentes antioxidantes lipofílicos: vitaminas E, BC y ubiquinol. El antioxidante más importante en la protección de las lipoproteínas es la vitamina E, calculándose que cada molécula de esta es capaz de proteger 500 moléculas de fosfolípidos.24-26
Antioxidantes y cáncer: más de 150 estudios epidemiológicos evidencian una correlación inversa entre la ingesta de antioxidantes y el riesgo de adquirir diversos tipos de tumores y tienden a señalar al betacaroteno como el agente protector en enfermedades tumorales. Como posible mecanismo se reconoce que el ADN puede dañarse y por ende, sufrir mutaciones por lesión directa de los RL sobre las bases, o en forma directa afectando la actividad de las proteínas específicas que lo repara (proto-oncogen), o lo frena (supresores). También el tabaquismo produce un alto grado de estrés oxidativo por diversos mecanismos y al mismo tiempo poseen bajos niveles de antioxidantes, la vitamina C.27-30
Antioxidantes y enfermedades oculares: la directa exposición del ojo a las radiaciones ionizantes, el humo del tabaco y otros agentes generadores de RL, determina que algunas estructuras se afecten por el estrés oxidativo. Jacques y otros, observaron que los individuos con altas concentraciones plasmáticas de por lo menos 2 de los 3 antioxidantes dorsados (vitaminas E, C, BC), presentaban un riesgo menor de adquirir cataratas que los individuos con valores bajos.31
Estrés oxidativo. Métodos de evaluación
El desbalance entre la producción de EROS y la defensa antioxidante provoca un daño orgánico conocido como estrés oxidativo, que lleva a una variedad de cambios fisiológicos y bioquímicos los cuales ocasionan el deterioro y muerte celular.32,33 Se puede medir este daño mediante métodos directos e indirectos.34-36 Entre los primeros tenemos la medición de agentes antioxidantes, lo cual es muy difícil por su corta vida media y lo caro de los equipos; lo que obliga a medirlos indirectamente mediante:
Determinación de productos terminales de la acción oxidante sobre biomoléculas: los métodos para medir peróxidos lipídicos son el patrón de oro cuando se trata de probar el papel de los oxidantes en algún tipo de daño celular. Ej. malondial-dehído (MDA).
Medición de la concentración de antioxidante: que se realiza con la técnica de HPLC (cromatografía líquida de alta resolución), sobre material biológico que puede ser plasma, orina o tejido. A fines prácticos solo se determinan niveles plas-máticos de los antioxidantes siguientes: vitaminas E, BC, coenzima Q (ubiquinol), glutatión y vitamina C.
Medición del estado oxidativo: refleja el balance entre el sistema oxidante y pro-oxidante y es beneficioso en muchas enfermedades.
En la medición del estrés oxidativo existen los métodos siguientes:
BIOMOLÉCULAS MÉTODOS
Lípidos Quimioluminiscencia
MDA(malondialdehído)
Dienos conjugados
Peróxidos
Pentano, etano
Proteínas Compuestos carbonilos
Grupos sulfhidrilos
Fragmentación de proteínas
Actividad de enzimas
Grupo aminos libres
ADN Base modificada
De todos estos métodos el más empleado por su sencillez y bajo costo es la determinación plasmática de MDA, uno de los subproductos de la peroxidación lipídica. La determinación del daño oxidativo constituye aún un terreno poco desarrollado y se realizan esfuerzos a nivel mundial para el desarrollo de nuevos y sencillos métodos de evaluación.
El estrés oxidativo es responsable de los eventos fisiopatológicos de las enfermedades inflamatorias intestinales, hepatopatías, desórdenes neurológicos y envejecimiento entre otras afecciones. Por otra parte, es vital el conocimiento de que se dispone en la práctica médica de antioxidantes con eficacia demostrada en la prevención y atenuación de los efectos negativos conocidos por el estrés oxidativo, permitiendo con pasos agigantados que estos agentes formen parte del arsenal terapéutico de muchas enfermedades (ej.: el uso de la vitamina E como neuroprotector en los trastornos neurodegenerativos operados en la enfermedad de Alzhemier).
SUMMARY
This topic deserves particular attention due to the participation of free radicals in an increasing number of affections of great medicosocial interest. The conceptual aspects linked to these mechanisms of generation of the forms of the free radicals and their consequence at the molecular level due to their action in lipids, proteins and nucleic acids are presented. Their expression is approached from the pathogenic point of view, associated with the generation of biomolecules mediators of their action and cellular repercussion. The system of antioxidant defense the body has for its protection is also dealt with. The oxidative stress and the methods available at present to measure the oxidative damage are defined and, at the same time, some of the antioxidants, their mechanisms of action and preventive function in different diseases are made known.
Subject headings: FREE RADICALS/toxicity; OXIDATIVE STRESS; ANTIOXIDANTS; MITOCHONDRIA.
Referencias bibliográficas
-
García JC, García B, Morin MA, Céspedes EM, Clapes S, Etienne O. Radicales libres: impacto médico. BEB (México) 1993;13(3):75-83.
-
Halliwell B, Gutterioge JMC. Free radical in biology and medicine. Oxford: Clarendon, 1989;1:142.
-
Freeman BA, Crapo JD. Free radicals and tissue injury. Lab Invest 1982;47:412-5.
-
Basaga HS. Biochemical aspects of free radicals. Biochem Cell Biol 1989;68:989-98.
-
Reilly PM, Bulkley GB. Tissue injury by free radicals and other toxic oxygen meyabolites. Br J Surg 1990;77:1324-5.
-
Witztum JI. Role of oxidised low density lipoprotein i atherogenesis. Br Heart J 1993;69:12-8.
-
Turrens J. Fuentes intracelulares de especies oxidantes en condiciones normales y patológicas. Antioxidante y Calidad de Vida 1994;1:16-9.
-
Market M, Andrew PC, Babiar BM. Measurement of superoxide production by human neutrophils. Methods Enzimol 1984;105:358-65.
-
Gerschman R. Oxigen poisoning and X-Irradiation. A mechanism in common. Science 1954;119:623-6.
-
Oteiza PA. Modificación activa de las proteínas. Antioxidante y Calidad de Vida 1995;2:12-20.
-
Tzu Chen Yen, Kwam Liang King, Hish Chen Lee. Age dependent increase of mitochondrial DNA deletions together with lipid peroxide and superoxide dismutase in human liver mitocondria. Free Radic Biol Med 1994;16:207-14.
-
Sohal RS, Sohal BH, Orr WC. Mitochondrial superoxide and hydrogen peroxide generation, protein oxidative damag, and longevity in different species of flies. Free Radic Biol Med 1995;19:499-504.
-
Orr WC, Sohal RJ. Extension of life-span by overexpression of superoxide dismutase and catalase in drosophila melanogester. Science 1994;263:1128-30.
-
Tosaki A, Droy-Lefaix MI, Pali L, Das DK. Effects of SOD, catalase and a novel antiarrhythmic drug; EGB 761 on reperfusion induced arrythmias in isolated rat hearts. Free Radic Biol Med 1993;14:361-70.
-
Left JA, Parson PE, Day CE. Increased serum catalase activity in septic patients with the adult respiratory distress syndrome. Am Rev Respir Dis 1992;146:985-9.
-
Kawada T, Kambara K, Arakawa M. Pretreatment with catalase of dimethyl sulfoxide protects alloxan-induced acute lung edema in dog. J Appl Physiol 1992;73:1326-33.
-
Zini A, De Lamirande E, Gagnon C. Reactive oxygen species in semen of infertile patients: levels of superoxi dismutase and catalase like activitier in seminal plasma and spermatozoa. Int J Androl 1993;16:183-8.
-
Stepanik TM, Ewing DD. Isolation of glutathione peroxidase, catalase and superoxide dismutase of human erytrocites. J Biochers Biophys Meyh 1993;20:157-69.
-
Salonen JJ. Risk of cancer in relation to serum concentrations of selenium and Vit. A and E. Matched case control analysis of prospectivedata. Br Med J 1985;290:417-20.
-
Black G. Fruit vegetables and cancer prevention: a review of epidemiological evidence. Nutr Cancer 1992;18:1-29.
-
Burr ML. Antioxidants and cancer. J Human Nutr Dietetics 1994;7:409-16.
-
Esterbawer H, Gebicki J, Puhl H, Jurgens G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radial Biol Med 1992;13:341-90.
-
Packer L. Vitamin E is nature´s master antioxidant. Sci Am Sci Med 1994;1:54-63.
-
Kushi LH, Folsom AR, Prineas RJ, Mink PJ, Wu Y, Bostick R. Dietary antioxidant vitamins and death from coronary heart disease in postmenopausal women. N Engl J Med 1996;334;1156-62.
-
Hodis HN, Mack WJ, Labreel C, Hemphill L, Sevanian A, Johnson R, et al. Serial coronary angiographic evidence that antioxidant vitamin intake reduces progression of coronary artery atherosclerosis. JAMA 1995;273:1849-54.
-
Stephens NG, Parsons A, Schofield PM, Kelly F, Cheesman K, Mitchisnon MJ, et al. Randomised controlled trial of Vit. E in patients with coronary disease: Cambridge Heart Antioxidant Study (CHAOS). Lancet 1996;347:781-6.
-
The Alpha -Tocopherol Beta Carotene Cancer Prevention Study Group. N Engl J Med 1994;330:1029-35.
-
Omen GS, Goodman GE, Thornquist MD. Effects of combination of beta carotene and Vit. A on lung cancer and cardiovascular disease. N Engl J Med 1996;334:1150-5.
-
Hennekens CH, Buring JE, Manson JE, Stampfer M, Rosner B, Coor NR. Lack of effect of Long-term suplementation with beta carotane on the incidence of malignant neoplasms and cardiovascular disease. N Engl J Med 1996;334:1145-9.
-
Nelson RL. Pretary iron and colorectal cancer risk. Free Radic Biol Med 1993;41:677-82.
-
Packer L. Vit. E is nature´s maste antioxidant. Sci Am Sci Med 1994;1:54-63. Seddon JM, Ajani VA, Sperduto RD. Dietary carotenoids, Vit. A, C, and E and advance age-related macular degeneration. JAMA 1994;272:1413-20.
-
Aejmelaus RT, Holm P, Kauskinen U, et al. Age related changes in the peroxyl radical scavenging capacity of human plasma. Free Rad Biol Med 1997;23:69-75.
-
Wei YH, Kad SH, Lee HC. Simultaneous increase of mitochondrial DNA deletion and lipid peroxidation in human aging. Ann NY Acad Sci 1996;786:23-34.
-
Luscesoli F, Fraga CG. Evaluación del estrés oxidativo. Antioxidante y calidad de vida 1995;1:8-13.
-
Motchnik PA, Frei B, Ames BN. Measurement of antioxidants in human blood plasma. Int Methods Entymol 1994;234:269-79.
Recibido: 6 de octubre del 2000. Aprobado: 10 de noviembre del 2000.
1er. Tte. José Miguel Rodríguez Perón. Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto". Avenida Monumental, Habana del Este, CP 11700, Ciudad de La Habana, Cuba.
1 Especialista de I Grado en Medicina Interna.
2 Doctor en Ciencias Médicas. Especialista de II Grado en Medicina Interna. Profesor Titular.
3 Especialista de I Grado en Medicina General Integral.












