Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Militar
versión On-line ISSN 1561-3046
Rev Cub Med Mil v.7 n.1 Ciudad de la Habana ene.-mar. 2002
Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto"
Histopatología del daño múltiple de órganos en un modelo experimental de ratón quemado
My. Teresita Montero González,1 Tte. Cor. José Hurtado de Mendoza Amat,2 Lic. Ofelia María Cabrejas Acuñas 3 y Téc. María Rosa Almarales Acosta4
Resumen
El síndrome de disfunción múltiple de órganos es una “respuesta inflamatoria sistémica” que se produce por la acción de múltiples mediadores que desencadenan la disfunción progresiva de órganos y sistemas. Se conoce como daño multiorgánico a las alteraciones morfológicas de los fallecidos con este diagnóstico. La enfermedad por quemaduras presenta todas las bases patogénicas para desarrollar ambos procesos (clínico y morfológico), por lo que se decidió caracterizar la histopatología de un modelo experimental de ratón quemado. Se emplearon ratones hembras, de la línea balc/c, de 20 ± 2 g, depilados y anestesiados siguiendo las normas éticas establecidas para el trabajo con animales de experimentación. La quemadura seca paravertebral se obtuvo con un soldador automático adaptado con 100 °C de temperatura y durante 20". Se comparó la vitalidad y morfología entre el grupo testigo (n = 5) y el quemado (n = 24) al cual se aplicó eutanasia a (n = 6) las 24 h, 72 h, 7 días y 14 días. Se empleó la prueba t para comparar porcentajes y la G para el análisis de la dependencia entre variables. Se observó que en los animales quemados existió una dependencia (G = 64,04 ** (p < 0,01) entre las lesiones con grados entre leves a moderados (se excluyeron los fallecidos de forma espontánea) y el daño multiorgánico fue moderado en todos los ratones quemados. Estos datos confirman que el daño multiorgánico es una alteración casi obligada de la enfermedad por quemadura, que puede llevar a la muerte por el fracaso funcional de los órganos (síndrome de disfunción múltiple de órganos), lo cual justifica los esfuerzos en busca de prevenir o atenuar la respuesta inflamatoria sistémica que le sirve de sostén.
DeCS: INSUFICIENCIA DE MULTIPLES ORGANOS/patología; RATONES CONSAGUINEOS BALB C; ANIMALES DE LABORATORIO; QUEMADURAS/ /patología; AUTOPSIA; MEDICINA MILITAR.
El síndrome de disfunción múltiple de órganos (SDMO) se inscribe en la literatura médica a finales de los años 70. Se define como una amenaza aguda de homeostasis por una respuesta estereotipada a una agresión fisiológica intensa.1 La respuesta del organismo es una “respuesta inflamatoria sistémica” que se produce por la acción de múltiples mediadores que desencadenan la disfunción progresiva de órganos y sistemas,2 y puede causar la muerte con frecuencia si no se asume un tratamiento enérgico y rápido.
Los trabajos relacionados con las alteraciones morfológicas son escasos, explicado por la crisis de la autopsia a escala internacional.3 En Cuba esta situación se revierte y ha permitido tratar este tema desde el punto de vista histopatológico. Los resultados de estas autopsias coinciden con las encontradas en la enfermedad por quemaduras, en los fallecidos traumatizados, los quirúrgicos graves y los sépticos graves, entre otros. Al conjunto de estas alteraciones morfológicas encontradas en estos fallecidos se llamó daño multiorgánico (DMO).4 Es decir, el SDMO es un diagnóstico clínico, mientras que el DMO lo es morfológico. Es un binomio de categorías como lo es desde el punto de vista filosófico la estructura y la función.
La enfermedad por quemaduras es una entidad frecuente e importante para la medicina militar y se considera un reto en el cuidado intensivo.5 La lesión cutánea es fuente primaria de los mediadores de la inflamación, que amplifican sus efectos a escala sistémica. Las autopsias de los pacientes quemados muestran la elevada frecuencia del DMO.4
Las quemaduras y los traumatismos estimulan la respuesta inflamatoria sistémica, la deficiencia en la función de los polimorfonucleares neutrófilos (PMNn) y la disminución de la acción del sistema monocítico fagocitario (SMF).6 Esto ha motivado el empleo de modelos experimentales en investigaciones relacionadas con la sepsis y la translocación bacteriana,7 alteraciones inmunológicas8 y el choque.6
Sobre esta base emerge la interrogante de ¿cuáles son las características histopatológicas de los ratones quemados relacionadas con el DMO? El propósito del presente trabajo fue caracterizar la histopatología del DMO en un modelo experimental de ratón quemado y conformar un método para el diagnóstico del DMO por grados de intensidad con posibilidades de aplicarse en el estudio de las autopsias en humanos.
Métodos
Se realizó el estudio sobre la base de un modelo experimental de ratón quemado previamente elaborado.9 Los animales procedían del Centro Nacional para la Producción de Animales de Experimentación. Se consideraron los procedimientos éticos descritos en el “Código sobre la ética profesional de los trabajadores de las Ciencias”,10 asimismo fue realizado bajo los principios de las Buenas Prácticas de Laboratorio. Los animales fueron ratones de la línea balbc/c, hembras, de 20 ± 2 g y de 12 semanas, depilados por métodos combinados y anestesiados con ketamina (100 mg//kg) 5' antes de la quemadura. Se empleó un modelo de quemadura seca11 paravertebral total en una superficie corporal quemada 11 %, con temperatura de 100 °C y tiempo de exposición de 20". Las condiciones de vida se desarrollaron con ambiente controlado en el Bioterio del Centro de Ingenieria Genética y Biotecnología. Los animales se aclimataron durante 7 días y el control de la evolución se realizó 2 veces al día. Se utilizó un grupo testigo (n = 5) y un grupo quemado sin tratamiento (n = 24) hidratados con 1 mL de solución salina al 0,9 % intraperitoneal posquemadura. Este grupo se subdividió en 4 subgrupos (n=6) con eutanasia a las 24 h, 72 h , 7 días y 14 días. La selección de los animales se realizó por tablas de números aleatorios mediante el paquete estadístico “CSS for Windows”.
La vitalidad de los animales se analizó con los siguientes criterios: moribundos (ratones con pocos reflejos, que no se alimentan y no se desplazan), vitales (reflejos mantenidos, que se alimentan y desplazan con actividad limitada) y activos (reflejos y alimentación adecuada con movilidad desde las 24 h).
La eutanasia utilizada fue la inmersión en nitrógeno líquido durante 7" y la autopsia se realizó in situ. Se tomaron fragmentos de pulmón, corazón, cerebro, estómago e intestino delgado (1 cm por encima de la válvula ileocecal), riñón, glándula suprarrenal, hígado, bazo, piel sana y quemada con tejido celular subcutáneo. Se fijaron en formol al 10 %, se procesaron para incluir en un bloque de parafina con un orden establecido, se cortaron y colorearon con hematoxilina/eosina. Se utilizó un microscopio de luz (Carl Zeiss). La observación se realizó con objetivos de 400x y 100x, y en cada órgano se tomaron diferentes puntos de observación fijos para cada fragmento.
El estudio morfológico se realizó de forma cualitativa de acuerdo con criterios establecidos para cada lesión evaluada en los diferentes órganos y según la media del resultado de los distintos puntos de observación en cada órgano. Se realizó a ciegas por el investigador y fue corroborado por 2 observadores. Los parámetros evaluados se encuentran en el anexo.
La necrosis de coagulación en la piel y tejido celular subcutáneo se evaluó solo para confirmar la efectividad de la quemadura.
Los criterios de evaluación fueron: 1-negativo; 2-leve; 3-moderado y 4-intenso.
El DMO se evaluó por la presencia de lesión en 3 o más órganos. La esplenitis y hepatitis reactiva se consideraron como respuesta del SMF. Para cada caso se valoró el promedio de las intensidades afectadas (leve, moderada e intensa) y se clasificó el DMO en estos grados.
Se calculó la media y la desviación estándar con respecto al número de órganos afectados por grupos. Se empleó la prueba t de Students al comparar los valores de porcentaje entre los 2 grupos de animales. Se aplicó la prueba G de tablas de contingencia para conocer la dependencia entre la mortalidad (espontánea o por eutanasia), la vitalidad de los animales entre los 2 grupos y las afecciones de los órganos analizados en el grupo de animales quemados.12
Resultados
El modelo de quemadura elaborado permitió observar lesiones en el 100 % de los animales quemados. En este grupo fallecieron de forma espontánea las ¾ partes de los animales, los cuales no se incluyen en el estudio por encontrarse fallecidos en el momento de la evolución diaria y presentar elementos de autolisis.
A las 24 h el 16,7 % de los animales quemados estaban fallecidos y el 75 % moribundos, de ellos el 58,33 % fallece antes de las 72 h. Solo el 8,3 % alcanzó la categoría de vitales, lo cual corresponde a los únicos animales que llegaron activos a la eutanasia en el tiempo correspondiente entre el séptimo y 14 días.
De los 9 órganos estudiados se afectaron un promedio de 7,66 (S = 0,51) órganos por animal con alteraciones del DMO. Se mostró el daño evidente del pulmón, el cerebro, el riñón y el hígado en el 100 % de los ratones. En los animales del grupo testigo se presentó lesión en grado leve en estos órganos entre el 40 y el 60 % de los animales. Existió diferencia entre los porcentajes de ambos grupos con valores de 2,96** (p < 0,01) para el pulmón y el hígado y de 2,26* (p < 0,05) para el riñón y el cerebro. En el resto de los órganos de los animales de este grupo no se presentaron lesiones (tabla).
Tabla. Alteraciones histopatológicas en el modelo de quemadura seca empleado en relación con el grupo testigo (%)
| Órgano | Alteraciones histológicas | Grupo testigo (n = 5) | Grupo de ratón quemado (n = 6) | ||||||
| 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | ||
| Pulmón* | EPP | 60 | 40 | 33,3 | 66,7 | ||||
| Riñón* | Tumefacción | 40 | 60 | 66,7 | 33,3 | ||||
| Necrosis tub | 100 | 33,3 | 16,4 | 33,3 | |||||
| Cerebro* | Edema | 40 | 60 | 66,7 | 33,3 | ||||
| Hipoxia | 100 | 50 | 33,3 | 16,7 | |||||
| Hígado* | Tumefacción | 60 | 40 | 83,3 | 16,7 | ||||
| Esteatosis | 100 | 50 | 33,3 | 16,7 | |||||
| Corazón | Tumefacción | 100 | 16,7 | 66,7 | 16,7 | ||||
| Miocarditis | 100 | 33,3 | 66,7 | ||||||
| Estómago | Inflamación | 100 | 16,7 | 66,7 | 16,7 | ||||
| Intestino | Inflamación | 100 | 33,3 | 66,7 | |||||
| Glándula | Agotamiento | 100 | 33,3 | 66,7 | |||||
| suprarrenal | lipídico | ||||||||
| Sangre | CID | 100 | 50 | 33,3 | 16,7 | ||||
| Esplenitis reactiva | 100 | 100 | |||||||
| Hepatitis reactiva | 100 | 33,3 | 33,3 | 33,3 | |||||
| G =64, 04** (p < 0,01) g.l. = 36 | |||||||||
* Ver explicación en el texto.
EPP: edema pulmonar de permeabilidad; tub: tubular; inflamación: incluye las úlceras agudas; CID: coagulación intravascular diseminada.
0= no lesión; 1= leve; 2= moderado; 3= intenso.
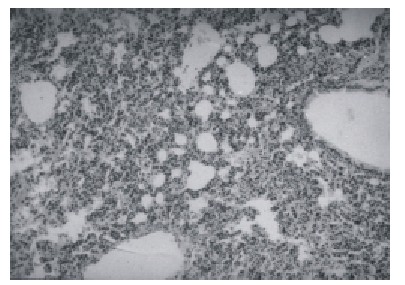
Existió un comportamiento diferente entre los órganos en el grupo de animales quemados (G= 64,04** (p < 0,01), aunque el mayor número de afectaciones estuvo entre el grado leve y moderado. En el edema pulmonar de permeabilidad hubo relación entre el grosor y la celularidad del tabique. El análisis de todos los puntos de observación en cada fragmento, no calificó a ninguno como grado intenso (fig. 1).
Fig. 1. Edema pulmonar de permeabilidad moderada en ratones quemados. Obsérvese el ensanchamiento del tabique pulmonar (H/E) (200 x).
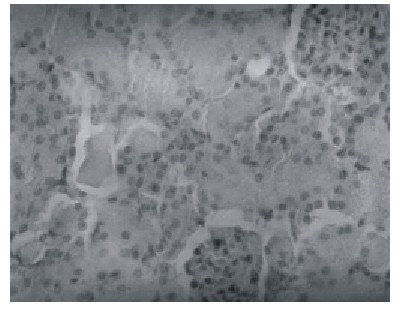
La tumefacción renal en los animales quemados se observó como un aumento de volumen celular con eosinofilia citoplasmática y se presentó en grado de extensión variable desde las primeras 24 h. La necrosis tubular afectó a casi todos los quemados (fig. 2).
Fig. 2. Necrosis tubular aguda en ratones quemados. Obsérvese los cilindros hialinos y la pérdida de células epiteliales (H/E) (400 x).
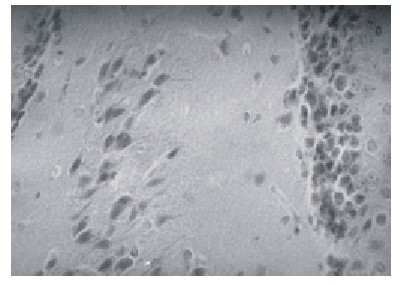
El edema y la hipoxia cerebral estuvieron presentes en todos los animales quemados en diferentes grados (fig. 3). La esteatosis en forma de microgotas afectó al 50 % de los quemados alrededor del núcleo.
Fig. 3. Hipoxia cerebral en áreas del hipocampo y edema cerebral moderado. Obsérvese la retracción de las neuronas del área del hipocampo y la condensación de la conectiva (H/E) (400 x).
Las alteraciones cardíacas mostraron grados entre moderado a intenso en los quemados, con lesión isquémica en un animal. La inflamación aguda de la mucosa gástrica se presentó entre leve a moderada en los animales quemados, solo un animal presentó úlcera gástrica aguda. En el intestino se mostró más la lesión moderada en el área estudiada. Se observó relación entre el aspecto macroscópico del contenido intestinal con la presencia de bilis oscura o contenido sanguinolento y el histopatológico.
El agotamiento lipídico de la corteza suprarrenal predominó con el grado moderado. La coagulación intravascular diseminada afectó al 50 % de los quemados. Se observó en pulmón, riñón, hígado, piel y bazo.
La respuesta del SMF estuvo presente en todos los animales quemados. En el hígado solo un animal no presentó aumento de las células de Kupffer. En 2 animales se observó intensa congestión esplénica. La expansión de la pulpa blanca fue extrema en los animales quemados que lograron sobrevivir hasta el séptimo y 14 días sin presentarse complicaciones sépticas en ninguno, los cuales desde las primeras 24 h estaban vitales en su actividad.
La piel y el tejido celular subcutáneo mostraron las alteraciones propias de la necrosis de coagulación en los diferentes tiempos evaluados. En ningún animal se presentó la sepsis de la quemadura.
En el análisis integral de los animales quemados estudiados, el DMO fue clasificado como moderado, lo cual no excluye que en los fallecidos de forma espontánea el DMO fuera intenso.
Discusión
Las alteraciones histopatológicas observadas en los ratones quemados muestran relación directa con la lesión provocada por la quemadura. El edema pulmonar de permeabilidad está mediado principalmente por la acción de los PMNn y la interacción de los mediadores.13 Los PMNn y el endotelio cumplen importantes funciones en la liberación de mediadores y la activación sistémica de la inflamación.14 Esler y otros15 realizan mediciones de la noradrenalina en algunos órganos, su porcentaje en el pulmón se encuentra entre los más elevados (33 %), relacionando así el papel del sistema nervioso simpático con la rápida respuesta del pulmón en el SDMO. Teplitz16 describe este edema como lesión fundamental en pacientes quemados fallecidos, aspecto este corroborado por otros autores.17
Teplitz y Sevitt16,17 antes de describirse el SDMO estudiaron y describieron la tumefacción celular y la necrosis tubular renal en los fallecidos con enfermedad por quemaduras. El aumento de volumen celular renal observado recuerda al término de oncosis,18 descrita en células de los túbulos renales y hepáticas, relacionada con procesos complejos intracelulares donde el metabolismo del calcio desempeña una función importante.
Teplitz16 describió la esteatosis hepática en pacientes quemados fallecidos como manifestación de cuadros agudos. Para Popper19 la localización de la esteatosis a gotas finas difusas está en relación con la causa. En los quemados se mezclan desde causas hipoxémicas hasta la nutricional.
Hurtado refiere cambios similares en pulmón, hígado y riñón en un modelo de quemadura seca similar al empleado en este trabajo (Hurtado de Mendoza J. Alteraciones locales y generales en la enfermedad por quemaduras. Estudio histopatológico y ultraestructural en un modelo experimental de ratón quemado. Tesis Doctoral, La Habana, 1983).
Zhao20 midió el contenido de agua de pulmones, corazón, riñones, hígado y bazo en pacientes accidentados y quemados con SDMO y encontró un aumento del peso del órgano proporcional al daño. Esto mostró el papel de la tumefacción en la patogenia del SDMO.
Según Lombardo y otros, la translocación bacteriana desempeña una función esencial en el SDMO.21 En ella se describe “el factor depresor del miocardio” liberado del intestino entre los mediadores tóxicos secundarios a la anoxia. En la enfermedad por quemaduras se relaciona desde 1966 la disfunción cardíaca con este factor detectado en el suero de pacientes quemados asociado con el estrés. Murphy y otros han corroborado la función del troponin 1, un complejo proteico que regula la contracción cardíaca. Su incremento se asocia a disfunción con daño subletal.22 La inhibición de esta proteína ha facilitado la función ventricular en modelos experimentales de quemadura.
Kaul y otros23 se refieren a la miocarditis inespecífica relacionada con la disfunción ventricular en relación con fenómenos inmunológicos. Esta lesión junto al agotamiento lipídico de la glándula suprarrenal se asocian con el estrés por la liberación de catecolaminas,15 aspecto importante en los pacientes quemados.
En los traumatismos y en las quemaduras se activan los sistemas fibrinolíticos y de la coagulación, esto provoca coagulación intravascular diseminada subclínica que en ocasiones no se diagnostica clínicamente.24
La respuesta inmunológica que se describe en pacientes con SDMO se considera disreactiva, pues en su primera fase es hiperreactiva (celular y humoral), pero con la persistencia del estímulo se altera la calidad de la respuesta.4 La disfunción inmune depende más de la función de los macrófagos esplénicos con la producción de citocinas o prostaglandinas que de la cantidad celular.
Faunce25 muestra que traumas severos como las quemaduras, traen alteraciones en la función con hipoactivación o hiperactivación de los esplenocitos. Estos cambios se traducen en diferencias entre el número de esplenocitos versus la cantidad de células linfoides T.
Después de las quemaduras, estos macrófagos son capaces de secretar factores inmunomoduladores como antagonista de IL-1, 6, 10 y prostaglandina E2. Esto explicaría la resistencia de los animales quemados que llegaron hasta el séptimo y 14 días.
Las células de Kupffer son importantes para el desarrollo del SDMO seguido del trauma y el choque. Su activación, la secreción de citocinas y otros mediadores son mecanismos conocidos relacionados con la respuesta inflamatoria sistémica.26 Se conoce la producción de células linfoides características en relación con los traumatismos y la sepsis. La activación de los linfocitos T requiere de la producción de citocinas reguladoras como la IL2; en los pacientes quemados disminuye la transcripción de la IL2 por la inhibición de la expresión del gen c-fos.27
Las proteínas del choque térmico estimulan su producción ante situaciones de estrés y en breve se codifican y transcriben ayudando a mantener la homeostasis corporal. Si su respuesta no es satisfactoria, se comienzan a dañar los sistemas in-tracelulares.14
Existe coincidencia en que cuando se desencadenan los procesos intracelulares es muy difícil revertir el evento. Los hallazgos de Teplitz16 en los pacientes quemados fallecidos y los de Iliopoulou más recientemente confirman este hecho. Las alteraciones descritas en el DMO4 se corresponden con las presentadas en forma aislada en estos trabajos.
Según Kaku28 el SDMO es en esencia la expresión clínico-biológica del severo déficit energético celular secundario a una agresión intensa o persistente, y la enfermedad por quemaduras ocasiona este déficit energético, como ya se ha planteado.
La caracterización morfológica de los animales quemados estudiados muestra la presencia del DMO en el modelo biológico empleado.
Summary
The multiple organ failure syndrome is a “systemic inflammatory response” caused by the action of multiple mediators that lead to the progressive dysfunction of organs and systems. The multiple organ failure is known as the morphological alterations of the dead with this diagnosis. The disease due to burns presents all the pathogenic bases to develop both processes (clinical and morphological). That’s why it was decided to characterize the hystopathology in an experimental model of burned mouse. Female balbc/c mice of 20 ± 2 g, depilated and anaesthetized, were used according to the ethical standards established to work with laboratory animals. The paravertebral dry burn was obtained with an automatic welder adapted with 100 ºC of temperature and during 20". The vitality and morphology were compared between the control group (n=5) and the burned (n=24) that were applied euthanasia (n=6) at 24 h, 72 h, 7 days and 14 days. The t test was used to compare percentages and the G test to analyze the dependence among variables. It was observed that in the burned animals there was a dependency (G=64.04**; (p < 0.01) among the injuries with degrees from mild to moderate (the individuals who died spontaneously were excluded) and the multiple organ failure was moderate in all the burned mice. These data confirm that the multiple organ failure is an almost compulsory alteration of the disease produced by burn that may lead to death owing to the functional organ failure (multiple organ dysfunction syndrome), which justifies the efforts made to prevent or attenuate the systemic inflammatory response that supports it.
Subject headings: MULTIPLE ORGAN FAILURE/pathology; MICE, INBRED BALB C; ANIMALS, LABORATORY; BURNS/pathology; AUTOPSY; MILITARY MEDICINE.
Referencias bibliográficas
- ACCP/SCCM Consensus Conference. Definitions for sepsis and organ failure and guidelines for the use of innovaties therapies in sepsis. Chest 1992;101(6):1644-55.
- Goris RJ, Boekhurt TP, Nuytinck JK, Gimbrere JS. Multiple organ failure: generalized autodestructive inflammation? Arch Surg 1985;120: 1109-15.
- Rodríguez LM, Sánchez MR, Medina G, Vega BE, Bolio AS, Valencia S, Sosa J, Echeverría M, Rivero J. La autopsia: la consulta final. Rev Biomed 1997;8(3):171-96.
- Hurtado de Mendoza JE, Montero T, Walwyn V, Álvarez R. Daño multiorgánico en autopsias realizadas en Cuba en 1994. Rev Cubana Med Milt 1997;26:19-26.
- Nguyen TT, Gilpin DA, Meyer NA, Herndon DN. Current treatment of severely burned patients. Annals of Surgery 1998; 223(1):14-25.
- Kowal-Vern A, Sharp-Pucci MM, Walenga JM, Dries DJ, Gamelli RL. Trauma and termal injury: comparation of hemostatic and cytokine changes in the acute phase of injury. J Trauma 1998;44(2):325-9.
- Zapata RT, Hansbrongh JF, Ohara MM, Rice AM, Nylan WL. Bacterial translocation in burned mice after administration of various diets including feber and glutamin-enriched entered formulas. Crit Care Med 1994;22(4):690-6.
- Tabata T, Meyer AA. Effect of burns injury on class specific B-cell population and inmunoglobulin synthesis in mice. J Trauma 1993;35(5):750-5.
- Hurtado de Mendoza J, Zorrilla JF. Elaboración de un modelo experimental de quemaduras. I) Experiencias preliminares. Rev Cubana Med Milit 1982;1(2):79-89.
- Código sobre la ética profesional de los trabajadores de las ciencias. La Habana: Universidad de la Habana; 1999.
- Montero T, Hurtado de Mendoza J, Moreno P, Berlanga J, Bacardí D, Urquiza D, Hurtado de Mendoza J. Modelo experimental de ratón quemado empleado en investigaciones biomédicas. Rev Cubana Med Milit 2001 (versión electrónica).
- Sigarroa A. Biometría y diseño experimental. La Habana: Pueblo y Educación; 1985;743.
- Teplitz C. Patobiología central y ciencia médica integrada en la insuficiencia respiratoria aguda del adulto. Clin Quir Nort Am 1976;56:1097.
- Cotran RS, Kumar V, Collins T. Patología estructural y funcional. 6 ed. Madrid: Mc Graw Hill Interamericana; 1999;1-95.
- Esler M, Jennings G, Leonard P. Contribution of individual organs to total noradrenalina release in humans. Acta Physiol Scans 1984;Suppl 527: 1-6.
- Teplitz C. Histopatología de las quemaduras. En: Artd CE, Moncriea JA. Tratado de quemaduras. 2 ed. México DF: Nueva Editorial Interamericana SA; 1972;cap 2:22-87.
- Sevitt S. A review of the complications of burns, their origin and importance for illnes and death. J Trauma 1979;19:359-69.
- Trump B, Bezezesky IK, Chang SH, Phelps PC. The pathways of cell death: oncosis, apoptosis and necrosis. Toxicol Pathol 1997;25(1):82-8.
- Popper H, Schaffner F. El hígado su estructura y función. Barcelona: Ed. Noguer; 1962: 483.
- Zhao ZD. Changes in organ water content in patients with postburn multiple organ failure. Chung Hua Cheng Hsing Shao Shang Wai Ko Tsa Chih 1990;6(1):78-9.
- Lombardo A, Montero T, Nodarse R. Translocación bacteriana en el paciente politraumatizado. Rev Cubana Med Milit 2000;29(2):127-33.
- Murphy JT, Horton JW, Purdue GF, Hurt JL. Evaluation of troponin 1 as an indicator of cardiac dysfunction after thermal injury. J Trauma 1998;45(4):700-4.
- Kaul S, Fishbein M, Siegel RJ. Cardiac manifestations of acquired immune deficiency syndrome. Am Heart J 1991;122(2):535-44.
- Kowal-Vern A, Sharp-Pucci MM, Walenga JM, Dries DJ, Gamelli RL. Trauma and thermal injury: comparison of hemostatic and cytokine changes in the acute phase of injury. J Trauma 1998;44(2):325-9.
- Faunce DE, Gregory MS, Kovacs EJ. Effects of acute ethanol exposure on cellular immune responses in a murine model on thermal injury. J Leukoc Biol 1997;62:733-40.
- Hower R, Marzi I, Bühren V, Trentz O. Selective digestive decontamination decreases activation of kupffer cells following SMA-schok in the rat. Hepatology 1991;3:433-5.
- Horgan AF, Méndez MV, Riordain O, Holzheimer RG, Mannick JA, Rodrick ML. Altered gene transcription after burn injury results in depresed T lymphocyte activation. Ann Surg 1994;220(3):342-51.
- Kaku N. Clinical feature and laboratory findings of multiple organ failure. Rinsho Byory 1990;38:547-52.
Recibido: 24 de febrero del 2001. Aprobado: 27 de marzo del 2001.
My. Teresita Montero González. Instituto Superior de Medicina Militar “Dr. Luis Díaz Soto”. Avenida Monumental, Habana del Este, CP 11700, Ciudad de La Habana, Cuba.
1 Especialista de II Grado en Anatomía Patológica. Profesora Asistente.
2 Doctor en Ciencias Médicas. Especialista de II Grado en Anatomía Patológica. Profesor Titular.
3 Licenciada en Bioquímica.
4 Técnica de Laboratorio de Anatomía Patológica.