Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Militar
versión impresa ISSN 0138-6557
Rev Cub Med Mil vol.41 no.1 Ciudad de la Habana ene.-mar. 2012
TRABAJO DE REVISIÓN
Vínculo entre estrés oxidativo y enfermedad por quemaduras
Link between the oxidative stress and burn disease
Dr. Yoel Rodríguez Rodríguez, Dr. C. Abraham Beato Canfux, Lic. Maura García Sánchez
Hospital Militar Central "Dr. Luis Díaz Soto". La Habana, Cuba.
RESUMEN
Se realizó una revisión bibliográfica sobre el tema del estrés oxidativo; y se tuvieron en cuenta la fisiología normal de este mecanismo metabólico, las causas de su alteración y el daño que produce, cuando se descompensan los sistemas de defensa del organismo, con el objetivo de evidenciar el vínculo entre el daño oxidativo a las células y la fisiopatología de las lesiones producidas por quemaduras mayores, a partir del análisis de las fuentes bibliográficas nacionales e internacionales impresas y en formato digital sobre el tema en cuestión. Se expone la importancia de trazar una estrategia más eficiente, que tenga en cuenta la magnitud del daño producido por el estrés oxidativo en el tratamiento de pacientes con quemaduras, con la finalidad de modular el daño oxidativo a las células. Se concluye que en el ejercicio médico no se puede pretender evitar a los pacientes la nueva situación de estado redox. Los esfuerzos asistenciales deben estar encaminados una vez más a ayudar al organismo en el restablecimiento del equilibrio redox, mediante una reanimación adecuada y precoz, con prácticas de tácticas quirúrgicas activas que minimicen los daños externos, aporten los nutrientes adecuadamente y respeten la política del uso de antibióticos sistémicos, mediante el uso de antioxidantes parenterales para reducir el tiempo de hospitalización con el apoyo de psicólogos y fisiatras en la terapéutica empleada.
Palabras clave: estrés oxidativo, radicales libres, daño oxidativo, quemaduras mayores, enfermedad por quemaduras.
ABSTRACT
A bibliographic review was carried out on the oxidative stress taking into account the normal physiology of this metabolic mechanism, the causes of its alteration and the damaged produced, when the defense organic system are unbalanced to evidence the link between the oxidative damage to cells and the physiology and pathology of the injuries produced by major burns, from the analysis of the printed bibliographic national and international sources and in digital format on this subject. The significance to design more effective strategies is emphasized that take into account the magnitude of the damage produced by the oxidative stress in the treatment of burnt patients to modulate the oxidative damage to cells. We conclude that in the medical practice it is not possible to avoid to patients the new situation of redox state. The healthcare efforts must to be directed once again to help to organism in restoration of redox balance by means of an appropriate and early recovery with practices of active surgical tactics minimizing the external damages, supply appropriately the nutrients and to respect the politic of use of systemic antibiotics, by means of the use of parental antioxidants to reduce the hospital stay with the support of psychologists and physiatrist trained in the therapy used.
Key words: oxidative stress, free radicals, oxidative damage, major burns, diseases due to burns.
INTRODUCCIÓN
En el marco de la biología, es posible catalogar el tema del estrés oxidativo como novedoso a pesar que desde 1775 Joseph Pristley, descubridor del oxígeno, sugirió que este gas podría ser tóxico a las células,1 pero no es hasta el siglo xx que aparecen los primeros artículos que demuestran este criterio. En 1900 Moses Gomberg demostró la existencia del radical trifenilmetilo (Ph3C×). En 1937 Babior y otros, en un artículo publicado en Journal of Clinical Investigation, informaron que una de las principales acciones bactericidas de los leucocitos era la generación enzimática del O2×, H2O2 y otros productos oxidantes como el ácido hipocloroso (HOCL).2 En ese mismo año la catalasa (CAT) fue obtenida en forma cristalina a partir de hígado bovino por Summer y Dounce3 en 1952 Conger & Fairchild, en un artículo publicado en la Proceedings of the Nacional Academy of Sciences (EE. UU.), demostraron por vez primera que el daño oxidativo mediado por ERO ocurría en los organismos vivos.2
En 1954 una investigadora argentina, Rebeca Gerschman, sugirió por primera vez que los radicales libres (RL) eran agentes tóxicos y generadores de enfermedades.4 En 1956 Harman propuso la teoría de los RL en el envejecimiento.5-7 En 1957 la GPx fue encontrada en el eritrocito bovino por Millis;8-10 en ese mismo año McCord y Fridovich demostraron que la eritrocupreína (una proteína que se encuentra en altas concentraciones en los eritrocitos) cataliza la descomposición de O2× en H2O2 y O2. Esta enzima se llamó más tarde superóxido dismutasa (SOD).2 En 1978 el grupo de McCord y Fridovich demuestra que la toxicidad biológica del O2× se debe fundamentalmente a la formación del radical hidroxilo (×OH).2 En 1987 Robert Furchgott, Lou Ignaro y Ferid Murad describen la naturaleza química y la vía biosintética de un mediador difusible de corta t 1/2 responsable de la relajación del músculo liso vascular identificado como óxido nítrico (×NO).2
En la actualidad, este tema se ha divulgado tanto entre las diferentes especialidades médicas que resulta difícil no encontrar en cualquier revista médica un artículo que se refiera a dicho tema; se ha llegado a declarar el estado redox celular como un componente crítico de enfermedades y respuestas celulares, inducidas por el estrés;3 y cada vez se relaciona con mayor diversidad de procesos patológicos como aterosclerosis, infarto del miocardio, enfermedad de Alzheimer, cáncer, envejecimiento, síndromes autoinmunes y enfermedad por quemaduras, entre otras, pero es en esta última donde menos informes se encontraron. Estos fueron iniciados por Santos y otros (1995), quienes realizaron estudios experimentales en ratas con 30 % de superficie corporal quemada, que revelaron alteraciones de la membrana con inhibición de la actividad ATPasa e incremento del contenido de calcio en el miocardio. Estos investigadores también reportan altos niveles de malonildialdehído (MDA) en el tejido cardíaco de las ratas tratadas, con respecto a los controles, lo cual puede estar asociado al daño que se produce en este órgano posterior a la lesión térmica.11 Por otra parte, Horton en 1996 realizó un estudio similar en ratas con el 42 % de superficie corporal comprometida, y demostró que la producción de RL mediada por la xantina oxidasa contribuye a las alteraciones en la función cardíaca como consecuencia de la que madura.12
A partir del 2000 encontramos las primeras publicaciones cubanas sobre el tema, fundamentadas con el trabajo de la Unidad de Quemados del Hospital General Docente "Calixto García», que incluyó 33 pacientes muy graves; aquí se describe el comportamiento a partir de sangre venosa de las concentraciones de malonildialdehído, productos de oxidación de las proteínas, vitamina A y b-carotenos, la actividad superóxido dismutasa, CAT, fosfolipasa A2 (FLA2), elastasa y el porcentaje de inhibición de tripsina12 en cuatro momentos evolutivos desde su ingreso. A pesar de detectar alteraciones significativas en estos marcadores no se establecen relaciones de dependencia con otras variables clínicas o humorales, y el estudio se limita a describir las variaciones de estos.
El Hospital Militar Central "Dr. Luis Díaz Soto" ha realizado trabajos de revisión sobre el tema con los títulos siguientes: "Métodos para medir el daño oxidativo"13 (2000), "Radicales libres en la biomedicina y estrés oxidativo"14 (2001) y "Daño oxidativo, radicales libres y antioxidantes"15 (2002). En el 2006 el Departamento de Anatomía Patológica, de este centro, realiza un estudio experimental en un modelo de ratón quemado con 11 % de superficie corporal dañada, donde se evalúa la respuesta al tratamiento con Aloe vera, factor de crecimiento y ozono, además del comportamiento del MDA, la CAT y la SOD en los 6 grupos del estudio.16
Se pretende con esta revisión evidenciar el vínculo entre el daño oxidativo a las células y la fisiopatología de las lesiones producidas por quemaduras mayores, a partir del análisis de las fuentes bibliográficas nacionales e internacionales impresas y en formato digital sobre el tema en cuestión.
FISIOLOGÍA
Los RL se generan de procesos fisiológicos tanto a nivel intracelular como extracelular. Entre las células relacionadas con la producción de RL del oxígeno tenemos los neutrófilos, monocitos, macrófagos, eosinófilos y las células endoteliales. Las enzimas oxidantes involucradas son la xantinoxidasa, la indolamindioxigenasa, la triptofanodioxigenasa, la mieloperoxidasa, la galactosa oxidasa, la ciclooxigenasa, la lipoxigenasa, la monoaminooxidasa y la NADPH oxidasa.17-21
Los procesos fisiológicos descritos en los que se generan especies reactivas de oxígeno son (tomado de Candelario-Jalil y León, 1999):
1. Reducción del O2 molecular hasta H2O durante el transporte electrónico mitocondrial.
2. Reacciones catalizadas por la monoaminooxidasa (MAO), tirosina hidroxilasa (TH) y aminoácido oxidasa (L-AAO) productoras de H2O2.
3. Autooxidación de catecolaminas (proceso no enzimático).
4. Metabolismo del ácido araquidónico (AA) como proceso generador de ERO. Además de la vía de la cicloxigenasa (representada), puede generarse ERO por la acción sobre el AA de la lipoxigenasa, el sistema P450 y la XO (Simonian y Cole, 1996).
5. Reacción catalizada por la óxido nítrico sintetasa (NOS).
6. Formación y descomposición del peroxinitrito.
7. Producción de ERO por acción de la xantina oxidasa (XO).
8. Reacciones catalizadas por metales. Reacción de Haber-Weiss y de Fenton.
9. Como resultado de la activación de células fagocíticas.
10. Por acción de agentes externos:
- Radiaciones ultravioleta inducen la síntesis de O2-, 1O2, OH y H2O2.
- Radiaciones ionizantes.
- La ingestión de alcohol favorece la formación de ERO por diversos mecanismos.
- El monóxido y dióxido de nitrógeno (NO, NO2) presentes en la atmósfera como contaminantes ambientales.
- El hábito de fumar da lugar a la formación de ERO por su alto contenido en NO, NO2.
- El ozono (O3) generado en el medio ambiente disminuye considerablemente los antioxidantes plasmáticos como las vitaminas D y E, y el ácido úrico.
- Algunos fármacos antibióticos y citostáticos.
- Exposición a sustancias tóxicas (fertilizantes y pesticidas).
- Elevado estrés físico o psíquico.
Toxicidad de los radicales libres
Por la alta inestabilidad atómica de los RL, colisionan con una biomolécula y le sustraen un electrón, la oxidan y, de esta manera, pierden su función específica en la célula. Si se trata de los lípidos (ácidos grasos poliinsaturados), se dañan las estructuras ricas en ellas como las membranas celulares y las lipoproteínas. En las primeras se altera la permeabilidad, que conduce al edema y la muerte celular; en la segunda,21-24 la oxidación de la LDL, génesis de la placa ateromatosa. 25
Las características de la oxidación lipídica por los RL tratan de una reacción en cadena en la que el ácido graso, al oxidarse, se convierte en radical de ácido graso con capacidad de oxidar a otra molécula vecina.2,19-21 Este proceso es conocido como perioxidación lipídica y genera numerosos subproductos, muchos de ellos como el MDA, cuya determinación en tejidos, plasma u orina es uno de los métodos para evaluar el estrés oxidativo.17-19
En el caso de las proteínas, se oxidan preferentemente los aminoácidos (fenilalanina, tirosina, triptofano, histidina y metionina) y como consecuencia se forman entrecruzamientos de cadenas peptídicas, fragmentación de la proteína y formación de grupos carbonilos, que impiden el normal desarrollo de sus funciones (transportadores iónicos de membranas, receptores y mensajeros celulares, enzimas que regulan el metabolismo celular, etcétera).26
Otra molécula que es dañada por los RL es el ADN; el daño a los ácidos nucleicos produce bases modificadas, lo que tiene serias consecuencias en la aparición de mutaciones y carcinogénesis, por una parte, o la pérdida de expresión por daño al gen específico, por la otra.27
El daño a biomoléculas que determinan los RL, se haya implicado en la génesis o exacerbación de numerosos procesos:
- Aparato cardiovascular: aterosclerosis, infarto del miocardio, cirugía cardíaca, diabetes, cardiopatía alcohólica
- Sistema neurológico: enfermedades de Parkinson y de Alzheimer, neuropatía alcohólica, hiperoxia, isquemia o infarto cerebral, traumatismos craneales
- Aparato ocular: cataratas, daño degenerativo de la retina, fibroplasia retrolental.
- Aparato respiratorio: distrés respiratorio (síndrome de dificultad respiratoria del adulto), tabaquismo, cáncer de pulmón, enfisema.
- SOMA: artritis reumatoidea.
- Riñón: síndrome autoinmune, nefrotoxicidad por metales.
Sistemas de defensa biológica contra los radicales libres 2
La vida en presencia del oxígeno molecular exige contar con una batería múltiple de defensa contra los diversos RL de oxígeno, que por un lado tiendan a impedir su formación y, por otro, los neutralicen una vez formados. Estas defensas se efectúan en cinco niveles:
Primero: consiste en evitar la reducción univalente del oxígeno, mediante sistemas enzimáticos capaces de efectuar la reducción tetravalente consecutiva, sin liberar los intermediarios parcialmente reducidos. Esto lo logra con gran eficacia el sistema citocromo-oxidasa de la cadena respiratoria mitocondrial, responsable de más del 90 % de la reducción del oxígeno en el organismo humano.
Segundo: lo constituyen enzimas especializadas en captar el radical anión superóxido (O2-).
Tercero: dado por un grupo de enzimas especializadas en neutralizar el peróxido de hidrógeno. Entre ellas está la CAT, que se encuentra en los peroxisomas que catalizan la reacción de dismutación siguiente:14-17
H2O2 + H2O= 2H2O + O2
También en los mamíferos, la glutatión-peroxidasa (enzima citoplasmática que contiene selenio), es la más importante y cataliza la reacción siguiente:18
(Glutatión-peroxidasa)
2GSH + H2O2= GSSG + 2H2O
GSH= glutatión reducido
GSSG= glutatión oxidado
Cuarto: aquí el radical hidroxilo producido en el ciclo de Haber-Weiss puede ser neutralizado por la vitamina E o alfatocoferol, que es un antioxidante efectivo y que por su hidrofobicidad se encuentra en las membranas biológicas, donde su protección es particularmente importante. También la vitamina C o ácido ascórbico es un agente reductor o donador de electrones y reacciona rápidamente con el radical OH-.2,28
Quinto: una vez producido el daño molecular, existe un quinto nivel de defensa que consiste en la reparación. Está demostrado que los RL son capaces de provocar rupturas en la cadena de DNA y aun de inducir mutagénesis, pero existen mecanismos enzimáticos de reparación que permiten restablecer la información genética.2,19
QUEMADURA Y ESTRÉS OXIDATIVO
El paciente con grandes quemaduras sufre un gran daño hístico y sistémico reconocido por Kirschbaum (1987), cito: "son lesiones traumáticas que conducen a una necrosis hística de variable extensión y profundidad. Causadas por diferentes agentes físicos, químicos o biológicos, que provocan alteraciones hístico humorales capaces de conducir a la muerte o dejar secuelas invalidantes o deformantes al paciente que las sufre".29
Podemos asumir que la magnitud del daño provocado por las quemaduras incluye alteraciones locales y sistémicas, que pueden afectar componentes moleculares y celulares, de los tejidos, órganos y sistemas completos del organismo.30 Desde este punto podremos apreciar que existe relación entre la enfermedad por quemadura y el estrés oxidativo (EO), que se define como aquella situación en que las células están sometidas a un ambiente prooxidante y los mecanismos defensivos antioxidantes del organismo son sobrepasados de forma que llega a afectar el estado redox celular.2,14,31
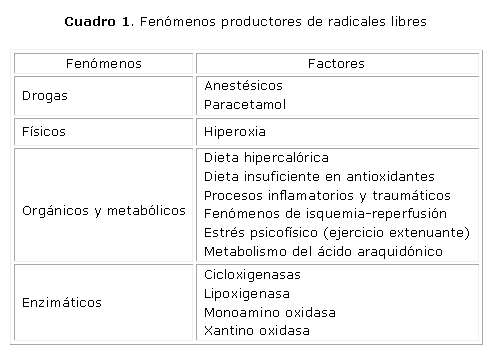
Las quemaduras forman parte de los traumatismos que producen EO; además de esta relación que existe entre estos fenómenos, se busca una explicación fisiopatológica, según la clasificación etiológica de los factores productores de RLO2 como se muestra en el cuadro 1.
Se puede vincular esta lista con la fisiopatología evolutiva de la lesión por quemadura, ya que se observa que, desde sus inicios, el paciente con grandes quemaduras reúne factores que lo van a conducir a un estado de EO. Desde el siglo XIX se describe la hemoconcentración existente en los quemados como factor esencialmente negativo en su evolución, hecho que después se vinculó, de forma aceptada, a la pérdida de líquido del espacio vascular y al shock hipovolémico.29-34
En la actualidad, conocemos que asociado a este mismo fenómeno está la isquemia de muchos tejidos, mecanismo utilizado por el organismo para priorizar la irrigación sanguínea de órganos diana como cerebro, corazón y pulmones.30,35 La reperfusión ocurre en la medida en que se recupera la permeabilidad vascular y se repone el volumen de líquido intravascular. Posteriormente se instaura la etapa tóxica y por lo general séptica; se hace referencia así debido a que no se presenta en el 100 % de los casos, pero en su mayoría confluyen la mayor parte de estos factores, por ejemplo el proceso inflamatorio que a través del metabolismo del AA activa los sistemas enzimáticos, combinado con la sepsis que estimula la producción de RL por los PMN como mecanismo de defensa,36 perpetúan el desbalance oxidativo.
A continuación, en la fase de adaptación cuando se inicia el tratamiento quirúrgico, el paciente no escapa al uso de anestésicos. Una dieta hipercalórica e insuficiente de antioxidantes acompañada de estados de hiperoxia, debido al manejo inadecuado del oxígeno administrado al enfermo, pueden formar parte también de los factores generadores de ERO en el paciente quemado. Aunque nuestros pacientes no realizan un ejercicio físico intenso hasta la fase final de adaptación, en la cual se incrementa la rehabilitación para su reincorporación a la sociedad, el estrés psíquico los acompaña en todos los momentos después de accidente, debido a los factores siguientes:
1. Impacto del accidente.
2. Temor a las curas.
3. Limitaciones por dolor somático.
4. Limitaciones físicas por las lesiones.
5. Secuelas invalidantes o deformantes.
Todas ellas convierten este factor en productor permanente de RL, por lo cual es difícil determinar el momento en el que nuestros pacientes rebasarán el nuevo estado redox celular.
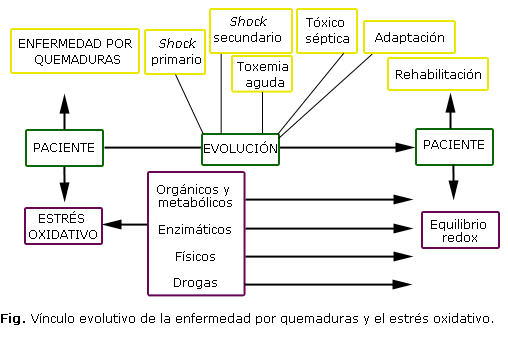
El paciente con grandes quemaduras permanece en EO durante la evolución de su enfermedad, en la cual aparecen momentos de exacerbación en la producción de RL, debido a la coincidencia de varios factores en la misma etapa evolutiva; durante el shock primario se sientan las bases para las alteraciones que siguen a partir del estrés psicofísico y la activación de las enzimas del primer nivel de defensa del organismo. Las etapas de shock secundario, tóxica aguda y tóxico séptica son las más críticas con respecto al daño oxidativo por los fenómenos que en ellas coinciden, como se muestra en la cuadro 2. Se espera una disminución paulatina de este daño durante la etapa de adaptación gracias a la recuperación de todos los sistemas orgánicos, si el paciente no se complica y fallece, y que el equilibrio redox del medio interno se alcance durante la fase de rehabilitación física, psicológica y social del paciente, como se muestra en la figura.
A manera de conclusión, se considera que en el ejercicio médico no se puede pretender evitar a los pacientes, la nueva situación de estado redox. Los esfuerzos asistenciales deben estar encaminados una vez más a ayudar al organismo en el restablecimiento del equilibrio redox, mediante una reanimación adecuada y precoz, con prácticas de tácticas quirúrgicas activas que minimicen los daños externos, aporten los nutrientes adecuadamente y respeten la política del uso de antibióticos sistémicos, mediante el uso de antioxidantes parenterales para reducir el tiempo de hospitalización con el apoyo de psicólogos y fisiatras en la terapéutica empleada.
REFERENCIAS BIBLIOGRÁFICAS
1. Freeman BA, Crapo JD. Free radicals and tissue injury. Lab Invest. 1982;47:412-5.
2. León OS, Martínez G, Candelario EJ, García I, Bilbao T, Ledesma L. Balance antioxidante-prooxidante: salud y enfermedad. La Habana: Editorial Ciencias Médicas; 2005. p. 60-5.
3. Maehly AC. The Assay of Catalases and Peroxidases. Methods of Biochemical Analysis. Volumen 1. New Jersey: John Wiley & Sons; 2006. p. 357-424.
4. Gerschman R. Oxygen poisoning and X-Irradiation. A mechanism in common. Science. 1954;119:623-6.
5. Ferreira R. Estrés oxidativo y antioxidantes. De las ciencias básicas a la medicina aplicada. Rev Méd Chile. 2006;139:644-6.
6. Medveded Z. An attempt at a rational classification of theories of aging. Biol Rev. 1990;65:375-98.
7. Hayflick L. Theories of biological aging. Exp Gerontol. 1985;20:145-59.
8. Lam KW, Wang L, Hong BS, Treble D. Purification of phospholipid hydroxiperoxide glutathione peroxidase from bovine retina. Curr Eye Res. 1993Jan;12(1):915.
9. Maiorino M, Chu FF, Ursoni F. GPxPH is the 8 KDa seleno proteins expressed in human tumor cell lines. J Biol Chem. 1991 Apr 25;266(12):772-832.
10. Zachara BA. Mamalian selenoproteins. J Trace Elem Electrolites Health Dis. 1992. Sep;6(3):1375.
11. Santos FX, Escudero M, Pérez L, Lozano T, Obispo J M, Hamann C, Rodriguez C. Comparison of the Effects of Nerve Growth Factor and Superoxide Dismutase on Vascular Extravasation in Experimental Burns. Burns. 1995;21(6):445-8.
12. Sánchez Álvarez Rl. Caracterización de indicadores bioquímicos de estrés oxidativo en pacientes quemados muy graves. Rev Cubana Invest Bioméd. 2000;19(3):164-7.
13. Pérez Gastell PL, Pérez de Alejo JL. Métodos para medir el daño oxidativo. Rev Cubana Med Mil. 2000;29(3):192-8.
14. Rodríguez Perón JM, Menéndez López JR, Trujillo López Y. Radicales libres en la biomedicina y estrés oxidativo. Rev Cubana Med Mil. 2001;30(1):15-20.
15. Venereo Gutiérrez JR. Daño oxidativo, radicales libres y antioxidantes. Rev Cubana Med Mil. 2002;31(2):126-33.
16. Montero González T, Hurtado de Mendoza Amat J, García Piñeiro JC, Llopiz Janer NA, Menéndez Cepero S, Berlanga Acosta J. Estrés oxidativo en un modelo de ratón quemado tratado con Aloe b, ozono y factor de crecimiento epidérmico. Rev Cubana Med Mil [Internet]. 2006;35(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-65572006000300007&lng=es
17. Luscesoli F, Fraga CG. Evaluación del estrés oxidativo. Antioxidante y Calidad de Vida. 1995;1:8-13.
18. Motchnik PA, Frei B, Ames BN. Measurement of antioxidants in human blood plasma. Int Methods Entymol. 1994;234:269-79.
19. García JC, García B, Morin MA, Céspedes EM, Clapes S, Etienne O. Radicales libres: impacto médico. BEB (México). 1993;13(3):75-83.
20. Halliwell B, Gutterioge JMC. Free radical in biology and medicine. Oxford: Clarendon; 1989. p. 1-142.
21. Basaga HS. Biochemical aspects of free radicals. Biochem Cell Biol. 1989;68:989-98.
22. Garner WL, Rodríguez JL, Miller CG, Till GO, Rees RS, Smith DJ, et al. Acute skin injury releases neutrophil chemoattractans. Surgery. 1994;116(1):42-8.
23. Goode HF, Cowley HC, Walker BE, Howdle PD, Webster NR. Decreased antioxidant status and increased lipid peroxidation in patients with septic shock and secondary organ dysfunction. Crit Care Med. 2005;23:646-51.
24. Larrondo M, León PD. Estrés oxidativo y sépsis. Rev Cubana Invest Bioméd. 2000;19(3):199-201
25. Leoper J. Lipid Peroxidation and Protective Enzymes during Myocardial Infarction. Clin Chim Acta. 2004;196:119-26.
26. Oteiza PA. Modificación activa de las proteínas. Antioxidante y Calidad de Vida. 1995;2:12-20.
27. Karlis Briviba, Bernhord Wintzl, Kerstin Níkel. A half-marathon and marathon run induce oxidative DNA damage reduce antioxidant capacity to protect DNA against damage and modify immune function. Rev Cubana Farm. 2007;41(1):123-8.
28. Weiss SW. Oxygen, Ischemia and Inflammation. Acta Physiol Scand. 2004;548: 937.
29. Kirschbaum MS. Quemaduras y cirugía plástica de sus secuelas. La Habana: Editorial Científico Técnica; 1987. p. 3-129.
30. Benaim F, Linares HA, Bendlin A. Tratado de quemaduras. México DF: Nueva Editorial Interamericana; 1993.
31. Sabeh F, Baxter CR, Norton SJ. Skin Burn Injury and Oxidative Stress in Liver and Lung Tissues of Rabbit Models. Eur J Clin Chem Clin Biochem. 1995;33(6):323-8.
32. Mir L. Fisiopatología y tratamiento de las quemaduras y sus secuelas. Barcelona: Editorial Científico-Médica; 1969.
33. del Sol Sánchez A. Las quemaduras y sus diferentes aspectos. La Habana: Editorial Científico Técnica; 1990.
34. Fernández Peláez F, Beato Canfux AI, González Planas G, Breff Frómeta A. Reanimación hídrica del paciente quemado mayor. Rev Cubana Med Mil [Internet]. 2007;36(4). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-65572007000400008&lng=es
35. Foldi V, Csontos C, Bogar L, Roth E, Lantos J. Effects of fluid resuscitation methods on burn trauma-induced oxidative stress. J Burn Care Res. 2009 Nov-Dec;30(6):957-66.
36. Bartha E, Asmussen S, Olah G, Rehberg SW, Yamamoto Y, Szabo C. Burn and Smoke Injury Activates Poly(ADP-Ribose)Polymerase in Circulating Leukocytes. Shock. 2011 Aug;36(2):144-8.
Recibido: 24 de septiembre de 2011.
Aprobado: 29 de octubre de 2011.
Yoel Rodríguez Rodríguez. Hospital Militar Central "Dr. Luis Díaz Soto". Avenida Monumental y Carretera de Asilo, Habana del Este, CP 11 700, La Habana, Cuba.