INTRODUCCIÓN
La Punica granatum Linn (granada) es un árbol caducifolio de la familia de las Punicáceas representada por un solo género, Punica y dos especies P. granatum y P. protopunica. La primera es la que se cultiva, por sus frutos comestibles.1,2) Tiene elevado valor nutricional, rica en antioxidantes , contiene potasio, calcio, magnesio, hierro, manganeso, cobre, zinc y vitaminas C, B y E.3
Se plantea que el extracto fluido de granada, es una mezcla compleja que contiene carbohidratos reductores, mucílagos, glucósidos, fenoles/ taninos, flavonoides, antocianidinas y alcaloides, de ahí que se le atribuyan propiedades antioxidantes, antiapoptótica, inmunomoduladora, antihipertensiva, cicatrizante, hipolipemiante y como alimento nutritivo.4,5,6,7,8
Se reporta que el extracto de fruta de granada, rico en antocianina e hidrolizable de tanino, modula las vías de MAPK (Mitogen-Activated Protein Kinases) y el factor nuclear NF-kappa B e inhibe la tumorigénesis de la piel en ratones.9
Actualmente se ha elevado el conocimiento acerca de la utilidad clínica y farmacológica de los extractos de plantas y sus derivados, como drogas para la quimioterapia e inmunoterapia. La inmunosupresión es uno de los problemas en el tratamiento de diversos tipos de cáncer, consecuentemente son estudiados diversos inmunomoduladores, naturales y sintéticos, con el fin de atenuar los efectos de este proceso.
Sobre la base de los precedentes de la Punica granatum L, se ejecutó un modelo farmacológico experimental en animales, de inmunosupresión con ciclofosfamida, para validar el uso de la Punica granatum L en polvo, como inmunomodulador.
MÉTODOS
Se utilizó Punicagranatum L en polvo, № de lote 13001, obtenido de un extracto fluido de granada fabricado en el CIDEM (Centro de Investigación y Desarrollo de medicamentos).
El polvo se presenta como un extracto seco de granada, de color carmelita, amorfo, altamente higroscópico. En el estudio fisicoquímico se encontró que el contenido de polifenoles totales era de 0,37 %, la pérdida por desecación 11,4 % y en el conteo microbiano hubo ausencia de patógenos.
Se utilizaron 32 ratas machos Wistar con peso de 180 a 390 g. Los animales fueron divididos aleatoriamente en cuatro grupos experimentales, de ocho ratas cada grupo:
Grupo I: Control, sin polvo de granada, sin inmunosupresión con ciclofosfamida, ni inmunización con glóbulos rojos de carnero.
Grupo II: Inmunizado con glóbulos rojos de carnero.
Grupo III: Inmunosuprimido con ciclofosfamida e inmunizado con glóbulos rojos de carnero.
Grupo IV: Tratado con polvo de granada, inmunosuprimido con ciclofosfamida e inmunizado con glóbulos rojos de carnero.
La concentración de ciclofosfamida administrada fue de 125 mg/kg de peso en dosis única, inyectada por vía intraperitoneal.
El polvo de Punica granatum L, se administró a una dosis de 150 mg/kg, diluida en agua destilada, conservada a 4 ºC, por vía intragástrica, durante 14 días.
Los animales fueron inmunizados con 0,2 mL de una suspensión de glóbulos rojos de carnero al 20 %, por vía intraperitoneal, como antígeno para medir la producción de anticuerpos.
Las variables utilizadas fueron cálculo de peso corporal y detección de anticuerpos hemoaglutinantes (HA).
El procesamiento estadístico se realizó a través del paquete SPSS versión 15.0 para determinar la estadística descriptiva, las medias de los pesos corporales fueron comparadas con el test de Student para muestras no pareadas. Se utilizó como nivel de significación una p < 0,05.
Detección de HA: a todos los grupos de animales se les tomó muestras de sangre para determinar respuesta inmune primaria (RIP) y respuesta inmune secundaria (RIS) de anticuerpo, con el empleo de la técnica de HA.
Los sueros se centrifugaron individualmente a 13.000 rpm por 10 minutos y se conservaron en viales a 4 ºC. Se realizaron diluciones dobles seriadas (puro, 1: 2 hasta 1: 512) con solución salina al 0,9 %.
Se dispensaron 25 µL de cada dilución en placas de microtitulación de fondo en U y se añadió 25 µL de la suspensión de glóbulos rojos de carnero al 1 %. La placa se agitó para homogenizar la mezcla y se incubó a temperatura ambiente durante 1 hora aproximadamente, hasta que los pozos controles, mostraron un patrón de negatividad inequívoco (botón rojo en el fondo del pozo). La lectura de las placas se realizó utilizando un microscopio invertido.
El patrón de aglutinación se evaluó, considerando que cuando los glóbulos rojos sedimentan en el fondo del pozo no hay aglutinación, si se observa un anillo de células aglutinadas alrededor de un botón en el centro hay hemoaglutinación, aunque no se lee como punto final; pero si los glóbulos forman una capa muy fina y bien distribuida en el pozo se lee como punto final de HA, interpretada como hemaglutinación completa.
Se cumplieron con las normas éticas para experimentos en animales, según el reglamento de buenas prácticas de la institución y la declaración de Helsinki.10
RESULTADOS
Al relacionar el peso promedio de las ratas de la RIP con la RIS, se observa que hubo una ligera tendencia al aumento del peso corporal en los grupos I, II y III, con leve disminución en el grupo IV (Fig. 1).
Se encontraron diferencias estadísticamente significativas entre las medias del peso corporal de la RIP y RIS del grupo I (RIP = 184,12; RIS = 201,87; p= 0,002) y entre los grupos III (RIP = 301,87; RIS = 306,71) y IV (RIP = 390; RIS = 383,75; p= 0,000). No fue así en el II (RIP = 305,75; RIS = 315) (Fig. 1).
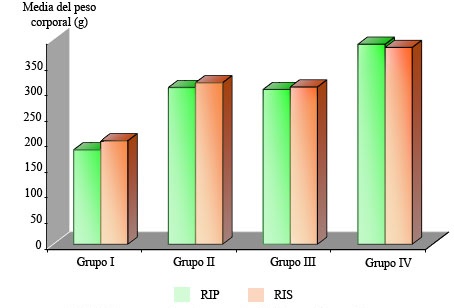 p = 0,0025. Respuesta primaria y secundaria del grupo I (control).p = 0,0025. Respuesta primaria y secundaria del grupo III vs grupo IV.
p = 0,0025. Respuesta primaria y secundaria del grupo I (control).p = 0,0025. Respuesta primaria y secundaria del grupo III vs grupo IV.Fig. 1 - Peso corporal de los animales por grupos.
El título del grupo III, fue inferior con relación al título de los grupos II y IV, tanto en la respuesta primaria como secundaria. El título de anticuerpos del grupo IV resultó estadísticamente significativo, con relación al título del grupo III, tanto para la RIP como RIS p= 0,000 (tabla).
DISCUSIÓN
La ciclofosfamida es un inmunosupresor que afecta directamente el sistema inmunitario, con amplia utilidad en el tratamiento de pacientes con cáncer, pero puede ser causa de infección fulminante y muerte.11) Es utilizada para prevenir el rechazo inmunológico en transplantes (corazón, riñón, hígado, etc.), presenta efecto inmunomodulador y cumple un rol importante en la respuesta antitumoral.12
La administración de grandes dosis produce atrofia importante de todo el tejido linfoide, reduce la producción de células T y de anticuerpos. Esto implica que el nivel de inmunidad humoral y celular disminuye para casi todos los agentes invasores ajenos al organismo. Por esto, la cantidad del inmunosupresor es importante para evaluar el efecto inmunopotenciador del extracto de una planta.
La ciclofosfamida puede inducir la liberación de citoquinas (IL-10) y el aumento de esta conlleva inmunosupresión. Inhibe la fase S del ciclo celular, la producción de anticuerpos e induce linfocitopenia, tanto de linfocitos T como B.13
Los protocolos de inmunosupresión con ciclofosfamida, en el tratamiento con extractos de plantas utilizados en ratas y ratones, van desde concentraciones de 50 mg/kg hasta 150 mg/kg de peso.14,15
La literatura reporta que la ciclofosfamida, utilizada por vía intraperitoneal para evaluar el efecto de extractos de plantas, puede producir disminución de peso corporal, la celularidad y el título de anticuerpos.13,16
El presente trabajo muestra que en el grupo inmunosuprimido, hubo disminución del peso, en relación a los grupos restantes. Se hizo más notorio en la respuesta primaria, que en la respuesta secundaria. Se observa que el efecto inmunosupresor se redujo y el sujeto repuso su sistema inmunológico.
Se han realizado algunos estudios acerca de la actividad inmunomoduladora de extractos de plantas. Jiao-jiao y otros14 evaluaron el efecto protector del extracto de la Mauremys mutica, administrada por vía oral a una dosis de 250 y 500 mg/kg, en ratones inmunosuprimidos con ciclofosfamida. Demostraron las potencialidades de este como adyuvante frente al cáncer de mama, debido a la mejoría del sistema inmune.
Se reporta que tres extractos de Lepidium peruvianum, a dosis de 300 mg/kg presentaron efecto modulador en relación al grupo de ratones inmunosuprimidos en cuanto a celularidad y título de anticuerpos.13
Un estudio in vitro del polisacárido PSP001 de Punica granatum, mostró un efecto estimulatorio sobre un linfocito normal aislado y alcanzó un índice de proliferación de 1.21 ± 0,01 a una concentración de 100 mg/mL, lo cual indica su actividad inmunomoduladora.17
Estudios realizados en extractos metanólicos y acuosos de Phenaxrugosus y Tabebuia chrysantha, encontraron incrementos en los niveles de IgG2b del grupo Phenax e IgM del grupo Tabebuia.18
El título de anticuerpos en el grupo tratado con el polvo seco de granada se incrementó. Los títulos obtenidos fueron menor en la RIP que en la RIS. Esto puede deberse a que los niveles de inmunoglobulinas se alcanzan tras un largo período de latencia, después de un estímulo antigénico, en tanto en la secundaria se alcanza más rápidamente.
Se han encontrado reportes donde los metabolitos son los responsables de la actividad sobre las células inmunes e inflamatorias.
Algunos autores describen que al parecer, la actividad biológica de mayor parte de los flavonoides se debe principalmente a su capacidad de penetrar en células y enzimas de bloque de senderos señalados y factores de transcripción. Incluyen aquellos complicados en la activación, proliferación y la realización de las funciones de células efectoras del sistema inmunológico.19
Hong y otros20 demostraron que el zumo y los extractos procedentes de la granada son potentes inhibidores del crecimiento celular. Son incluso más potentes que algunos polifenoles considerados de modo aislado. Esto sugiere un efecto sinérgico con los fitoquímicos presentes en la granada y sus extractos.
Un análisis fitoquímico en la remolacha, identificó un flavonoide, metabolito secundario, que explicaría probablemente el incremento de leucocitos.21)
Hay evidencias científicas que demuestran que el zumo de granada, suprime la expresión COX-2 inducida por TNF-α, la vía NF-κB y la activación de la proteína Akt. Puede que ciertos componentes bioactivos presentes en el zumo de granada, tales como antocianinas y flavonolas, puedan ser las responsables del aumento de la actividad antiproliferativa de las células cancerígenas.22
Los resultados obtenidos son similares a lo reportado, donde los metabolitos de la planta, pueden ser responsables de las propiedades inmunomoduladoras que se le atribuyen.
Se concluye que el uso de Punica granatum L en polvo, en un modelo farmacológico experimental de inmunosupresión con ciclofosfamida, mostró efecto inmunomodulador, al incrementar el nivel de anticuerpos hemaglutinantes.
Se recomienda estudiar diferentes dosis del producto en otros modelos experimentales de inmunosupresión, para identificar si es efectiva su actividad inmunomoduladora.














