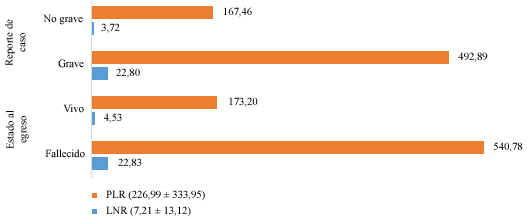INTRODUCCIÓN
En la actualidad, el mundo está abrumado por una pandemia causada por un nuevo coronavirus que surgió en Wuhan, Hubei, China a finales de diciembre de 2019, nombrado SARS-CoV-2.1) En poco tiempo lo que consistía en un brote epidémico localizado, se extendió con rapidez a 208 países, con un porcentaje importante de casos que se presentan como graves o críticos y una tasa de letalidad bruta que supera el 3 %.2
La enfermedad producida por este virus se nombra la COVID-19 y está considerada como el mayor desafío sanitario ocurrido en el mundo desde la conocida como gripe española en 1918.3) Llega a la actualidad con una historia corta que impresiona por la facilidad y la rapidísima velocidad de propagación y la alta tasa de contagio del virus, la cual se eleva aún a partir de personas asintomáticas. Todos los seres humanos son en potencia susceptibles a la infección, y provoca una proporción significativa de casos graves y muertes, en especial a determinados grupos de riesgo. Los ancianos, sobre todo con comorbilidades, tienen un mayor riesgo de muerte. Además, pueden presentarse complicaciones letales, tales como miocarditis fulminante y coagulación intravascular diseminada.4
Aunque está bien documentado que las principales manifestaciones son características de una infección del tracto respiratorio, los datos emergentes indican que debe considerarse como una enfermedad sistémica que involucra múltiples sistemas, incluyendo el cardiovascular, respiratorio, gastrointestinal, neurológico, hematopoyético e inmunológico.4
Las evidencias de alteraciones en las pruebas de laboratorio de rutina, son muy inespecíficas, pero existen numerosos estudios que muestran que algunos parámetros hematológicos y hemoquímicos estuvieron alterados y que permitieron evaluar la gravedad de la enfermedad, el pronóstico y dar seguimiento a los tratamientos.2,5
La identificación de nuevas pruebas de laboratorio capaces de discriminar entre los casos graves y los que no, así como los pacientes con alto o bajo grado de mortalidad, permitirá una mejor estratificación del riesgo y una asignación adecuada de los recursos. También la mortalidad de los pacientes con la COVID-19 grave podría reducirse con la observación temprana de las alteraciones de los complementarios y el actuar de manera oportuna. La utilización de biomarcadores o pruebas tempranas que ayuden al diagnóstico y alerten sobre el progreso de la enfermedad, sería de mucha utilidad.
Ante esta problemática, el presente estudio se propone describir los parámetros de laboratorio clínico, en pacientes diagnosticados con la COVID-19.
MÉTODOS
Se efectuó un estudio descriptivo en pacientes ingresados en el Hospital Militar “Comandante Manuel Fajardo Rivero”, de Villa Clara, diagnosticados con la COVID-19, durante los meses de marzo y abril del 2020.
Se seleccionaron 82 pacientes mayores de 18 años, que tuvieran completos los análisis del laboratorio clínico de interés, en los primeros 7 días de evolución de la enfermedad. Los parámetros hematológicos analizados fueron: la hemoglobina, el recuento de glóbulos blancos (WBC), el conteo absoluto de neutrófilos (NEU), el conteo absoluto de linfocitos (LYM), el conteo de plaquetas evaluados en un complejo hematológico Spincell, la eritrosedimentación y el dímero D.
Se analizaron muestras de suero, para determinar los analitos: creatinina, urea, alanina aminotransferasa (ALT), aspartato aminotransferasa (AST), γ-glutamil transpeptidasa (GGT), fosfatasa alcalina (ALP) y lactato deshidrogenasa (LDH) en un analizador químico Spin200E. La obtención de las muestras de sangre fue realizada con las debidas condiciones de bioseguridad y se realizó el procesamiento analítico cumpliendo los requisitos normados para estos procederes pertenecientes a la fase preanalítica en el laboratorio clínico.
Se determinaron, además, indicadores de la respuesta inflamatoria sistemática, que se investigan como predictores útiles para el pronóstico de los pacientes: la relación neutrófilos/ linfocitos (LNR) y la relación de plaquetas/linfocitos (PLR).
Se estudiaron variables demográficas y clínicas, obtenidas de las historias clínicas: edad, sexo, comorbilidades, reporte de paciente (grave o no grave) y estado al egreso (vivo o fallecido).
El procesamiento estadístico se realizó mediante el paquete SPSS 20.0 para Windows. Se calcularon medias, desviaciones estándar y porcentajes. La relación entre las variables cualitativas se determinó mediante el estadístico Ji cuadrado. Si p ≤ 0,05 se consideró que existen diferencias significativas; si p ≤ 0,001 existen diferencias muy significativas. La recopilación de los datos fue anónima para respetar el principio de confidencialidad y la información recogida solo se empleó con fines científicos declarados para este trabajo.
RESULTADOS
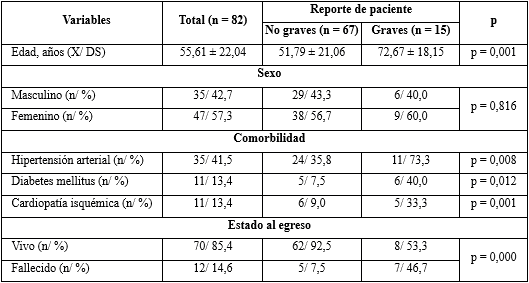
En la tabla 1 se muestra la caracterización demográfica y clínica de los pacientes. La edad promedio fue de 55,61 ± 22,04 años, en su mayoría del sexo femenino (57,3 %), con predominio de los pacientes hipertensos, con 41,5 % en relación a otras comorbilidades.
Se observó que 15 (18,3 %) de los pacientes, en el momento de la investigación, estaban reportados de grave, con una edad promedio de 72,67 ± 18,15 años, y las comorbilidades más frecuentes fueron la hipertensión arterial (73,3 %), la diabetes mellitus (40 %) y la cardiopatía isquémica (33,3 %). Hubo una relación muy significativa entre los casos graves, con la edad avanzada y la presencia de comorbilidades.
El 85,4 % de los pacientes egresaron vivos (el 14,6 % falleció). Poco menos de la mitad de los graves (46,7 %) murieron en el transcurso de su enfermedad y un 7,5 % de los no graves, también fallecieron. Las variables estado al egreso y el reporte de paciente, mostraron diferencias muy significativas. Excepto la variable sexo, en el resto se encontraron diferencias significativas (p < 0,05).
Tabla 1 Características demográficas y clínicas en los pacientes con la COVID-19, según el reporte de paciente en el momento de la extracción
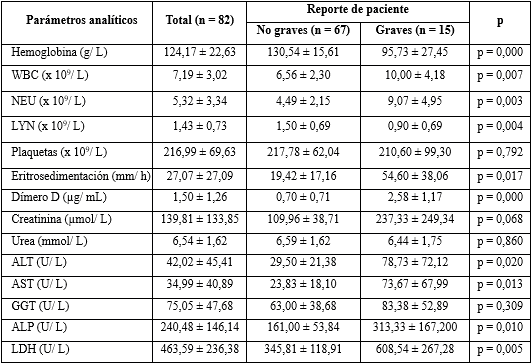
En la tabla 2 se muestran los valores medios, obtenidos para cada análisis de laboratorio, ajustados por el reporte de paciente y el valor medio general de todos los enfermos estudiados.
En los valores medios de los parámetros del laboratorio analizados, se observó que de manera general, el conteo de linfocitos se mostró inferior a los límites de referencia reportados, por el método utilizado. Por el contrario, la eritrosedimentación, el dímero D, la creatinina, la GGT y la LDH, se mostraron por encima de los valores normales.
La hemoglobina presentó una media inferior en los pacientes graves de 95,73 ± 27,45 g/L, no así en los no graves, cuya media estuvo dentro de los valores normales para ambos sexos, lo cual es muy significativo (p = 0,000) al relacionarla con la gravedad de los pacientes.
El conteo global de leucocitos fue más alto en los casos reportados de graves, con una mayor desviación estándar que resultó significativa. Cuando se analizó el diferencial, es decir, el conteo absoluto de neutrófilos y de linfocitos, se encontró que las diferencias fueron muy significativas para ambos parámetros, en relación con el reporte de paciente, pues como se observa, la neutrofilia (9,07 ± 4,95) y la linfopenia (0,90 ± 0,69) caracterizaron a los pacientes graves.
Las plaquetas por su parte, no mostraron diferencias significativas desde el punto de vista estadístico.
La eritrosedimentación presentó medias elevadas para los límites de referencia. En cuanto al reporte de la condición del enfermo, así como el dímero D, presentaron valores mucho más altos en los pacientes graves, con diferencias estadísticamente significativas en ambos parámetros de laboratorio.
Al asociarse los valores medios de la creatinina, la urea y la GGT, con el reporte de pacientes, se observó que no hubo diferencias significativas, sin embargo, la creatinina mostró una media superior (237,33 ± 249,34) en los pacientes graves y la GGT se mantuvo elevada, independientemente de la condición de los casos; no ocurrió así para la urea. Las enzimas hepáticas ALT, AST y ALP estuvieron dentro de los valores normales en los no graves, pero en los graves hubo aumento de las medias a 78,73 ± 72,12; 73,67 ± 67,99 y 313,33 ± 167,200 respectivamente.
Otra de las enzimas estudiadas fue la LDH, que evidenció valores elevados (608,54 ± 267,28) en los pacientes graves, con diferencias estadísticamente significativa (p = 0,005).
En la figura 1 se muestra la representación de las medias de los valores de la LNR y la PLR, en relación con la gravedad del enfermo y el estado al egreso. La LNR es alta, con diferencias estadísticamente significativas para ambas variables contrastadas. Igual ocurrió con el índice plaquetas/ linfocitos.
DISCUSIÓN
Los exámenes de rutina de laboratorio clínico revelan alteraciones en pacientes con la COVID-19. La utilización de biomarcadores o pruebas tempranas, que ayuden al diagnóstico y alerten sobre el progreso de la enfermedad, sería de gran utilidad.
Del total de pacientes estudiados solo el 18,3 % llegó a la condición de grave y el 14,6 % falleció por complicaciones propias de la enfermedad, muy parecido a lo presentado por Liu y otros6 en un estudio en el cual el 12,8 % de sus pacientes fallecieron.
Para Yang y otros7 la media de edad de los pacientes graves, es de 57,9 ± 11,8; también para Acosta y otros8) la edad promedio fue de 53,5 años, muy por debajo de la que se presenta en estos resultados. A criterio de los autores, el hecho de que fuera más frecuente la gravedad en pacientes con una edad media de 72,67 ± 18,15 años se debe a la implementación de protocolos de tratamiento adecuados, así como una pesquisa activa que logró diagnosticar precozmente la enfermedad, desde los casos asintomáticos.7,8
En correspondencia con otras revisiones, es evidente la comorbilidad como factor agravante. Se observa una evolución tórpida en aquellos enfermos en quienes se asocia la presencia de enfermedades crónicas. Las más frecuentes fueron la hipertensión arterial y la diabetes mellitus.4,7,8
Terpos y otros5) resumieron los hallazgos y complicaciones de la COVID-19, expuestas por varios autores. Encontraron que la linfopenia se puede considerar como un hallazgo de laboratorio cardinal en la mayoría de los pacientes. En esta investigación la media general del conteo global de linfocitos, estuvo en 1,43 ± 0,73 x 109/ L, por debajo del límite inferior de los estimados como valores normales, que acentúa su disminución en los casos complicados.
Durante el curso de la enfermedad la evaluación longitudinal de la dinámica del recuento de linfocitos y los índices inflamatorios, incluida la LDH, la PCR y la IL-6, puede ayudar a identificar los casos con un posible resultado desalentador; una pronta intervención ayuda a mejorar los resultados según Terpos y otros.5
Se describen por otros autores, anormalidades en los exámenes rutinarios, como la disminución de la albúmina sérica, el aumento de la proteína C reactiva, la elevación de la LDH, de las enzimas hepáticas y la disminución de la hemoglobina.5,9,10,11
También los pacientes atendidos por la COVID-19 en el Hospital de Villa Clara presentaron alteraciones de los parámetros de laboratorio significativos, entre los que se encuentran las enzimas AST, ALT, GGT y LDH. Según los autores, es necesario tener en cuenta que estas enzimas pudieran estar elevadas en gran medida por el tratamiento empleado, que en su mayoría es hepatotóxico; no necesariamente está en relación con la enfermedad.
Al analizar por separado la LDH, que es un marcador de daño tisular pulmonar, su incremento pudo estar más relacionado con la neumonía presente en estos casos, así como por las manifestaciones del distress respiratorio.5)
Estudios recientes evidencian que las complicaciones respiratorias de la infección por SARS-CoV-2, se presentaban debido a la elevada concentración sanguínea de citoquinas proinflamatorias. Este fenómeno, que ha sido reportado con mayor frecuencia en pacientes graves y críticos, ha sido denominado como síndrome de liberación de citoquinas. Esto a su vez genera un proceso inflamatorio mantenido a nivel del parénquima pulmonar, el cual, junto con el trastorno de la coagulación local, es responsable del compromiso respiratorio.12
Dichos mecanismos no han podido ser descritos del todo, sin embargo, se puede resumir que la tormenta de citoquinas y la activación exagerada de macrófagos, constituyen parte importante en el desarrollo de las trombosis. De ahí una explicación posible de por qué el dímero D se encuentra elevado en la mayoría de los casos, como ocurrió en los pacientes investigados.9,12
También se vio alterada la hemoglobina, el conteo global de linfocitos, la eritrosedimentación, la creatinina. Por su parte Acosta y otros8 reportan otras anormalidades, que corresponden con complicaciones propias de la enfermedad: incremento progresivo de la creatinina, de la bilirrubina, de las troponinas cardiacas y la prolongación del tiempo de protrombina.
Los cambios dinámicos de plaquetas, dentro los primeros 7 días después del ingreso, se correlacionan negativamente con el pronóstico, según Liu y otros;13 pero en los pacientes del estudio, no se mostraron diferencias significativas, al asociar el conteo de plaquetas y la condición de gravedad. Al hallar la PLR se vio significación estadística al contrastarlo con el reporte de paciente y el estado al egreso, con cifras medias muy elevadas de 540,78 y 492,89 en los pacientes que fallecieron y en los graves respectivamente.6
Tanto la LNR como la PLR mostraron valor pronóstico para determinar los casos graves. Según otro estudio de Liu y otros,13 observan que una RLN < 3,13 es indicador de bajo riesgo y ≥ 3,13 es un indicador de alto riesgo. Enunciaron que la aplicación temprana de la LNR combinada con la edad (< o > 50 años) es beneficiosa para la clasificación de pacientes, ayuda a aliviar la escasez de recursos médicos y materiales de cuidado crítico. Esto sería muy útil para estudios posteriores, incluso para actuar oportunamente y evitar las complicaciones. Muy superior a ese valor, se encontró los valores medios de la LNR, de 22,8 e igual cifra en los pacientes que tuvieron una evolución fatal.
Yang y otros7 reportan la LNR en los pacientes graves de su estudio, que fue de 20,7 ± 24,1 y el PLR de 436,5 ± 329,2, lo que demostró una vez más la importancia de tener en cuenta, en la valoración médica del paciente, estos dos indicadores consideradas como herramientas prácticas para evaluar el pronóstico y la gravedad de los síntomas clínicos en pacientes con la COVID-19.7
Basbus y otros,14 valoran el índice neutrófilo - linfocito como factor pronóstico de la COVID-19, demuestran también que el rol de la LNR como predictor de gravedad, radica en el aumento de la probabilidad posttest de presentar un curso grave de la COVID-19 con un INL ≥ 3.
En la actualidad no existe ningún biomarcador que sea lo suficientemente sensible ni específico para establecer un diagnóstico de la COVID-19, o para predecir de forma pragmática su curso clínico. A medida que se disponga de más datos y se informen de más estudios, permitirá que surjan parámetros de laboratorio que ayuden a discernir entre los casos graves y los no graves, incluso entre los pacientes que tienen más posibilidades de morir por un alto grado de riesgo. Las bondades del laboratorio clínico representan un apoyo primordial para el área médica, por eso numerosos investigadores han observado que los exámenes rutinarios revelan una serie de anormalidades en los pacientes con la COVID-19, tal como resulta en el presente trabajo.
Para seguir combatiendo la pandemia de la COVID-19, aún queda mucho camino por recorrer, la situación epidemiológica es cambiante y por ello las medidas adoptadas en relación con el diagnóstico también deberán ser dinámicas. Planificar los análisis de laboratorio y explotar al máximo la capacidad diagnóstica, actuar con rapidez frente a situaciones emergentes en el contexto de la pandemia, parece un camino correcto a seguir trabajando.15
Los pacientes estudiados se caracterizaron por presentar una edad media de 55,61 años en su mayoría del sexo femenino, con hipertensión arterial como la comorbilidad más frecuente. Predominaron los que egresaron vivos y los reportados de no graves. Se observó disminución de los valores medios de la hemoglobina y del conteo global de los linfocitos, sobre todo en los casos graves; así como aumento de los analitos dímero D, creatinina, ALT, AST, ALP, GGT, y LD. Tanto la LNR como la PLR mostraron valores medios altos, con relación al indicador de alto riesgo referenciado, sobre todo en los pacientes graves y en quienes fallecieron.