INTRODUCCIÓN
La aspergilosis se refiere a una variedad de afecciones causadas por Aspergillus spp, un moho saprofítico ubicuo que se encuentra comúnmente en el suelo, agua, plantas y materiales de construcción.1 Su transmisión es por la inhalación de esporas de hongos, y principalmente afecta a individuos inmunocomprometidos o aquellos inmunocompetentes con enfermedades pulmonares crónicas subyacentes. El Aspergillus fumigatus produce la mayoría de las infecciones en humanos, seguido de Aspergillus flavus, Aspergillus terreus, Aspergillus niger y Aspergillus nidulans.2) La respuesta del huésped después del contacto con este microorganismo, determinará si el huésped eliminará el microorganismo sin desarrollar enfermedad, si será colonizado, infectado o desarrollará una enfermedad por hipersensibilidad.3
La sensibilización es un proceso bidireccional con respuesta humana a las esporas inhaladas en un extremo y germinación de conidias, con formación y persistencia de hifas en el tracto respiratorio, en el otro extremo. La interacción humano-hongos conduce colectivamente, por último, a la manifestación de la enfermedad.4
La aspergilosis del tracto respiratorio puede tener varias manifestaciones, desde trastornos de hipersensibilidad hasta enfermedades diseminadas invasivas, las cuales se pueden clasificar en tres categorías: aspergilosis alérgica, colonización saprófita y aspergilosis invasiva. La aspergilosis alérgica se puede subdividir en tres formas diferentes: aspergilosis broncopulmonar alérgica (ABPA), asma inducida por Aspergillus (AIA) y sinusitis alérgica por Aspergillus (AAS).5
La ABPA fue descubierta por el Dr. K.F. Hinson en 1952. En 1968, fue diagnosticada por primera vez en los Estados Unidos y solo después fue reconocida a escala mundial.5,6) Es una infección fúngica del pulmón debido a una reacción de hipersensibilidad a los antígenos de Aspergillus fumigatus después de la colonización en las vías respiratorias. Afecta predominantemente a pacientes con asma bronquial y fibrosis quística.7) Se presenta característicamente con broncoespasmo, infiltrados pulmonares, eosinofilia y evidencia inmunológica de alergia a los antígenos de las especies de Aspergillus.7,8,9
Cuba, por sus características geográficas, tiene una biodiversidad micológica muy amplia y el género Aspergillus está entre los de mayor frecuencia de aparición en los estudios de aeromicota urbana. Sin embargo, existe escasa información sobre la incidencia de la aspergilosis pulmonar crónica (APC). Según San Juan Galán y otros,10 el Laboratorio Nacional de Referencia de Micología del Instituto de Medicina Tropical “Pedro Kourí” tiene como proyecciones futuras realizar un estudio sobre la incidencia de la APC y otras micosis asociadas a la infección por Aspergillus en colaboración con diferentes hospitales de Cuba.
Se realizó una revisión bibliográfica temática, observacional y retrospectiva. Se accedió a las bases de datos PubMed/MEDLINE, SciElo, ReserchGate, Scopus, ScienceDirect, Redalyc, Latindex, Web of Science y LILACS. La búsqueda de los artículos científicos se realizó utilizando los descriptores siguientes: Aspergillus fumigatus; aspergilosis broncopulmonar alérgica; hipersensibilidad; allergic bronchopulmonary aspergilosis; aspergilose broncopulmonar alérgica; pulmonary aspergilosis; aspergilose pulmonar; hypersensitivity; hipersensibilidade. Se incluyeron los artículos escritos en español, inglés o portugués, que informaron sobre la temática relacionada con aspergilosis broncopulmonar alérgica, publicados durante el período de 1988 a 2020. La inclusión o no de un artículo se decidió, primero, por la lectura del título y el resumen y segundo, con la lectura del texto completo. Se descartaron aquellos con criterios de exclusión (artículos que registraron resultados en cadáveres o estudios en animales). Los artículos seleccionados se sometieron a la evaluación de las variables (tipos de diseños metodológicos reportados en los artículos, aspectos metodológicos generales propios de cada uno de los diseños encontrados y nivel de calidad de la investigación) Tanto la inclusión como la evaluación de las variables se llevaron a cabo por dos revisores de forma independiente. Con estos criterios fueron seleccionados 36 artículos nacionales e internacionales que incluyeron artículos originales, revisiones bibliográficas, estudios de intervención, revistas y anuarios estadísticos.
De forma particular, la ABPA con frecuencia se subdiagnostica y el diagnóstico se hace varios meses o años después del inicio de los signos y síntomas. Por tanto, el objetivo de este trabajo ha sido actualizar los conocimientos en el diagnóstico y manejo de esta enfermedad.
DESARROLLO
El género Aspergillus se compone de un grupo grande de especies distribuidas de forma ubicua. A pesar de ser microorganismos saprófitos, causan infecciones tanto en pacientes inmunocomprometidos como inmunocompetentes, con un amplio espectro de localizaciones que van desde formas pulmonares hasta infecciones oculares y diseminadas o sistémicas.11 Este género es probablemente el taxón fúngico de mayor distribución en el mundo por la fácil diseminación de sus esporas y por la amplia gama de sustratos que puede degradar.12
El Aspergillus fumigatus, es el más ubicuo, y sus esporas constituyen del 1 al 22 % de todas las esporas del aire, que se propagan sin modo especial de transporte. Las esporas son hidrofóbicas, con diámetro de 2 a 4 mm y pueden incluso llegar a los alvéolos. Producen aproximadamente el 90 % de las infecciones invasivas en el pulmón. El A. fumigatus se distingue de otros hongos en la patogenia pulmonar.4
Se cree que la ABPA afecta a más de 4 millones de personas.13 Según la Organización Mundial de la Salud (OMS), actualmente la carga global real supera los 4,8 millones de pacientes. Por región, la OMS estima la carga de la ABPA: Europa, 1 062 000 pacientes (297 000 - 1 487 000); las Américas, 1 461 000 (409 000 - 2 045 000); Mediterráneo Oriental, 351 000 (98 000 - 491 000); África, 419 000 (117 000 - 587 000); Pacífico occidental, 823 000 (230 000 - 1 152 000); Sudeste asiático, 720 000 (202 000 - 1 009 000). A nivel mundial, alrededor de 4 837 000 pacientes con asma activa de 193 000 000 desarrollarán la ABPA, que tiene una tasa de prevalencia de 2,51 %.6
Se presenta entre la tercera y quinta década de la vida. También es común en niños. Por lo general, se encuentra en asmáticos graves y pacientes con fibrosis quística,14,15 en los cuales la prevalencia es de aproximadamente 13 % y 9 %, respectivamente.16
Otros autores informan que la prevalencia estimada de la ABPA en pacientes con fibrosis quística, es del 3 % al 25 % en adultos, y del 8 % al 10 % en niños, con una prevalencia general del 8,9 %.17
La APC tiene una presentación clínica similar a otras enfermedades respiratorias, por lo que es difícil de diagnosticar. La asistencia clínica en Cuba es notable, sin embargo, existen muy pocos reportes de esta enfermedad en el país y, por lo tanto, se sospecha poco y se confunde con otras enfermedades crónicas como la tuberculosis pulmonar.18
Según el Anuario Estadístico de Salud de Cuba,19 las enfermedades crónicas de las vías respiratorias inferiores, ocupan el sexto lugar entre las causas de mortalidad en el país, con 4310 defunciones en 2019; 209 más que en 2018. Además, en 2019 la incidencia de tuberculosis pulmonar por 100 000 habitantes fue de 4,8 con un total de 537 casos, discretamente menor que en 2018, cuando la tasa por 100 000 habitantes fue de 5,1. Cuba es considerada un país con baja incidencia de tuberculosis pulmonar en la región americana, según informes de la OMS.20 Estimaciones de incidencia y prevalencia de la APC, basadas en estos datos, podría ayudar a comprender la magnitud de este problema.
La patogénesis de la ABPA permanece incompleta. Las esporas de A. fumigatus que se inhalan en cantidades suficientes, actúan como alergenos. Normalmente, un nivel bajo de IgG contra antígenos fúngicos en la circulación y la baja IgA secretora antifúngica en el líquido broncoalveolar sugieren que las personas sanas pueden eliminar eficazmente las esporas de hongos.21,22
En individuos susceptibles, el A. fumigatus coloniza las vías respiratorias, germina y desarrolla tapones de moco que consisten en hifas; provocan una respuesta alérgica e inflamatoria crónica que en última instancia puede provocar daños en los tejidos y las vías respiratorias, bronquiectasias y/o fibrosis pulmonar.1
Según Beltrán Rodríguez y otros,18) la colonización de las vías respiratorias por especies de Aspergillus podría ser una amenaza para el desarrollo de aspergilosis después de una enfermedad pulmonar obstructiva crónica (EPOC), en la cual existe una función pulmonar deficiente y es habitual el uso de corticosteroides.
En su estudio, Patel y otros,23 refieren que en la ABPA, hay un mayor número de células T CD4 (fenotipo tipo 2) en el lavado broncoalveolar, hay aumento de función de la interleucina-4 , que provoca la activación de las células B CD20 y la regulación positiva de CD23 (el receptor de IgE de baja afinidad, Fc RII). Estos autores también refieren que, el A. fumigatus puede servir como factor de crecimiento de eosinófilos, que potencia los efectos de IL-3, IL-5 y factor estimulante de colonias de granulocitos (G-CSF).
Se conocen cinco etapas o estadios de la ABPA: (I) aguda, (II) remisión, (III) exacerbación, (IV) asma dependiente de corticosteroides, (V) enfermedad pulmonar fibrótica, que han sido descritas de forma detallada por múltiples autores,5,6,23) para estadificar al paciente según características clínicas, hallazgos radiográficos y niveles de IgE (tabla 1). El paciente con ABPA puede transitar de un estadio a otro dependiendo del curso de su enfermedad. Al respecto, Vlahakis y otros,24) afirman que la historia natural, la progresión, la remisión y las recurrencias de la ABPA no se comprenden bien. No obstante, la progresión de la enfermedad en estadio V a fibrosis pulmonar, puede prevenirse si los pacientes mantienen una terapia con dosis bajas de esteroides. Las personas con un FEV1 persistentemente por debajo de 0,8 L tienen un peor pronóstico.
Las manifestaciones clínicas de la ABPA generalmente se presentan en pacientes con asma difícil de controlar, sin embargo, el espectro de presentación puede ser variable. Los pacientes se quejan de síntomas que incluyen: disnea, sibilancias, mucosidad productiva espesa, tos, fiebre baja, malestar y, en algunos casos, hemoptisis.2) Recientemente, Tetikkurt y otros,25 plantearon que, episodios repetidos de obstrucción bronquial, inflamación e impactación mucoide, puede conducir a bronquiectasias, fibrosis, obstrucción del flujo de aire y compromiso respiratorio; que la mayoría de los pacientes experimentan problemas de larga duración y a menudo un perfil de asma difícil, mientras que otros pueden experimentar síntomas leves o permanecen relativamente asintomáticos.
Tabla 1 Estadificación de la ABPA, hallazgos radiográficos y niveles de IgE correspondientes
| Estadios | Descripción | Hallazgos radiográficos | Concentración de IgE total |
| Estadio I: Agudo | Paciente diagnosticado con ABPA. Se pueden observar IgE específica de Aspergillus, anomalías radiológicas, eosinofilia en sangre periférica y precipitinas séricas específicas de Aspergillus | Puede haber infiltrados homogéneos, taponamiento de moco, consolidación o colapso lobular, apariencia de "árbol en brote", bronquiectasias | En general elevada |
| Estadio II: Remisión | Paciente asintomático con asma controlada subyacente pero sin nuevos infiltrados radiológicos y sin aumento en la IgE total durante un mínimo de seis meses | No se observan infiltrados | Nivel de IgE normal o elevado pero inferior al nivel de etapa I |
| Estadio III: Exacerbación | En la radiografía aparecen nuevos infiltrados pulmonares con eosinofilia en sangre periférica y duplican los niveles de remisión de IgE | Los mismos hallazgos que en la etapa aguda | Los niveles elevados de IgE generalmente duplican el nivel de la etapa II |
| Estadio IV: Asma esteroide-dependiente | Los pacientes se vuelven dependientes del corticosteroide y no pueden disminuirlo por completo | No se ven infiltrados. Puede haber atelectasia o hiperinflación por asma. Si se produce una exacerbación, los hallazgos se parecerán a la etapa I | Nivel de IgE normal o elevado |
| Estadio V: enfermedad fibrótica en etapa terminal | Radiografías de tórax y tomografías computarizadas mostrarán fibrosis irreversible y cavitación crónica. Los parámetros serológicos suelen ser negativos | Cicatrices pulmonares, hiperinflación, infiltrados crónicos, fibrosis o cavidades o hallazgos fibrocavitarios | Nivel de IgE normal o elevado |
Fuente: tomado de Patel y otros6
ABPA: aspergilosis broncopulmonar alérgica; IgE: inmunoglobulina E; CT: tomografía computarizada
En un estudio piloto en Cuba,18 sus autores refieren que, los esquemas para el diagnóstico de enfermedades respiratorias a menudo subestiman las infecciones por hongos, especialmente la APC, porque no se realizan las pruebas adecuadas.
Peccini y otros,26 plantean que la ABPA con frecuencia se subdiagnostica y el diagnóstico, generalmente, se hace de forma tardía, debido a que las infecciones bacterianas más comunes y recurrentes tienen superposición clínica, radiográfica y características de laboratorio.
Un reciente estudio en China,27 arrojó que hay tres posibles razones para que el diagnóstico sea erróneo: primero, las diversas presentaciones clínicas de la ABPA; segundo, algunos pacientes carecen de los antecedentes de asma e incluso no tienen síntomas de obstrucción del flujo de aire al momento del diagnóstico; tercero, son los síntomas similares y los hallazgos radiológicos entre la ABPA y la tuberculosis pulmonar.
Tampoco existe una prueba individual que establezca el diagnóstico, se basa en manifestaciones clínicas clásicas, hallazgos radiográficos y hallazgos inmunológicos.
La prueba cutánea de Aspergillus es la investigación más utilizada para diagnosticar la sensibilización a A. fumigatus y revela hipersensibilidad cutánea inmediata a este microorganismo. Una reacción de hipersensibilidad positiva tipo I es típica de la ABPA y representa la presencia de anticuerpos IgE específicos de A. fumigatus.
Un estudio iraní,1) da a conocer que la prevalencia de la reactividad de esta prueba en pacientes con asma varía de 16 % a 45 % en todo el mundo. Esta variación puede explicarse por las diferencias en los extractos de A. fumigatus utilizados para las pruebas cutáneas y las diferencias en la humedad local, que está relacionada con la sensibilización fúngica.
También se pueden encontrar anormalidades de la sangre en pacientes con la ABPA como: IgE sérica total elevada (generalmente más de 1000 UI/ mL), IgE sérica específica elevada a A. fumigatus, presencia de precipitinas séricas (por difusión en gel) o de IgG sérica específica elevada a A. fumigatus, eosinofilia en sangre periférica (a menudo ausente si el paciente toma corticosteroides orales o inhalados).7
Según Gao y otros,2 los niveles de IgE específicos de A. fumigatus son la mejor prueba de detección para la ABPA y son más sensibles que la prueba cutánea de Aspergillus, pero, lamentablemente en Cuba, no existe disponibilidad para esta prueba en la mayoría de los laboratorios de los centros de salud.
Otro referente para diagnóstico, es la prueba de activación del basófilo. Un estudio sobre la evaluación de la respuesta celular para el diagnóstico de la micosis broncopulmonar alérgica en pacientes con fibrosis quística,28) dio a conocer que debido a que los basófilos están involucrados en el daño del tejido pulmonar, una fuerte activación de basófilos ex vivo podría no solo ser un marcador indirecto de una reacción inmune ligada a IgE, sino también un marcador directo de la enfermedad pulmonar.
La radiografía de tórax tiene una sensibilidad del 50 % para el diagnóstico de la ABPA.7) Patel y otros,23 plantean que pueden mostrar infiltrados transitorios o permanentes (Fig. 1) y, cuando es avanzado, puede mostrar fibrosis pulmonar, cavitación, lóbulos superiores contraídos y colapso lobular. Gao y otros,2 describen estos infiltrados transitorios o permanentes consistentes con la ABPA como características que incluyen opacidades pulmonares, "sombras de la línea de tranvía" que indican engrosamiento de la pared bronquial, sombras de "dedo en guante" y "pasta de dientes" por la impactación mucosa que causan los bronquios dilatados.
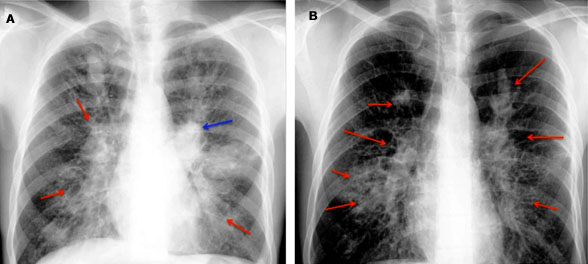 Fuente: Tomado de Patel AR y otros.5
Fuente: Tomado de Patel AR y otros.5
Fig. 1 Rx simple de tórax de un paciente con ABPA. A: opacidad perihiliar del lado izquierdo (flecha azul) junto con infiltrados no homogéneos (flechas rojas) en todas las zonas de ambos campos pulmonares, vistos en casos agudos y etapa de remisión. B: cuatro meses después, resolución espontánea de la opacidad perihiliar del lado izquierdo con un aumento de infiltrados no homogéneos (flechas rojas).
Según Sisodia y otros,7) la tomografía computarizada de alta resolución (TCAR) de tórax es la investigación de elección para detectar la distribución de bronquiectasias y otras anormalidades que son indetectables en una radiografía de tórax. Por ejemplo: nódulos centrolobulares, bronquiectasias centrales con apariencia de “anillo de sello”, “collar de perlas”, “rail de tren”, “árbol en brote” y tipo “circulares”, además de la impactación mucoide. (Fig. 2).
 Fuente: Tomado de Patel y otros.5
Fuente: Tomado de Patel y otros.5
Fig. 2 Tomografía computarizada de tórax que muestra: A: bronquiectasia central en caso de ABPA con apariencias de “anillo de sello”, “collar de perlas”, impactación mucoide y bronquios dilatados. B: bronquiectasia proximal tipo cilíndrica y tipo “raíl de tren”. C: bronquiectasia proximal tipo “árbol en brote”, tipo “raíl de tren” y tipo “circulares”.
Según los hallazgos de la TCAR, la ABPA puede subclasificarse en 3 tipos: los ABPA serológicos o seropositivos de la ABPA (ABPA-S), las bronquiectasias centrales en la ABPA (ABPA-CB) y el asma grave con sensibilidad fúngica (SAFS)6) (tabla 2).
Tabla 2 Subclasificaciones de la ABPA según la TCAR
| Clasificación | ABPA-S | ABPA-CB | SAFS |
|---|---|---|---|
| Hallazgos | Pacientes con asma que cumplen con los requisitos mínimos de la ABPA pero no tienen bronquiectasia central o periférica | Pacientes que cumplen con los criterios mínimos para la ABPA y también tienen bronquiectasias centrales | Pacientes con asma grave y sensibilidad a los hongos, pero que no cumplen con los criterios de la ABPA |
Fuente: tomado de Patel y otros6
Las pruebas de función pulmonar ayudan a medir la gravedad del deterioro de la función pulmonar y a monitorear su mejora en el seguimiento. Según algunos autores,7 puede existir un defecto ventilatorio obstructivo en las tapas I, III, IV y, a menudo en la V y puede no correlacionarse con la duración de la ABPA o asma.
En la broncoscopía la impactación mucoide puede ser evidente y los cepillados bronquiales pueden revelar moco que contiene agregados de eosinófilos, hifas fúngicas y cristales de Charcot-Leyden derivados de eosinófilos. El hallazgo de tapones de moco llenos de hifas se considera patognomónico para la ABPA.7
En relación al cultivo de esputo para el A. fumigatus, Beltrán Rodríguez y otros,18) refieren que, según lo declarado por la Infectious Disease Society of América, el cultivo micológico de esputo tiene una baja frecuencia de recuperación. Incluso los cultivos de esputo positivos son cuestionables, pues el Aspergillus está muy extendido en el medio ambiente y puede ser parte de la microbiota de la cavidad oral y las vías respiratorias superiores.
Para el diagnóstico de la ABPA, y teniendo en cuenta las características clínicas y hallazgos radiográficos y de laboratorio mencionados anteriormente, se han propuesto múltiples criterios diagnósticos, pero los más conocidos son: los criterios de Rosenberg-Patterson (propuestos en1977),29) que fueron los primeros en aparecer; están compuestos por criterios mayores y menores. Están, además, los propuestos por la Sociedad Internacional de Micología Humana y Animal (ISHAM) (del año 2013)5,30,31) que proponen condiciones predisponentes, criterios obligatorios y otros criterios (tabla 3).
Tabla 3 Criterios de diagnóstico para la ABPA
| Criterios de Rosenberg-Patterson (1977) | Grupo de trabajo ISHAM (2013) |
|---|---|
| Criterios mayores (1) Asma, (2) Presencia de opacidades pulmonares fugaces o fijas en la radiografía de tórax, (3) Reacción cutánea de hipersensibilidad inmediata a Af, (4) IgE sérica total elevada, más de 1000 UI / ml, (5) Anticuerpos precipitantes contra Af, (6) Eosinofilia en sangre periférica, (7) Bronquiectasias centrales o proximales con disminución normal de los bronquios distales. | Condiciones predisponentes (1) Asma, (2) Fibrosis quística Criterios obligatorios (ambos deben estar presentes) (1) Prueba cutánea de |
| Criterios menores (1) Tapones de esputo marrón dorado en el expectorante, (2) Cultivo de esputo positivo para especies de |
Otros criterios (dos de tres al menos) (1) Presencia de anticuerpos IgG contra Af o anticuerpos precipitantes, (2) Presencia de opacidades pulmonares fugaces o radiográficas consistentes con la ABPA, (3) Eosinófilos cuentan más de 500 células / μL en pacientes sin tratamiento previo con esteroides (puede ser un valor histórico) |
Fuente: tomado de Patel AR y otros6
ABPA: aspergilosis broncopulmonar alérgica; Af: Aspergillus fumigatus; IgE: inmunoglobulina E; IgG: inmunoglobulina G; ISHAM: Sociedad Internacional de Micología Humana y Animal.
Una vez confirmado el diagnóstico, el siguiente paso es indicar el tratamiento. Los objetivos del tratamiento en la ABPA, según Patel y otros,6 son controlar los síntomas de asma o fibrosis quística, prevenir o tratar las exacerbaciones pulmonares de la ABPA, reducir o remitir la inflamación pulmonar, y reducir la progresión a enfermedad fibrótica o cavitaria en etapa terminal.
Los fármacos utilizados para el tratamiento de la ABPA son: corticosteroides; drogas antimicóticas; antibióticos y terapia anti IgE.
Los corticosteroides alivian los síntomas y disminuyen la obstrucción del flujo de aire, disminuyen la IgE sérica y los eosinófilos de la sangre periférica. Además, proporcionan resolución de la inflamación pulmonar y evitan el daño pulmonar irreversible. En Cuba, la prednisolona, que se encuentra en el cuadro básico de medicamentos, es lo más comúnmente utilizado para el tratamiento de la ABPA. Suri y otros,32 recomiendan un régimen de 0,5 mg/ kg de prednisolona durante dos semanas seguido de una disminución gradual durante 6 a 8 semanas.
La respuesta clínica al tratamiento con glucocorticoides debe controlarse con mediciones de IgE sérica total y la resolución de las opacidades radiográficas.
El uso de glucocorticoides es especialmente preocupante en pacientes con fibrosis quística ya propensos a diabetes mellitus, osteopenia y retraso en el crecimiento, según afirmaron recientemente Gothe y otros.32
La creciente evidencia respalda el beneficio adicional de los agentes antifúngicos en pacientes con ABPA grave o dependiente de esteroides.32 Estos actúan disminuyendo la carga fúngica que reduce la actividad inflamatoria, como agentes ahorradores de esteroides y disminuyen las exacerbaciones.
Un boletín epidemiológico semanal del Instituto de Medicina Tropical “Pedro Kouri”, en 2017 publicó que los triazoles como voriconazol, itraconazol y posaconazol, están recomendados como el tratamiento de primera línea para los pacientes con aspergilosis pulmonar.11
Chishimba L y otros,33 plantearon en su estudio que el voriconazol (300 a 600 mg/ día) o el posaconazol (800 mg/ día) muestran una mejoría clínica con una reducción en el requerimiento de glucocorticoides orales, una mejora en el control del asma y una disminución en los niveles de IgE.
El voriconazol no se importa a Cuba, pero el itraconazol es una opción adecuada para el manejo de aspergilosis. El itraconazol (vía intravenosa/vía oral) y de manera alternativa anfotericina B liposomal o del complejo lipídico (vía intravenosa) son los antifúngicos usados en el tratamiento de la aspergilosis en todos los centros de salud cubanos.
El uso prolongado del tratamiento antifúngico, está asociado con la aparición de hongos resistentes. Según Lanternier y otros,34) en Europa, las cepas de Aspergillus resistentes a los “azoles” están emergiendo recientemente en determinadas áreas. Emergen hongos pan-resistentes como Mucorales, Scedosporium, Candida, “azol” resistente o nuevos hongos emergentes como Rasamsonia argillacea species o Saprochaeta clavata.
En Cuba, una investigación preliminar sobre el comportamiento de los patrones de sensibilidad en cepas cubanas de las especies de Aspergillus de mayor interés clínico, se encontró que la resistencia a los “azoles” era poco frecuente, lo cual es favorable desde el punto de vista epidemiológico y terapéutico. La resistencia a la anfotericina B, en cambio, fue considerable y ello constituye una alerta.12
Los antibióticos son usados para prevenir o tratar una infección bacteriana secundaria asociada a la ABPA.
Los anticuerpos monoclonales como el omalizumab, son una buena opción alternativa en pacientes con la ABPA y fibrosis quística, en quienes existe la dependencia de esteroides y contraindicaciones a éstos, según informaron Nové-Josserand y otros.35 Este medicamento también tiene un efecto ahorrador de esteroides y disminuye los marcadores inflamatorios sistémicos.
San Juan Galán y otros,11) plantean que el sistema de salud cubano tiene cobertura para el tratamiento de las infecciones fúngicas según lo que indican las entidades reguladoras de salud a nivel internacional. No obstante, el tratamiento de las infecciones por Aspergillus recomienda la necesidad de incorporar algunos medicamentos que en estos momentos no conforman el cuadro básico de medicamentos del país. Estos autores sugieren que incluir el voriconazol como droga de primera elección frente a las formas pulmonares y sistémicas de aspergilosis y la disponibilidad de las equinocandinas para el tratamiento contribuiría a disminuir la morbilidad y mortalidad de estas enfermedades de manera significativa, tal y como sugieren las guías de expertos.
Por último, se considera que el diagnóstico y tratamiento precoz de la ABPA previenen la progresión de la enfermedad a serias complicaciones. No es necesario disponer de laboratorios sofisticados para diagnosticarla. La clave para hacerlo tempranamente es considerarla en cualquier persona asmática con un resultado positivo de la prueba cutánea a Aspergillus, que de manera inexplicable presente eosinofilia en sangre periférica e infiltrados blandos en radiografías o tomografía axial computarizada de pulmón.
El género Aspergillus está entre los de mayor frecuencia de aparición en Cuba, existen muy pocos reportes de aspergilosis broncopulmonar alérgica y, por lo tanto, se sospecha poco y se confunde con otras enfermedades respiratorias crónicas. La aspergilosis broncopulmonar alérgica con frecuencia se subdiagnostica y el diagnóstico se hace varios meses o años después del inicio de los signos y síntomas. Establecer un diagnóstico oportuno e iniciar el tratamiento tempranamente, ayuda a prevenir el desarrollo de bronquiectasias o fibrosis pulmonar en pacientes con la ABPA.














