Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión impresa ISSN 0253-570X
Rev Salud Anim. v.31 n.3 La Habana sep.-dic. 2009
Artículo original
PROPIEDADES ANTIOXIDANTES DE Rhizophora mangle (L.) Y SU RELACIÓN CON EL PROCESO DE CURACIÓN DE HERIDAS EN RATAS
ANTIOXIDANT PROPERTIES OF Rhizophora mangle (L.) AND ITS RELATION WITH THE WOUND HEALING PROCESS IN RATS
Janet Sánchez*, R. Faure*, G. Martínez***, E. Vega**, O. Fernández**
*Grupo de Química-Farmacología-Toxicología, **Grupo de Clínica. Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de Las Lajas, La Habana, Cuba. Correo electrónico: jsanchez@censa.edu.cu; ***Centro de Investigaciones y Evaluaciones Biológicas (CIEB), Instituto de Farmacia y Alimentos (IFAL), Universidad de La Habana, La Lisa, Ciudad Habana, Cuba
RESUMEN
El extracto acuoso de Rhizophora mangle (L.) y su fracción polifenólica mayoritaria fueron evaluados en un modelo de curación de heridas abiertas asépticas en ratas para la determinación de sus propiedades antioxidantes y su efecto sobre el balance redox durante el proceso de reparación de las heridas. La curación de las heridas fue evaluada al séptimo día mediante la medición del área de las herida (mm2) empleando el Sistema de Procesamiento Digital de Imágenes MADIP 3.0 Lab Lapdis del Hospital Carlos J. Finlay. El balance redox durante el proceso de reparación de las heridas se analizó mediante la determinación de los indicadores: superóxido dismutasa, catalasa, glutatión reducido y malonildialdehído en el nuevo tejido cicatricial a los 0, 3, 7 y 14 días de realizadas las heridas. Los resultados demostraron las propiedades antioxidantes in vivo del extracto acuoso de Rhizophora mangle (L.) y que su fracción polifenólica mayoritaria constituyó el principal determinante de dichos efectos. Además el tratamiento de heridas cutáneas con estas preparaciones redujo el área de las heridas (p< 0,05) y modificó el balance redox durante el proceso de reparación del tejido. La actividad antioxidante del extracto y su fracción en el tejido cicatricial puede explicar, al menos en parte, el efecto acelerador de la curación de heridas mostrado por esta planta en estudios previos.
Palabras claves: Rhizophora mangle (L.); polifenoles; antioxidante; curación de heridas
ABSTRACT
Rhizophora mangle (L.) aqueous extract and its major polyphenolic fraction were evaluated in an aseptic open wound healing model in rats in order to evaluate their antioxidant properties and the effect on redox balance during the wound reparation process. Wound healing was evaluated at the seventh day measuring the wound area (mm2) using MADIP 3.0 Lab Lapdis Image Digital Processing System from Carlos J. Finlay Hospital. The redox balance during wound reparation process was analyzed using the indicators: superoxide dismutase, catalase, reduced gluthatione and malondialdehyde in the new tissue at 0, 3, 7 and 14 days after provoking the wounds. The results showed that Rhizophora mangle (L.) aqueous extract had antioxidant properties in vivo and its major polyphenolic fraction was responsable of this effect. Beside, the treatment of cutaneous wounds with these preparations reduced the wound area (p< 0,05) and modified the redox balance during the tissue reparation process. Antioxidant activity of the extract and its fraction can explain, at least in part, the wound healing accelerator effect shown in previous studies.
Key words: Rhizophora mangle (L.); polyphenols; antioxidant; wound healing
INTRODUCCIÓN
El extracto acuoso de la corteza de Rhizophora mangle (L.) (R. mangle) se caracteriza por poseer una composición química compleja, destacándose la presencia de polifenoles (54,78 %), representados en su mayoría por taninos poliméricos (80 %) y taninos hidrolizables (20 %), destacándose la presencia en estos últimos de epicatequina, catequina, ácido clorogénico, ácido gálico y ácido elágico, además se encontraron galotaninos y elagitaninos. De las estructuras no tánicas, se refiere la presencia de carbohidratos (17,5 %) libres y enlazados; ácidos grasos (4,0 %) de cadena larga, saturados e insaturados; fitoesteroles (0,0285 %); componentes volátiles o semivolátiles (70 compuestos) (0,0205 %) y aromas o aceites esenciales no volátiles (1).
En la última década se demostraron varias propiedades farmacológicas del extracto de R. mangle, que incluyen, prevención de la mastitis bovina (2) y eficacia en la curación de las heridas (3, 4), así como propiedades antimicrobianas (5, 6), a su vez resultó exitoso en el tratamiento de las infecciones uterinas (7) y las úlceras gastroduodenales (8), recientemente se demostraron sus propiedades antiinflamatorias (9) y antioxidantes en modelos in vitro (10, 11).
En los últimos años se ha desarrollado un gran número de modelos experimentales para la evaluación de la actividad antioxidante in vivo de una sustancia, en los cuales se reproducen diferentes situaciones fisiopatológicas generadoras de estados de estrés oxidativo. Entre estos modelos se encuentra, el de curación de heridas abiertas asépticas en ratas (12, 13), teniendo en cuenta que el proceso de curación de heridas se inicia por una fase inflamatoria, en la que se generan grandes cantidades de especies reactivas del oxígeno (ERO) (14). Este modelo se utilizó para demostrar el efecto acelerador sobre el proceso de reparación de heridas del CIKRON-V (15), un producto de uso veterinario desarrollado por el CENSA a base del extracto de R. mangle (1).
Teniendo en cuenta que no se conocen las bases farmacológicas que sustentan las propiedades cicatrizantes del extracto de R. mangle y que su actividad antioxidante in vivo aún no ha sido evaluada, pero que en estudios previos este extracto y su fracción polifenólica mayoritaria mostraron propiedades antioxidantes in vitro, evidenciadas por el secuestro de radicales hidroxilo y la actividad quelante de iones de hierro (11) , así como por el efecto inhibidor de la peroxidación lipídica y de la hemólisis de los eritrocitos expuestos a condiciones de estrés oxidativo (10). El objetivo de este trabajo fue determinar la actividad antioxidante in vivo del extracto de R. mangle y su fracción polifenólica mayoritaria, así como el efecto que ambos ejercen sobre indicadores del balance redox durante el proceso de curación de heridas.
MATERIALES Y MÉTODOS
Modelo experimental:
Se empleó un modelo de curación de heridas abiertas asépticas en ratas según se describió previamente (16). Se emplearon cuatro grupos experimentales que se muestran en la Tabla 1.
Se les realizó a los animales cuatro heridas en la región dorso-escapular, dos a cada lado de la linea dorsal, utilizando un biótomo de 8 mm de diámetro (Acuderm, Lauderdale, FL, USA). Las heridas se mantuvieron abiertas y fueron tratadas diariamente, una vez al día, con 0.5 mL de la sustancia correspondiente a cada grupo.
Los tratamientos por herida fueron distribuidos aleatoriamente de forma tal que estuvieran presentes en las cuatro posiciones posibles. Cada grupo estuvo conformado por 9 ratas, lo cual se corresponde con 36 heridas para cada tratamiento. En cada grupo se emplearon 6 animales (24 heridas) para el estudio de los indicadores de la curación de las heridas y 3 animales (12 heridas) para la evaluación de los indicadores del balance redox, excepto el grupo del ácido ascórbico, donde solo se realizó el último estudio.
Determinación de los indicadores de la curación de las heridas:
La curación de las heridas se evaluó mediante la medición del área de las heridas en (mm2), la cual se realizó al séptimo día de realizadas las mismas, utilizando el Sistema de Procesamiento Digital de Imágenes MADIP 3.0 Lab Lapdis del Hospital Carlos J. Finlay. Las imágenes fueron obtenidas con una cámara digital. Los datos de las áreas fueron automáticamente introducidos en una base de datos.
Determinación de los indicadores del balance redox en las heridas:
Los indicadores del balance redox durante el proceso de curación de las heridas evaluados fueron: la actividad de las enzimas antioxidantes Superóxido Dismutasa (SOD) y Catalasa (CAT) (17), los niveles de glutatión reducido (GSH) (18) y la concentración de malonildialdehído (MDA) (19). Para la determinación de los mismos se realizó la escisión del tejido cicatricial a los 0, 3, 7 y 14 días después de realizadas las heridas usando el mismo biótomo, realizando el ponche exactamente sobre el nuevo tejido cicatricial formado. Estos ponches de piel, fueron conservados a -80°C hasta que se realizaron las determinaciones bioquímicas de los indicadores del balance redox, para las cuales las muestras fueron procesadas como previamente se describió (12).
Análisis estadístico:
El análisis estadístico se inició con la detección y eliminación de outliers. Los resultados de la medición de las heridas se procesaron por el Procedimiento del Modelo Lineal Generalizado del SAS, donde el efecto a evaluar fue el tratamiento y el área inicial se usó como covariable con vistas a eliminar la posible influencia del tamaño inicial en el resultado final. Las variables dependientes fueron los valores de las áreas en los diferentes grupos de tratamiento.
La fórmula empleada en el análisis fue la siguiente:
Y 1 a n = A 1 a n + AF1 a n + E
Donde: Y es el tratamiento; A es el área de la herida el día cero (covariable); AF es el área de la herida el día 7; E es el error
Para el análisis del resto de los resultados se utilizó el paquete estadístico STATGRAPHICS versión 4.1 para WINDOWS. Los valores de los indicadores del balance redox se procesaron por un análisis no paramétrico utilizando la prueba de Mann-Whitney U.
En todos los casos se consideró como nivel de significación estadística (p<0,05).
RESULTADOS Y DISCUSIÓN
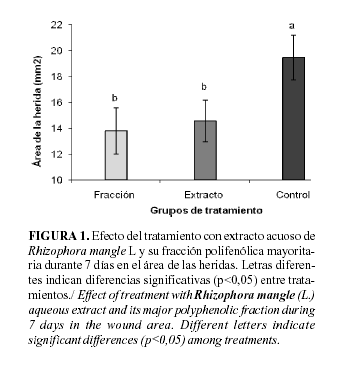
La Figura 1 muestra que las preparaciones de extracto y fracción no mostraron diferencias significativas entre sí en los valores del área de las heridas y resultaron más eficaces en reducir la misma que el grupo control (p< 0,05). Estos resultados corroboran los obtenidos previamente para el extracto de R. mangle por otros autores (3, 4).
Las Figuras 2 A, B, C y D muestran respectivamente el efecto del extracto de R. mangle y su fracción polifenólica mayoritaria sobre la actividad de las enzimas SOD y CAT, así como sobre las concentraciones del GSH y el MDA, evaluados en diferentes momentos del proceso de curación de las heridas. Se aprecia a los 3 y 7 días de realizadas las heridas en todos los grupos de tratamiento, una disminución significativa (p< 0,05) en la actividad de las enzimas SOD y CAT y en las concentraciones de GSH y un incremento significativo (p< 0,05) en la concentración de MDA en el tejido cicatricial, en comparación con los valores obtenidos para estos indicadores en la piel normal (0 días). Estos resultados se corresponden con lo reportado por otros autores (12, 20). Esta disminución fue mucho más marcada a los tres días después de realizadas las heridas, momento que se corresponde con la fase inflamatoria del proceso de curación de heridas, caracterizada por la infiltración de leucocitos PMN y macrófagos en el tejido lesionado, los cuales a la vez que fagocitan los fragmentos celulares y residuos de los tejidos dañados, producen una gran cantidad de ERO (21), por tanto, las fuentes endógenas antioxidantes se consumen para neutralizar las nuevas ERO generadas, y de esta forma mantener el equilibrio redox celular. A su vez estas ERO oxidan a los lípidos presentes en el tejido nuevo formado, incrementando las concentraciones de MDA. Se ha planteado que la producción exacerbada de ERO puede dañar el tejido naciente y entorpecer el proceso de curación de la herida (22).
En los grupos tratados con el extracto, su fracción y el ácido ascórbico, se observó un incremento en las concentraciones de antioxidantes endógenos (p< 0,05) y una disminución de la peroxidación lipídica (POL) (p< 0,05) en el tejido en reparación, con respecto al grupo control, lo cual sugiere que el extracto y su fracción muestran propiedades antioxidantes, dado el hecho de incrementar la actividad de las enzimas antioxidantes, encargadas de la conversión de ERO en moléculas menos perjudiciales, aumentar las concentraciones de GSH, principal reservorio de grupos sulfidrilos y responsable de mantener el equilibrio redox celular, y proteger a los lípidos del daño oxidativo en el tejido naciente. No obstante, se observa una recuperación gradual de estos indicadores de manera total o parcial en el transcurso del tiempo en todos los grupos, tal comportamiento ha sido reportado previamente (12, 13).
Los efectos del extracto y su fracción encontrados para las enzimas SOD y CAT pueden estar asociados a un incremento de la expresión o a un aumento en la actividad de estas enzimas, lo cual ha sido sugerido por otros autores (23, 13).
A su vez las propiedades quelantes de iones de hierro (11) y protectoras sobre el daño oxidativo de los lípidos (10) que mostraron ambas muestras en estudios anteriores empleando modelos in vitro pueden explicar su eficacia en disminuir las concentraciones de MDA in vivo.
Los elevados porcentajes que aporta la fracción a la actividad antioxidante del extracto indican que los compuestos polifenólicos contenidos en la misma, son los principales responsables del incremento de las enzimas antioxidantes SOD y CAT y de las concentraciones de GSH, así como de la inhibición de la POL en el tejido cicatricial. En este sentido existen numerosos reportes en la literatura acerca de los efectos antioxidantes in vivo, relacionados con los indicadores mencionados anteriormente, por extractos de plantas que contienen polifenoles o por compuestos polifenólicos puros. Así, un estudio revela que heridas cutáneas en ratas albinas tratadas por vía tópica con el extracto acuoso de hojas de la planta Seabuckthorn (Hippophae rhamnoides L.) mostraron a los 7 días de tratamiento un incremento significativo con respecto al control, en la concentración de GSH y vitamina C, así como en las actividades de las enzimas SOD, CAT y Glutatión Peroxidasa (GPx), mientras las concentraciones de MDA estaban disminuídas; a su vez también encontraron que este extracto aumentó significativamente el proceso de curación, evidenciado por el aumento de hidroxiprolina, hexosamina y proteínas y la reducción del área de la herida. Los investigadores sugieren que el efecto del extracto de promover la curación puede deberse a un incremento en los niveles de antioxidantes en el tejido de granulación (23). Efectos similares en cuanto a la actividad cicatrizante, el incremento del nivel de antioxidantes, representados por el GSH, la vitamina C y la actividad de la enzima CAT y la disminución de la oxidación de los lípidos fueron obtenidos por el empleo de la flavona de la planta Seabuckthorn (Hippophae rhamnoides L.) en el tratamiento de heridas cutáneas provocadas en ratas (24). En otro estudio se informa que el tratamiento tópico de un extracto de polifenoles del té verde en la piel de ratones expuestos a radiación ultravioleta resultó en una significativa prevención de la disminución de las enzimas antioxidantes: GPx y CAT y de los niveles de GSH, igualmente inhibió la POL y la oxidación de proteínas (25).
Resultados similares a los obtenidos en el presente estudio con el empleo del extracto de R. mangle y su fracción, se han encontrado utilizando otros compuestos con efecto antioxidante en modelos de curación de heridas, así la suplementación de ratas diabéticas con dos preparaciones de vitamina E aumentó la reparación de las heridas y la actividad de las enzimas antioxidantes SOD y GPx en el tejido cicatricial; a su vez ambos redujeron significativamente la POL en el área de las heridas comparado con el grupo control (15). En otro trabajo se informa que la aplicación de Asiaticoside en heridas cutáneas de ratas, un compuesto derivado de la planta Centella asiatica, el cual previamente mostró actividad cicatrizante, incrementó el nivel de los antioxidantes enzimáticos y no enzimáticos, correspondientes a SOD, CAT, GPx, vitamina E y ácido ascórbico, a su vez disminuyó las concentraciones de los peróxidos lipídicos, a los 7 días de tratamiento (13).
CONCLUSIONES
Los resultados del presente trabajo demostraron las propiedades antioxidantes in vivo del extracto acuoso de Rhizophora mangle (L.) y que su fracción polifenólica mayoritaria constituyó el principal determinante de dichos efectos; a la vez que el tratamiento de heridas cutáneas con estas preparaciones modificó el balance redox durante el proceso de reparación y que esta actividad antioxidante del extracto de R. mangle y su fracción en el tejido cicatricial pueden explicar, al menos en parte, el efecto acelerador de la curación de heridas mostrado por esta planta en estudios previos.
REFERENCIAS
1. Sánchez LM, Melchor G, Alvarez S, Bulnes C. Caracterización química y toxicológica de una formulación cicatrizante de Rhizophora mangle L. Rev Salud Anim. 1998;20(2):69-72.
2. Armenteros M. Evaluación de un desinfectante mamario post-ordeño de origen natural [Tesis doctoral]. La Habana: Centro Nacional de Sanidad Agropecuaria, Universidad Agraria de La Habana; 1998.
3. Bulnes C, Fernández O, Navarro D, Marrero E, Rueda D, Figueroa O, et al. Healing effect of a red mangrove extract in open aseptic wounds in rat. Rev Salud Anim. 2001;23(2):102-8.
4. Fernández O, Capdevila JZ, Dalla G, Melchor G. Efficacy of Rhizophora mangle aqueous bark extract in the healing of open surgical wounds. Fitoterapia. 2002;73:564-8.
5. Melchor G, Armenteros M, Fernández O, Linares E, Fragas I. Antibacterial activity of Rhizophora mangle bark. Fitoterapia. 2001;72:689-91.
6. Montes de Oca N, Riverón Y, González R. Evaluation of antimicrobial activity of different extracts of Rhizophora mangle L using five methods. Rev Salud Anim. 2001;23:1-11.
7. Agüero F. Evaluación de un producto natural, a base de Rhizophora mangle L. en la terapia de la endometritis bovina [Tesis doctoral]. La Habana: Centro Nacional de Sanidad Agropecuaria, Universidad Agraria de La Habana; 2004.
8. Sánchez LM, Rueda D, Gómez BC. Gastric antiulcer effect of Rhizophora mangle L. J Ethnopharmacol. 2001;77:1-3.
9. Marrero E, Sánchez J, de Armas E, Escobar A, Melchor G, Abad MJ, et al. COX-2 and sPLA2 inhibitory activity of aqueous extract polyphenols of Rhizophora mangle (red mangrove). Fitoterapia. 2006;77:313- 5.
10.Sánchez J, Melchor G, Martínez G, Sánchez LM, Faure R, Vinardel P. Protective effect of Rhizophora mangle bark on lipid peroxidation and erythrocyte hemolysis. Pharmacognosy Magazine. 2005;1(3):101-4.
11.Sánchez J, Melchor G, Martínez G, Escobar A, Faure R. Antioxidant activity of Rhizophora mangle bark. Fitoterapia. 2006;77:141-3.
12.Gupta A, Singh LR, Raghubir R. Antioxidant status during cutaneous wound healing in immunocompromised rats. Molecular and Cellular Biochemistry. 2002;241:1-7.
13.Shukla A, Rasik AM, Dhawan BN. Asiaticoside induced elevation of antioxidant levels in healing wounds. Phytother Res. 1999;13(1):50-4.
14.Torres R. Curación y cuidado de las heridas. Tratado de cirugía. Nueva Edt. Interam. S.A. de C.V. Mexico. 1986;1:1-17.
15.Musalmah M, Nizrana MY, Fairuz AH, Noor-Aini AH, Azian AL, Gapor MT, et al. Comparative effects of palm vitamin E and á-tocopherol on healing and wound tissue antioxidant enzyme levels in diabetic rats. Lipids. 2005;40:575-80.
16.Melchor G. Efectos cicatrizante y antiséptico del extracto y de una forma farmacéutica obtenida a partir de Rhizophora mangle L [Tesis doctoral]. La Habana: Centro Nacional de Sanidad Agropecuaria, Universidad Agraria de La Habana; 1999.
17.Boehringer M. Biochemical information. A revised biochemical reference sources. Enzymes for routine. First Edition. Boehringer Mannheim: Germany; 1987:80-81.
18.Sedlak J, Lindsay RH. Estimation of total protein-bound and nonprotein sulfhydryl groups in tissue with Ellman´s reagent. Anal Biochem. 1968;25:192-205.
19.Esterbaver H, Cheeseman KH. Determination of aldehydic lipid peroxidation products: malonaldehyde and 4hydroxynonenal. Meth Enzymol. 1990;186:407-21.
20.Shukla A, Rasik AM, Patnaik GK. Depletion of reduced glutathione, ascorbic acid, vitamin E and antioxidant defence enzymes in a healing cutaneous wound. Free Radic Res. 1997;26:93-101.
21.Sen CK, Khanna S, Gordillo G, Bagchi D, Bagchi M, et al. Oxygen, Oxidants, and Antioxidants in Wound Healing: an emerging paradigm. Annals of the New York Academy of Sciences. 2002;957:239-49.
22.Sen CK. The general case for redox control of wound repair. Wound Repair and Regeneration. 2003;11(6):431-38.
23.Gupta A, Kumar R, Pal K, Banerjee PK, Sawhney RC. A Preclinical Study of the Effects of Seabuckthorn (Hippophae rhamnoides L.) Leaf Extract on Cutaneous Wound Healing in Albino Rats. Lower Extremity Wounds. 2005;4(2):88-92.
24.Gupta A, Kumar R, Pal K, Singh V, Banerjee PK, Sawhney RC. Influence of sea buckthorn (Hippophae rhamnoides L.) flavone on dermal wound healing in rats. Molecular and Cellular Biochemistry. 2006;290(1-2):193-98.
25.Vayalil PK, Elmets CA, Katiyar SK. Treatment of green tea polyphenols in hydrophilic cream prevents UVB-induced oxidation of lipids and proteins, depletion of antioxidant enzymes and phosphorylation of MAPK proteins in SKH-1 hairless mouse skin. Carcinogenesis. 2003;24(5):927-36.
(Recibido 5-2-2009; Aceptado 9-7-2009)