Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión impresa ISSN 0253-570X
Rev Salud Anim. vol.35 no.1 La Habana ene.-abr. 2013
ARTÍCULO RESEÑA
Adición de sustancias antioxidantes en los medios de cultivo empleados en la producción in vitro de embriones en mamíferos
Addition of antioxidant substances to culture media used in the in vitro production of mammal embryos
J.R. García-DíazI, J. Romero-AguirregomezcortaII, S. Astiz BlancoIII, S. Ruiz LópezII
IDepartamento de Medicina Veterinaria y Zootecnia. Facultad de Ciencias Agropecuarias. Universidad Central "Marta Abreu" de las Villas. Carretera a Camajuaní km 5,5. Santa Clara (54830), Villa Clara, Cuba. Correo electrónico: juanramon@uclv.edu.cu.
IIDepartamento de Fisiología. Facultad de Veterinaria. Universidad de Murcia. España.
IIIDepartamento de Reproducción Animal. INIA. Madrid. España.
RESUMEN
Dentro de los factores que afectan el desarrollo embrionario in vitro se encuentra el estrés oxidativo, que ha sido atenuado con la adición de sustancias antioxidantes a los medios utilizados en la producción in vitro. Las Vitaminas A y E, adicionadas a los medios de maduración y cultivo in vitro favorecieron el desarrollo embrionario, mientras el ácido ascórbico mostró resultados contradictorios. La adición de cisteína a la maduración y fertilización in vitro, los factores de crecimiento al cultivo in vitro y la combinación insulina-transferrina-selenio a la maduración in vitro, favorecieron el desarrollo embrionario. Los microelementos también se han estudiado como antioxidantes; diferentes niveles de Zn2+ añadidos al medio de maduración in vitro incrementaron los porcentajes de división y de blastocistos. Diferentes concentraciones de Fe2+ y Cu2+añadidas al medio de maduración in vitro no afectaron la tasa de maduración, pero su adición al medio de cultivo in vitro aumentó los porcentajes de embriones a 8 células, mórulas y blastocistos. A pesar de las ventajas de la suplementación de los medios utilizados en la producción in vitro con sustancias antioxidantes, en algunas de estas aún existen aspectos por estudiar que deben constituir la ruta crítica de las investigaciones en este campo, tales como, el tiempo de exposición y las concentraciones óptimas de ácido ascórbico, las necesidades de microelementos de los ovocitos y el embrión en sus diferentes estadíos, sus niveles de inclusión adecuados y el efecto de la suplementación combinada de los mismos y su asociación con otras sustancias antioxidantes.
Palabras clave: desarrollo embrionario, estrés oxidativo, antioxidantes.
ABSTRACT
The oxidative stress is among the factors affecting the embryonic development in vitro. It has been attenuated by adding antioxidant substances to the media used for the in vitro embryo production. Vitamins A and E, added to the maturation and in vitro cultivation media, favored the embryo development, while the ascorbic acid showed contradictory results. The addition of cysteine to the in vitro maturation and fertilization, the use of growth factors in the in vitro cultivation, and the combination insulin-transferrin-selenium during in vitro maturation, favored the embryo development. Microelements have also been studied as antioxidants; different levels of Zn2+ added to the maturation medium in vitro increased the percentage of division and of blastocysts. Different concentrations of Fe2+ and Cu2+ added to the maturation medium in vitro did not affect the maturation rate, but their addition to the cultivation medium in vitro increased the percentage of 8 cell embryos, morulae, and blastocysts. Despite the advantages of the supplementation of the media used in the in vitro production of embryos with antioxidant substances, there are aspects to be deeply studied that should constitute the critical route of investigations in this field such as: the exposure time and optimum concentrations of ascorbic acid, the necessities of microelements by the oocyte and the embryo during the different development phases, their appropriate inclusion levels, the effect of their combined supplementation, and their association with other antioxidant substances.
Key words: embryo development, oxidative stress, antioxidants.
1. INTRODUCCIÓN
La producción in vitro (PIV) de embriones comprende varios procesos fundamentales: la maduración ovocitaria, la capacitación espermática, la fecundación in vitro de los gametos masculino y femenino y por último, el desarrollo embrionario. En todos ellos, concurren una compleja serie de procesos fisiológicos, muchos de los cuales no son aún del todo conocidos.
En la especie bovina, aproximadamente, el 90% de los ovocitos inmaduros de calidad óptima (tipos I y II) alcanzan la metafase II y expulsan el primer corpúsculo polar entre las 16 y 24 horas de comenzada la maduración in vitro (MIV). De los mismos, alrededor del 80% es fecundado y comienzan a dividirse, al menos, hasta el estadio de 2 a 4 células a las 48 horas de realizada la fecundación in vitro (FIV); aunque se reportaron porcentajes inferiores de división (43%) en igual periodo con ovocitos obtenidos mediante ovum pick up (OPU) en la raza Murciano-Levantina (1). No obstante, sólo un 25-40% alcanza el estadio de blastocisto después de 6-7 días de cultivo (2).
Uno de los problemas que afecta a la PIV de embriones es la producción de radicales libres (RL) y en consecuencia el estrés oxidativo, con sus efectos negativos sobre el desarrollo embrionario (3). En general, durante las diferentes etapas por las que ha transitado el desarrollo de la PIV de embriones y especialmente en los últimos años, se ha prestado atención a los elementos antioxidantes, fundamentalmente, los microelementos, vitaminas y otras sustancias con esas propiedades.
Si bien, el suero fetal bovino (SBF) aporta a los distintos medios de PIV de embriones aminoácidos, vitaminas y minerales, entre otros componentes, que pueden estimular y/o inhibir la maduración de ovocitos y el desarrollo embrionario (4); éste también presenta fluctuaciones en sus componentes, dependientes del animal donante y del lote de procedencia del suero. Por tal razón, el empleo de algunas sustancias antioxidantes en los medios de PIV de embriones ha evolucionado progresivamente hasta los momentos actuales y requiere de continuas investigaciones para su perfeccionamiento.
Por ello, el presente trabajo tiene como objetivo contribuir a la proyección de la ruta crítica de la investigación científica sobre la adición de sustancias antioxidantes en los medios utilizados en la PIV de embriones en mamíferos, a partir de los resultados precedentes y sus expectativas.
2. DESARROLLO
2.1. Estrés oxidativo sobre los resultados de la PIV de embriones.
Los RL se generan durante el desarrollo embrionario por procesos endógenos, como son el metabolismo celular normal de los embriones y exógenos como las sustancias químicas añadidas a los medios de cultivo, hiperoxia, exposición a luz, cationes metálicos y espermatozoides, que las defensas antioxidantes naturales de los gametos y embriones son incapaces de neutralizar y que provocan un grave problema en la PIV de embriones, el estrés oxidativo (3).
En su ambiente natural, los ovocitos y embriones están protegidos contra el daño oxidativo por los agentes antioxidantes presentes en los fluidos folicular y oviductal, además de varias enzimas, tales como Cu-Zn superóxido dismutasa (Cu-Zn/SOD), Mn/SOD (EC 1.15.1.1), catalasas (CAT; EC 1.16.3.1), glutatión-peroxidasa (GSH-Px; EC 1.11.1.9) y ceruloplasmina (CP; EC 1.16.3.1) (5), además de las vitaminas A, C y E (6).
Sin embargo, durante la PIV los ovocitos y embriones están expuestos a un ambiente carente de los sistemas de protección descritos y tienden a experimentar mayor estrés oxidativo; originado cuando la producción de RL excede a la capacidad antioxidante, provocando la peroxidación de lípidos de membrana, modificación de lípidos, proteínas y ácidos nucleicos a nivel celular, alteraciones mitocondriales, el bloqueo de las células embrionarias, el agotamiento del ATP y la apoptosis celular (7).
Por lo tanto, durante los diferentes procesos de la PIV de embriones, el estrés oxidativo debe contrarrestarse mediante la adición de agentes antioxidantes a los medios de maduración, fecundación y cultivo in vitro (CIV) (8). Numerosos productos, biológicos o químicos con estas propiedades, se han agregado como suplemento para medios de PIV de las células de mamíferos, entre los que se encuentran proteínas, vitaminas, enzimas y minerales.
2.2. Antioxidantes utilizados en los medios de PIV de embriones.
2.2.1. Vitaminas, enzimas, aminoácidos y factores de crecimiento (FC).
La suplementación de los medios de MIV de ovocitos bovinos con diferentes concentraciones de vitamina A, incubados en atmósfera con bajo (5%) y alto (20%) porcentaje de O2 demostró que la adición de la misma a bajas concentraciones de O2 no afectó el desarrollo embrionario; en cambio, con una atmósfera del 20% de O2, niveles de 5 µM de vitamina A incrementó el porcentaje de blastocistos (P<0.001), lo que sugiere un efecto antioxidante de la misma (9).
Al evaluarse el efecto de la adición de diferentes niveles de a-tocoferol (0, 50, 100, 200, 400 y 500 µM en los medios de MIV y CIV en ovinos, se demostró que la concentración de 200 µM aumentó los porcentajes de división (P<0.05), mórulas (P<0.05) y número total de células por blastocisto (P<0.01), y que las concentraciones de 100, 200 y 400 µM incrementaron (P<0.05) el porcentaje de blastocistos en comparación con el grupo control (3).
En la especie porcina se evaluaron las concentraciones óptimas de a-tocoferol y ácido ascórbico para el desarrollo de embriones, procedentes de FIV o transferencia nuclear de células somáticas (SCNT), añadiéndose ambas vitaminas exclusivamente en los medios de CIV. Los mejores porcentajes de blastocistos se obtuvieron con 100 µM de a-tocoferol, independientemente del origen de los cigotos y los índices de apoptosis con esta misma dosis para ambas sustancias fue similar, aumentando con respecto a los controles cuando fueron combinadas (10).
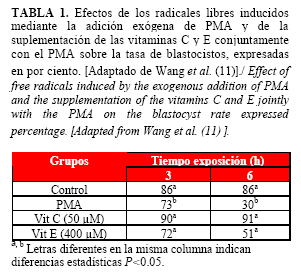
Para evaluar los efectos adversos de los RL, inducidos mediante la administración exógena en el medio de CIV del éster 12-phorbol 13-myristato acetato (PMA), sobre el desarrollo embrionario en ratones y el efecto antioxidante que ejercían las vitaminas C y E (Tabla 1); se conformaron 4 grupos que fueron cultivados en dos periodos de tiempo (3 y 6 horas), trasladándose posteriormente los embriones a un medio de cultivo nuevo. La adición del PMA redujo, significativamente, la tasa de blastocistos a las 3 (p=0.02) y las 6 horas (P=0.0001) con respecto al grupo control; la suplementación de vitaminas C y E conjuntamente con el PMA incrementó (P<0.05) los porcentajes de blastocistos en ambos periodos de tiempo (11). Estos resultados confirman los efectos perjudiciales del estrés oxidativo sobre el desarrollo embrionario y la eficacia de las vitaminas utilizadas para la reducción del mismo, especialmente la de la vitamina C.
El ácido ascórbico actúa como antioxidante modulando muchos procesos bioquímicos intra o extracelulares y se introduce a menudo en los medios de MIV de ovocitos y de cultivo de embriones para optimizar sus resultados (12); sin embargo, la exposición de los ovocitos al ácido ascórbico por periodos prolongados y a altas concentraciones puede provocar citotoxicidad en los gametos, y en consecuencia, reducir el porcentaje de blastocistos, como ya demostraron Córdova et al. (13).
Los resultados de la utilización del ácido ascórbico en los medios de MIV son contradictorios; en ovocitos de ratas no afectó la maduración nuclear (14), al contrario de lo reportado en porcinos (15); por otro lado, con ovocitos bovinos madurados durante 22 horas, ni el porcentaje de blastocistos (16) ni el potencial de desarrollo in vitro de ovocitos denudados (12), se vieron alterados. Las causas de la variabilidad de los resultados parecen estar dadas por la especie animal, el tiempo de exposición y las concentraciones empleadas; por lo que las investigaciones con esta vitamina deben dirigirse a determinar con precisión estos aspectos en las diferentes etapas de la PIV de embriones y el efecto de su asociación con otras sustancias antioxidantes.
También se evaluó el efecto de la adición a la MIV y FIV de diferentes antioxidantes [cisteína, N-acetil-L-cisteína (NAC), CAT y SOD] sobre el desarrollo embrionario en bovinos, demostrándose que la cisteína tuvo un efecto beneficioso sobre el mismo, mientras que NAC, CAT y SOD no influyeron sobre el desarrollo de los embriones (17). Sin embargo, los resultados anteriores deben ser interpretados con cautela porque la actividad catalítica de las enzimas evaluadas depende fundamentalmente de los microelementos.
La CAT es dependiente del Fe2+ y la SOD del Cu2+, Zn2+ y Mn2+, utilizándolos como componentes estructurales y/o cofactores enzimáticos; estos iones metálicos no son suplementados sistemáticamente en los medios y su aporte proviene del SFB, que como se sabe posee una gran variabilidad en sus componentes, determinado, entre otros factores, por el animal donante y el lote de procedencia del suero (18). La adición a los medios de MIV y FIV de la CAT y la SOD en combinación con los microelementos mencionados pudiera tener un efecto beneficioso sobre el desarrollo embrionario, lo que indica la necesidad de realizar los estudios para corroborar esta hipótesis.
Más recientemente, se concluyó que la administración de suplementos de cisteína combinada con FC durante la MIV de los ovocitos, pese a no aumentar el número de blastocistos podría utilizarse como un sustituto del SFB dada su acción antioxidante, expresada por la reducción de los indicadores de estrés oxidativo en los embriones (8).
En la especie porcina se ha demostrado que el cultivo de embriones con un 20% de O2 afectó el desarrollo embrionario significativamente (P<0.05), con respecto a los que fueron incubados con 5% de O2, obteniéndose tasas de división (70.6 vs 65.6%), de blastocistos tempranos (21.3 vs 18.9%) y expandidos (42.1 vs 37.6%), diferentes entre ambos grupos (19); estos autores comprobaron que con un 20% de O2, la adición de 20 y 50 µM de b-mercaptoetanol (b-ME) al medio de CIV incrementó significativamente, los porcentajes de división y de blastocistos en comparación con el medio no suplementado.
Los efectos perjudiciales del aumento de concentración de O2 pueden deberse al incremento y acumulación de peróxido de hidrógeno (H2O2), provocando un aumento en la fragmentación del DNA embrionario. Estas consideraciones y los resultados anteriores permiten explicar que la suplementación de vitamina E en concentraciones de 0, 50, 100, 200 y 400 µM en el medio de CIV con 5% O2, no afectara el desarrollo embrionario en búfalos, mientras que la adición de 400 µM, con 20% de O2, produjera un incremento significativo (P<0.05) del porcentaje de blastocistos y del total de células por embrión (6).
También se comprobó que la adición de los FC epidérmico (EGF) e insulínico (IGF-I) a un medio de CIV de embriones de ratón con 0.1 µM de peróxido de hidrógeno (H2O2) fue capaz de protegerlos contra el estrés oxidativo (20).
En bovinos, la adición de una combinación de FC y Citoquinas al medio de cultivo SOF (Fluido Sintético Oviductal) aumentó los porcentajes de blastocistos (P< 0.05) en comparación con el medio SOF sin suplementar (45% vs. 24%) y SOF + 10% de SFB (38%) al día 8 posterior a la FIV. Así mismo, incrementó las células totales, la masa celular interna (MCI) y las células de trofoectodermo, evidenciando que los FC y las citoquinas poseen acción estimulatoria combinada en el desarrollo embrionario (21).
La adición al medio de CIV de 100 o 200 ng/ml de EGF y IGF-I (50 o 100 ng/ml) incrementaron significativamente los porcentajes de embriones bovinos a los 8 días posteriores a la FIV de ovocitos obtenidos de ovarios procedentes de matadero; además IGF-I aumentó la cantidad de células de la MCI y el trofoectodermo, mientras que EGF sólo estimuló la proliferación en la MCI (22).
2.2.2. Minerales.
Un aspecto que no debemos obviar es el hecho de que los medios de MIV y de CIV de embriones intentan asemejar (replicar) la composición fisiológica de los fluidos folicular y oviductal, respectivamente. Aunque estos últimos difieren en su composición iónica, pH y osmolaridad con el suero sanguíneo, es de suponer que contengan niveles de microminerales, que aunque pequeños, resulten esenciales para la maduración del ovocito y el desarrollo embrionario.
En cuanto a los macroelementos, se conoce que el fluido oviductal bovino y ovino se caracteriza por bajos niveles de Na+ y altos de K+, comparados con los del plasma sanguíneo. Estos dos elementos son cuidadosamente balanceados al formular los medios de cultivo, al igual que Mg2+, Ca2+, bicarbonato, sulfatos y fosfatos (2).
Todos estos iones tienen funciones fisiológicas catalíticas y sus niveles de inclusión en los medios utilizados en la PIV de embriones se basan en el análisis bioquímico de sangre o del líquido oviductal (2). Según este autor, el déficit de Ca2+ en el medio de cultivo origina reducción de las divisiones embrionarias e incapacidad para la compactación de las mórulas, el Ca2+ y Mg2+ juegan un papel importante en el proceso de adhesión celular y el ión fosfato parece ser efectivo sólo a una muy determinada concentración (0.35 mM) en los medios de cultivo para embriones bovinos.
Está demostrado en la literatura científica que los minerales trazas tienen una acción importante en la actividad reproductiva, participando en la síntesis, activación y regulación de hormonas sexuales (23); observándose en rebaños con carencia de cobre, zinc y manganeso una disminución de la fertilidad (24,25) y una respuesta beneficiosa de su suplementación in vivo (26,27). Por lo que la adición de estos microelementos con acción antioxidante a los medios empleados en la PIV de embriones podría favorecer el desarrollo embrionario y la obtención de blastocistos de alta calidad.
Sin embargo, no existen datos concluyentes en la literatura consultada sobre los valores de microelementos en los fluidos folicular y oviductal, sus variaciones a lo largo del ciclo estral de la vaca y la relación que puede existir entre estos niveles y los que se encuentran en suero sanguíneo. Tales conocimientos serían de gran utilidad teórica y práctica para determinar los niveles de inclusión más apropiados de los microelementos en los medios de PIV de embriones y el momento optimo del proceso para suplementarlos.
Diferentes concentraciones de Fe2+ y Cu2+ añadidas al medio de MIV de ovocitos bovinos no mejoró la tasa de maduración, pero su adición al medio de CIV aunque no produjo un aumento de los porcentajes de embriones de 2 células, sí incrementó los de 8 células, mórulas y blastocistos; en el caso del Fe2+, la dosis más efectiva fue 1.96 mg/L, mientras que para el Cu2+ fueron 0.46 y 0.68 mg/L, sin diferencias entre ellas (Tabla 2). Se apreció además, que en ambos microelementos, todas las dosis empleadas redujeron la apoptosis en comparación con los ovocitos cultivados en medios no suplementados (28).
Los resultados anteriores sugieren que los ovocitos necesitan y utilizan pocas cantidades de Fe2+ y Cu2+ durante la maduración o que las mismas son satisfechas a partir de sus reservas citoplasmáticas de estos microelementos, y por tanto, en esta etapa parecen ser más dependientes de la administración exógena de otras sustancias, entre las que se incluyen las hormonas foliculoestimulante (FSH) y luteinizante (LH) (29).
Por el contrario, el efecto beneficioso de la adición de Fe2+ y Cu2+ sobre los porcentajes de embriones de 8 células, mórulas y blastocistos en los estadios más avanzados y la reducción progresiva de los niveles de estos microelementos en los medios de CIV en la medida que avanzaban las horas de cultivo, observada en el mismo experimento (28), indica que los cigotos tienen distinta demanda de estos minerales en los medios de cultivo y que depende del estadio del embrión.
Si bien un consumo insuficiente de microelementos por parte de los embriones puede conducir a su deficiencia y un pobre desarrollo embrionario (30); altas concentraciones de Fe2+ y Cu2+ pueden provocar la toxicidad de los embriones. Elevados niveles de Fe2+ junto con ácidos grasos insaturados pueden estimular la formación de RL e hidroperóxidos y provocar el daño oxidativo de los embriones (31). Esto puede explicar que en el estudio realizado por Gao et al. (28), el porcentaje de blastocistos obtenido con 3.26 mg/L de Fe2+ haya sido menor que el alcanzado con 1.96 mg/L de este microelemento.
Por otra parte, Anchordoquy et al. (32), trabajando con ovocitos obtenidos a partir de ovarios recogidos en matadero, demostraron que la adición de diferentes concentraciones de Zn2+ al medio TCM-199 ejerció un efecto beneficioso sobre la capacidad de desarrollo embrionario hasta el estadio de blastocisto, obteniéndose una tasa de división superior (P<0.01) y mayores porcentajes de blastocistos (P<0.01) en los medios de MIV suplementados con 0.7 mM y 1 mM de Zn2+ con respecto al medio control (Tabla 3).
Los resultados obtenidos sobre la adición de microelementos a los medios utilizados en la PIV de embriones son poco concluyentes y aún quedan muchos aspectos por estudiar. Entre los que mayor interés demanda se encuentran las necesidades de microelementos de los ovocitos y el embrión en sus diferentes estadíos, sus niveles de inclusión adecuados en los medios de MIV, FIV y CIV, y el efecto de la suplementación combinada de los mismos y su asociación con otras sustancias antioxidantes. El estudio de estos aspectos contribuirá a generar nuevos conocimientos sobre el tema y a obtener una mayor eficiencia en la PIV de embriones.
2.2.3. Otras combinaciones de antioxidantes.
Dada la complejidad del metabolismo de vitaminas y minerales y de las interacciones que se producen entre ellos en el medio interno del organismo, es difícil que la adición de éstos por separado pueda constituir la mejor solución; de ahí que en la actualidad en los medios de PIV de embriones se empleen combinaciones que contienen diferentes proporciones de los mismos.
La transferrina es una glicoproteína sintetizada en el hígado, posee 2 dominios homólogos de unión para Fe3+, siendo responsable del transporte de este microelemento y puede tener actividad antioxidante en los sistemas biológicos. La combinación insulina-transferrina-selenio (ITS) se ha añadido a medios de MIV, libres de SFB para promover el desarrollo de ovocitos en vaca (33) y cabra (34).
Yeong et al. (35) evaluaron el efecto de la adición de diferentes concentraciones de ITS a medios de MIV, definidos e indefinidos, sobre los parámetros de fecundación de ovocitos porcinos (Tabla 4). Los resultados obtenidos en ambos medios fueron similares, ninguno de los tratamientos afectó al porcentaje de penetración, pero sí redujeron significativamente la polispermia (P<0.05) y aumentaron (P<0.05) la formación de pronúcleos femeninos. Además, en el mismo experimento se demostró que en iguales condiciones se incrementó significativamente la actividad GSH-PX de los ovocitos.
Basado en los resultados anteriores, se evaluó el efecto de la adición de ITS (10 mg/L I, 5.5 mg/L Tf y 5 µg/L Se) en diferentes condiciones de maduración después de FIV y la transferencia nuclear de células (SCNT) (Tabla 5). La combinación de ITS+10% de fluido folicular porcino (pFF) ofreció los mejores resultados después de la fecundación y cultivo, aumentando significativamente (P<0.05) el número de embriones de dos células, el porcentaje de blastocistos y el número de células por blastocisto (35).
Estos resultados pudieran explicarse porque la suplementación de ITS durante la MIV incrementó los niveles de GSH-Px sintetizada por los ovocitos durante el proceso de maduración; el aumento de esta enzima a nivel intracelular, con un potente efecto antioxidante, se considera un indicador de buena maduración citoplasmática (36), lo que pudo haber propiciado el incremento del número de células y del porcentaje de blastocistos obtenidos.
Recientemente, Córdova et al. (13), trabajando con ovocitos procedentes de terneras prepúberes, evaluaron el efecto de la adición durante 12 ó 24 horas de ITS y/o ácido L-ascórbico (ASC) al medio TCM-199 (Tabla 6). Nótese que la tasa de división a las 48 horas de los ovocitos expuestos durante 12 y 24 horas con los suplementos referidos no se vio afectada por los distintos tratamientos; pero el porcentaje de blastocistos a las 12 horas de exposición fue superior (P<0.05) en el grupo ITS+ASC en comparación con los restantes; mientras que a las 24 horas de exposición fue inferior (P<0.05) en el grupo ASC con respecto al grupo control.Recientemente, Córdova et al. (13), trabajando con ovocitos procedentes de terneras prepúberes, evaluaron el efecto de la adición durante 12 ó 24 horas de ITS y/o ácido L-ascórbico (ASC) al medio TCM-199 (Tabla 6). Nótese que la tasa de división a las 48 horas de los ovocitos expuestos durante 12 y 24 horas con los suplementos referidos no se vio afectada por los distintos tratamientos; pero el porcentaje de blastocistos a las 12 horas de exposición fue superior (P<0.05) en el grupo ITS+ASC en comparación con los restantes; mientras que a las 24 horas de exposición fue inferior (P<0.05) en el grupo ASC con respecto al grupo control.
Este experimento demostró además (Tabla 7) que si bien la organización de los cromosomas no resultó afectada a las 12 horas por ninguno de los tratamientos, a las 24 horas sí se obtuvieron porcentajes superiores (P<0.05) de ovocitos con una alineación normal de los cromosomas en el grupo ASC con respecto al control. Por su parte, los ovocitos madurados en el medio que contenía ITS+ASC y ASC durante 12 horas mostraron porcentajes significativamente más altos de gránulos corticales (GC) en la periferia que los ovocitos control e ITS. A las 24 horas no se hallaron diferencias en el porcentaje de GC en la periferia entre los diferentes grupos.
Los resultados anteriores indican que la combinación de ITS+ASC resultó la más efectiva, lo que puede deberse al mayor porcentaje de gránulos corticales en la periferia (GCP) observados en este tratamiento. La distribución los GCP es un indicador de maduración citoplasmática y la consiguiente capacidad de los ovocitos para desarrollar la fase de blastocisto (37).
Sin embargo, los resultados obtenidos por Córdova et al. (13) en bovinos no son coherentes con los reportados previamente en búfalos (38) y en cerdos (19), quienes comunican que la adición de ITS exclusivamente sí mejoraba el desarrollo embrionario. La falta de concordancia entre estos resultados puede estar dada por la especie animal, las concentraciones empleadas y los medios utilizados en cada experimento.
Se concluye que resultan incuestionables las ventajas de la suplementación de los medios utilizados en la PIV con sustancias antioxidantes; sin embargo, en algunas de estas aún existen aspectos por estudiar que deben constituir la ruta crítica de las investigaciones en este campo, tales como, el tiempo de exposición y las concentraciones empleadas de ácido ascórbico, las necesidades de microelementos de los ovocitos y el embrión en sus diferentes estadíos, sus niveles de inclusión adecuados en los medios de MIV, FIV y CIV, y el efecto de la suplementación combinada de los mismos y su asociación con otras sustancias antioxidantes.
AGRADECIMIENTOS
Proyecto «Biotecnología de la Reproducción aplicada a la recuperación de la raza bovina Murciano-Levantina» (MICINN-INIA, RZ2010-00003-02-00). Agencia Española de Cooperación Internacional para el Desarrollo (AECID).
REFERENCIAS
1. García JR, Romero-Aguirregomezcorta J, Astiz S, Poto A, Ruiz, S. OPU oocyte yield and early embryo development after follicular ablation or exogenous GnRH (Dalmarelin®) in Murciano-Levantina cows. Libro de resúmenes del 28th Annual Meeting A.E.T.E. Saint Malo, France, 7th 8th September 2012;144-146.
2. De la Fuente J. Producción de embriones bovinos in vitro: Impulso de la eficiencia de los programas MOET mediante la FIV bovina. XXXIII Curso Internacional de Reproducción Animal. Compendio de conferencias. Ed. Visión Libros. 2010;273-279.
3. Natarajan R, Bhawuani M. Effect f a-tocopherol suplementation on in vitro maturation of sheep oocytes and in vitro development of preimplantation sheep embryos to the blastocyst stage. J Asist Reprod Genet. 2010;27:483-490.
4. Senbon S, Fukumi Y, Hamakawi A, Yoshikawa M, Miyano T. Bovine oocytes grown in serum free medium acquire fertilization competence. J Reprod Dev. 2004;50:541-547.
5. Oyawoye O, Gadir AA, Garner A, Constantinovici N, Perrett C, Hardiman P. Antioxidants and reactive oxygen species in follicular fluid of women undergoing IVF: relationship to outcome. Hum Reprod. 2003;18:2270-2284.
6. Thiyagarajan B, Valivittan K. Ameliorating effect of vitamin E on in vitro development of preimplantation buffalo embryos J Assist Reprod Genet. 2009;26:217-225.
7. Takahashi M, Keicho K, Takahashi H, Ogawa H, Schultz RM, Okano A. Effect of oxidative stress on development and DNA damage in vitro cultured bovine embryos by comet assay. Theriogenology. 2000;54:137-145.
8. Lott WM, Anchamparuthy VM, McGilliard ML, Mullarky LK, Gwazdauskas FC. Influence of cysteine in conjunction with growth factors on the development of in vitro-produced bovine embryos. Reprod Domest Anim. 2011;46:585-594.
9. Livingston T, Eberhardt D, Edwards L, Godkin J. Retinol improves bovine embryonic development in vitro. Reprod Biol Endocrinol. 2004;2:83-90.
10.Jeong YW, Park SW, Hossein MS, Kim S, Kim JH, Lee SH, et al. Antiapoptotic and embryotrophic effects of alpha-tocopherol and L-ascorbic acid on porcine embryos derived from in vitro fertilization and somatic cell nuclear transfer. Theriogenology. 2006;66:2104-2112.
11.Wang X, Falcone T, Attaran M, Goldberg J, Agarwal A, Sharma R. Vitamin C and Vitamin E supplementation reduce oxidative stress-induced embryo toxicity and improve the blastocyst development rate. Fertil Steril. 2002;78:1272-1277.
12.Tao Y, Chen H, Tian NN, Huo DT, Li G, Zhang YH, et al. Effects of l-ascorbic acid, a-tocopherol and co-culture on in vitro developmental potential of porcine cumulus cells free oocytes. Reprod Domest Anim. 2010;45:19-25.
13.Córdova B, Morató A, Izquierdo D, Paramio T, Mogas T. Effect of the addition of insulin-transferrin-selenium and/or L-ascorbic acid to the in vitro maturation of prepubertal bovine oocytes on cytoplasmic maturation and embryo development. Theriogenology. 2010;74:1341-1348.
14.Takami M, Preston SL, Toyloy VA, Behrman HR. Antioxidants reversibly inhibit the spontaneous resumption of meiosis. Am J Physiol. 1999;276:684-688.
15.Tao Y, Zhou B, Xia G, Wang F, Wu Z, Fu M. Exposure to L-ascorbic acid or alpha-tocopherol facilitates the development of porcine denuded oocytes from metaphase I to metaphase II and prevents cumulus cells from fragmentation. Reprod Domest Anim. 2004;39:52-57.
16.Dalvit G, Llanes SP, Descalzo A, Insani M, Beconi M, Cetica P. Effect of alpha-tocopherol and ascorbic acid on bovine oocyte in vitro maturation. Reprod Domest Anim. 2005;40:93-97.
17.Ali AA, Bilodeau JF, Sirard MA. Antioxidant requeriments for bovine oocytes varies during in vitro maturation, fertilization and development. Theriogenolgy. 2003;59:939-949.
18.Herradón PG, Quintela LA, Becerra JJ, Ruibal S, Fernández M. Fecundación in vitro: Alternativas para la mejora genética de bovinos. Arch Latinoam Prod Anim. 2007;15:33-40.
19.Kitagawa Y, Suzuki K, Yoneda A, Watanabe T. Effects of oxygen concentration and antioxidants on the in vitro developmental ability, production of reactive oxygen species (ROS) and DNA fragmentation in porcine embryos. Theriogenology. 2004;62:1186-1197.
20.Kurzawa R, Glabowski W, Baczkowski T, Wiszniewska B, Marchlewicz M. Growth factors protect in vitro cultured embryos from the consequences of oxidative stress. Zygote. 2004;12:231-240.
21.Neira JA, Tainturier D, Peña MA, Martal J. Effect of the association of IGF-I, IGF-II, bFGF, TGF-b1, GM-CSF, and LIF on the development of bovine embryos produced in vitro. Theriogenology. 2010;73:595-604.
22.Sakagami N, Umerki H, Nishino O, Uchiyama, H, Ichikawua K, Takeshita K, et al. Normal calves produced after transfer of embryos cultured in a chemically defined medium supplemented with epidermal growth factor and insulin-like growth factor I following ovum pick up and in vitro fertilization in Japanese Black cows. J Reprod Dev. 2012;58:140-146.
23.Suttle NF. Mineral Nutrition of Livestock. 4th Ed. CAB International. 2010;39-54.
24.García JR, Cuesta M, García R, Quiñones R, Figueredo JM, Faure R, et al. Characterization of the content of microelements in the soil-plant-animal system and its influence on cattle reproduction in the central region of Cuba. Cuban J Agric Sci. 2010;44:227-231.
25.García JR, García R, Cuesta M, Figueredo JM, Quiñones R, Faure R, et al. Blood copper levels and their influence on reproductive indicators of cows in tropical conditions. Cuban J Agric Sci. 2010;44:233-239.
26.Griffiths LM, Loeffler SH, Socha MT, Tomlinson DJ, Johnson AB. Effects of supplementing complexed zinc, manganese, copper and cobalt on lactation and reproductive performance of intensively grazed lactating dairy cattle on the South Island of New Zealand. Anim Feed Sci Tech. 2007;137:69-83.
27.García JR, Joseph-Ajakaiye J, Cuesta M, Quiñones, R, Munyori H, Figueredo JM, Mollineda A. Effects of parenteral supplementation of Cu in female cattle with different levels of cupremia. Archiv Tierzucht. 2012;55:113-122.
28.Gao G, Yi J, Zhang M, Xiong J, Geng M, et al. Effects of iron and copper in culture medium on bovine oocyte maturation. Preimplantation embryo development and apoptosis of blastocysts in vitro. J Reprod Dev. 2007;53:777-784.
29.Salgado R, Vergara Ó, Ramírez L. Efecto de gonadotropinas sobre la maduración y desarrollo embrionario de oocitos bovinos cultivados in vitro. Rev. MVZ Córdoba. 2010;5:1954-1960.
30.Goldhaber SB. Trace element risk assessment: essentiality vs toxicity. Regul Toxicol Pharm. 2003;38:232-242.
31.Raquel D, Tegra B, Encarnacion S, Adela B. Study of the effect of different ions salts used to fortify infant formulas on the bioavailability of trace elements using ICP-OES. Int Dairy J. 2004;14:1081-1087.
32.Anchordoquy JM, Anchordoquy JP, Mattioli G, Picco SJ, Rosa DE, Peral P, et al. Importancia del Zinc durante la maduración in vitro de ovocitos: Consecuencias en el desarrollo embrionario temprano. Tercera Época. 2010;2:1-2.
33.Gardner DK, Lane M, Maybach JM, Hasler JF. Bovine oocyte maturation in a completely defined medium: replacing serum with recombinant albumin and hyaluronan. Theriogenology. 2001;55:471-479.
34.Herrick JR, Behboodi E, Memili E, Blash S, Echelard Y, Krisher RL. Effect of macromolecule supplementation during in vitro maturation of goat oocytes on developmental potential. Mol Reprod Dev. 2004;69:338-346.
35.Yeong YW, Hossein MS, Bhandari DP, Kim YW, Kim JH, Park SW, et al. Effects of insulin-transferrin-selenium in defined and porcine follicular fluid supplemented IVM media on porcine IVF and SCNT embryo production. Anim Reprod Sci. 2008;106:13-24.
36.Yoshida M, Ishigaki K, Nagai T, Chikyu M, Pursel VG. Glutathione concentration during maturation and after fertilization in pig oocytes: relevance to the ability of oocytes to form male pronucleus. Biol Reprod. 1993;49:89-94.
37.Duque P, Diez C, Royo L, Lorenzo PL, Carneiro G, Hidalgo CO, et al. Enhancement of developmental capacity of meiotically inhibited bovine oocytes by retinoic acid. Hum Reprod. 2002;17:2706-2714.
38.Raghu HM, Nandi S, Reddy SM. Effect of insulin, transferring and selenium and epidermal growth factor on development of buffalo oocytes to the blastocyst stage in vitro in serum-free, semidefined media. Vet Rec. 2002;151:260-265.
Recibido: 24-10-2012.
Aceptado: 8-2-2013.