Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión impresa ISSN 0253-570X
Rev Salud Anim. vol.35 no.2 La Habana mayo.-ago. 2013
ARTÍCULO RESEÑA
Oestrus ovis (Diptera: Oestridae): un importante ectoparásito de los ovinos en Cuba
Oestrus ovis (Diptera: Oestridae): an important ectoparasite of sheep in Cuba
Vilmaris MatosI, Jesús G. Rodríguez DiegoII, Pastor AlfonsoII, Javier L. OlivaresIII
ICentro de Desarrollo de la Montaña (CDM). Limonar de Monte Ruz, Km 1, El Salvador, Guantánamo. Cuba. Correo electrónico: vilma@cdm.gtmo.inf.cu.
IICentro Nacional de Sanidad Agropecuaria (CENSA), Centro Colaborador de la OIE para la Reducción del Riesgo de Desastres en Sanidad Animal. Apartado 10, San José de las Lajas, Mayabeque, Cuba. Correo electrónico: alfonso@censa.edu.cu.
IIIDepartamento de Producción Agrícola y Animal. Universidad Autónoma Metropolitana, Unidad Xochimilco (UAM-X). Calzada del Hueso No. 1100. Col. Villa Quietud, Deleg. Coyoacán, México 04960.
RESUMEN
Oestrus ovis L. (Diptera: Oestridae) constituye un importante agente productor de miasis en diversos ambientes de explotación de ovinos y caprinos. A pesar de la distribución cosmopolita del agente, el primer informe de su presencia en Cuba data de 1995 en el municipio Imias de la provincia de Guantánamo. Desde ese momento la oestrosis se ha informado en otras dos provincias orientales (Santiago de Cuba y Granma). Se resumen aspectos de la biología, acción sobre el hospedero y control de Oestrus ovis. Se aportan elementos de estudios realizados en Cuba por los autores sobre la fase parasitaria, la clínica y el tratamiento de la enfermedad. Los brotes de oestrosis registrados en la provincia de Guantánamo en un periodo de 6 años (2006-2011) revelan una morbilidad promedio de 50,2%; mientras la mortalidad y letalidad suelen ser bajas (2,17% y 4,33% respectivamente). Por su parte el diagnóstico activo de la enfermedad en esta provincia reveló que el 80% de los rebaños examinados están afectados, lo cual es una prevalencia alta. Estos datos sugieren que la oestrosis puede tener un alto impacto económico en la producción ovina debido a la alta cuantía de animales susceptibles en la región oriental de Cuba.
Palabras clave: Oestrus ovis, ectoparásito, ovino.
ABSTRACT
Oestrus ovis L. (Diptera: Oestridae) is an important myiasis-producing agent of sheep and goats in diverse production environments. Despite of the cosmopolitan distribution of this agent, the first report of its presence in Cuba was in 1995 in Imias municipality, Guantánamo province. Since that, oestrosis has been reported in other two eastern provinces (Santiago de Cuba and Granma). Some aspects regarding biology, host action and control of Oestrus ovis have been summarized. Information on the parasitic phase, clinical expression as well the treatment of the disease is provided from studies conducted by the authors in Cuba. Oestrosis outbreaks registered by the Veterinary Services during a 6 year period (2006-2011) in Guantánamo province showed that disease has an morbidity average of 50.2%; while either mortality or lethality used to be lower (2.17% and 4.33% respectively). The active diagnosis of oestrosis revealed that the 80% of the herds examined are affected by its causal agent, indicating a high prevalence. According to these data, oestrosis may have an important economic impact on sheep production because of the high amount of susceptible animals in the eastern region of Cuba.
Key words: Oestrus ovis, ectoparasite, sheep.
INTRODUCCIÓN
El término miasis proviene del vocablo griego, myia que significa mosca (1). Se conoce como tal, a la infestación por ciertas especies del orden Diptera que durante su estadio larvario se alimentan de tejido vivo o muerto, o de fluido biológico de vertebrados vivos (2). Más recientemente se incluye en este concepto la alimentación, por parte de las larvas, de alimento ingerido por el hospedero (3).
Del mismo modo, se conoce como miasis obligatoria a la infestación de ciertas especies de moscas, cuyo ciclo biológico transita, imperativamente, por un huésped vivo para la ovoposición y el desarrollo de las larvas (3).
Oestrus ovis (Linneé, 1761), también llamada «mosca del carnero», es un parásito productor de miasis obligatoria de los ovinos y caprinos que tiene amplia distribución mundial (4). La oestrosis, es la miasis cavitaria de los senos nasales, paranasales y a veces frontales de los ovinos y caprinos (5). También se le conoce con el nombre de «miasis de la nariz», «rinitis parasitaria», «enfermedad de la mosca de los senos» y en aquellos casos en los que se presenta con síntomas nerviosos derivados de la localización de larvas en sistema nervioso central se le denomina «falsa modorra».
El agente que nos ocupa, O. ovis, se informa, por primera vez, en el país en el año 1995 (6) y algunos aspectos de su manifestación clínica-patológica fueron estudiados por parte de los autores de este trabajo (7).
Taxonomía
La taxonomía del ectoparásito según Rodríguez Diego et al. (8), es la siguiente:
Imperio. Eucariota
Reino: Animalia
Phylum: Arthropoda
Clase: Insecta
División: Endopterygota
Orden: Diptera
Suborden: Cyclorrapha
Familia: Oestridae
Género: Oestrus
Especie: Oestrus ovis
La familia Oestridae es un pequeño taxón dentro de los dípteros cuyas larvas son parásitos obligados que afectan un amplio rango de mamíferos, desde roedores hasta paquidermos. Se divide en cuatro bien definidas subfamilias, caracterizadas por la alta especificidad hospedera (9). La especie O. ovis es de las más importantes para pequeños rumiantes (4).
Biología
Estadios larvarios
Las moscas hembras adultas depositan las larvas del primer estadio (L1) (Fig. 1), en paquetes directamente en las fosas nasales del hospedero, con la ayuda de los tres últimos segmentos abdominales. La apertura del gonoporo de la hembra adulta está situada entre los segmentos abdominales VII y VIII y normalmente se retrae telescópicamente por lo que el conducto de la vagina debe extenderse cuando las larvas son expulsadas (10). Las L1 se activan en contacto con el aire y la temperatura del mamífero. El tamaño de cada grupo de larvas depende del tamaño de la mosca adulta (11).Mediante un eficiente mecanismo termo-sensorial cuticular y su rápida motilidad, los estadios uno pueden alcanzar los conductos y establecerse en la cavidad nasal, en segundos; de esa manera, vencen las primeras reacciones defensivas del hospedero, tales como los estornudos y otras (12). No obstante, ocasionalmente, algunos migran hacia el exterior y mueren desecados en poco tiempo.
Las larvas del primer estadio presentan numerosas espinas y ganchos que utilizan para la fijación en la mucosa nasal (13, 14, 15), ya que debe prever ser expulsado por el estornudo del hospedero; del mismo modo esas estructuras le ayudan al movimiento en el interior del ovino infestado. Estas larvas son de color cremoso claro, y tienen un desarrollo primario del esqueleto cefalofaríngeo y poca robustez de los ganchos bucales. Del mismo modo, los espiráculos posteriores se notan difusos (16).
Se considera que las ovejas proporcionan un ambiente más adecuado para el pronto establecimiento de larvas y el desarrollo, que las cabras, debido a que estas son mucho más reactivas a la presencia de larvas de dípteros; además, la nariz de esa especie suele ser menos húmeda que la del caprino. El mayor nivel de humedad en las ovejas, puede ayudar a las larvas a sobrevivir con mayor facilidad (17, 18).
Gebremedhin (19) y Papadopoulos et al. (20) demuestran respectivamente un riesgo relativo de infestación por O. ovis, de 2 a 4,8 veces superior para los ovinos respecto a los caprinos; aunque en similares condiciones, Alem et al. (18) no encuentran diferencias de significación entre estas especies.
Las diferencias observadas en las prevalencias e intensidades de infestación por O. ovis entre ovinos y caprinos en general responden a causas multifactoriales que consideran, incluso, la capacidad de la mosca para percibir olores del hospedero (21), así como fenómenos de mejor coevolución entre el parásito y las cabras, que aun requieren de investigaciones para establecer su importancia relativa (22). Incluso entre las razas de ovinos se reconocen diferencias en la susceptibilidad a la infestación por el parásito (23).
La fase L1 dura entre 10 a 25 días bajo temperaturas favorables (12). Dentro de la nariz del hospedero, las larvas siguen creciendo o pasan a estado de hipobiosis, en dependencia de la combinación de estímulos internos y señales externas ambientales (11).
Tanto las bajas temperaturas, como las muy altas (>38 °C) aletargan el desarrollo de las L1 (24). Aunque Rogers et al. (25), no logran demostrar que la temperatura del aire del sitio de hibernación de este estadio sea la causa directa de la hipobiosis; evidencias experimentales muestran que las larvas sometidas a 5 °C se fijan fuertemente a la mucosa mediante sus ganchos orales, disminuyen al máximo sus movimientos y sobreviven varios días sin alimentarse. Del mismo modo, el movimiento delantero se restablece a 12 °C y la locomoción se hace vigorosa entre 15 y 22 °C, lo que hace suponer que las L1 en la cavidad nasal, monitorean la temperatura del aire exterior. Las temperaturas medias favorables in vitro superiores a 19 °C parecen ser determinantes para el desarrollo de la muda (11).
La L1 muda a L2 antes de entrar en los senos nasales y rara vez lo hace en los frontales. Después de la primera muda, el proceso de crecimiento es continuo (26). Se ha observado migración transnasal a través de la faringe; en estos casos, hasta el 65% de las larvas pueden colonizar la cavidad nasal contralateral (27).
Las medidas de los diferentes estadios larvarios de O. ovis obtenidas por Matos et al. (16), en un estudio realizado en Cuba, se muestran en la Tabla 1.
Por su parte, el segundo estadio larvario (Fig. 2) alcanza los senos paranasales y el tamaño de sus ganchos y espinas se reduce, aunque logra no ser expulsado cuando el animal estornuda (28). La L2, se asemeja más al estadio L3, aunque de menor tamaño (Tabla 1).
El segundo y tercer estadios (Fig. 3) comparten las cavidades frontales compitiendo por los sitios de fijación en la superficie de la mucosa del hospedero y ahí se alimentan; esto es frecuente en hospederos altamente infestados (11). La L3 (Fig. 3) se caracteriza por el cuerpo robusto, marrón oscuro, dividido en 11 segmentos cubiertos de espinas (16).
El último segmento es bilobulado y muestra los estigmas (Fig. 4); cada lóbulo está coronado de 12 ganchos. En esta fase de la ontogénesis del insecto se notan los estigmas totalmente formados (16).
En el extremo anterior de la L3 se ponen de manifiesto los dos potentes y agudos ganchos quitinosos (Fig. 5), de color carmelita oscuro, criterio de madurez larvaria, rodeados por grupos de numerosos ganchos circundantes, más pequeños, en el borde anterior. En la Fig. 5 se observan también, ampliadas, las espinas que circundan cada segmento del cuerpo de este estadio (16).
Las L3 maduras caen fuera del hospedero, en grupos de tres a ocho al mismo tiempo, con vistas de continuar el estadio de pupa en el suelo. Una vez fuera, la mayoría busca lugares frescos y sombreados donde puedan continuar su ontogénesis. Algunas, con movimiento errante, se exponen a depredadores y a las injurias del ambiente a las que son muy sensibles (11).
Pupa
La fase de pupa se caracteriza por una cubierta gruesa de aproximadamente 0.5 mm de grosor que le ofrece protección y le permite el intercambio gaseoso mediante la conexión de la pared interna de ese estadio, con la tráquea (11). Al igual que otros oestridos, el desarrollo de la pupa, es altamente dependiente de la temperatura que regula la metamorfosis (29). Ese estadio puede soportar temperaturas tan altas como 45 °C, por corto periodo. Por otro lado, pierden peso aceleradamente y eclosionan tardíamente (siete semanas o más) cuando se exponen a altas temperaturas persistentes. Bajo estas condiciones, los adultos nacen débiles y con malformaciones (11).
Las altas temperaturas son perjudiciales porque afectan el incremento de peso de las pupas (12) lo que repercute negativamente en la supervivencia de los adultos, ya que los de bajo peso (<60 mg) mueren en unos pocos días bajo condiciones de laboratorio y de campo. En condiciones de laboratorio la emersión de las hembras ocurre a los 22 días y los machos a los 21 días (11).
Adulto
Al cabo de tres a seis semanas emergen los adultos (4). Durante este período la mosca hembra suele refugiarse en oquedades y grietas de edificaciones, y cuando tiene a su alcance ovejas o cabras deposita las larvas, como se explicó con antelación y así continúa el ciclo biológico (30). La mosca adulta (Fig. 6) se encuentra activa en los meses en los que la temperatura ambiental es alta (19, 31).
Algunos oestridos, especialmente aquellos que parasitan especies de ungulados migratorios, han coevolucionado para recorrer distancias de 600 a 900 Km a velocidades entre 40 y 48 Km/hora (32). Sin embargo, las hembras adultas de O. ovis, tardan al menos una semana para alcanzar rebaños ovinos ubicados de 20 a 30 Km de distancia (33). Este hecho puede estar propiciado por el alto grado de domesticación de los ovinos, explotados además en crianzas localmente establecidas, sin trashumancia o traslados a grandes distancias. De esta forma el fácil encuentro entre el parásito y el hospedero no constituye un estímulo para el desarrollo evolutivo de mayor capacidad de vuelo, al encontrar hospederos en las proximidades de los sitios de desarrollo de las pupas.
De acuerdo con el potencial de dispersión, la colonización de nuevos espacios por O. ovis pudiera estar más influenciada por el traslado de animales infestados, que por la capacidad de vuelo del parásito adulto. Dados los mecanismos que favorecen la atracción hacia el hospedero (21), las nuevas moscas tenderían a permanecer en los lugares dedicados a la crianza ovina, cercanas a donde se desarrollaron las pupas. La capacidad de vuelo también depende de las reservas energéticas que la L3, como último estadio parasitario, logró acumular antes de abandonar el hospedero, dado que la hembra adulta carece de capacidad para alimentarse (32), lo cual determina una corta vida (30) que alcanza entre 1 y 2 semanas en dependencia de las reservas energéticas acumuladas (32). Como mecanismo compensatorio, cuando las moscas hembras emergen de las pupa ya tienen los huevecillos desarrollados solo en espera de la fertilización (30).
Acción patógena y clínica de la enfermedad
La característica de los oestridos de presentar espinas a través de todo el cuerpo de las larvas, agrava la acción parasitaria de las mismas en su paso por los conductos respiratorios anteriores, toda vez que la mucosa resulta lacerada por estas al provocar grave irritación del tejido, que suele complicarse con infecciones secundarias por diversos microorganismos (17).
La presencia de ganchos anteriores es una adaptación al parasitismo que le permite al agente fijarse fuertemente al tejido, abrirse paso en su recorrido y causar el daño expoliativo típico. Las larvas dañan la mucosa nasal con sus ganchos y espinas; este proceso lo apoyan con descarga de abundante óxido nítrico (34), que según Tabouret et al. (35), en estudios in vitro induce la producción de proteínas plasmáticas por las larvas.
La alimentación larvaria está apoyada por proteasas, fundamentalmente tripsina, producto de la excreción-secreción del parásito (35). Estas proteasas originadas en el intestino de esos estadios, producen la licuefacción de los tejidos del animal y son útiles en la pre-digestión de las proteínas del animal infestado, y facilitan la digestión y posterior asimilación de las mismas por parte de los estadios larvarios de O. ovis. La acción de los ganchos anteriores de la larva 3 en ocasiones es responsable de las afecciones del encéfalo por perforación de la placa cribiforme del hueso etmoide, aunque también se atribuye a una respuesta inflamatoria exagerada por parte del hospedero (28). En cualquier caso esta alteración constituye una manifestación rara de la enfermedad.
Aunque la actividad proteolítica de las glándulas salivales es débil, se ha demostrado que es la principal fuente de la mayoría de los antígenos inmunogénicos (36). De igual manera se describen siete tipos de proteasas (fosfatasa ácida, naftol-AS-BI-phosphohidrolasa, esterasa (C4), esterasa lipasa (C8), leucina arilamidasa, glucosidasa y Nacetyl b-glucosaminidasa), en las glándulas salivales de las L3 de O. ovis (37). Estas proteasas son capaces de degradar los componentes de la matriz extracelular y la lámina de epitelio (38), para evitar un estrecho contacto con los anticuerpos, lo que limita la acción defensiva del organismo frente a la agresión larvaria y, probablemente también, previene el bloqueo de los espiráculos respiratorios de esos estadios parasitarios.
Aunque, no hay cambios cualitativos en el perfil de proteasas entre los tres estadios, el aumento de mayor parte de las proteasas liberadas en la mucosa animal por las L2 y L3 revelan los mayores requerimientos nutricionales de esas larvas. Esas evidencias sugieren el almacenamiento de nutrientes por parte del estadio 3, que aumenta de tamaño y guarda reservas para la fases no parasitarias (pupa, eclosión, copula y larviposición) del ciclo biológico (5, 37).
Según las observaciones de la clínica de la oestrosis en Cuba, las ovejas infestadas muestran, en su mayoría, abundante secreción nasal de moco purulento (Fig. 7), signo clínico presuntivo que, junto a frecuentes estornudos que sufre el animal, son indicios característicos de parasitismo por O. ovis (6, 7). A su vez, resultan sugestivos de infestación por O. ovis el ocultamiento de los ollares en el pasto y huidas repentinas que llegan a desarrollar los animales como reflejo ante los zumbidos del parásito adulto (22).
Por ser un agente productor de miasis cavitaria de los senos nasales, paranasales y a veces frontales de los ovinos y caprinos, en algunos casos se pueden presentar con síntomas nerviosos derivados de la localización de larvas en el sistema nervioso central (28). La proximidad a los tejidos del sistema nervioso central se ha considerado que favorece la transmisión de enfermedades causadas por priones y una probable explicación de la persistencia de scrapie a pesar de los esfuerzos por controlarlo (39).
Si bien tiene limitaciones el diagnóstico clínico de la oestrosis (28), la asociación de estornudos y un abundante moco purulento en los ollares de un porcentaje elevado de animales, es un indicio muy característico que puede estar acompañado por la presencia de las larvas en los comederos y bebederos (6,40).
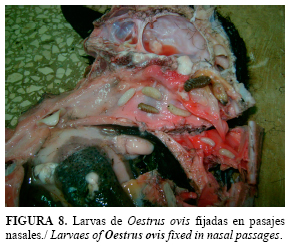
La necropsia es un método confirmativo, aunque tiene limitaciones si no coincide con el sacrificio programado de los animales al concluir el ciclo de crianza. En la necropsia, se observan larvas de diferentes estadios del insecto parasitando los senos frontales (Fig. 8) donde migran hacia las cavidades sinusales, y se desarrollan desde el primer hasta el tercer estadio (11, 27).
La serología, fundamentalmente mediante inmunoensayos acoplados con enzimas (ELISA), demuestra gran utilidad para estudios epidemiológicos de la afectación por oestridos, incluso, en diversas especies animales (41,42,43,44) aunque se requieren varias semanas post-infestación para que la respuesta inmune sea detectable (45). Los juegos ELISA no están disponibles comercialmente y los estudios se realizan con medios desarrollados a nivel de laboratorio.
Situación de la oestrosis en Cuba
La primera notificación de oestrosis en Cuba data de 1995 (6), en el municipio Imias, provincia de Guantánamo. Posteriormente, los registros estadísticos del sistema de vigilancia epizootiológica (SIVE) de los Servicios Veterinarios (46) reflejan que la enfermedad afecta prácticamente todos los municipios de esta provincia y posteriormente también ha sido notificada en algunas zonas de la provincia de Santiago de Cuba desde el año 2002 y más recientemente (2011) en la provincia de Granma.
De acuerdo con los registros de focos (46) en la primera provincia afectada la enfermedad se manifiesta de forma más intensa y algunos de sus indicadores epidemiológicos correspondientes a un periodo de 6 años (2006-2011) se reflejan en la Tabla 2. Como puede apreciarse la mortalidad y la letalidad son bajas, no así el valor de morbilidad. Esta manifestación coincide con los efectos patogénicos reconocidos para la enfermedad, cuyas principales afectaciones son de tipo económico, principalmente por afectación de la ganancia media diaria, la producción de leche y lana (4, 9).
Los registros estadísticos de la presencia y distribución de la oestrosis pueden haber estado sesgados por el desconocimiento epidemiológico de la enfermedad, además de que no es de notificación obligatoria. En cambio mediante diagnóstico activo durante el año 2011 (resultados no publicados), en 43 rebaños distribuidos en 9 de los 10 municipios que conforman la provincia de Guantánamo, se detectó la enfermedad con una prevalencia de rebaño del 81,4%. Esta prevalencia significó, con un intervalo de confianza al 95%, que la probabilidad de que un rebaño se encuentre afectado fuera de 0,70 a 0,89 con una probabilidad media de 0,80. Esta magnitud de prevalencia se encuentra entre los valores más altos que registran diversos estudios (41, 42) y, de acuerdo al efecto económico de la enfermedad (31, 47), permite esperar un alto impacto, al menos en esta provincia donde se ha verificado tan alta extensión.
En la provincia de Guantánamo existen zonas caracterizadas por la aridez y altas temperaturas (48) que pudieran explicar la mayor intensidad de la presentación de la oestrosis, dada la influencia de estas condiciones climáticas en la biología de O. ovis (31) y, como consecuencia, la afectación ocasionada por sus estadios parasitarios. Lo anterior también concuerda con el lento patrón de difusión hacia provincias limítrofes en las cuales existe considerable presencia de hospederos susceptibles.
Desde la primera notificación de la oestrosis en Guantánamo (6) han transcurrido más de 17 años; sin embargo, según los registros del SIVE (46), la presencia de la enfermedad abarca solo otras dos provincias orientales (Santiago de Cuba y Granma). Este patrón de difusión se puede considerar lento, teniendo en cuenta que según el Anuario Estadístico de Cuba (49) en las provincias orientales, con una superficie correspondiente al 27% del país, se concentra más del 50% del patrimonio ovino caprino nacional, lo cual constituye la más alta densidad de especies susceptibles en todo el país.
El carácter lento de la difusión, aun cuando existe alta densidad de la población susceptible, se pudiera explicar porque los insectos suelen ser endémicos donde la temperatura, la humedad, así como las condiciones de hábitat y alimentación son adecuadas de forma estable para su supervivencia y reproducción. En correspondencia con esta característica, en la provincia de Guantánamo la distribución de los focos de oestrosis en ovinos está influenciada por la aridez del clima, con localización predominantemente (90%) en regiones con clima subhúmedo y semiárido (50). El estudio anterior también revela que las temperaturas ambientales altas son el factor que mejor explica la distribución espacial de la enfermedad con un coeficiente de determinación (R2 ajustado) de 88,63%; en correspondencia con los efectos descritos para esta variable climática en la biología de los insectos (51).
A pesar de la alta importancia económica de la oestrosis (47), suele ser ignorada por criadores y veterinarios (30). En las provincias afectadas por esta parasitosis en Cuba no se han realizado evaluaciones de su impacto económico lo cual resulta un aspecto importante dada la alta cuantía de población susceptible que concentran (49). La modelación puede constituir un recurso de utilidad para la toma de decisión sobre alternativas de control de enfermedades de esta naturaleza, tal como reconocen Singer et al. (52). Tales evaluaciones, asociadas a estudios de la dinámica poblacional del parásito constituyen el punto de partida para valorar la factibilidad de implementar un programa de control.
Otro aspecto relativo a la decisión de establecer un programa de control, es el hecho que en países en vías de desarrollo las enfermedades del ganado tienen efectos más amplios y duraderos en el mercado y en el nivel de vida de la población, dada la complejidad de las cadenas de valor del ganado (53). Para enfrentar esta situación pueden ser de valor estrategias participativas con productores como las que han demostrado efectividad para aumentar el conocimiento y habilidades de las comunidades rurales en aspectos de salud animal de pequeños rumiantes (54).
Tratamientos antiparasitarios
Uno de los principales métodos de control de O. ovis es la aplicación de antiparasitarios. La extinción de las larvas de oestridos, pudiera ocurrir mediante la generalización eficaz de medicamentos antiparasitarios en los animales infestados y la co-extinción de hospederos que estén en peligro de desaparecer (56). Colwell et al. (9), notifican como efectiva la aplicación de las lactonas macrocíclicas endectocidas, por la elevada sensibilidad de los miembros de Oestridae, a ellas. Matos et al. (57) mediante la aplicación subcutánea de una formulación comercial de ivermectina al 1% a razón de 200 mcg/Kg o closantel oral al 5% en dosis de 2 mL/10 Kg de peso, logran 100% de eficacia terapéutica en ovinos infestados naturalmente por el agente en Cuba.
El uso de tratamientos sistemáticos durante el período de actividad de las moscas y el comienzo del período de hipobiosis, parece ser muy eficiente en el control de O. ovis y puede lograr un control eficaz del agente (40, 56). Esta estrategia no solo garantiza la eliminación de larvas de los animales parasitados, sino que influye en la dinámica poblacional del insecto con disminución de la probabilidad de que se generen nuevas infestaciones en otros individuos y rebaños.
Las diferencias en la estacionalidad del parásito (18, 19,20,41,42) pueden ser más notables en países templados, pero donde todo el año existen temperaturas favorables para el desarrollo de O. ovis, la periodicidad de los tratamientos puede depender de las condiciones ambientales de cada región, ya que éstas influyen en el número de ciclos que puede completar la mosca.
En Guantánamo la relación porcentual de los diversos estadios parasitarios encontrados en animales infestados en el mes de noviembre indican que la mosca se encontraba activa en este momento del año (57). Con independencia de las consideraciones de estacionalidad, Scott (40) señala tratar solo cuando se observen infestaciones altas de los rebaños. Una posibilidad de lograr efectos duraderos con una sola aplicación de antiparasitarios es el empleo de formulaciones de larga acción (LA); por ejemplo la moxidectina LA al 2%, que mantiene los animales libres de la infestación por al menos 80 días (58).
Los tratamientos como el pilar fundamental de un programa de control deben considerar diversos aspectos como el momento de aplicación y su relación con otras intervenciones antihelmínticas con ivermectinas, dada su capacidad de acción dual contra los estadios larvarios de O. ovis (40). Estas intervenciones requieren considerarse de forma integral para en lo posible hacer coincidir los tratamientos antiparasitarios de amplio espectro con los momentos referidos como más adecuados (57) para el tratamiento de la oestrosis. Esta consideración es de importancia porque las enfermedades parasitarias se encuentran entre las más frecuentes que afectan los ovinos y caprinos (28). De otra parte, la efectividad de los tratamientos en un rebaño puede controlarse mediante la vigilancia activa de los animales más jóvenes, especialmente ovinos, dada la mayor frecuencia de infestación que presentan que los convierten en un sistema eficaz de alerta rápida (59).
REFERENCIAS
1. Spradbery JP. Screw-worm Fly: a Tale of Two Species. Agric Zoo Reviews. 1994;6(3):1-62.
2. Zumpt F. Myiasis in man and animals. In: The Old World. Butterworths 1965; pp 267. Londres, UK.
3. James MT. A study in the origin of parasitism. Bull Entomol Soc Am. 1964;15:251-253.
4. Gracía MJ, Lucientes J, Peribáñez MA, Castillo JA, Calvete C, Ferrer LM. Epidemiology of Oestrus ovis infection of sheep in Northeast Spain (mid-Ebro Valley). Trop Anim Health Prod. 2010;42(5):811-813.
5. Angulo-Valadez CE, Ascencio F, Jacquiet P, Dorchies P, Cepeda-Palacios R. Sheep and goat immune responses to nose bot infestation: A review. Med Vet Entomol. 2011;25(2):117-125.
6. Puebla Domínguez HM, Zaldivar Quintero N, Soñora Bonilla R. Oestrosis. Aspectos biológicos de la miasis cavitaria ovina. REDVET. 2005;VI(9):1-4.
7. Matos V, Torres R, Betancourt RD, Frómeta L, Díaz Matos M, Dubrooks Z, et al. Oestrus ovis (Diptera: Oestridae) en ovinos en Cuba. Rev Salud Anim. 2008;30(3):189-191.
8. Rodríguez Diego JG, Olivares JL, Sánchez Castilleja Y, Cortés S. Generalidades de Evolución y Taxonomía de parásitos. Términos más utilizados en Parasitología Veterinaria. 2013. Editorial Academia Española, Deutsehlan, Alemania.
9. Colwell DD, Hall MJR, Scholl PJ. A synopsis of the biology, hosts, distribution, disease significance and management of the genera. En: DD Colwell, MJR Hall y PJ Scholl (eds.), The Oestrid Flies: Biology, HostParasite Relationships, Impact and Management 2006; pag. 220-305, CABI Publishing, UK.
10.Cepeda-Palacios R, Scholl PJ. Factors affecting the larvipositional activity of Oestrus ovis gravid females (Diptera: Oestridae). Vet Parasitol. 2000;91(1-2):93-105.
11.Cepeda-Palacios R, Angulo-Valadez CE, Scholl JP, Ramírez-Orduña R, Jacquiet Ph, Dorchies PH. Ecobiology of the sheep nose bot fly (Oestrus ovis L.): a review. Rev Méd Vét. 2011;162(11):503-507.
12.Cepeda R. Studies of pupal and ovary development in the sheep botfly Oestrus ovis L. (Diptera: Oestridae) and conditions favoring the larvipositional activity of gravid flies. PhD. Thesis. 2000. Northwest Biological Research Center. La Paz, Mexico.
13.Guitton C, Dorchies Ph. Etude des larves d' Oestrus ovis (Linné 1761) en microscopie électronique à balayage. Rev Méd Vét. 1993;144:687-692.
14.Guitton C, Morand S, Dorchies Ph. Scanning electron microscopy of larval instars and imago of Rhinoestrus usbekistanicus Gan 1947 (Oestridæ). Parasite. 1996;38(2):155-159.
15.Guitton Ch, Pérez JM, Dorchies Ph. Scanning electron microscopy of larval instars and imago of Oestrus caucasicus (Grunin, 1948) (Diptera: Oestridae). Parasite. 2001;8(2):155-160.
16.Matos V, Rodríguez Diego JG, Alfonso P, Olivares J. Morfometría de Oestrus ovis (Diptera: Oestridae) de ovinos, en Cuba. Rev Salud Anim. 2012;34(3):184-187.
17.Cepeda R, Greene E, Loya JG, Espinoza JL. Incidencia de Oestrus ovis en rebaños de ovinos y caprinos en Baja California Sur. Rev Inv Cient Cs Agrop. 1993;4:29-36.
18.Alem F, Kumsa B, Degefu H. Oestrus ovis larval myiasis among sheep and goats in Central Oromia, Ethiopia. Trop Anim Health Prod. 2010;42(4):697-703.
19.Gebremedhin EZ. Prevalence of ovine and caprine oestrosis in Ambo, Ethiopia. Trop Anim Health Prod. 2011;21(1):265-270.
20.Papadopoulos E, Chaligiannis I, Morgan E. Epidemiology of Oestrus ovis L (Diptera: Oestridae) larvae in sheep and goats in Greece. Small Ruminant Research. 2010;89(1):51-56.
21.Poddighe S, Dekker T, Scala A, Angioy AM. Olfaction in the female sheep botfly. Naturwissenschaften. 2010;97(9):827-35.
22.Sotiraki S, Hall MJR. A review of comparative aspects of myiasis in goats and sheep in Europe. Small Ruminant Research. 2012;103(1):75-83.
23.da Silva BF, Bassetto CC, Shaw RJ, Canavessi AM, Amarante AF. Parasitism by Oestrus ovis: Influence of sheep breed and nematode infections. Vet Parasitol. 2012;186(3-4):437-444.
24.Yilma JM, Dorchies PH. Epidemiology of Oestrus ovis in southwest France. Vet Parasitol. 1991;40(3-4):315-323.
25.Rogers CE, Knapp FW, Cook D, Crowe MV. A temperature study of the overwintering site of the sheep bot fly Oestrus ovis L. J Parasitol. 1968;54(1):164-165.
26.Breev KA, Sultanov FR. On some developmental peculiarities of nasal sheep botfly larvae, Oestrus ovis L. (Diptera, Oestridae). Parasitologiya. 1975;9:47-56.
27.Yacob HT, Jacquiet PH, Prevot F, Bergeaud JP, Bleuart C, et al. Examination of the migration of first instar larvae of the parasite Oestrus ovis (Linné 1761) (Diptera: Oestridae) in the upper respiratory tract of artificially infected lambs and daily measurements of the kinetics of blood eosinophilia and mucosal inflammatory response associated with repeated infection. Vet Parasitol. 2004;126(3):339-347.
28.Demeler J, Schein E, von Samson-Himmelstjerna G. Advances in laboratory diagnosis of parasitic infections of sheep. Vet Parasitol. 2012;189(1):52-64. http://dx.doi.org/10.1016/j.vetpar.2012.03.032.
29.Nilssen AC. Effect of temperature on pupal development and eclosion dates in the reindeer oestrids Hypoderma tarandi and Cephenemyia trompe (Diptera: Oestridae). Physiol Chem Ecol. 1997;26(2):296-306.
30.Angulo-Valadez CE, Scholl PJ, Cepeda-Palacios R, Jacquietd Ph, Dorchies Ph. Nasal bots… a fascinating world! Vet Parasitol. 2010;174(1-2):19-25.
31.Alcaide M, Reina D, Frontera E, Navarrete I. Epidemiology of Oestrus ovis (Linneo, 1761) infestation in goats in Spain. Vet Parasitol. 2005;130(3/4):277-284.
32.Anderson J. Adult biology. En: Colwell DD, Hall MJR, Scholl PJ (eds.), The Oestrid Flies: Biology, Host-Parasite Relationships, Impact and Management 2006; pag 140-165, CABI Publishing, UK.
33.Semenov PV, Gomoiunova NP, Tarasenko NN. Radius of flight of Oestrus ovis. Veterinariia. 1975;8:58-59.
34.Tabouret G, Vouldoukis I, Duranton C, Prevot F, Bergeaud JP, Dorchies P, et al. Oestrus ovis (Diptera: Oestridae): effects of larval excretory/secretory products on nitric oxide production by murine RAW 264.7 macrophages. Parasite Immunol. 2001;23(3):111-119.
35.Tabouret G, Bret-Bennis L, Dorchies P, Jacquiet P. Serine protease activity in excretory-secretory products of Oestrus ovis (Diptera: Oestridae) larvae. Vet Parasitol. 2003;114(4):305-314.
36.Innocenti L, Masetti M, Macchioni G, Giorgi F. Larval salivary gland proteins of the sheep nasal bot fly (Oestrus ovis L.), are major immunogens in infested sheep. Vet Parasitol. 1995;60(3-4):273-282.
37.Angulo-Valadez CE, Cepeda-Palacios R, Ascencio F, et al. Proteolytic activity in salivary gland products of sheep bot fly (Oestrus ovis) larvae. Vet Parasitol. 2007;149(1-2):117-125.
38.Dorchies P, Tabouret G, Hoste H, Jacquiet PH. Oestrinae host-parasite interactions. En: Colwell DD, Hall MJR, Scholl PJ (eds.), The Oestrid Flies 2006; pag. 359, CABI Publishing, UK.
39.Lupi O. Could ectoparasites act as vectors for prion diseases? Int J Dermatol. 2003;42(6):425-429.
40.Scott PR. Treatment and Control of Respiratory Disease in Sheep. Vet Clin Food Anim. 2011;27(1):175-186.
41.Arslan M, Kara M, Gicik Y. Epidemiology of Oestrus ovis infestations in sheep in Kars province of north-eastern Turkey. Trop Anim Health Prod. 2009;41(3):299-305.
42.Shoorijeh SJ, Tamadon A, Negahban S, Behzadi MA, Biglari SM. Seasonal infection rates of Oestrus ovis. OJVR 2010;14(2):302-310.
43.Milillo P, Traversa D, Elia G, Otranto D. Analysis of somatic and salivary gland antigens of third stage larvae of Rhinoestrus spp. (Diptera: Oestridae). Exp Parasitol. 2010;124(4):361-364.
44.Hendawy SHM, Allam NAT, Kandil OM, Ahmed AZ, Desouky ARAY, El-Seify MA. Immunological Evaluation of the Diagnostic Values of Cephalopinatitillator Different Larval Antigens in Camels from Egypt. Global Vet. 2013;10(2):158-164.
45.Angulo-Valadez CE, Cepeda-Palacios R, Ascencio F, et al. IgG antibody response against salivary gland antigens from Oestrus ovis L. larvae (Diptera: Oestridae) in experimentally and naturally infected goats. Vet Parasitol. 2009;161(3-4):356-359.
46.Sistema de Vigilancia Epizootiológica (SIVE) de la República de Cuba. 2012. Registro de datos de focos de oestrosis. Instituto de Medicina Veterinaria.
47.El-Tahawy AS. The prevalence of selected diseases and syndromes affecting Barki sheep with special emphasis on their economic impact. Small Ruminant Research. 2010;90(1):83-87.
48.Baza R, Delgado R, Peña A. Regionalización climática digital provincia Guantánamo. Compilado a partir del Estudio Climático. 1996.
49.Oficina Nacional de Estadísticas (ONE). Anuario Estadístico de Cuba. 2010. Disponible en: http://www.one.cu/aec2010/esp/09_tabla_cuadro.htm (Fecha de consulta: enero 25, 2012).
50.Matos V, Fonseca O, Ferrer E, Martin J, Elias A, Rodríguez J, et al. Ecological niche for the establishment of Oestrus ovis L. (Diptera: Oestridae) in Cuba. Proceedings of the 13th International Symposium on Veterinary Epidemiology and Economics, ISVEE 13, 2012; pag 195, Maastricht, Netherlands.
51.Morgan ER, Wall R. Climate change and parasitic disease: farmer mitigation? Trends in Parasitol. 2010;25(7):308-313.
52.Singer A, Salman M, Thulke HH. Reviewing model application to support animal health decision making. Prev Vet Med. 2011;99(1):60-67.
53.Rich KM, Perry BD. The economic and poverty impacts of animal diseases in developing countries: New roles, new demands for economics and epidemiology. Prev Vet Med. 2011;101(3-4):133-147.
54.Vatta AF, de Villiers JF, Harrison LJ, Krecek SRC, Pearson RA, Rijkenberg FHJ, et al. A framework for the transfer of animal health knowledge to rural goat owners. Small Ruminant Research. 2011;98(1):26-30.
55.da Silva BF, Bassetto CC, do Amarante AFT. Epidemiology of Oestrus ovis (Diptera: Oestridae) in sheep in Botucatu, State of São Paulo. Rev Bras Parasitol Vet Jaboticabal. 2012;21(4):386-390.
56.Colwell DD, Otranto D, Stevens JR. Oestrid flies: eradication and extinction versus biodiversity. Trends Parasitol. 2009;25(1):500-504.
57.Matos V, Rodríguez Diego JG, Alfonso P, Martín J, Mengana E, Pérez E, et al. Eficacia antiparasitaria de ivermectina y closantel contra Oestrus ovis en ovinos infestados naturalmente. Rev Salud Anim. 2011;33(3):184-189.
58.Rugg D, Ferrer LM, Sarasola P, et al. Persistent efficacy of a long acting injectable formulation of moxidectin against natural infestations of the sheep nasal bot (Oestrus ovis) in Spain. Vet Parasitol. 2012;188(3-4):330-336. doi: 10.1016/j.vetpar.2012.03.057.
59.Paredes-Esquivel C, Del Rio R, Monerris M, Borràs D, Laglera LM, Miranda MÁ. The influence of sheep age group on the seasonal prevalence of oestrosis in the island of Majorca. Vet Parasitol. 2012;186(3-4):538-541.
Recibido: 20-2-2012.
Aceptado: 15-10-2012.