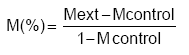Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión impresa ISSN 0253-570X
Rev Salud Anim. vol.36 no.1 La Habana ene.-abr. 2014
ARTÍCULO ORIGINAL
Efecto in vitro de extractos acuosos de Moringa oleifera y Gliricida sepium en el desarrollo de las fases exógenas de estrongílidos gastrointestinales de ovinos
In vitro effect of Moringa oleifera and Gliricida sepium aqueus extracts in the development of non- parasitic stages of sheep gastrointestinal strongyles
Mileydy Puerto AbreuI, Javier Arece GarcíaII*, Yoel López LeyvaII ,Yaima RocheII, Michael MolinaII, Argemiro SanavriaIII, Adivaldo H. da FonsecaIII
IEmpresa de Ganado Menor. Establecimiento Colón. Matanzas. Cuba.
IIEstación Experimental de Pastos y Forrajes «Indio Hatuey» de la Universidad de Matanzas Camilo Cienfuegos. Central España Republicana. CP. 44280. Matanzas. Cuba.
IIILaboratório de Doenças Parasitárias. Departamento de Epidemiologia e Saúde Pública. Instituto de Veterinária. Universidade Federal Rural do Rio de Janeiro. Seropédica. RJ. Brasil.
RESUMEN
Con el objetivo de determinar el efecto antiparasitario, in vitro, de extractos acuosos de Moringa oleifera y Gliricidia sepium en las fases exógenas del ciclo biológico de estrongílidos gastrointestinales de ovinos, se prepararon extractos acuosos, para cada planta, en tres concentraciones (50, 25 y 12,5 mg/ml) y se evaluó su actividad sobre la eclosión de huevos y la migración de las larvas del tercer estadio, comparado con controles positivos (Albendazol o Levamisol) y negativos (PBS y DMSO). En el primer ensayo se realizaron once tratamientos que corresponden a las tres concentraciones de M. oleifera (MOR-50, MOR-25 y MOR-12,5), G. sepium (GLR-50, GLR-25 y GLR-12,5), PBS (control negativo, solvente de los extractos), Albendazol (control positivo) (ABZ-5, ABZ-2,5, ABZ-1,25) y DMSO (control negativo, solvente del ABZ). En la migración larvaria se utilizaron las mismas concentraciones del extracto acuoso de cada planta, un control negativo (PBS) y uno positivo en tres concentraciones (Levamisol, LEV-5, LEV-2,5, LEV-1,25). Las dos plantas inhibieron la capacidad de eclosión de huevos, con mayor tasa de inhibición (p<0,05), para M. oleifera. El análisis Probit demostró que la concentración efectiva media fue de 60,92 y 30,70 mg/ml para M. oleifera y G. sepium, respectivamente. Las dos plantas mostraron efectos (p<0,05) sobre la migración larvaria, comparadas con los controles, con tasas de inhibición de la migración por encima de 97%. Los resultados in vitro sugieren que las dos plantas poseen propiedades antiparasitarias que pudieran ser valoradas en posteriores estudios in vivo.
Palabras clave: Moringa oleifera, Gliricidia sepium, Antihelmíntico, ovinos, Strongylida.
ABSTRACT
A research was carried out aimed at determining the in vitro anthelmintic effects of aqueous extracts of Moringa oleifera and Gliricidia sepium on the non-parasitic stages of sheep gastrointestinal strongyles. The activity of three concentrations were evaluated (50, 25 and 12,5 mg/ml) on egg hatching and larval migration, compared with negative (PBS or DMSO) and positive controls (Albendazole or Levamisole). The egg hatching assay was carried out with eleven treatments corresponding to the three concentrations: (M. oleifera: MOR-50, MOR-25 and MOR-12,5 mg/ml and G. sepium: GLR-50, GLR-25 and GLR-12,5 mg/ml), PBS and DMSO (negative controls) and three Albendazole concentrations (ABZ-5, ABZ-2,5, ABZ-1,25 mg/ml). For the larval migration test, the same plant extract concentrations were used, and also PBS as negative control and three Levamisole concentrations (LEV-5, LEV-2,5, LEV-1,25 mg/ml). The results showed that the two plants interfered on egg hatching with higher inhibition rates (p<0,05) for M. oleifera. A Probit analysis showed an effective concentration of 60,92 and 30,70 mg/ml for M. oleifera and G. sepium, respectively. Both plants affected (p<0,05) the larval migration ability, as compared to the controls, showing migration inhibition over 97%. This in vitro screening suggests that these plants have anthelmintic properties, and further in vivo studies are needed.
Key words: Moringa oleifera, Gliricidia sepium, Anthelmintic, sheep, Strongylida.
INTRODUCCIÓN
La búsqueda de alternativas que minimicen el uso de los antihelmínticos en pequeños rumiantes constituye una de los principales retos en el contexto actual, donde la resistencia a los principales medicamentos antiparasitarios se acentúa, como resultado de su uso indiscriminado (1). Esta situación se agudiza por el lento desarrollo, a corto plazo, de moléculas antiparasitarias.
Diferentes estrategias se han estudiado con el objetivo de encontrar soluciones a la problemática del parasitismo gastrointestinal en ovinos. Entre ellos se destacan los relacionados con el uso de plantas con potencialidades antiparasitarias (2, 3).
Los estudios in vitro constituyen una herramienta de mucha utilidad para discriminar plantas con propiedades antiparasitarias (4,5,6,7). Estos poseen como principio su corta duración y bajo costo para su realización, además de fiabilidad con los modelos actuales para la evaluación de fármacos antiparasitarios.
En Cuba existen experiencias en el uso de fitofármacos en el control parasitario. El resultado de mayor impacto se desarrolló en Bromelia pinguin (Piña de ratón), la cual mostró ser efectiva ante Haemonchus spp. en terneros (8) y posteriormente se evaluó en México en infestaciones por Oesophagostomum columbianum en ovinos (9).
En la actualidad, muchos de los productores de pequeños rumiantes usan en la alimentación de sus rebaños árboles y arbustos forrajeros proteicos. Resultaría interesante demostrar en la práctica social que estos, además de contribuir a la mejora de la dieta de los animales, tuvieran propiedades antiparasitarias. En tal sentido, el objetivo del presente estudio fue evaluar el efecto antiparasitario in vitro de extractos acuosos de Moringa oleifera y Gliricidia sepium sobre las fases exógenas de estrongílidos gastrointestinales de ovinos.
MATERIALES Y MÉTODOS
El estudio se desarrolló en el Laboratorio de Parasitología de la Estación Experimental de Pastos y Forrajes «Indio Hatuey», situada en la provincia de Matanzas. Las hojas de M. oleifera y G. sepium se cosecharon en horario de la mañana (8:00-8:30 am) de áreas experimentales pertenecientes a la Institución. Posteriormente, se realizó una extracción acuosa con PBS en fresco (10) con el empleo de nitrógeno líquido. A partir de ello, se preparó una solución madre de 500 mg/ml. Para los ensayos se utilizaron tres concentraciones: 50, 25 y 12,5 mg/ml.
Prueba de eclosión de huevos (PEH). Estos ensayos se realizaron a partir de modificaciones de las técnicas descritas por Hubert y Kerboeuf (11) y Marie-Magdeleine et al. (3). Para ello se conformaron once tratamientos que corresponden a las tres concentraciones de M. oleifera (MOR-50, MOR-25 y MOR-12,5), G. sepium (GLR-50, GLR-25 y GLR-12,5), PBS (control negativo, solvente de los extractos), Albendazol (control positivo) (ABZ-5, ABZ-2,5, ABZ-1,25), y Dimetil sulfóxido, DMSO (control negativo, solvente del ABZ). Se colectaron huevos de estrongílidos de animales infestados según lo descrito por Hubert y Kerboeuf (12) y se depositaron en placas de cultivo celular de 24 pocillos, para ser enfrentados con las diferentes soluciones o tratamientos experimentales, sobre la base de un diseño completamente aleatorizado con seis réplicas por tratamiento. Se incubaron por 48 h y, transcurrido ese tiempo, se detuvo la eclosión con 100 µL de solución de Lugol. Se contaron larvas y huevos en 20 alícuotas de 10 µL, y se determinó el porcentaje de eclosión.
Prueba de migración larvaria (PML). El principio de esta prueba consistió en enfrentar larvas del tercer estadio (L3) obtenidas mediante coprocultivos (13) a las tres concentraciones del extracto acuoso de cada planta, un control negativo (PBS) y uno positivo (Levamisol) en tres concentraciones (LEV-5, LEV-2,5, LEV-1,25). Los ensayos consistieron en enfrentar las larvas L3 a las soluciones por 2 horas en un tubo de ensayo Falcon® cónico y, después de sucesivos lavados con PBS se pusieron a migrar a través de un tamiz de 20 µm en un dispositivo preparado para este fin. Posteriormente, se determinó la cantidad de larvas migradas y se calculó el porcentaje de migración (14).
Análisis estadístico. Los datos se procesaron con el paquete estadístico SPSS®. Los valores porcentuales (X) de cada prueba se transformaron ( ) para la realización de un análisis de varianza de clasificación simple. Se comprobó la homogeneidad de las varianzas y la distribución normal de los datos. Las diferencias entre las medias se realizaron mediante la prueba de comparación de rangos múltiples de Duncan (15). Los porcentajes de eclosión y migración larvaria se corrigieron mediante la fórmula de Abbott:
Donde:
M (%)- Eclosión o Migración, según corresponda
M ext.- Eclosión o Migración de los extractos o grupo control positivo.
M control- Eclosión o Migración del grupo control negativo con PBS.
Se realizó un análisis de regresión Probit para la determinación de la concentración efectiva (CE50) de cada planta, en la eclosión de los huevecillos (16).
RESULTADOS Y DISCUSIÓN
La principal ventaja del empleo de ensayos in vitro para discriminar plantas con propiedades antihelmínticas incluye el bajo costo relativo y su rápida respuesta, lo que permite trabajar a gran escala, con una cantidad considerable de plantas. Adicionalmente, los ensayos in vitro poseen la ventaja de que se puede trabajar al mismo tiempo en diferentes fases del desarrollo de los parásitos, ya sea en la validación de la eclosión de huevecillos, el desarrollo, desenvainamiento y la migración de las larvas, hasta incluso con parásitos adultos, sin interferir en las funciones fisiológicas de los hospederos (2, 17, 18).
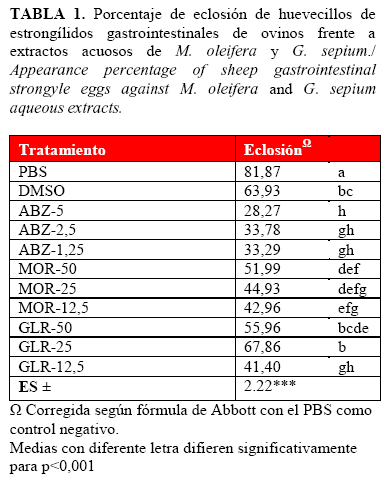
En la Tabla 1 se muestra el porcentaje de eclosión de cada tratamiento.
Se aprecia que los extractos en las concentraciones utilizadas, interfirieron en la eclosión de los huevecillos de estrongílidos gastrointestinales en las concentraciones utilizadas. Los grupos control negativo (DMSO y PBS) presentaron los porcentajes de eclosión más altos (p<0,05), en relación con todos los extractos de plantas. Esta situación indica la inocuidad de la solución tampón (PBS) y del DMSO. Por su parte, la tasa de eclosión obtenida con el grupo control positivo (ABZ) fue la más baja (p<0,001), lo cual ratifica el efecto ovicida de este fármaco (19).
Las dos plantas lograron inhibir de manera significativa (p<0,001) la eclosión de huevos, con efecto dependiente de las dosis empleada. Estos valores estuvieron entre 41,40 y 67,86 % con los mejores resultados para la concentración más baja (41,40 % en dosis de 12,5 mg/ml) de G. sepium.
En estudios realizados con extractos de Spigelia anthelmia (14) y Melia azedarach (17) se obtuvieron resultados similares en la inhibición de la eclosión de huevecillos de H. contortus. Por su parte, en Cuba con Azadirachta indica (20) se encontró tasas de eclosión inferior a las del presente estudio, lo que pudo estar relacionado con los efectos directos de la azadirachtina o algunos metabolitos secundarios como los triterpenoides y los taninos condensados, a los cuales se les atribuyen efectos ovicidas (21). En una investigación desarrollada con extractos de mango (Mangifera indica) en Brasil (22) se apreció una tasa de inhibición de la eclosión de un 95,66 %, en concentraciones de 50 mg/ml, con efecto dependiente de la dosis empleada.
Los porcentajes de eclosión obtenidos son también similares a los hallados con extractos acuosos de semillas de Carica papaya y superiores a los de hojas de yuca (M. esculenta) (12,35 %) y plátano (Musa paradisiaca) (6,14%), obtenidos en Guadalupe (23).
En la Tabla 2 se aprecian las regresiones realizadas para el análisis Probit.
La CE50 más baja encontrada fue para G. sepium con valores 50% inferiores en relación con M. oleifera, lo cual está posiblemente relacionado con las diferencias en los perfiles y concentraciones de los metabolitos secundarios presentes en cada una de ellas.
La concentración efectiva media (a veces empleada la dosis letal media, DL50) presenta variaciones en función de la especie de nematodo frente al extracto, lo cual se justifica por la individualidad de cada especie de helminto y el tipo de planta. En Pakistán se encontró efectos antiparasitarios en Adhatoda vasica con DL50 entre 14 y 15 mg/ml para H. contortus, T. colubriformis y O. columbianum (24).
La medición de la capacidad de migración de las larvas a través de un tamiz de 20 µm (Fig. 1) demostró que los extractos, en sus tres concentraciones, tuvieron efectos inhibitorios en la motilidad de las mismas. Mediante este estudio, se demostró que el PBS no interfirió de manera significativa en la capacidad migratoria de los estadios infestivos, mientras que con el Levamisol solo migró del 6 al 13%. Este fármaco es un potente larvicida que produce una parálisis espástica por actuar como antagonista selectivo en los receptores nicotínicos y acetilcolínicos (sinápticos y postsinápticos) de las células musculares de los parásitos (25).
Las mayores tasas de inhibición de la migración larvaria se encontraron (p<0,05) para M. oleifera y G. sepium, superiores a las del grupo control positivo (Levamisol). Estos resultados son inferiores a los reportados en extractos metanólicos de yuca (M. esculenta) y huevo de gallo (Tabernaemontana citrifolia), con valores de 57,6 % y 50,6 % para cada uno, respectivamente (3,14). El efecto de inhibición de la capacidad de migración de las larvas se atribuye a la presencia de metabolitos secundarios con propiedades antiparasitarias, como los taninos condensados (26), las lectinas (27, los terpenoides (17) y flavonoides (28).
En el caso de M. oleifera, se encontró en un tamizaje fitoquímico la presencia de alcaloides, glicósidos, flavonoides, esteroides, terpenoides, saponinas, taninos y antraquinonas (29), mientras que en Nigeria (30) se encontraron concentraciones de taninos condensados (TC) de 21,9 %. Por su parte, G. sepium es una planta que presenta una gran variedad de metabolitos secundarios, tales como saponinas, taninos y alcaloides (31) y también se han encontrado concentraciones de TC entre 3,6 y 4,6 % (32).
Es muy probable que los TC (fundamentalmente en M. oleifera) sean los principales responsables de la actividad inhibitoria de la migración larvaria. La forma en que los TC actúan, continúa en un debate profundo. Sobre el tema, existen dos hipótesis: la primera de ellas se sustenta en los posibles efectos directos de estas sustancias al poseer la capacidad de formar complejos con las proteínas de los parásitos del tracto gastrointestinal (33). Estos, se considera que actúan de dos formas fundamentales: I) unión a las proteínas libres, lo que reduce la cantidad de nutrientes disponibles y las larvas mueren o, II) unión a la cutícula de la larva que es rica en glicoproteínas, causando la muerte de la larva (34). Esta hipótesis constituye la más aceptada en estudios in vivo de corta duración o en estudios in vitro. En adición, los taninos intervienen en la disminución de la capacidad fecundativa de los parásitos (35) y, directamente sobre los parásitos adultos (36, 37).
Es muy probable que los efectos antiparasitarios no sean solo por algún metabolito secundario en particular, sino por la presencia combinada de ellos. Es conocido que la M. oleifera (38) y el G. sepium (27) poseen niveles considerables de lectinas. Posiblemente, la combinación de los efectos de los TC condensados y este metabolito secundario contribuyeron a inmovilizar mayor cantidad de larvas y posiblemente interfirieron en la capacidad de migración de las L3 de nematodos gastrointestinales de ovinos.
AGRADECIMIENTOS
El proyecto fue cofinanciado por el Ministerio de la Agricultura (Proyecto No. P131LH001-0072) y el Programa CAPES/MES-Proyectos. Agradecemos también a la Dra. Carine Marie-Magdeleine de la Unité de Recherches Zootechniques del INRA, Guadeloupe, por la asistencia técnica en estas investigaciones.
REFERENCIAS
1. Arece J, Mahieu M, Archimède H, Aumont G, Fernández M, González E, et al. Comparative efficacy of six anthlemintics for the control of nematodes in sheep in Matanzas, Cuba. Small Rum Res. 2004;5(1-2):61-67.
2. Githiori JB, Athanasiadou S, Thamsborg SM. Use of plants in novel approaches for control of gastrointestinal helminths in livestock with emphasis on small ruminants. Vet Parasitol. 2006;139:308-320.
3. Marie-Magdeleine Carine, Udino L, Philibert L, Bocage B, Archimede H. In vitro effects of Cassava (Manihot esculenta) leaf extracts on four development stages of Haemonchus contortus. Vet Parasitol. 2010;1-2: 85-92.
4. Alawa CBI, Adamu AM, Gefu JO, Ajanusi OJ, Abdu PA, Chiezey NP, et al. In vitro screening of two Nigerian medicinal plants (Vermonia amygdalina and Annona senegalensis) for anthelmintic activity. Vet Parasitol. 2003;113:73-81.
5. Diehl MS, Atindehou KK, Téré H, Betschart B. Prospect for anthelmintic plants in the Ivory Coast using ethno-botanical criteria. J Ethnopharmacol. 2004;95:277-284.
6. Maciel MV, Morais SM, Bevilaqua CM, Camurça-Vasconcelos AL, Costa CT, Castro CM. Ovicidal and larvicidal activity of Melia azedarach extracts on Haemonchus contortus. Vet Parasitol. 2006;140:98-104.
7. Bizimenyera ES, Githiori JB, Eloff JN, Swan GE. In vitro activity of Peltophorum africanum Sond (Fabaceae) extracts on the egg hatching and larval development of the parasitic nematode Trichostrongylus colubriformis. Vet Parasitol. 2006;142:336-343.
8. Marrero Evangelina, Alfonso HA, García Teresita, Rodríguez-Diego JG, Figueredo María de los Ángeles, Pérez R. Actividad antihelmíntica de Bromelia pinguin L. (Bromeliaceae) en terneros. Rev Salud Anim. 1994;16(1-3):63-68.
9. Olivares J. Oesophagostomum columbianum: Puesta en evidencia, caracterización y control en ovinos de la región de Huichapán, Estado de Hidalgo, México. Tesis presentada en opción al grado de Doctor en Ciencias Veterinarias. CENSA. La Habana, Cuba. 2001; 137 p.
10.Díaz Maykelis, Pérez Y, Cazaña Yanet, Prieto Marlene, Wencomo Hilda, Lugo Yudit. Determinación de antioxidantes en variedades e híbridos de Morus alba. Pastos y Forrajes. 2010;33(3):301-310.
11.Hubert J, Kerboeuf D. A new method for culture of larvae used in diagnosis of ruminant gastrointestinal strongylosis: Comparison with fecal cultures. Can J Comp Med. 1984;48:63-71.
12.Hubert J, Kerboeuf D. A microlarval development assay for the detection of anthelmintic resistance in sheep nematodes. Vet Rec. 1992;130:442-446.
13.Roberts FHS, O´Sullivan JP. Methods for egg counts and larval cultures for strongyles infesting the gastrointestinal tract of cattle. Aust J Agr Res. 1950;1:99-102.
14.Marie-Magdeleine Carine, Mahieu M, D'Alexis S, Philibert L, Archimede H. In vitro effects of Tabernaemontana citrifolia extracts on Haemonchus contortus. Res Vet Sci. 2010;89(1):88-92.
15.Duncan D. Multiple ranger and multiple F. Test. Biometric. 1955;1:11.
16.Waller PJ, Dobson RJ, Donald AD, Griffiths DA, Smith EF. Selection studies on anthelmintic resistant and susceptible populations of Trichostrongylus colubriformis of sheep. Int J Parasitol. 1985;15:669-676.
17.Molan AL, Meagher LP, Spencer PA, Sivakumaran S. Effect of flavan-3-ols on in vitro egg hatching, larval development and viability of infective larvae of Trichostrongylus colubriformis. Int J Parasitol. 2003;33:1691-1698.
18.Assis LM, Bevilaqua CML, Morais Vieira LS, Costa CTC, Souza JAL. Ovicidal and larvicidal activity in vitro of Spigelia anthelmia Linn. extracts on Haemonchus contortus. Vet Parasitol. 2003;117:43-49.
19.Martín RJ, Robertson AP, Bjorn H. Target sites of anthlelmintics. Parasitol. 1997;114: S111-S124.
20.Barrabí Mireysi, Arece J. Actividad antihelmíntica in vitro de extracto acuoso de hojas y semillas de Neem (Azadirachta indica A. Juss). I. Inhibición de la eclosión de huevos y del desarrollo larvario. Rev Salud Anim. 2013;35(2):103-108.
21.Pesoa LM. Actividade ovicida in vitro de plantas medicinais contra Haemonchus contortus. Tesis en opción al grado de Máster en Parasitología Veterinaria. Universidade Estadual do Ceará. Brasil. 2001; 68 p.
22.Costa CTC, Morais SM, Bevilaqua DE, Souza CML, et al. Efeito ovicida de extratos de sementes de Mangifera indica L. sobre Haemonchus contortus. Rev Bras Parasitol Vet. 2002;11:57-60.
23.Marie-Magdeleine Carine. Etude de ressources végétales tropicales pour un usage anthelminthique en élevage de ruminants. Tesis presentada en opción al grado de Doctor en Ciencias Agronómicas. Universidad de las Antillas, Guadalupe F.W.I. 2009; 276 p.
24.Al-Shaibani IR, Phulan M, Arijo A, Qureshi TA. Ovicidal and larvicidal properties of Adhatoda vasica (L.) extracts against gastrointestinal nematodes of sheep in vitro. Pakistan Vet J. 2008;28(2):79-83.
25.Martin RJ. Modes of Action of Anthelmintic Drugs. Vet J. 1997;154:11-34.
26.Nguyen TM, Binh DV, Ørskov RV. Effect of foliages containing condensed tannins on gastrointestinal parasites. Anim Feed Sci Tech. 2005;121:77-87.
27.Ríos de Álvarez Leyla, Jackson F, Greer A, Bartley Y, Bartley DJ, et al. In vitro screening of plant lectins and tropical plant extracts for anthelmintic properties. Vet Parasitol. 2012;186:390-398.
28.Ademola IO, Akanbi AI, Idowu SO. Anthelmintic activity of Leucaena leucocephala chromatographic seed fractions on gastrointestinal sheep nematodes. Pharm Biol. 2005;45:599-604.
29.Sinha SN. Phytochemical analysis and antibacterial potential of Moringa oleifera Lam. IJSID. 2012;2(4):401-407.
30.Ogbe AO, Affiku JP. Proximate study, mineral and anti-nutrient composition of Moringa oleifera leaves harvested from Lafia, Nigeria: potential benefits in poultry nutrition and health. J Microbiol, Biotechn Food Sci. 2012;1(3):296-308.
31.García DE, Medina María G. Composición química, metabolitos secundarios, valor nutritivo y aceptabilidad relativa de diez árboles forrajeros. Zootecnia Trop. 2006;24(3):233-250.
32.Romero Claudia, Palma JM, López J. Influencia del pastoreo en la concentración de fenoles totales y taninos condensados en Gliricidia sepium en el trópico seco. LRRD. 2000;12(4).
33.Mueller-Harvey I. Unraveling the conundrum of tannins in animal nutrition and health. J Sci Food Agr. 2006;86:2010-2037.
34.Cala C, Chagas ACS, Oliveira MCS, Matos AP, Borges LMF, et al. In vitro Anthelmintic effect of Melia azedarach L. and Trichilia claussenii against sheep gastrointestinal nematodes. Exp Parasitol. 2012;130:98-102.
35.Martínez-Ortíz de Montellano Cintli, Vargas-Magaña JJ, Canul-Ku HL, Miranda-Soberanis R, Capetillo-Leal C, et al. Effect of a tropical tannin-rich plant Lysiloma latisiliquum on adult population of Haemonchus contortus in sheep. Vet Parasitol. 2010;172:283-290.
36.Manolaraki F, Sotiraki S, Stefanakis A, Skampardonis V, Volanis M, Hoste H. Anthelmintic activity of some Mediterranean browse plants against parasitic nematodes. Parasitol. 2010;137:684-696.
37.Martínez-Ortíz de Montellano Cintli, Arroyo-López C, Fourquaux I, Torres-Acosta JFJ, Sandoval-Castro CA, Hoste H. Scanning electron microscopy of Haemonchus contortus exposed to tannin-rich plants under in vivo and in vitro conditions. Exp Parasitol. 2013;133:281-286.
38.Coelho Juliene, Santos ND, Napoleão TH, Gomes FS, Ferreira RS, et al. Effect of Moringa oleifera lectin on development and mortality of Aedes aegypti larvae. Chemosphere. 2009;77:934-938.
Recibido: 10-9-2013.
Aceptado: 8-11-2013.
*Correspondencia: Javier Arece García. Estación Experimental de Pastos y Forrajes «Indio Hatuey» de la Universidad de Matanzas «Camilo Cienfuegos». Central España Republicana. CP. 44280. Matanzas. Cuba. Email: arece@ihatuey.cu.