Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop v.29 n.1 La Habana ene.-mar. 2008
REVISIÓN BIBLIOGRÁFICA
CONSIDERACIONES GENERALES EN LA OBTENCIÓN, CARACTERIZACIÓN E IDENTIFICACIÓN DE LOS OLIGOGALACTURÓNIDOS
Ms.C. Yuliem Mederos I, e. mail: yuliem@inca.edu.cu y Dra.C. Josefa HormazaII
I Investigadora del Departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), Gaveta Postal 1, San José de las Lajas, CP 32700
II Investigadora Titular del Departamento de Investigaciones Analíticas, Instituto Cubano de Investigaciones Azucareras (ICINAZ), Carretera al Central Manuel Martínez Prieto km 2 1/2, Ciudad de La Habana, Cuba
ABSTRACT
Oligogalacturonides are pectic oligosaccharides derived from the polygalacturonic acid. they have a high biological activity, which is closely related to their polymerization degree. This paper presents the general aspects involved for obtaining, identifying and characterizing oligogalacturonides. It also deals with the main methods currently used for oligogalacturonide identification and characterization, the capillary and gel electrophoreses standing out recently, as well as different effects they have on plants.
Key words: bioproducts, plant growth substances, oligosaccharides, pectins
RESUMEN
Los oligogalacturónidos son oligosacáridos pécticos derivados del ácido poligalacturónico. tienen una elevada actividad biológica muy relacionada con el grado de polimerización que estos presenten. En este trabajo se reflejan los aspectos generales involucrados en la obtención, identificación y caracterización de los oligogalacturónidos. Se abordan los principales métodos que se emplean en la actualidad para su identificación y caracterización, destacándose recientemente la electroforesis capilar y en gel, así como los disímiles efectos que los oligogalacturónidos ejercen en las plantas.
Palabras clave: productos biológicos, sustancias de crecimiento vegetal, oligosacáridos, pectinas
Introducción
El creciente desarrollo de la agricultura ha favorecido la demanda de nuevos productos de origen natural, que permitan el incremento de las producciones agrícolas, beneficien el desarrollo de los cultivos y no sean factor de contaminación del medio ambiente.
Las nuevas investigaciones sugieren el empleo de productos bioactivos, como sustitutos de los productos de origen químico, dados los efectos beneficiosos que estos ejercen en las plantas, tales como la inducción de mecanismos defensivos y estimulación del crecimiento vegetal, siendo una de sus ventajas fundamentales no ser dañinos a las plantas ni al medio ambiente (1).
Los oligogalacturónidos están entre las oligosacarinas más estudiadas; su actividad biológica depende de la estructura química del oligosacárido y su concentración en el medio celular. Se ha demostrado que están involucrados en los mecanismos de regulación de diferentes procesos relacionados con el crecimiento, desarrollo, la maduración e incluso organogénesis de las plantas ( 2).
Estos pueden obtenerse a partir de la hidrólisis ácida o enzimática del ácido péctico. Se consideran oligosacáridos lineales de unidades de ácido D-galacturónico unidos por enlaces del tipo a (1-4) y han sido estudiados tanto por la respuesta biológica que desencadenan en las plantas, en dependencia de su grado de polimerización, como por la posibilidad de permitir la elucidación de la estructura de la pectina, mediante el estudio de la obtención, separación y cuantificación de los oligogalacturónidos metilesterificados.
En este trabajo se abordan los aspectos fundamentales sobre la obtención, detección y cuantificación de los oligogalacturónidos, y se argumentan los efectos que estos ejercen en las plantas, dada la actividad biológica que manifiestan.
Aspectos generales
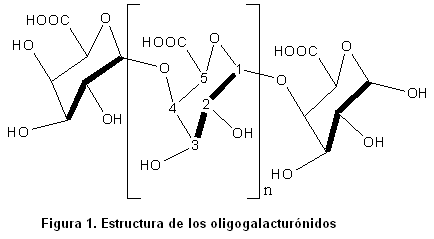
Los oligogalacturónidos son oligómeros lineales de unidades de ácido D-galacturónico unidos por enlaces del tipo a (1-4). La estructura más estable del anillo piranósido del ácido D-galacturónico es la conformación de silla 4C1 (3).
Los enlaces glicosídicos entre los carbonos ubicados en las posiciones uno y cuatro se presentan en la posición axial-axial. El número de restos de D-galacturonatos que contiene el oligosacárido permite definir su grado de polimerización (GP).
Los ácidos poligalacturónicos (PGA) son sintetizados en el aparato de Golgi, con altos niveles de carboximetilesterificación del carbono C-6 en los residuos de ácido galacturónico. En la pared celular la metil esterificación es parcialmente removida por las pectin metiles-terasas (4).
La estructura química de estos oligosacáridos se encuentra representada a continuación.
Preparación. Estos pueden ser preparados por hidrólisis ácida o enzimática de la pared celular vegetal o el ácido poligalacturónico (5). La síntesis química no es una vía que se emplee con frecuencia para obtener estos oligosacáridos (6), debido al alto costo de estos procedimientos y a la existencia de desechos de productos agrícolas enriquecidos en polisacáridos pécticos, a partir de los cuales se pueden preparar estos oligosacáridos con altos rendimientos y bajos costos mediante la hidrólisis enzimática.
La hidrólisis ácida ofrece la ventaja de no ser necesaria la purificación de la enzima en la obtención, pero la hidrólisis enzimática produce un mayor rendimiento y los oligogalacturónidos obtenidos por esta vía no son expuestos a las condiciones drásticas de la hidrólisis química, que puede alterar la estructura de algunos oligogalacturónidos (7).
Existen diferentes informes en la literatura referentes al método de obtención de los oligogalacturónidos mediante hidrólisis enzimática. Uno de ellos es el desarrollado por Simpson (8) para obtener oligogalacturónidos con GP<8 empleando como sustrato el ácido poligalacturónico (PGA) (Sigma) y la enzima poligalacturonasa (Sigma) preparada a partir de Aspergillus niger.
Otro procedimiento similar es el empleado por Bellincampi (9), cuando realizó una digestión parcial del poligalacturonato de sodio (sal del ácido péctico) con endopoligalactu-ronasa homogénea proveniente de Aspergillus niger, obteniendo mezclas de oligogalacturónidos con un grado de polimerización variable desde 1 hasta 18 residuos. Otros (10) desarrollaron un procedimiento muy parecido a los anteriores, con la particularidad de emplear una a 1-4 endopoligalacturonasa homogénea a partir de Fusarium moniliforme.
El método desarrollado por Cabrera (3) permite la obtención de una mezcla de oligogalacturónidos con un grado de polimerización entre 9 y 16, a partir de una hidrólisis enzimática del ácido péctico obtenido de Pectina comercial con la enzima comercial Pectinex Ultra SPL.
Separación. Los hidrolizados pécticos obtenidos mediante la hidrólisis ácida o enzimática contienen una mezcla de moléculas pécticas con una dispersión de pesos moleculares bastante amplia (3). Esto hace necesario el desarrollo de diferentes procedimientos de separación selectiva o cromatográficos para aislar a los oligogalacturónidos y otros galacturonatos de interés. La separación de estos oligogalactu-rónidos es necesaria para los estudios de validación biológica y, en muchos casos, se hace imprescindible para el análisis estructural de los polisacáridos de la pared celular de las plantas y en el estudio del modo de acción de las enzimas pectinolíticas.
En función de ello, se ha logrado aislar las mezclas de oligogalactu-rónidos con un grado de polimeriza-ción entre 3 y 7, utilizando un método de precipitación selectiva, en una solución de cloruro de bario y etanol (11).
Dentro de los procedimientos basados en la precipitación selectiva de los grupos de oligogalactu-rónidos presentes en un hidrolizado enzimático, está el desarrollado por Spiro (12), el cual se basa en la poca solubilidad de los polisacáridos en presencia de sales y etanol; así, en presencia de 50 mM de acetato de sodio y 11 % de etanol, los oligogalac-turónidos con GP entre 7 y 25 precipitan, mientras quedan en solución el ácido galacturónico y los oligogalacturónidos con grado de polimerización entre 2 y 7 (10).
Otra vía de separación de los oligogalacturónidos consiste en marcar los extremos reductores de los oligos con 2-aminopiridina y luego analizarlos por cromatografía líquida de intercambio aniónico de alta resolución (HPAEC) empleando un gradiente de acetato de sodio. El método determina cantidades de oligogalacturónidos comparándolos con una referencia interna por encima de 0.5 y 20 nmol por oligómero (13). Se requieren aproximadamente cinco horas de incubación en la 2-aminopiridina para obtener los máximos resultados y los tamaños de los oligómeros independientes de la derivatización. Para que puedan ser analizados por esta técnica, los oligogalacturónidos deben tener extremos reductores y estar desesterificados antes de la derivatización para poder identificar la longitud de la cadena. Esta técnica es válida para aquellos oligómeros que presentan una longitud de cadena de 3 a 25 unidades de residuos. Las posibilidades que esta técnica ofrece van desde la simple caracterización de una mezcla de oligogalacturónidos hasta su purificación para ser empleados en bioensayos (13).
La cromatografía de intercambio aniónico de alta resolución acoplada a un detector de impulso amperomé-trico (HPAEC-PAD) se utiliza en la separación de ácidos oligogalactu-rónicos no derivatizados con un grado de polimerización entre 2 y 50; la fase estacionaria utilizada es un intercambiador aniónico Carbo Pac PA1 (14) y la fase móvil es un gradiente lineal de buffer oxalato de potasio a pH 6, lo que permite separar los fragmentos pécticos. Esta metodología permite utilizar este gradiente solo en separaciones de ácidos oligogalacturónicos que sean solubles en este solvente (GP menores de 20) (14).
La HPAEC ha sido empleada para la separación de los oligoga-lacturónidos (9), desde el punto de vista preparativo de estos con grado de polimerización de 1 a 18 residuos, utilizando una columna semipreparativa CarboPac PA1 (9 3 250 mm). Otros también han empleado este método con excelentes resultados (10, 15, 16).
Algunos (17) han usado la cromatografía de exclusión por tamaño de alta resolución (HPSEC) y la cromatografía de intercambio iónico de alta resolución (HPIEC), para la separación y cuantificación de los oligogalacturónidos. Estos refieren que la utilización de la HPSEC presenta muy buenos resultados, mientras que la HPIEC con columnas PRP-X600 y elusión en gradiente de acetato de amonio a pH 5.5 no permite resolver más de siete picos.
La cromatografía de intercambio iónico en columna abierta constituye un método conveniente para una purificación substancial de grandes cantidades de oligogalacturónidos con altos valores de su GP, en particular, con los intercambiadores fuertes ManoQ (3) y Q-Sepharose en intercambio aniónico (10). El uso de gradientes lineales de los tampones de elusión logra una resolución satisfactoria en poco tiempo (3).
Otro método es el desarrollado por Simpson para separar oligos con un gp entre 1-8 residuos, dializando repetidamente el hidrolizado péctico con agua y concentrándolo por evaporación, para su posterior separación por cromatografía de intercambio aniónico empleando una columna QAE-Sephadex A-25 (Pharmacia, 2.5 × 60 cm) y un gradiente linear de buffer formiato de amonio; las sales de los picos individuales son eliminadas empleando una columna Sephadex G-25 matrix (Pharmacia) y agua desionizada como eluyente. Para separar los oligómeros con GP 5-15, Simpson empleó la separación descrita por Spiro (12) y mantuvo el procedimiento descrito anteriormente.
La electroforesis en gel de poliacrilamida es otro de los métodos que permite separar los oligogalacturónidos en función de su grado de polimerización. El empleo de oligogalacturónidos patrones permite determinar la relación entre el grado de polimerización y el corrimiento de la banda correspondiente (18).
Caracterización química. Se considera establecida la estructura completa de un oligosacárido cuando se ha determinado su grado de polimerización, la naturaleza de los monómeros, el tamaño de los anillos (piranósido o furanósido) y la posición de los enlaces entre los diferentes monosacáridos. Es necesario, además, definir la configuración anomérica (a o b) y la conformación de las unidades de monosacáridos (3).
En los poligalacturonatos provenientes de las pectinas de origen vegetal, los ácidos urónicos se presentan solo en forma piranósida y unidas por enlaces del tipo a (1-4). Esto establece que los parámetros más importantes para confirmar la estructura de los oligogalacturónidos obtenidos de estas fuentes sean definir su grado de polimerización y su composición en monosacáridos (3).
Se han empleado disímiles procedimientos para definir el grado de polimerización de estos oligosacáridos. Entre ellos la cromatografía permite determinar el grado de polimerización de un oligogalacturónido de su posición relativa en un cromatograma, respecto a miembros conocidos de su serie homóloga. Con estos fines se han utilizado: la cromatografía de papel (11), cromatografía de capa fina (19), cromatografía de intercambio iónico en columna abierta (3, 10), cromatografía líquida de alta presión (HPLC) (20) o HAE- PAD (21), HPAEC- PAD (14,10,15 ), HPAEC-ELS (16); en todos estos casos, la movilidad del oligosacárido es inversamente proporcional a su grado de polimerización, mientras que en la cromatografía de exclusión por tamaño HPSEC (16), la movilidad es directamente proporcional a su GP. El hecho de que los oligosacáridos eluyen en orden creciente o decreciente de su grado de polimerización, permite determinar su masa molecular, estableciendo su orden de elusión relativo a los miembros conocidos de la misma serie (3).
El grado de polimerización de los oligosacáridos reductores, particularmente los que poseen bajas masas moleculares, puede determinarse por su poder reductor. El cociente entre la concentración en monosacáridos totales de una solución del oligosacárido y su concentración en azúcares reductores es utilizado como estimado de su grado de polimerización (3). En el caso de los oligogalacturónidos, se ha utilizado con este fin la determinación de ácidos urónicos totales por la técnica del m-hidroxidifenilo y la determinación de azúcares reductores por el método de Nelson. En ambos casos, se utiliza ácido monogalacturónico como sustancia patrón (22), las diferencias en el poder reductor de miembros sucesivos de la serie homóloga de estos oligosacáridos disminuye con el incremento de su grado de polimerización, por lo que este procedimiento solo es recomendable en el caso de los oligosacáridos con GP=5.
La espectrometría de masa permite determinar con exactitud las masas de los oligosacáridos puros (8, 9, 10). En el caso de los oligogalacturónidos, se ha logrado determinar la masa molecular de los oligosacáridos sin derivatizar con un GP hasta 15, utilizando como ionizador el método de bombardeo rápido de átomos (FAB) en modo negativo (23).
Se combinan métodos estadísticos y enzimáticos en la determinación del tamaño de los bloques demetilados de homogalacturanos con un grado variable de esteri-ficación. Para ello se utilizan las enzimas endopoligalacturonasa y exopoligalacturonasa, lo que reafirma la acción de las polimetiles-terasas provenientes de plantas, hongos y bacterias sobre los ácidos galacturónicos metilados. (24). Estos métodos tienen la incapacidad de detectar y cuantificar directamente los oligogalacturónidos con un tamaño superior a los trímeros (16).
Aun cuando la detección por pulso amperométrico ha sido empleada para hallar los oligómeros con gp de hasta 50 residuos (14) y más recientemente los oligómeros con gp de hasta 70 (16), no es conveniente para la cuantificación de los oligogalacturónidos individuales, por no estar estandarizada y disponible, a consecuencia de que la respuesta del detector decrece marcadamente con el incremento de la longitud del oligómero (16).
Se ha publicado la separación electroforética capilar (25) y por gel (26, 27) de oligómeros de ácidos galacturónicos. El método de electroforesis capilar permite estimar las cantidades molares, pero está limitado a oligómeros con GP menores de 15-20 (25).
Otros autores (17) han utilizado el detector de dispersión de luz evaporativa (ELS) acoplado a un sistema cromatográfico de exclusión por tamaño, para estimar la masa de los oligómeros con un GP de 20, encontrando que la resolución de la línea base se pierde luego de analizar oligómeros con un GP de 3, lo que conlleva a que las mezclas complejas no puedan ser analizadas. Al igual que los detectores de masa, el ELS no depende de la presencia de un cromóforo en el analito y la línea base no se ve afectada por una elusión en gradiente, cuando se utilizan componentes volátiles del buffer (16). También se ha utilizado el detector de luz evaporativa (ELS) acoplado a un sistema cromatográ-fico de intercambio iónico de alta resolución (HPAEC), para la detección, separación y cuantificación de oligómeros de ácidos galacturónicos, incrementándose el limite de detección en un 40 % por encima de los límites previos encontrados previamente (16).
Aspectos generales de las enzimas Pécticas
Las enzimas pécticas son aquellas que degradan las sustancias pécticas como sustratos naturales, pueden aparecer en las plantas superiores o ser producidas por diferentes microorganismos. Las enzimas pécticas endógenas son capaces de producir importantes cambios estructurales en los frutos y vegetales durante la maduración y su almacenamiento. La activación o inactivación de estas enzimas tiene una influencia decisiva sobre las etapas del procesamiento de estos productos (28).
Las enzimas pécticas microbianas son determinantes en la patología vegetal y los alimentos fermentados, pero también son producidas por vía biotecnológica para su utilización en la industria alimentaria. Estas pueden clasificarse en dos grupos, dependiendo del tipo de actividad que catalizan: desesterificantes (pectina esterasas) y depolimerizantes. Las primeras pueden dividirse a su vez según la naturaleza del grupo éster que hidrolicen (metil, acetil o feruil), catalizando la hidrólisis de los ésteres metílicos de los ácidos poligalacturónicos, liberando metanol al medio y convirtiendo las pectinas en ácidos pécticos (29). En el otro se encuentra una serie amplia de enzimas depolimerizantes. Las enzimas incluidas dentro de este grupo pueden atacar preferentemente a las zonas lineales (HG) o ramificadas (RG) y ser divididas según tres criterios como mínimo.
El sustrato que prefieran: pectina, ácidos pécticos, protopectina u oligo-Dgalacturonatos
Si actúan por hidrólisis o transeliminación
Por el sitio de ataque a la cadena: aleatoriamente dentro de la cadena (endo) o desde el extremo de ella (exo).
Dentro de las enzimas que atacan al homogalacturano se encuentran las esterasas, hidrolasas, liasas y protopectinasas. Las esterasas, a su vez, se clasifican en pectin metil esterasas y pectin acetil esterasas. Las primeras se caracterizan por cortar los enlaces éster del C-6 liberando metanol al medio y convirtiendo la pectina de alto grado de esterificación en pectatos de bajo grado de esterificación. Estas enzimas son producidas por plantas superiores: tomate, cítricos, papa, manzana, banana, uva, etc, así como por varios hongos y bacterias (30). Las segundas rompen el enlace éster entre el acético y los carbonos tres o cuatro de los restos de ácido galacturónico de la región de homogalacturonano (31).
Las hidrolasas se subdividen en Endopoligalacturonasas, Exopoligalac-turonasas, Polimetilgalacturonasas, Oligogalacturonasas, Liasas, Pectin-liasas, Pectato liasas, Endopoliga-lacturonatoliasas, Exopoligalactu-ronatoliasas, Oligogalacturonato liasas y Protopectinasas (29). En lo adelante se amplía la información relacionada con las dos primeras hidrolasas, por su vinculación en la obtención de oligogalacturónidos.
Las Endopoligalacturonasas (endo-PG) actúan sobre el ácido poligalacturónico o ácidos pécticos liberando monómeros de ácidos galacturónicos u oligómeros (29). Su acción puede dividirse en dos subclases, según corten una cadena de homogalacturanos: un ataque múltiple (a cadena simple) o la separación del sustrato luego del corte para unirse a un nuevo blanco (ataque simple a cadenas múltiples) (32); su actividad (grado y velocidad de hidrólisis) disminuye con el incremento del grado de esterificacion (33).
Las endopoligalacturonasas (PG) son producidas por una gran variedad de microorganismos, tales como los hongos, las bacterias, las plantas, que están envueltas en muchos procesos fisiológicos y patológicos, caracterizados por la degradación y remodelación de la pared celular de las plantas. Las poligalacturonasas fúngicas que presentan carácter endo en su modo de acción, catalizan la fragmentación y solubilización de los polímeros pécticos por la escisión de los enlaces internos de los homogalacturanos (34).
Los ensayos viscosimétricos y colorimétricos son generalmente utilizados para cuantificar la actividad endopoligalacturonasa (endo-PG). Las hidrolasas escinden el enlace de los polisacáridos en sitios específicos; esta característica les permite ser utilizadas para analizar tanto la estructura de los polisacáridos como la especificidad de las hidrolasas (35). Luego de la hidrólisis, las muestras pueden ser analizadas tanto por HPLC (36) como mediante electroforesis capilar y electroforesis de gel de carbohidratos (27), para separar y cuantificar los ácidos galacturónicos producidos por esta enzima; sin embargo, pueden existir fenómenos de agregación al estudiar los oligogalacturónidos por HPLC, ya sea por intercambio iónico o cromatografía de exclusión por tamaño (26).
Por su parte, las exopoligalac-turonasas (exo-PG) se presentan con una frecuencia menor que las endopoligalacturonasas (endo-PG). Estas enzimas son producidas por hongos y algunas bacterias (37).
Dos tipos de exo-PG pueden ser identificados según su origen y su mecanismo de acción. Las enzimas fúngicas producen ácido monogalacturónico a partir del extremo no reductor como producto principal de reacción. Poseen pH óptimos comprendidos entre 4.0 y 6.0. Este grupo de enzimas se denominan galacturonan 1,4-a- galacturonidasa o exo-PG de tipo I; un ejemplo de este tipo de enzimas es la producida por Coniothyrium diplodiella (32).
En contraposición, las enzimas de origen bacteriano como la generada por Erwinia aroideae o Selenomonas ruminantium (38) producen digalacturónico como producto principal. Estas enzimas se denominan exo-poli-a-galacturonidasa o exo-PG 2. Al igual que las de tipo 1, atacan al sustrato por su extremo no reductor (29).
La actividad de las exopoligalac-turonasas puede ser medida a partir de la cuantificación de grupos reductores liberados de una solución de pectina por el método del DNS (Dinitrosalicílico) (39), las lecturas se realizan a 575nm. La determinación de los azúcares reductores liberados se realiza empleando como patrón el ácido monogalacturónico. Una unidad enzimática (U) estaría determinada por la cantidad de enzima que libera un mmol de ácidos monogalacturónicos por minuto en las condiciones experimentales, que quedaría expresada como mmol/ml.
En caso de presencia simultánea de las enzimas exoPG y endoPG, la actividad endo se puede analizar viscosimétricamente. Este método es muy sensible y se basa en el cambio de viscosidad de una solución de ácido poligalacturónico, cuando sobre este actúa la enzima. Una actividad de endoPG se define arbitrariamente como la cantidad de enzima que provoca una disminución del 50 % de la viscosidad del sustrato en un minuto (3).
La actividad exo en cambio no puede ser determinada de forma específica en estas condiciones, por lo que se ha introducido el parámetro de relación de comparación (RC) proporcional al carácter endo de una preparación pectolítica (40).
RC= actividad viscosimétrica endoPG/
actividad poligalacturonasa total
Actividad biológica en las plantas
Los carbohidratos que actúan como moléculas señalizadoras en las plantas se denominan oligosacarinas, que se extraen de los polisacáridos de la pared celular de plantas y hongos, a partir de los simbiontes bacterianos de las plantas. Los oligogalacturónidos son oligosaca-rinas derivadas de la pared celular de las plantas que liberan respuestas biológicas en estas (41).
Los efectos biológicos liberados en las plantas por las oligosacarinas son diversos, pero generalmente pueden ser ubicados en dos grupos: respuestas retardadas y respuestas rápidas. Las retardadas son observadas horas y días después del tratamiento con las oligosacarinas y frecuentemente están envueltas en la adaptación de las condiciones medioambientales. Las rápidas generalmente se observan en la superficie celular de las plantas unos minutos después de haberse añadido las oligosacarinas (41).
Las respuestas retardadas liberadas por los oligogalacturónidos pueden ser ampliamente dividas en aquellas que inducen respuestas defensivas y las que modifican el crecimiento y desarrollo. Las relacionadas con la defensa, dependiendo de la especie de la planta, incluyen la acumulación de fitoalexinas, lignificación de las paredes celulares y acumulación de inhibidores de proteasa, que requieren la presencia del extremo reductor en el carbono C-1 de los di y trigalacturónidos (41).
Las respuestas involucradas en el crecimiento y desarrollo incluyen la inducción de etileno en frutos de tomate (8, 42) y la acumulación de etileno en tallos de guisantes (19), fundamentalmente con el empleo de oligómeros de cadena corta; la inhibición de la auxina, que induce el alargamiento del tallo en los guisantes (19) y la estimulación de la floración (43).
Estas propiedades le han permitido a los oligogalacturónidos ser utilizados como reguladores en la morfogénesis de los explantes de tabaco (Nicotiana tabacum) (44) y tomate (Lycopersicon esculentum, Mill) var. Amalia (45), como promotores de enraizamiento en margullos de ficus (Ficus benjamina) (46) y como biorreguladores en la organogénesis in vitro del Anthurium cubense (47).
Los estudios realizados (48) con una mezcla de oligogalacturónidos bioactivos con grado de polimeriza-ción entre 8 y 16 mostraron incrementos altamente significativos en el crecimiento (altura, diámetro del tallo, longitud radical) del Tagasaste.
Estos resultados fueron consistentes con otros anteriores (49), al emplear la misma mezcla en semillas de tomate de la variedad Amalia, encontrando cierta relación entre la concentración de oligogalacturónidos empleada y el momento de la siembra de las semillas.
Otros estudios realizados con mezclas de oligogalacturónidos y grado de polimerización entre 8 y 16 en violetas africanas (50) y claveles chinos (51) mostraron un aumento en el número de raíces en las primeras, lo que repercute en un incremento en el número de explantes, así como en la longitud y el número de nudos en el tallo de los segundos, lo que favorece el empleo de dichas mezclas en la propagación in vitro en ambos casos.
Es importante resaltar que las diferencias en el pH, fuerza iónica o composición iónica del medio usado en el sistema de cultivo de tejido, puede afectar el enlace entre los oligogalacturónidos y sus receptores, y su conformación tanto directa como indirectamente (41).
Para estudiar el modo de acción de los oligogalacturónidos, es imprescindible definir el tamaño de la estructura que es reconocida por la planta y que puede interactuar con el receptor de la superficie (8).
Al realizar un estudio sobre el efecto antagónico que manifiestan en la alcalinización extracelular los ácidos oligogalacturónicos y el ácido indolacético en raíces de pepino, Spiro (10) plantea que los oligogalacturónidos con un GP entre 10 y 14 son más activos que aquellos fuera de este rango. Dentro de este rango, los OGA que presentan la mayor actividad son los que tienen un GP entre 10 y 12, seguidos por aquellos con un GP de 13. Los OGA con un GP de 9, 14 y 16 presentan una actividad mucho menor que la de los OGA con GP de 10-12 y 13. Por su parte, los OGA con un GP de 3, 5 y 7 no inducen respuestas de alcalinización.
Estos estudios indican que los OGA actúan por un mecanismo específico de alta afinidad, de manera similar a las hormonas clásicas en las plantas; sin embargo, no se ha demostrado que los OGA activos de apropiado tamaño estén presentes en las plantas (10). Este trabajo mostró que la alcalinización inducida por los oligogalacturónidos no está acompañada por una alteración en el crecimiento de las raíces en el pepino y que independientemente de que el empleo de 50 µmol induce máximas respuestas de alcaliniza-ción, este se acompaña de un crecimiento en las raíces; de esta forma, al establecer un monitoreo del crecimiento de las raíces por espacio de seis horas, luego de ser aplicada la solución de oligogalacturónidos, a los 90 minutos de tratadas las raíces se observó un crecimiento del 116 %± 12 % con respecto al pretratamiento.
Algunos autores (2) manifiestan que el tamaño mínimo requerido por los oligogalacturónidos para liberar respuestas biológicas está dado por la inhabilidad de los oligogalactu-rónidos con GP menores que 9 de formar la egg-box, refiriendo que el flujo iónico en las células del tabaco y las zanahorias y la acumulación de fitoalexinas en las células de las zanahorias requieren de un GP mínimo de 9 ó 10 y de la presencia de Ca2+ milimolar. Sin embargo, existen informes de que los oligómeros de pequeño tamaño, incapaces de formar complejos con el Ca2+, también son capaces de inducir efectos en las plantas (8); ejemplo de ello son los estudios realizados por Bishop (52), al observar las respuestas en las heridas de plantas de tomate, encontrando que los oligogalacturónidos con GP 2-9 inducen la producción de proteínas inhibidoras de proteasa.
Por todo lo expuesto anteriormente, se puede concluir que los oligogalacturónidos presentan gran actividad biológica, que está determinada por su grado de polimeriza-ción, por lo que ellos pueden ser utilizados con fines agrícolas, con el fin de aumentar los rendimientos, promover el enraizamiento y la micropropagación in vitro, etc.
REFERENCIAS
1. Pospieszny, H. Potential use of chitosan in plant protection. En: Chitin and Chitosan. Polish-Russian Monograph. Eds: Struszczyk, H. Pospienzny, H. and Gamzazade; 1999, p 115-130.
2. Van Cutsem, P. y Messiaen, J. Biological effects of pectic fragments in plant cells. Acta Bot Neerl, 1994, vol. 3, no. 3, p. 231-245.
3. Cabrera, J. C. Obtención de (1-4)-a-D-Oligogalacturónidos bioactivos a partir de los subproductos de la industria citrícola [Tesis doctoral]; Universidad de La Habana, 2000.
4. Barton, C. J.; Tailford, L. E.; Welchman, H.; Zhang, Z.; Gilbert, H. J.; Dupree, P. y Goubet, F. Enzymatic fingerprinting of Arabidopsis pectic polysaccharides using polysaccharide analysis by carbohydrate gel electrophoresis (PACE). Planta, 2006, vol. 224, p. 163-174.
5. Ló, V. M.; Hahn, M. G. y Van Halbeek, H. Preparation, purification and structural characterization of linear oligogalacturonides. An FBAB mass espectrometric and NRM spectroscopy study. Carbohydrate Research, 1994, vol. 255, p. 271-284.
6. Nakahara, Y. y Ogawa, T. Síntesis of (1-4) linked galacturonic acid trisaccharides, a proposed plant wound hormone and a stereoisomer. Carbohydrate Research, 1990, vol. 200, p. 363-375.
7. Coté, F. y Hahn, M. G. Oligosaccharins: Structure and signal transduction. Plant Molecular Biology, 1994, vol. 26, p. 1379-1411.
8. Simpson, S. D.; Ashford, D. A.; Harvey, D. J. y Bowles, D. J. Short chain oligogalacturonides induce ethylene production and ex-pression of the gene encoding aminocyclopropane 1-carboxylic acid oxidase in tomato plants. Glycobiology, 1998, vol. 8, no. 6, p. 579-583.
9. Bellincampi, D.; Dipierro, N.; Salvi, G.; Cervone, F.; Delorenzo, G. Extracellular H2O2 induced by Oligogalacturonides is not involved in the inhibition of the auxin-regulated role gene expression in tobacco leaf explants. Plant Physiology, 2000, vol. 122, p. 1379-1385.
10. Spiro, M. D.; Bowers, J. F. y Cosgrove, D. J. A. Comparison of Oligogalacturonide- and auxin-induced extracellular alkalinization and growth responses in roots of intact cucumber seedlings. Plant Physiology, 2002, vol. 130, p. 895-903.
11. Edstrom, R. D. y Phaff, H. J. Eliminate cleavage of pectin and oligogalacturonide methyl ester by pectin transeliminase. J. of Biological Chemistry, 1964, vol. 239, no. 8, p. 2409-2415.
12. Spiro, M. D.; Kates, K. A.; Koller, A. L.; O’neill, M. A.; Albersheim, P.y Darvill, A. G. Purification and characterization of biologically active 1,4-a-D-oligogalacturonides after partial digestion of polygalacturonic acid with endopolygalacturonase. Carbohydrate Research, 1993, vol. 247, p. 9-20.
13. Maness, N. O. y Mort, A. J. Separation and quantitation of galacturonic acid oligomers from 3 to over 25 residues in length by anion-exchange high-performance liquid chromatography. Anal. Biochem., 1989, vol. 178, no. 2, p. 248-254.
14. Hotchkiss, A. T. Jr. y Hicks, K. B. Analysis of oligogalacturonic acid with 50 or fewer residues by high- performance anion-exchange chromatography and pulse amperometric detection. Anal. Biochem., 1990, vol. 184, p. 200-206.
15. Alebeek, G. J.; Scherpenzeel, K.; Beldman, G.; Schols, H. A. y Voragen, A. G. Partially esterified oligogalacturonides are the preferred substrates for pectin methylesterase of Aspergillus Níger. Biochem. J., 2003, vol. 372, p. 211-218.
16. Cameron, R. G. y Grohmann, K. Separation, detection and quantification of Galacturonic Acid Oligomers with a degree of polymerization greater than 50. Journal of Liquid Chromatography & Related Technologies, 2005, vol. 28: p. 559-570.
17. Cameron, R.G. /et al./. Utilization of an evaporative light scattering detector for high-performance size-exclusion chromatography of galacturonic acid oligomers. J Chromatography, 2003, vol. 1011, p. 227-231.
18. Bellincampi, D. /et al./. Oligoga-lacturonides inhibits the formation of roots on tobacco explants. The Plant Journal, 1993, vol. 4, no. 1, p. 207-213.
19. Branca, C.; Delorenzo, G. y Cervone, M. Competitive inhibition of the auxin-induced elongation by oligogalacturonides in pea stem segments. Physiologia Plantarum, 1988, vol. 72, p. 499-504.
20. Messiaen, J. y Van Cutsem, P. Defense gene transcription in carrot cells treated with oligogalacturonides. Plant Cell Physiology, 1993, vol. 34, no. 7, p. 1117-112.
21. Reymond, P. /et al./. Oligogalac-turonidase defense signals in plants: large fragments interact with the plasma membrane in vitro. Self-defense by plants: induction and signaling pathways. Presented at a colloquium held on September 15-17, 1994, in Irvine, California, USA. Procceding-of-the-National-Academy-of-Sciences-of-the-United-States-of-America, 1995, vol. 92, no. 10, p. 4145-4146.
22. Moscatiello, R.; Mariani, P.; Sanders, D. y Maathuis, F. J. Transcriptional analysis of calcium-dependent and calcium-independent signalling pathways induced by oligogalacturonides. Journal of Experimental Botany, 2006, vol. 57, no. 11, p. 2847-2865.
23. Boudart, G. /et al./. Elicitors and suppressors of hydroxyproline-rich glycoprotein accumulation are solubilized from plant cell wall by endopolygalacturonase. Eur. J. Biochem., 1995, vol. 232, p. 449-457.
24. Limberg, G. /et al./. Analysis of different de-esterification mecha-nisms for pectin by enzymatic finger printing using endopectin lyase and endopolygalacturonase II from A niger. Carbohydr. Res., 2000, vol. 327, p. 293-307.
25. Strom, A. y Williams, M. A. K. On the separation, detection and quantification of pectin derived oligosaccharides by capillary electroforesis. Carbohydr. Res., 2004, vol. 339, p. 1711-1716.
26. Goubet, F.; Morriswood, B. y Dupree, P. Analysis of methylated and unmethylated polygalactu-ronic acid structure by poly-saccharide analysis using carbohydrate gel electrophoresis. Analytical Biochemistry, 2003, vol. 321, p. 174-182.
27. Goubet, F. /et al./. Resolution of the structural isomers of partially methylesterified oligogalac-turonides by polysaccharide analysis using carbohydrate gel electrophoresis. Glycobiology, 2006, vol. 16, no. 1, p. 29-35.
28. Fernández, B. J.; Rodriguez, R.; Guillen, R.; Jimenez, A. y Heredia, A. Activity of cell wall-associated enzymes in ripening olive fruit. Physiol. Plant 1995, vol. 93, no. 4, p. 651-658.
29. Fernando, S. C. Crecimiento de Geotrichum klebahnii y expresión de Protopectinasa-SE. [Tesis doctoral]. Universidad Nacional de la Plata (on line). Disponible en: www.cindefi.com.ar (Consultado 1-1-07).
30. Pilnik, W. y Voragen, A. G. The significance of endogenous and exogenous pectic enzymes in fruit and vegetable processing. En P. F. Fox (ed.), Food Enzymology. New York. Elsevier Applied Science, 1991.
31. Voragen, A. G.; Pilnik, W.; Thibault, J. F.; Axelos, M. A. y Renard, C. Pectins. En A. M. Stephen (ed.). Food polysaccharides and their applications. New York. Marcel Dekker, 1995, p. 287-339.
32. Fogarty, W. y Kelly, C. T. Pectic enzimes. En W. Fogarty (ed.), Microbial Enzymes and Biotechnology. New York. Applied Science, 1983.
33. Rexova-Benková, L. y Markovic, O. Pectic enzymes. En R. S. Tipson & D. Horton (eds.), Adv. Carbohyd. Chem.and Biochem., 1976.
34. Federici, L.; Caprari, C.; Mattei, B.; Savino, C.; Di Matteo, A.; Delorenzo, G.; Cervone, F. y Tsernoglou, D. Polygalacturonase for the interaction with PGIP endo structural requirements of (polygalacturonase-inhibiting protein). PNAS 2001, 98; 13425-13430.
35. Gadre, R. V.; Van Driessche, G.; Van Beeumen, J. y Bhat, M. K. Enzyme Microbiol. Technol, 2003, vol. 32, p. 321–330.
36. Akita, K.; Ishimizu, T.; Tsukamoto, T.; Ando, T. y Hase, S. Successive glycosyltransfer activity and enzymatic characterization of pectic polygalacturonate 4-galacturonosyltransferase solubilized from pollen tubes of Petunia axillaris using pyridylaminated oligogalac-turonates as substrates. Plant Physiology, 2002, vol. 130, p. 374–379.
37. Parenicová, L. Pectinases of Aspergillus niger: a molecular and biochemical characterisation. Wageningen Agricultural University. The Netherlands. Ref Type: Thesis/Dissertation, 2000.
38. Heinrichova, K. y. Wojciechowicz, M. The pectinolitic enzyme of Selenomonas rumiantum. J. Appl. Bacteriol., 1989, vol. 66, p. 169-174.
39. Miller, G. L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Chem., 1995, vol. 31, p. 426-428.
40. TAM, S. Y. T. A new calculation method for distinguishing endo- from exo-polygalacturonases. Journal of Food Science, 1983, vol. 48, no. 2, p. 532–533.
41. Spiro, M. D.; Ridley, B. L.; Eberhard, S.; Kates, K. A.; Mathieu, Y.; O’Neill, M. A.; Mohnen, D.; Guern, J.; Darvill, A. y Albersheim, P. Biological activity of reducing-end-derivatized oligo-galacturonides in tobacco tissue Cultures. Plant Physiol., 1998, vol. 116, p. 1289-1298.
42. Brecht, J. K. y Huber, D. J. Products released from enzymically active cell wall stimulate ethylene production and ripening in periclimateric tomato fruit. Plant Physiology, 1988, vol. 88, p. 1037-1041.
43. Marfa, V. /et al./ Oligogalacturo-nides are able to induce flowers to form on tobacco explants. The Plant Journal, 1991, vol. 1, no. 2, p. 1991.
44. Eberhard, S.; Doubrava, N.; Marfa, V.; Mohnen, D.; Southwick, A.; Darvill, A. G. y Albersheim, P. Pectic cell wall fragments regulate tobacco thin-cell layer explant morphogenesis. Plant Cell, 1989, vol. 1, p. 747-755.
45. Plana, D.; Álvarez, M.; Florido, M.; Lara, R. M. y Cabrera, J. C. Actividad biológica del Pectimorf en la morfogénesis in vitro del tomate (Lycopersicon esculentum, Mill) var. Amalia. Cultivos Tropicales, 2003, vol. 24, no. 1, p. 29-33.
46. Dominí, M. E. y Benítez, B. Uso de biopreparados como promotores de enraizamientos en margullos de Ficus (Ficus benjamina). Cultivos Tropicales, 2004, vol. 25, no. 3, p. 45-48.
47. Montes, S.; Aldaz, J. P.; Cevallos, M.; Cabrera, J. C. y López, M. Uso del biorregulador PECTIMORF en la propagación acelerada del Anthurium cubense. Cultivos Tropicales, 2000, vol. 21, no. 3, p. 29-31.
48. Sibise, I.; Morales, D.; Jiménez, E. T.; Jiménez, M. S. y Morales, D. Evaluación de la acción de biomoléculas en el crecimiento del Tagasaste. Congreso Hispano-Luso de Fisiología Vegetal (2005:Portugal).
49. Costales, D.; Martínez, L. y Núñez, M. Efecto del tratamiento de semillas con una mezcla de oligogalacturónidos sobre el crecimiento de plántulas de tomate (Lycopersicon esculentum Mill). Cultivos Tropicales, 2007, vol. 28, no. 1, p. 85-91.
50. Castilla, Y. Efecto del Pectimorf en la propagación in vitro de violetas africanas (Saintpaulia ionantha Wend). Memorias En: Taller Internacional sobre Recursos Fito-genéticos, Fitogen (6:2005 nov: Sancti Spíritus).
51. Castilla, Y.; López, M. y Pérez, A. Propagación acelerada de clavel chino (Dianthus chinensis L.) con el empleo del Pectimorf. Memorias. En Simposio Internacional de Biotecnología de las Plantas (7:2006 abril 17-21, Santa Clara.
52. Bishop, P. D.; Pearce, G.; Bryant, J. E. y Ryan, C.A. Isolation and characterization of the proteinase inhibitor-inducing factor from tomato leaves. Identity and activity of poly- and oligogalacturonide fragments. J. Biol. Chem., 1984, vol. 259, p. 13172–13177.
Recibido: 17 de julio de 2007
Aceptado: 21 de abril de 2008