Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión On-line ISSN 1819-4087
cultrop v.30 n.4 La Habana oct.-dic. 2009
Contenido de clorofila e iones en la variedad de trigo harinero Cuba-C-204 en condiciones de estrés salino
Chlorophyll content and ions of a bread wheat variety Cuba-C-204 under salinity stress conditions
Ms.C. L. ArgentelI, email: largentelm@udg.co.cu, Dr.C. R. C. LópezI, Ms.C. I. FonsecaI, Ms.C. R. GirónI y E. GómezI, Dr.C. L. M. GonzálezII, Dr.C. D. R. López AguilarIII
I Profesores Asistentes, Universidad de Granma, Bayamo
II Investigador y Profesor Titular, Instituto de Investigaciones Agropecuarias Jorge Dimitrov, Bayamo, Cuba
III Profesor e Investigador, Centro de Investigaciones Biológicas del Noreste, México.
Abstract
Chlorophyll (a) content and ion accumulation were determined at different plant organs of a Cuban bread wheat variety, Cuba-C-204, by applying different salinity stress levels by NaCl adjusted to electric conductivities (CE) of 4, 8 and 12 dS.m-1, and a control treatment with distilled water and CE of 0.02 dS.m-1. Dry matter accumulation per organ and root/shoot relationship was also calculated. Such determinations were performed at seedling and flowering stages following the validated methodologies. A chlorophyll content reduction was recorded as salt concentrations increased, which were just significant between the control and 12 dS.m-1. There was a significant negative correlation between chlorophyll content and Na in leaves during both stages studied, whereas the other microelements did not show this behavior. A root dry weight reduction was recorded as salt concentration increased. When evaluating leaf cation content, there was a negative correlation between K+ and Na+ contents, which proves there is a nutritional interference as an adverse salinity effect on the wheat variety studied. Consequently, as a result of the nutritional effect, chlorophyll content decreased significantly when CE surpassed 8 dS.m-1.
Key words: wheat, salt tolerance, salinity, chlorophylls
Resumen
Se determinaron el contenido de clorofila (a) y la acumulación de iones en diferentes órganos de las plantas de la variedad cubana de trigo harinero Cuba-C-204, aplicando diferentes niveles de estrés salino por NaCl ajustados a conductividades eléctricas (CE) de 4, 8 y 12 dS.m-1, y un tratamiento control con agua destilada y CE de 0.02 dS.m-1. Se calculó, además, la acumulación de materia seca por órgano y relación raíz/follaje. Tales determinaciones se realizaron en las fenofases de plántula y floración siguiendo las metodologías validadas. Se encontró una disminución del contenido de clorofilas a medida que se incrementaron las concentraciones de sales, que solo fueron significativas entre el control y 12 dS.m-1. Se registró una correlación negativa significativa entre el contenido de clorofilas y sodio en follaje durante las dos fenofases estudiadas, mientras que los restantes microelementos no mostraron este comportamiento. Se produjo una disminución del peso seco de la raíz a medida que aumentó la concentración de sales. En la evaluación del contenido foliar de cationes, se encontró correlación negativa entre los contenidos de K+ y Na+, lo que demuestra la existencia de interferencia nutricional como efecto adverso de la salinidad en la variedad de trigo estudiada. Como consecuencia del efecto nutricional, el contenido de clorofilas disminuyó significativamente cuando CE superó los 8 dS.m-1.
Palabras clave: trigo, tolerancia a la sal, salinidad, clorofilas
INTRODUCCIÓN
Entre los mecanismos que explican la capacidad de las especies vegetales para tolerar el estrés salino se encuentra el ajuste osmótico (1); tal término es utilizado para definir la disminución del potencial osmótico celular en las plantas superiores, como resultado de la acumulación activa de solutos en respuesta a una situación estresante por déficit hídrico o salinidad (2). De este modo, las plantas regulan su potencial osmótico hasta conseguir que el potencial hídrico de la célula sea similar o menor al del medio que la rodea (3).
El ajuste osmótico implica, por una parte, la absorción y acumulación de iones salinos procedentes del medio y, por otra, la biosíntesis endógena de solutos orgánicos. Aunque ambos mecanismos, por lo general, operan conjuntamente, su importancia relativa varía entre especies y genotipos, incluso entre distintos tejidos de la misma planta (4).
Se han descrito muchos síntomas fisiológicos asociados a la toxicidad de los iones a partir de determinados niveles críticos de salinidad, tales como interferencia en la acumulación de otros iones importantes (potasio) para el metabolismo y la toxicidad, debido al exceso de sodio y cloro fundamentalmente. Como consecuencia se afectan los procesos vitales de los distintos órganos y tejidos, la actividad enzimática y funcionalidad de las membranas: transporte y selectividad (5); se inhibe la fotosíntesis (6) y el consumo energético se incrementa para poder subsistir al estrés (7). Por ello, el estudio de la acumulación de estas sales en el interior de las plantas, una vez sometidas a condiciones estresantes, pudiera ser un rasgo importante de tolerancia al estrés.
Por la importancia del cultivo de los cereales y, en particular, el trigo, que está siendo objeto de experimentación en Cuba, país que presenta zonas con significativos niveles de salinidad, este trabajo contiene parte de los resultados de un estudio realizado en la variedad Cuba-C-204, sometida a cuatro niveles de estrés salino, evaluando los indicadores contenido de clorofila, acumulación de iones y ganancia de materia seca. Con los resultados aquí mostrados se tiene una información preliminar sobre la inclusión de iones en variedades cubanas y su relación con la tolerancia a la salinidad.
MATERIALES Y MÉTODOS
El experimento se realizó en condiciones semicontroladas, en la casa de cultivos protegidos del Centro de Estudios de Biotecnología Vegetal de la Universidad de Granma, Bayamo, Cuba.
Variantes experimentales. Se establecieron cuatro variantes experimentales, que consistieron en aplicar riegos con agua salinizada por NaCl ajustada a conductividades eléctricas (CE) de 4, 8 y 12 dS.m-1; el tratamiento control consistió en riegos con agua de buena calidad y una CE de 0.02 dS.m-1. Todos los riegos se realizaron hasta la capacidad de campo, controlando la humedad del suelo por el método gravimétrico.
Se tomaron semillas al azar de la variedad cubana de trigo harinero Cuba-C-204, las cuales fueron suministradas por el Instituto Nacional de Ciencias Agrícolas (INCA) y se pusieron a germinar, a razón de cuatro por maceta plástica, con capacidad para 8 kg de suelo vertisol (8) de concentración de sales conocidas.
En el análisis de suelo se determinaron el P2O5 por el método de Oniani, K2O por fotometría de llama y el método de Oniani, K+ y Na+ por fotometría de llama, Ca2+ y Mg2+ por complexometría, pH(H2O) por el método potenciométrico, las sales solubles totales por conductimetría (1:5), la materia orgánica por el método de Walkley-Black, el nitrógeno por el método de Kjeldhal, el CO-3, HCO-3, Cl-y SO2-4 por los métodos unificados de la Dirección General de Suelos y Fertilizantes del MINAGRI.
Estos análisis se realizaron según los procedimientos normalizados de operación establecidos en el laboratorio.

Evaluaciones. Todas se realizaron en las fenofases de plántula y floración.
Determinación del contenido de clorofila a. Se siguió la metodología de Lichtenthaler y Wellburn (9) y se realizaron cinco repeticiones.
Se pesó un gramo de tejido foliar, se cortó en pequeños pedazos y se maceraron con alcohol etílico (96 v/v); se filtró a través de un papel de filtro de poros finos y se completó hasta un volumen de 50 mL con alcohol. Posteriormente, se leyó la absorbancia a 665, 649 y 470 nm para la clorofila a, b y los carotenos, respectivamente, y se calculó la concentración de pigmentos en mg (mL de extracto)-1, según las ecuaciones siguientes. Esta evaluación se realizó en los estadios de plántula y floración:
Ca = 13.95 A665–6.68 A649
donde A649, A665–absorbancia a 470, 649 y 665 nm
Determinación del contenido de iones. Se realizó en el laboratorio de bioquímica de la Facultad de Ingeniería de la universidad de Granma.
Después de determinar el peso fresco de las muestras, estas se lavaron con agua destilada. Posteriormente, se introdujeron en bolsas de papel para su secado en la estufa, DK 83 de fabricación japonesa, a una temperatura de 75oC durante 72 horas.
Los cationes y el fósforo fueron extractados con una muestra de ácidos (H2SO4; HNO3; HClO4) en proporción 1:10:4 (v/v) respectivamente. Las concentraciones de Ca, Mg, K, Zn y Fe en el extracto se determinaron mediante espectroscopía de absorción atómica empleando un espectrofotómetro SHIMATSU AA-660.
El fosforo se calculó por el método de azul molibdeno. El cloro, los nitritos, nitratos y sulfatos fueron extractados con agua en ebullición y su concentración se determinó por cromatografía de iones mediante un cromatógrafo SHIMATZU HIC-6A.
El nitrógeno total se calculó por el método de micro Kjeldahl, utilizando en su digestión ácido salicílico y sulfúrico. Después de finalizado el proceso de digestión, la solución fue diluida convenientemente para la cuantificación de N-NH4, considerado como nitrógeno total, mediante el método de Nessler, empleando un espectrofotómetro HITACHI-1100. La absorbancia de las soluciones se determinó a una longitud de onda de 420 nm.
Análisis estadísticos. Se determinó la media y su error estándar para todos los indicadores evaluados en ambas condiciones y se establecieron las diferencias entre los tratamientos, un análisis de varianza de clasificación simple y mediante la prueba de comparación múltiple de medias de MDS para un nivel de significación del 5 y 1%, cuando existieron diferencias entre los tratamientos. Se calculó, además, el coeficiente de correlación entre los valores de microelementos y el contenido de clorofila.
RESULTADOS Y DISCUSIÓN
El contenido de clorofila (a) disminuyó en la medida que se incrementaron las concentraciones salinas en ambas fenofases desde el control hasta 12 ds.m-1, mientras que en los restantes tratamientos no existieron diferencias (Figura 1). Este comportamiento indica estabilidad a medida que los niveles de salinidad se incrementan. Sin embargo, las investigaciones sobre el efecto que provoca la salinidad en la concentración de pigmentos fotosintéticos son abundantes y coincidentes, y tienden a revelar que tales afectaciones son fundamentalmente debidas a la destrucción de los cloroplastos y a un aumento de la actividad de la enzima clorofilasa, afectando la síntesis de clorofilas (1, 5).

Se encontró que, en condiciones salinas, en esta variedad no se produce una disminución pronunciada del contenido de clorofilas durante la floración respecto al estadio de plántula. Este resultado contradice lo obtenido anteriormente en Cuba en relación con la susceptibilidad del trigo a la sal en estadio de floración. La susceptibilidad fenológica del trigo a la salinidad es un tema muy discutido y no todos los resultados convergen (6, 7).
Se ha estudiado que, en condiciones salinas, también pueden surgir problemas con la disponibilidad de micronutrientes, aunque la influencia de la salinidad sobre sus concentraciones en las plantas depende tanto de la planta como del micronutriente considerado (9). Distintos estudios muestran que la concentración de hierro aumentaba con la salinidad en plantas de guisante (10), tomate, soya y calabaza (11), arroz (12), y disminuía en cebada y maíz (13). La concentración de manganeso aumentaba en cebada, arroz, remolacha azucarera, tomate y disminuía en calabaza, guisante y maíz. Por otra parte, la concentración de zinc aumentaba en cebada, judía, soya, tomate y calabaza, pero disminuía en maíz. La salinidad incrementa los efectos de la toxicidad del micronutriente en plantas de trigo cultivadas en soluciones nutritivas con alta concentración del micronutriente (14).
Mediante el análisis de correlación, se determinó la relación entre el contenido de clorofila y diversos elementos químicos implicados en funciones metabólicas y fisiológicas de las plantas evaluadas en los estadios de plántulas y floración (Tabla I).

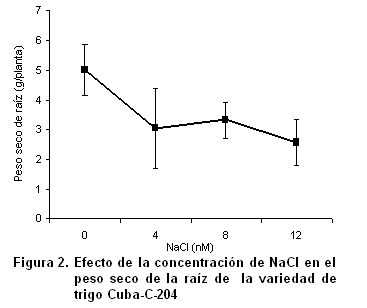
Desde décadas anteriores, se ha informado que el estrés por salinidad durante la etapa vegetativa suprime el crecimiento de todos los órganos de la planta, aunque el crecimiento de la raíz es menos afectado que el de la parte aérea (15). Al incrementarse la concentración de sales, el peso seco de la raíz disminuyó con la salinidad; esta reducción se acentuó significativamente en las plantas cultivadas con 12 dS.m-1 de NaCl (Figura 2).
Las plantas generalmente mantienen una proporción característica entre raíz/follaje. Cuando esta proporción es afectada, la respuesta inmediata de la planta es disminuir la acumulación de materia seca en ambas partes y muchas veces trata de compensar la pérdida mediante un rápido crecimiento de la parte afectada, para restablecer la proporción raíz/follaje que la caracteriza (16).
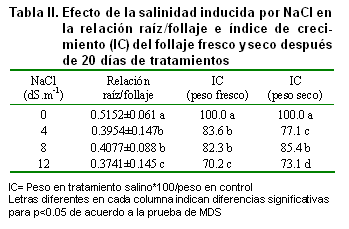
En este estudio la relación raíz/follaje disminuyó con el incremento de la salinidad y estas reducciones fueron significativas (Tabla II).
El efecto negativo del estrés salino en la reducción del crecimiento de la raíz y el follaje, así como de la relación raíz/follaje es conocido desde tiempo atrás, pero no ocurre en todas las especies (17).
La reducción del crecimiento de las plantas bajo estrés salino es debido a una alteración en la tasa fotosintética y modificación en el metabolismo de los carbohidratos. La producción de biomasa y relación raíz/follaje son criterios comúnmente utilizados para seleccionar individuos con tolerancia a la salinidad, ya que el efecto inhibitorio que causa el estrés salino sobre estas variables de crecimiento es más notable en los cultivares sensibles a la salinidad que en los tolerantes de la misma especie (18).
El índice de crecimiento del follaje disminuyó significativamente con el incremento de NaCl en los tratamientos. Es bien conocido que el crecimiento de las plantas es el resultado directo de una masiva y rápida expansión de las células jóvenes producidas por las divisiones meristemáticas (19). Sin embargo, la expansión celular tanto en raíces como en hojas puede ser inhibida por la salinidad (20), reduciendo el crecimiento como sucedió en este estudio.
Contenido de cationes en las raíces de la variedad de trigo Cuba-C-204 y su relación con la tolerancia a la salinidad. El contenido de Ca2+ y Mg2+ en las raíces no mostraron diferencias significativas entre las diferentes variantes experimentadas (Figura 3); sin embargo, el contenido de K+ y Na2+ sí varió estadísticamente, produciéndose correlación negativa entre ellos. Este resultado está muy acorde con lo planteado sobre los efectos nutricionales de la salinidad en las plantas. Generalmente, se produce una interferencia por parte del sodio en la absorción de otros cationes como el K+. Este efecto es propuesto como defensa para el organismo vegetal (21), como vía para elevar la concentración de solutos en las células y, por consiguiente, mantener un potencial hídrico más bajo que el del suelo, y así garantizar la absorción de agua, pero tiene como resultado que si se incrementa la concentración de Na+ incluido, se produce la toxicidad iónica. Como consecuencia de estos efectos primarios, a menudo ocurren otros estrés como el daño oxidativo.
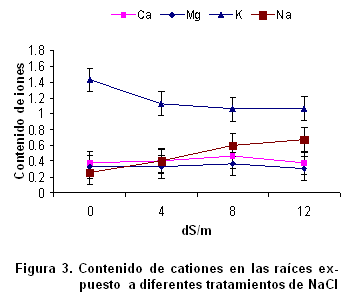
El papel del ión Ca2+ en la respuesta de las plantas a la salinidad resulta esencial, por su función estructural en la membrana y su efecto sobre la actividad de algunos trasportadores iónicos (22). Aunque con los resultados de este experimento no puede ser señalado, se ha reportado que la presencia de Ca2+ puede reducir la magnitud del efecto negativo de la salinidad en el crecimiento (23).
En la presente investigación la reducción de la absorción de K+ por el estrés salino coincide con lo reportado anteriormente (6, 17, 24). La toxicidad que sufren las plantas por sales de sodio es causada por el reemplazo de K+ por Na+ en importantes reacciones bioquímicas (25).
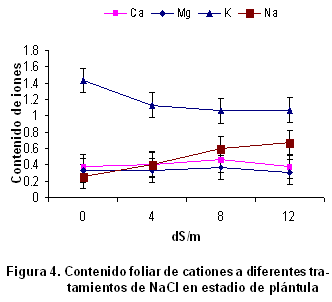
Contenido de cationes en el follaje de la variedad de trigo Cuba-C-204 y su relación con la tolerancia a la salinidad. El contenido de K+ disminuyó significativamente con el incremento de NaCl en los tratamientos, mientras que el Na+ se acumuló mayormente en los tratamientos de 8 y 12 dS.m-1. El contenido de K+ disminuyó y también se observó que se redujo en los tratamientos de mayor contenido de NaCl, aunque estas diferencias no fueron significativas (Figura 4).
Se encontró que el contenido de Ca2+ y Mg2+ disminuyó ligeramente con el incremento de NaCl para un nivel superior a 8 dS.m-1; sin embargo, para niveles menores hubo un ligero incremento de su concentración, aunque estadísticamente estos no fueron significativos. Uno de los primeros resultados que revelaron desequilibrios nutricionales en las plantas, como consecuencia de la presencia de iones salinos, se alcanzaron en estudios de nutrición del Ca2+, comprobándose en judías que la absorción de Ca2+ depende de la relación Na+/Ca2+. A su vez, numerosos estudios muestran que la concentración de K+ en la planta disminuye al aumentar la salinidad o la relación Na+/Ca2+ en el medio (26).
El contenido foliar de Na+ se incrementó significativamente, conforme se elevó la concentración de NaCl en los tratamientos. La disminución del contenido de potasio pudo haberse producido por la desestabilización de la bomba Na+/K+. Las variaciones que se producen en la concentración Na+/K+ en las células ha sido un tema muy discutido (23, 27), por su relación con la tolerancia a la salinidad.
En los programas de mejora genética para la tolerancia a este tipo de estrés se trabaja en la introgresión de genes que confieran tolerancia, basada en la estabilización de la bomba Na+/K+ en condiciones de estrés salino. Una de las aproximaciones a estos estudios ha sido con el empleo de métodos estadísticos y mapeo genómico, con lo que se consigue asociar el fenotipo de un carácter cuantitativo con marcadores genéticos a través del análisis de loci de caracteres cuantitativos o QTL (quantitative trait locus) (28).
El análisis genético por QTL permite emplear un número manejable de variables asociadas a un carácter fisiológico complejo: por ejemplo, absorción, selectividad y compartimentación iónica (29). En arroz, cultivo en el que la tolerancia se asocia con la exclusión de Na+ y a una mayor capacidad de absorción de K+, la capacidad de mantener una alta relación K+/Na+ está regida por la acción de genes aditivos y dominantes (30). Recientemente, se encontraron QTL asociados a la absorción de K+ y Na+, y la selectividad K+/Na+, que podrían emplearse como marcadores en la mejora genética por tolerancia a salinidad en cebada y centeno (31). Se encuentra en estudio el trigo (32).
El K+ es uno de los principales solutos empleados para el ajuste osmótico celular (25, 30, 33) y, por esta razón, uno de los factores más evaluados para determinar tolerancia a la salinidad es la capacidad de las plantas para mantener una elevada relación K+/Na+, que le permita llevar a cabo funciones fisiológicas y bioquímicas que perturban el exceso de Na+.
La reducción en la absorción de K+ en la planta por el Na+ es un proceso competitivo. Aunque las plantas tienen una selectividad alta de K+ con respeto a Na+, cantidades excesivas de K+ pueden tener un efecto negativo (34). Quizás por ello, a pesar de los numerosos estudios que indican la disminución en la absorción y traslocación de K+ en las plantas cultivadas en sustratos donde predomina el Na+, hay pocos datos que demuestren que la adición de K+ en dichas condiciones mejore el desarrollo de las plantas (35). Sin embargo, la disminución de la relación Na+/Ca2+ por adición de Ca2+ a la solución nutritiva sí recupera eficazmente los niveles de K+ intracelular, aumentando la tolerancia de la planta a la salinidad (36). Además de este clásico desequilibrio iónico, una disminución de la concentración de NO3- en la planta en condiciones salinas, ha sido ampliamente documentada en distintas condiciones experimentales y con diferentes especies de plantas (37). Sin embargo, a pesar de la drástica reducción de la concentración de NO3- en la hoja como respuesta a la salinidad, aumentan o al menos no disminuyen diversas fracciones nitrogenadas, como el contenido en prolina, betaína y aminoácidos o proteínas solubles totales (38). Estos resultados contradicen que la deficiencia de nitrógeno per se sea un efecto tóxico de la salinidad (39).
Por otra parte, se ha comprobado que el NaCl puede también inducir toxicidad de fósforo en algunas especies como maíz (40), sésamo y en ciertas variedades de soya (16).
Los estudios de la tolerancia al estrés salino basados en indicadores fisiológicos tales como la absorción, retención o exclusión de iones, es una de las vías más efectivas para la exploración del germoplasma disponible. En el caso particular del trigo, que está siendo objeto de introducción y validación en la región oriental de Cuba, donde el 55 % de los suelos dedicados a la agricultura son afectados por la salinidad, permiten discriminar variedades con tolerancia a esta condición estresante. Actualmente, en la región oriental se cuenta con 19 variedades de trigo, las cuales están siendo estudiadas en base a indicadores fisiológicos, bioquímicos y moleculares muy precisos, que permiten su caracterización en cuanto al grado de tolerancia a este tipo de estrés (41).
REFERENCIAS
1. Appels, A. y Lagudah, H. E. Manipulation of chromosomal segments from wild wheat for the improvement of bread wheat. Aust. J. Plant Physiol., 1990, vol. 17, p. 253-266.
2. Ludlow, M. y Muchow, R. A critical evaluation of traits for improving crop yields in water limited environments. Advances in Agronomy, 1990, vol. 43, p. 107-151.
3. Murillo, A. /et al./. Path analysis of cowpea early seedling growth under saline conditions. PHYTON, International Journal of Experimental Botany, 2000, vol. 67, p. 85-92.
4. Torrecillas, A. Strategies for drought resistance in leaves of two almond cultivars. Plant Science, 1996, vol. 118, p. 135-143.
5. Flowers, T. J. y Yeo, A. R. Ion relations of plants under drought and salinity. Australian Journal of Scientific Research, 1986, vol. 75, 91 p.
6. Wyn J y Gorham, J. Physiological effects of salinity: scope for genetic improvement. En: Improvement and management of winter cereals under temperature, drought and salinity stresses. Córdoba: Proceeding of the International Symposium. 1983, p. 177-201.
7. Yeo, A. R. Molecular biology of salt tolerance in the context of whole-plant physiology. Journal of Experimental Botany, 2000, vol. 49, p. 915-929.
8. Hernández, A. Nueva versión de la clasificación genética de los suelos de Cuba. La Habana: Instituto de Suelos. 1995, 42 p.
9. Lichtenthaler, H. K. y Wellburn, A. R. Determination of total carotenoids and chlorophylls a and b of leaf extracts in different solvents. Biochemical Society Transactions, 1984, vol. 603, p. 591-592.
10. Maas, E. Salt tolerance of plants. Applied Agricultural Research, 1986, vol. 1, no. 1, p. 12-15.
11. Singh, K. P. y Singh, K. Stress physiological studies on seed germination and seedling growth of some wheat hybrids. Indian Journal of Plant Physiology, 1981, vol. 25, p. 180-186.
12. Kobata, T.; Palta, J. y Turner, N. Rate of development of post anthesis water deficit and grain filling of spring wheat. Crop Science, 1992, vol. 32, p. 1238-1242.
13. Maas, E.; Lesh, S.; Francois, L. y Grieve, C. Tiller development in salt-stressed wheat. Crop Science, 1994, vol. 34, p. 1594-1603.
14. Scott, S. J.; Jones, R. y Wiliams, A. Review of data analysis. Methods for seed germination. Crop Science, 1984, vol. 24, p. 1192-1199.
15. Chartzoulakis, K. y Klapaki, G. Response of two greenhouse pepper hybrids to NaCl salinity during different growth stage. Scientia Horticulturae, 2000, vol. 86, p. 247-260.
16. Mano, Y. y Takeda, K. Genetic resources of salt-tolerance at germination and the seedling stage in wheat. Japanese Jounal of Crop Science, 2001, vol. 70, no. 2, p. 215-220.
17. Kumar, D. Salt-tolerance of some induced mutants of HD 2009 wheat. Indian Journal of Agricultural science, 1991, vol. 51, no. 7, p. 475-479.
18. Abrishami, H. Persian Pistachio. Tehran: Tehran University Press. 1995.
19. Aschan, G. y Pfanz, H. Non-foliar photosynthesis-a strategy of additional carbon acquisition. Flora, 2003, vol. 198, no. 2, p. 81-97.
20. Ashraf, M. y Leary, J. W. O. Effect of drought stress on growth, water relations, and gas exchange of two lines of sunflower differing in degree of salt tolerance. Int. J. Plant Sci., 1996, vol. 157, no. 6, p. 729-732.
21. Behboudian, M. H.; Walker, R. R. y Torokfalvy, E. Effects of water stress and salinity on photosynthesis of pistachio. Sci. Hortic., 1986, vol. 29, p. 251-261.
22. Brodribb, T. Dynamics of changing intercellular CO2 concentration (ci) during drought and determination of minimum functional ci. Plant Physiol., 1996, vol. 111, p. 179-185.
23. Burlyn, E. M. y Merrill, R. K. The osmotic potential of polyethylene glycol 6000. Plant Physiol., 1973, vol. 51, p. 914-916.
24. Chazen, O.; Hartung, W. y Neumann, P. M. The different effects of PEG 6000 and NaCl on leaf development are associated with differential inhibition of root water transport. Plant, Cell Environ. 2005, vol. 18, p. 727-735.
25. Chaves, M. M. Effects of water deficits on carbon assimilation. J. Exp. Bot., 2006, vol. 42, p. 1-16.
26. Cornic, G. Drought stress and high light effects on leaf photosynthesis. En: Baker, N. R., Bowyer, J. R. (Eds.). Photoinhibition of Photosynthesis: From Molecular Mechanisms to the Field. Oxford: BIOS Scientific Publishers, 2004, p. 297-313.
27. De Herralde, F.; Biel, C. y Save, R. Leaf photosynthesis of eight almond tree cultivars. Biol. Plantarum, 2003, vol. 46, no. 4, p. 557-561.
28. Slafer, G.; Calderini, D. y Miralles, D. Yield components and compensation in wheat: opportunities for further increasing yield potential. En: Reynolds, M., Rajaram, S. Y. 1996, p. 101-133.
29. Shimshi, D. y Ephrat, J. Stomatal behavior of wheat cultivars in relation to their transpiration, photosyntesis and yield. Agronomy Journal, 1975, vol. 67, p. 326-330.
30. Singh, P. y Kanemasu, E. Leaf and canopy temperatures of Pearl Millet genotypes under irrigated conditions. Agronomy Journal, 1983, vol. 75, p. 497-501.
31. Turner, N. Crop water deficit: A decade of progress. Advances in Agronomy, 1986, vol. 39, p. 1-51.
32. Van Den Boogard, R.; Veneklaas, E.; Peacock, J. y Lambers, H. Yield and water use of wheat (Triticum aestivum) in a Mediterranean environment: cultivar differences and sowing density effects. Plant and Soil, 1996, vol. 181, p. 252-262.
33. Flexas, J. y Medrano, H. Drought-inhibition of photosynthesis in C3 plants: stomatal and non-stomatal limitations revisited. Ann. Bot., 2002, vol. 89, p. 183–189.
34. Goldhamer, D. A. y Viveros, M. Effects of pre-harvest irrigation cutoff durations and post-harvest water deprivation on almond tree performance. Irrigation Sci., 2000, vol. 19, p. 125-131.
35. Heilmeier, H.; Wartinger, A.; Erhard, M.; Zimmerman, R.; Horn, R. y Schulze, E.D. Soil drought increases leaf and whole-plant water use of Prunus dulcis grown in the Negev Desert. Oecologia, 2002, vol. 130, no. 3, p. 329-336.
36. Higgins, S. S.; Larsen, F. E.; Bendel, R. B.; Radamaker, G. K.; Bassman, J. H.; Bidlake, W. R. y Alwir, A. Comparative gas-exchange characteristics of potted, glasshouse-grown almond, apple, fig, grape, olive, peach and Asian pear. Sci. Hortic., 1992, vol. 52, no. 4, p. 313-329.
37. Jones, H. G. Plants and Microclimate. A Quantitative Approach to Environmental Plant Physiology. 2nd ed. Cambridge: University Press. 1992.
38. Kicheva, M. E.; Tsonev, T. D. y Popova, L. P. Stomatal and nonstomatal limitations to photosynthesis in two wheat cultivars subjected to water stress. Photosynthetica, 1994, vol. 30, p. 107-116.
39. Larcher, W. Physiological Plant Ecology. Ecophysiology and Stress Physiology of Functional Groups. 4th ed. Heidelberg: Springer-Verlag. 2003.
40. Mediavilla, S.; Santiago, H. y Escudero, A. Stomatal and mesophyll limitations to photosynthesis in one evergreen and one deciduous Mediterranean oak species. Photosynthetica, 2002, vol. 40, no. 4, p. 553-559.
41. Argentel, L. y González, L. M. Respuesta de variedades de trigo a la salinidad en los primeros estadios del crecimiento. Cultivos Tropicales, 2007, vol. 27, no. 3, p. 41-44.
Recibido: 14 de abril de 2009
Aceptado: 29 de julio de 2009