Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.32 no.2 La Habana abr.-jun. 2011
UTILIZACION DE CEPAS EFICIENTES DE HONGOS MICORRIZICOS ARBUSCULARES EN EL DESARROLLO DE PORTAINJERTOS DE AGUACATE EN UN SUSTRATO SUELO- CACHAZA
EFFICIENT USE OF STRAINS arbuscular mycorrhizal fungi IN THE DEVELOPMENT OF AVOCADO ROOTSTOCKS IN A SOIL SUBSTRATE-Cachaça
Dr.Sc. Ramón A Rivera Espinosa1, José Victor Martin Cardenas2, M.Sc. Alfredo Calderón Puig2, Ariel Torrez Hernández3
1Investigador Titular del departamento de Biofertilizantes y Nutrición de las Plantas. Email: rrivera@inca.edu.cu
2 Especilistas del departamento de Biofertilizantes y Nutrición de las Plantas del Instituto Nacional de Ciencias Agrícolas (INCA) gaveta postal 1, San José de las Lajas, Mayabeque, Cuba,CP 32700
3 Productor, Granja Urbana, Madruga, Mayabeque, Cuba.
RESUMEN
El objetivo del presente trabajo, fue evaluar el efecto de dos cepas eficientes de hongos micorrízicos arbusculares sobre indicadores de crecimiento y desarrollo en portainjertos de aguacate. La inoculación del producto a las semillas, se llevo a cabo mediante una pasta fluida compuesta por 1kg del Biofertilizante EcoMic® y 600ml de agua. Con esta pasta, se recubrieron las semillas de los tratamientos 1 y 2 quedando conformado el esquema de la forma siguiente T1: Semillas inoculadas con la cepa Glomus hoi-like, T2 Semillas inoculadas con la cepa Glomus mosseae y T3 Semillas no inoculadas. Se utilizo un germinador con cáscara de maní como lecho de germinación; a los 30 días después de la germinación las plantas fueron llevadas a bolsas, las cuales contenían un sustrato formado por suelo agrícola + cachaza en una relación (75%:25% v/v). Las variables de crecimiento y desarrollo estudiadas fueron: altura del portainjerto, diámetro del tallo, número de hojas, longitud y ancho de las hojas, área foliar y tasa de crecimiento relativo; dentro de los parámetros micorrízicos se determino el porcentaje de colonización radical, la densidad visual y el índice de eficiencia micorrízica.
Los resultados encontrados demostraron, que la utilización de cepas eficientes de hongos micorrízicos arbusculares; estimula el desarrollo de los portainjertos de aguacate en condiciones de vivero lo cual repercute en la obtención de plantas de mayor calidad y a su vez constituyen una alternativa nutricional para este cultivo.
Palabras clave: Glomus, aguacate, propagación, sustrato.
ABSTRACT
The objective of the present work was to evaluate the effect of two efficient stumps of mushrooms mycorrhizal arbuscular on indicators of growth and development in avocado rootstok. One prepares flowing leg composed by 1kg of the biofertilizer EcoMic® that was compound for the stumps of evaluated HMA and 600ml of water. With this leg, the seeds of the treatments 1 and 2 were recovered being conformed the outline in the following way T1: Seeds inoculated with the stump Glomus hoi-like, T2 Seeds inoculated with the stump Glomus mosseae and T3 not inoculated Seeds. You uses a germinator with peanut shell like germination channel; to the 30 days after the germination the plants were taken to bags, which contained a substrate formed by agricultural floor + phlegm with a relationship (75%:25% v.v). The variables of growth and evaluated development were: height of the rootstock, diameter of the shaft, number of leaves, longitude and wide of the leaves, area to foliate and rate of relative growth; inside the parameters micorrízicos you determines the percentage of radical colonization, the visual density and the index of efficiency mycorrhizal.
The opposing results demonstrated that the use of efficient stumps of mushrooms mycorrhizal arbuscular; it stimulates the development of the avocado rootstock under nursery conditions that which rebounds in the obtaining of plants of more quality and in turn they constitute a nutritional alternative for this cultivation in those during this phase.
Key word: Glomus, avocado, propagation, substrate.
INTRODUCCIÓN
En la actualidad, incrementar la productividad de las plantas cultivadas de manera sostenible, con baja cantidad de insumos y con los mejores estándares de calidad, es una necesidad inmediata, más aun cuando la globalización cultural, el libre mercado y los acuerdos internacionales de comercio abierto se convierten en las bases de cualquier programa de producción agrícola.
Conocido mundialmente como avocado, aguacate, o aguacatero, la especie Persea americana actualmente se produce en casi todos los países de climas cálido y templado, aunque sus mayores cultivos están en países latinoamericanos, dentro de los que se destaca México como primer productor mundial, seguido por Chile, Brasil, Perú y República Dominicana (1).
La ausencia de embrionia nuclear en el aguacatero, a diferencia de otros frutales como la mayoría de los cítricos y el manguero, no permite la obtención de un material genético uniforme para ser usado como patrón o porta injerto (2). Como consecuencia de las diferentes constituciones genéticas de cada plántula, se pone de manifiesto una gran heterogeneidad en los patrones que presentan variabilidad en cuanto a resistencia a enfermedades y plagas, adaptabilidad a diferentes suelos, características de los frutos. Por ello, es necesario un tipo de propagación asexual que permita obtener patrones uniformes que al ser injertados luego con la variedad deseada brinde uniformidad en cuanto a patrón-injerto se refiere.
El término “micorriza “ fue utilizado por primera vez por el fitopatólogo alemán A. B. Frank en 1885 para describir las estructuras modificadas de las raíces de árboles forestales, y desde entonces se ha extendido para referirse a un rango de asociaciones simbióticas mutualistas entre hongos y raíces de plantas (3)
Una de las alternativas para incrementar la producción agrícola es la aplicación de biofertilizantes producidos a partir de hongos micorrízicos arbusculares (HMA), los que al establecer la simbiosis con las raíces de las plantas desempeñan importantes funciones, pues contribuyen de forma más eficiente a la supervivencia y el crecimiento de los cultivos, además de reducir los efectos de estrés asociados con la nutrición y las relaciones con el agua (4)
En este sentido, la formación de micorrízas juega un papel importante en el crecimiento de las plantas en condiciones de estrés hídrico (5-6)
La micorrización de patrones de frutales se ha estudiado en condiciones controladas obteniéndose una respuesta favorable de las plantas inoculadas frente a las no inoculadas en crecimiento y en protección frente a patógenos del suelo y estreses abióticos (7).
Este trabajo se realizó con el objetivo evaluar la eficiencia de la simbiosis micorrízica en la obtención de portainjertos de aguacate en condiciones de vivero, utilizando un sustrato compuesto por suelo agrícola y cachaza en el desarrollo y fisiología de plantas de aguacate.
MATERIALES Y MÉTODOS
Para el estudio se realizó un experimento en el año 2008, en el vivero tradicional dedicado a la producción de posturas de frutales que pertenece a la Granja Urbana del Municipio Madruga, Provincia La Habana.
Las semillas fueron seleccionadas de plantas criollas entre los meses de junio y agosto, libre de afectaciones de patógenos y daños mecánicos. Se utilizo un pregerminador, relleno con un sustrato inerte compuesto por cáscara de maní, donde se colocaron las semillas de forma sentada sobre su parte ancha o base con el ápice o parte aguda hacia arriba dejando 2 o 3cm de ápice sin tapar por lo que se arroparon para evitar los daños por el sol durante el proceso de germinación. Antes de ponerlas a germinar se preparo una pasta fluida que estaba compuesta por 1kg de EcoMic® y 800ml de agua; esta pasta se utilizo para el recubrimiento de las semillas siguiendo la metodología establecida para el uso del producto (8).
El EcoMic® estaba compuesto por cepas de HMA del género Glomus sp Glomus mosseae (Nicolson & Gerddeman) (INCAM IV) y Glomus hoi-like (Gerdemann & Trappe, emend. Walter & Koske) (INCAMII). Las 2 cepas de HMA estudiadas corresponden al inóculo certificado perteneciente al Cepario del Dpto. Biofertilizantes y Nutrición de las Plantas del INCA; y contaban con un titulo de calidad de mas de 20 esporas /gramos de sustrato.
Se preparo un sustrato para el llenado de las bolsas; compuesto por suelo Ferralítico Rojo Típico éutrico (9) y cachaza obtenida del proceso de clarificación de los jugos en el CAI Boris Luis Santa Coloma en una proporción: relación suelo/cachaza 3:1, cuyas características agroquímicas (Tabla I) se determinaron según las técnicas establecidas en el laboratorio de análisis químico de suelos del INCA.

El trasplante se realizo entre los 25 y 30 días después de la germinación cuando las plantas tenían las hojas de color morado a verde, y una altura entre 15 y 25 cm.
Las atenciones culturales se realizaron según los instructivos técnicos para esos frutales en la fase de vivero.
Los tratamientos estudiados se conformaron de la siguiente forma:
T1: Semillas inoculadas con la cepa Glomus hoi-like (INCAM II)
T2: Semillas inoculadas con la cepa Glomus mosseae (INCAM IV)
T3: Testigo semillas sin inocular.
Variables a estudiar:
Altura de las plantas: Se midió con una regla graduada en cm. desde el cuello de la raíz hasta el ápice
Grosor del tallo: Se empleo un pie de rey y se tomo la lectura a partir de los 2cm del suelo.
Numero de hojas: Mediante el conteo físico de las hojas.
Longitud de las hojas y ancho de las hojas: Se utilizo una regla graduada en cm. La longitud se tomo desde la unión del pecíolo con la laminar foliar y el ancho de borde a borde de dicha superficie por el centro de la parte más ancha.
Área foliar: A través de la ecuación de regresión (10).
Tasa de crecimiento relativo: De acuerdo a la formula (11).
TCR (cm3 dia-1) = Biovolumen
Días después de la aplicación de tratamientos
Biovolumen = p (diámetro / 2)2 x altura.
Porcentaje de colonización (%Col): Se motearon las raíces de las plantas muestreadas, se lavaron con agua corriente, eliminando todo el suelo y después se secaron al aire. Con posterioridad se tomaron las raicillas más finas y se desmenuzaron. Para las determinaciones se tomaron 200 mg de raicillas por tratamiento, para teñirlas con azul de tripan (12). La cuantificación se realizó a través del método de los interceptos (13). Los resultados fueron transformados utilizando la función 2arcsenvx (14).
Densidad Visual (DV): se realizó a través de la metodología descrita por Trouvelot (15).
Índice de eficiencia: Fue empleado para determinar el efecto de la inoculación micorrízica (16,17).
IF (%) = A.F. inoculado - A.F. Testigo x 100
A.F.Testigo.
Análisis estadísticos y diseño experimental:
En todos los casos los resultados experimentales fueron sometidos al análisis estadístico correspondiente (Anova), aplicándose la prueba de comparación de rangos múltiples de Duncan (18) como criterio comparativo entre los distintos tratamientos en los casos donde se encontró diferencias significativas. Se empleo un diseño completamente aleatorizado con cuatro repeticiones, conformado por 5 plantas cada una.
Resultados y discusión
El beneficio que aporta la simbiosis micorrízica a las plantas esta determinado por el micelio interno del hongo, ya que posee mayor capacidad de absorción de los nutrimentos del suelo mediante la extensa red de hifas que el hongo pueda generar.
Altura de las plantas.
Las dimensiones de las posturas, ya sea longitud de la raíz o de la parte aérea, constituye uno de los indicadores más importante para determinar la calidad de las posturas producidas en viveros frutícolas (19).
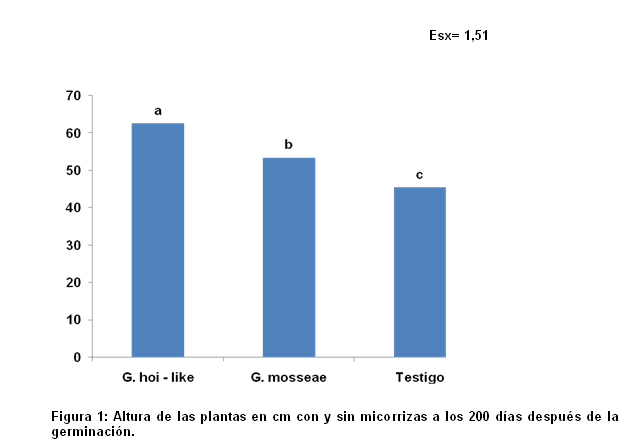
A los 200 días de edad del cultivo, el análisis estadístico indicó, que el efecto de los hongos micorrízicos arbusculares en el crecimiento, fue evidente comparado contra el control. El mayor crecimiento en las plantas se registró con los tratamientos donde se aplicaron las cepas de hongos, cuya altura registraron valores promedio de 62.6 Glomus hoi - like y Glomus mosseae 53.4 cm respectivamente Figura 1.
Diámetro del tallo: El diámetro como un parámetro que permite conocer el vigor de la planta, manifestó diferencias estadísticas entre las cepas estudiadas, resultando mayor el efecto con Glomus hoi – like con relación a Glomus mosseae y al Testigo. En general se observa un crecimiento de tallo diferenciado en el momento del muestreo Figura 2.
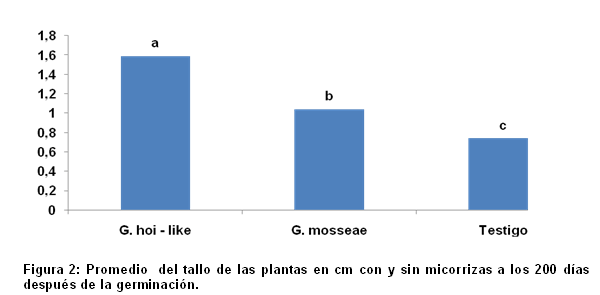
La plantas tuvieron respuestas a la inoculación con las diferentes especies de HMA, un efecto diferenciado entre las cepas, ya que se obtuvieron los mayores incrementos en altura y diámetro del tallo con la inoculación de Glomus hoi–like respecto al testigo sin inoculación y a la cepa Glomus mosseae
Al analizar fisiológicamente el comportamiento productivo de cualquier especie vegetal de interés agrícola, los incrementos de las variables de crecimiento y el rendimiento está estrechamente relacionado con los procesos fotosintéticos que ocurren en las hojas por lo que es de vital importancia el análisis de las variables morfológicas vinculadas a este proceso.
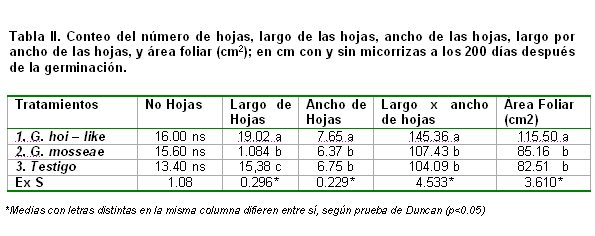
En la Tabla II, se muestran los resultados de las variables largo de las hojas, ancho de las hojas, largo por ancho de las hojas y el área foliar en la que se puede apreciar para la mayor parte de las variables se manifiesta una influencia significativa de la composición del sustrato y la inoculación del producto micorrizógeno, no siendo haci para el numero de hojas donde no se muestran diferencias estadísticamente significativas. Estos resultados no coinciden con los reportados (20) que en similar experimento en suelo Ferralítico Cuarcítico amarillo lixiviado en posturas de guayaba obtiene diferencias significativas para el número de hojas; como producto del aumento de la dosis se EcoMic® donde se incrementa el numero de hojas.
No sólo los ciclos biogeoquímicos de los nutrientes son propulsados por microorganismos, sino que, además, los componentes de la microbiota del suelo protagonizan diversas acciones que producen beneficios para las plantas con las que se asocian. Entre otras acciones, los microorganismos facilitan la captación de nutrientes, producen fitohormonas que favorecen el enraizamiento, protegen a la planta contra patógenos, incrementan la resistencia/tolerancia de la planta a la sequía o salinidad, descomponen sustancias tóxicas en el ecosistema y mejoran la estructura del suelo (21,22).
(23) evaluando el comportamiento de 15 cepas de HMA en tres tipos de suelos (Ferralíticos Rojos Lixiviados de montaña, Fersialíticos Rojos Lixiviados y Pardos Gleyzosos) sobre el crecimiento de posturas de cafeto; ejemplificó muy claramente el comportamiento diferenciado de los inóculos para cada tipo de suelo quedando claro el agrupamiento de las cepas en estos casos en cuatro grupos dependiendo de la eficiencia de las mismas en los resultados medidos (área foliar, extracción y concentración de nutrientes, altura y pares de hojas).
Otros resultados importantes fueron encontrados (24) en suelos Cambisoles calcáreos y Nitisoles éutricos para cuatro cultivos (papa, yuca, boniato y ñame). Dentro de los resultados más significativos se encontró el hecho del buen funcionamiento o efectividad de la inoculación con cepas de HMA en las raíces y tubérculos en ambos suelos, con comportamientos muy superiores al testigo sin inocular. Es decir, se presentaron dos efectos al unísono, por una parte una alta especificidad suelo-cepa eficiente y por la otra una baja especificidad cultivo-cepa.
Esta conducta fue completamente reproducible en este experimento con este sustrato, en presencia de un solo cultivo, así como de las condiciones de disponibilidad de nutrientes.
(25) estudiaron el grado de colonización por hongos micorrízicos arbusculares y la dependencia fisiológica a la simbiosis micorrízica en poblaciones silvestres y cultivadas de pitayo, nopal y agave. Los resultados de estas investigaciones arrojaron que la colonización de las MVA se acompañó con un incremento en el contenido de P en la planta y se asoció con un mayor crecimiento vegetativo. En las plantas de pitayo se registró una mayor tasa de crecimiento en las ramas, peso del fruto y semillas, y germinación de éstas, lo cual se atribuye al hecho de diferentes grados de colonización favorecida por un contenido bajo de P en el suelo y una mayor precipitación pluvial. Consideramos que las respuestas en crecimiento vegetativo, observadas son debidas a que la simbiosis micorrízica favorece la absorción de P, y tal vez Fe y Zn.
(26) plántulas micropropagadas de aguacate que mostraron un lento crecimiento durante la fase de aclimatación y ensayaron la inoculación con G. fasciculatum. La inoculación mejoró la formación de un sistema radical bien desarrollado, el cual fue convertido en sistema micorrízico. Mejoró el crecimiento radical de la parte aérea, y se incrementó la relación parte aérea-raíz, la concentración de Nitrógeno, Fósforo y Potasio en el tejido de la planta, y la tolerancia de las plantas al estrés ambiental en el trasplante. Así, la micorriza parece ser un factor para el subsecuente crecimiento y desarrollo de plántulas micropropagadas de aguacate.
Al analizar los indicadores del comportamiento de la simbiosis micorrízica, se observó un efecto de la inoculación con las cepas de HMA sobre el porcentaje de colonización de las raíces de las posturas y la densidad visual; los mayores valores se obtuvieron con la cepa Glomus hoi–like, con diferencias respecto a la otra cepa estudiada y el testigo sin inoculación (Tabla III).

Este resultado estuvo en correspondencia con los obtenidos en las variables analizadas anteriormente Tabla II; al ocurrir un mejor comportamiento de la simbiosis micorrízica, se estimuló el desarrollo vegetativo de las posturas en esta fase.
Esto, demostró las ventajas de la inoculación de las semillas de aguacate con una cepa eficiente de HMA, pues estimuló su crecimiento aportando así mayores beneficios provocados por esta alternativa nutricional.
El establecimiento efectivo de la micorriza arbuscular depende de muchos factores: la existencia de una planta hospedera susceptible y propágulos infectivos, así como la confluencia de factores físicos, químicos, biológicos, climáticos y de prácticas que favorezcan su formación y funcionamiento. Así mismo, el porcentaje de asociación y el número de esporas, también dependen de este tipo de factores, que siempre son específicos para cada sitio, entre ellos el pH, la temperatura, el contenido de humedad del suelo, la fertilización y el uso de agroquímicos (27, 28).
Se ha afirmado que la biomasa total de los organismos del suelo, incluidos los HMA, es mayor en un suelo rico en materia orgánica (29). Esto concuerda con estudios realizados (30), quienes encontraron una interacción de tipo positiva entre el número de esporas y el contenido de materia orgánica, en un Inceptisol cultivado con Avena sativa, lo que sugiere que esta condición le es favorable al hongo para su desarrollo. Sin embargo (31) no obtuvieron diferencias en el número de esporas, al adicionar composta en un Ultisol.
Aunque los registros varían y aún no es claro el efecto de la materia orgánica sobre los HMA, hay evidencias de que puede afectar positivamente la presencia de especies de HMA nativos. Este efecto positivo se ha explicado con el aumento en la disponibilidad de nutrientes para la planta hospedera y el incremento en las comunidades microbianas que favorecen la acción de los HMA (27).
Al analizar el índice de eficiencia de las cepas estudiadas se observó que el mayor valor se obtuvo con la cepa Glomus hoi–like, con respecto a la cepa Glomus moseeae (Tabla IV). Resultado este que demostró como el crecimiento es afectado favorablemente por las micorrizas.

La adición de fertilizantes en el sustrato mejora en algunas ocasiones la interacción de la planta con la endomicorriza. Estudios realizados (32) con mezclas de suelo - vermiculita con y sin superfosfato soluble (SS) mostraron diferencias en el crecimiento de plántulas inoculadas; cuando se adicionó SS el crecimiento aumentó con Glomus clarum, G. intraradix, Scutellospora heterogama y Gigaspora margarita en cambio, cuando la mezcla de suelo no se mejoró, únicamente S. heterógama aumentó el crecimiento de la planta. Estos mismos autores trabajando con el mango obtuvieron una mayor respuesta en crecimiento al inocular con G. margarita. La respuesta para mango y aguacate por efecto de la micorriza fue de 30% y 20 % con SS; sin embargo, no hubo efecto significativo con la mezcla sin el fósforo.
La cepa de Glomus hoi–like estudiada ha funcionado adecuadamente en los suelos Ferralíticos Rojos, para una diversidad de cultivos, lo que indica una baja especificidad cepa eficiente de HMA-cultivo (33).
La baja especificidad cepa eficiente de HMA-cultivo significa que, para una condición edáfica dada, establece una simbiosis efectiva con cualquier cultivo dependiente de la micorrización que se establezca en ese suelo. Los diferentes cultivos muestran distintos efectos cuantitativos por la inoculación, pero las cepas eficientes siempre son las mismas para cualquiera de los cultivos o al menos para la mayoría (34).
Conclusiones
Los resultados indicaron que las posturas de aguacate fue un cultivo con el que Glomus hoi–like resultó la cepa más eficiente en este sustrato, lo que concuerda con los criterios de baja especificidad cepa de HMA–cultivo, obtenidos en otras investigaciones que evaluaron la efectividad de varias cepas de HMA en diversos cultivos (35).
Los hongos micorrízicos en aguacate además de favorecer la absorción y aprovechamiento de los nutrimentos del suelo para la planta, también producen incrementos del crecimiento y salud de las plantas. Sin embargo, los hongos requieren para su funcionalidad satisfacer sus requerimientos energéticos mediante el uso de compuestos orgánicos procedentes de la planta, creando así un sistema de asociación del tipo mutualista, donde como su nombre lo indica, se establece el beneficio mutuo de ambos componentes involucrados en dicha asociación.
El uso de la micorriza como técnica aplicada en aguacate (Persea americana Mill) representa una estrategia potencial en el desarrollo de la especie como cultivo dentro de un enfoque sustentable. La presencia de la simbiosis en campo y el papel que pueda tener dentro de un sistema de producción no está muy documentado, ya que los trabajos realizados en su mayoría son en vivero y propagación in vitro donde se han logrado los mejores resultados.
Con el uso de biotecnologías como la endomicorriza y en la medida en que se de mas importancia a las estructuras ecológicas involucradas en los sistemas de producción, se tenderá a la creación de sistemas sustentables que contribuyan en la preservación del ambiente, reduciendo además los costos de producción al utilizar en menor proporción insumos externos.
Referencias
1. Bernal, J. A., C. A. Díaz. 2005. Tecnología para el cultivo de aguacate. Manual Técnico 5. Corpoica. Centro de Investigación La Selva. Rionegro, Antioquia. 54p.
2. Molina, L. M. 2000. Propagaçao de Frutíferas Tropicais. Livraria e Editora Agropecuaria. 122 p.
3. Finlay R.D. 2008. Ecological aspects of mycorrhizal symbiosis: with specialemphasis on the functional diversity of interactions involving the extraradical mycelium. Journal of Experimental Botany, Vol. 59, No. 5, pp. 1115–1126.
4. Encina, C. y Barceló, A. Micorríza. En línea. Disponible en: <http://www.Ciencias.uma.es/publicaciones/encuentros/ENCUENTROS55/micorriza. Html>. Consultado en: 2 de mayo del 2006.
5 Fernández, M. A. Micorríza, una simbiosis vital en la naturaleza. Disponible en: http://www.Consumer.es/medioambiente. Consultado en: 7 de julio 2006.
6. Dell´ Amico, J. M.; Rodríguez, P.; Torrecillas, A.; Morte, A. y Sánchez-Blanco, M. J. Influencia de la micorrización en el crecimiento y las relaciones hídricas de plantas de tomate sometidas a un ciclo de sequía y recuperación. Cultivos Tropicales, 2002, vol. 23, no. 1, p. 29-34.
7. Fundora-Sánchez, L. R: Empleo de hongos micorrízicos arbusculares en el cultivo del tomate en condiciones de buen abastecimiento hídrico y período de estrés y suefecto sobre el desarrollo y las relaciones hídricas. Tesis en opción al Título Académico de Maestro en Ciencias. INCA. MES. Cuba, 2007, p. 8-40.
8. Estaún V; Calvet C. y A. Camprubí. 2002. Inoculación con hongos formadores de micorrizas arbusculares de plantones de olivo y portainjertos de frutales micropropagados. Valoración de su comportamiento después de su trasplante a campo. Informe final del proyecto PETRI 95-0141-OP. Agromillora Catalana S.A. & FRUTESA. España.
9. Proorganic.com/Eco_dosis.htm. El biofertilizante EcoMic®. Instrucciones de uso., 2008, 3 p.
10. Hernández, A.; Pérez, J. M.; Bosch, D. y Rivero, L. Nueva versión de la clasificación genética de los suelos de Cuba. Instituto de Suelos. MINAGRI, 1999. La Habana, 64 p.
11. Calderón, A., Soto F., Calderón, M. y Fundora L. R. ESTIMACION DE AREA FOLIAR EN POSTURAS DE MANGO (Manguifera indica L.) y AGUACATERO (Persea spp) EN FASE DE VIVERO, A PARTIR DE LAS MEDIDAS LINEALES DE LAS HOJAS. Cultivos Tropicales, 2009, vol. 30, no. 1, p. 43-48.
12. Hurtado, T. y E. Sieverding. 1986. Estudio del efecto de hongos formadores de micorriza vesiculo-arbuscular (MVA) en cinco especies latifoliadas regionales en la zona geográfica del Valle de Cauga, Colombia. Suelos Ecuatoriales.16:109-115.
13. Phillips, J.M.; Hayman, D.E. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Trans. Br Mycol. Soc. 55: 158-161, 1970.
14. Giovanetti, M.; Mosse, B. An evaluation of techniques to measure vesicular-arbuscular infection in roots. New Phytologist 84: 489-500, 1980.
15. Lerch, G. La experimentación en las ciencias biológicas y agrícolas. Editorial Científico técnico, 1977, 452 p.
16. Trouvelot, A.; Kough, J.; Gianinazzi Pearson, V. Mesure du Taux de Mycorhization VA d'un Systeme Radiculaire. Recherche de Methodes d'Estimation ayantune Signification Fonctionnelle. Proceedings of the 1st European Symposium on Mycorrhizae: Physiological and Genetical Aspects of Mycorrhizae, Dijón, 1 5 July, 1985. (V. Gianinazzi Pearson y S. Gianinazzi, eds.). INRA, Paris. p. 217 222, 1986.
17. Siqueira, J. O. y A. A. Franco. Biotecnologia do solo. Fundamentos e Perspectiva. MEC-ESAL-FAEPE-ABEAS. Brasilia, D. F. 235 p.1988.
18. Rivera, R. /et al/. Efecto de la inoculación con hongos micorrizógenos (v.a) y bacterias rizosféricas sobre el crecimiento de las posturas de cafeto. Cultivos Tropicales 18(3): 15-23, 1997.
19. Cochran, W and G. Cox. Diseños experimentales. México Editorial Trellas.132,135.—1990.
20. Cañizares J. 1976. La guayaba y otras frutas mirtáceas. Ed. Pueblo y Educación. La Habana. 34-36p.
21. Negrín R. J, Martínez D. García L.E. y M. Picarín. 2005. Determinación del área foliar en posturas en vivero de aguacate y guayaba utilizando métodos matemáticos no destructivos. Trabajo presentado en el XIV Fórum de Ciencia y Técnica de Fac. Agronomía. CUJMO. (No publicado).
22. Barea, J.M. Las micorrizas arbusculares componente clave en la productividad y estabilidad de agroecosistemas 2002. Disponible en: http://www.csic.es/asociaciones/api/principal.html [Consulta: Nov. 2004].
23. García de la Rosa J. EL REINO DE LOS HONGOS. 2003. Disponible en: http://www.csic.es/asociaciones/api/principal.html [Consulta: diciembre 2003].
24. Sánchez, C. 2001. Manejo de las asociaciones micorrízica arbusculares y abonos verdes en la producción de posturas de cafeto en algunos tipos de suelos. Tesis de Doctorado. INCA. 105p.
25. Ruiz, L. 2001. Efectividad de las asociaciones micorrízicas en especies vegetales deraíces y tubérculos en suelos Pardos y Ferralíticos rojos de la Región central de Cuba. Tesis de Doctorado. 95 p. INCA, Cuba.
26. Pimienta, E., Olalde V. y Nobel P., S. 2001. Efecto de las micorrizas versículo arbusculares en la respuesta estructural y fisiológica de plantas CAM de importancia económica. Departamento de Ecología. CUCBA. Universidad de Guadalajara. Código de Proyecto: 28818-B.
27. Gonzáles, CH. C,; Ferrera, C. R. y Pérez, M. J. 1998. Biotecnología de la MicorrizaArbuscular en Fruticultura. Folleto Técnico Plant Health Care. 16-19- pp.
28. Sánchez de Prager, M. 1999. Las Endomicorrizas en Agroecosistemas Colombianos. Universidad Nacional de Colombia. Sede Palmira. pp: 33-92.
29. Alvarado, A., M. Chavarría, R. Guerrero, J. Boniche & J. R. Navarro. 2004. Características edáficas y presencia de micorrizas en plantaciones de teca (Tectona grandis L.f). Agronomía Costarricense 28(1): 89-100.
30. Magdoff, F. 1999. Calidad del suelo. En: Agroecología:Bases científicas para una agricultura sustentable. Altieri, M. A. (Edit). Nordan Comunidad. Uruguay. pp 291-304.
31. Castillo, C., I. Astroza, F. Borie & R. Rubio. 2008. Efecto de cultivos hospederos y no hospederos sobre propágulos micorrícicos arbusculares. R.C. Suelo Nutr. Veg. 8 (1): 37-54.
32. Millaleo, R., C. Montecinos, R. Rubio, A. Contreras & F. Borie. 2006. Efecto de la adición de compost sobre propágulos micorrícicos arbusculares en un suelo volcánico del centro sur de Chile. R.C.Suelo Nutr. Veg. 6 (3): 26-39.
33. Silva L. C. and J. O. Siqueira. 1991. Growth and nutrient contents of avocado, mango and papaya seedlings under the influence of different vesicular-arbuscular mycorrhiza fungal species. Revista Brasileira de Ciencia do solo 15: 283-288.
34. Rivera, R. y Fernández, K. Bases científico-técnicas para el manejo de los sistemas agrícolas micorrizados eficientemente. En: Rivera, R. y Fernández, K., Eds. Manejo efectivo de la simbiosis micorrízica, una vía hacia a agricultura sostenible. Estudio de caso: el Caribe. LaHabana : Ediciones INCA, 2003. 166 p.
35. Rivera, R.; Ruiz, L.; Fernández, F.; Sánchez, C.; Riera, M.;Hernández, A.; Fernández, A.; Fernández, K. y Planas, R. La simbiosis micorrízica efectiva y el sistema suelo-plantafertilizante En: Congreso Sociedad Cubana de la Ciencia del Suelo (6: 2006 mar 8–10: La Habana). Memorias. [CD–ROM] Ciudad de la Habana: Centro de Convenciones Capitolio, 2006.
36. González, P. J.; Arzola, J.; Morgan, O.; Rivera, R.; Plana, R.y Fernández, F. Manejo de las asociaciones micorrízicas en pastos del género Brachiaria cultivados en suelos Ferralítico Rojo y Pardo Mullido. En Congreso Científico del INCA (16: 2008, nov 24-28, La Habana). Memorias.[CD–ROM]. Instituto Nacional de Ciencias Agrícolas. ISBN 978-959-16-0953-3.
Recibido 21/07/2010, aceptado 7/06/2011.













