Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.33 no.3 La Habana jul.-set. 2012
Actividad antifúngica de la quitosana en el crecimiento micelial y esporulación del hongo Pyricularia grisea Sacc
Antifungal activity of chitosan on mycelial growth and sporulation of the Pyricularia grisea Sacc. fungus
Anayza Echevarría Hernández, I Ariel Cruz Triana;II Deyanira Rivero GonzálesII y Aida T. Rodrígues Pedroso; II Miguel A. Ramirez Arrebato, III Regla M. Cárdenas Travieso, IV
IEspecialista de La Unidad Científico Tecnológica de Base Los Palacios.
IIInvestigadores Agregados de La Unidad Científico Tecnológica de Base Los Palacios.
III Investigador Auxiliar de La Unidad Científico Tecnológica de Base Los Palacios.
IV Investigador Auxiliar del departamento de Genética y Mejoramiento Vegetal, Instituto Nacional de Ciencias Agrícolas, gaveta postal 1,
San José de las Lajas, Mayabeque, CP 32 700.
RESUMEN
El presente trabajo se desarrolló en el laboratorio de Fitopatología Vegetal de La Unidad Científico Tecnológica de Base Los Palacios. Con el objetivo de estudiar la actividad antifúngica de cuatro formulados de quitosana Q (100, 500, 1000 mg.L-1) y quitosana + cobre (QCu-100 mg.L-1), en el crecimiento micelial y esporulación in vitro del hongo Pyricularia grisea Sacc. Los resultados mostraron que solo la quitosana a la concentración de 1000 mg.L-1 y QCu-100 mg.L-1 indujeron mayor efecto inhibitorio a los cuatro días de la aplicación, que resultó ser de 27-30 %; no ocurrió lo mismo en el caso de la esporulación, que fue inhibida al 100 % por el QCu, mientras que la quitosana a la concentración de 100 y 500 mg.L-1 desarrolló porcentajes de inhibición comprendidos entre 80 y 96 % el centro y la periferia de la colonia, respectivamente. Adicionalmente, la quitosana, con una concentración mayor (1000 mg.L-1), no produjo un efecto inhibitorio notable en la esporulación.
Palabras clave: Pyricularia grisea, Oryza, arroz, quitosana.
ABSTRACT
The work was made in the Plant Phytopathology Laboratory belonging to the Scientific and Technological Base Unit Base Los Palacios. The aims of this research was to evaluate the antifungal activity of four chitosan formulates Q (100, 500, 1000 mg.L-1) y chitosan and copper (QCu-100 mg.L-1) on the mycelial growth and in vitro sporulation rate of Pyricularia grisea Sacc fungus. Results showed that 1000 mg.L-1 chitosan and QCu-100 mg.L-1 had the greatest inhibitory effect on four day with 27 y 30 %, respectively. However fungal sporulation was inhibited in 100 % by el QCu, while Q 100 y Q 500 had inhibitory percentages between 80 y 96 % on center and peripheral zones respectively. In addition, Q-l000 mg.L-1 chitosan had not a noticeable effect on fungal sporulation.
Key words: Pyricularia grisea, Oryza, rice, chitosan.
INTRODUCCIÓN
El arroz es considerado uno de los cereales de mayor preferencia en el consumo mundial, lo que explica la importancia estratégica en su producción para muchos países (1, 2). En Cuba constituye el producto básico en la canasta familiar, con un consumo percápita de 69.5 kg.año-1 (1, 2, 3); sin embargo, la producción nacional anual abastece menos del 50 % del consumo (4).
Entre los que limitan altas producciones del cultivo se destacan los bajos rendimientos, los que no sobrepasan las 3.6 t.ha-1 (5), en lo cual las enfermedades fungosas juegan un papel predominante.
La Piriculariosis, producida por el hongo Pyricularia grisea Sacc o Magnaporthe grisea Herbert, es la enfermedad más devastadora en el cultivo del arroz, con gran distribución en el país y en el mundo entero, llegando a ocasionar pérdidas superiores al 70 % del rendimiento agrícola (6, 7).
Dentro de las medidas técnicas del cultivo están incluidas las aplicaciones foliares de fungicidas químicos en distintas fases de su ciclo vegetativo, además del tratamiento a la semilla (8); en este sentido, los formulados a base de cobre, tienen la propiedad de actuar sobre las esporas coagulando el protoplasma celular, encontrándose este elemento entre los iones de metales pesados que actúan como elicitores químicos (9, 10); no obstante, la enfermedad persiste en las áreas de siembra.
Es por eso que se trabaja en la búsqueda de productos bioactivos para el control de la piriculariosis, que sean biodegradables, no tóxicos para el hombre y animales, tengan elevada efectividad, bajo costo y no contaminen el ambiente. En este sentido, diferentes estudios indican que la quitosana tiene la potencialidad de inhibir el crecimiento micelial de numerosos hongos fitopatógenos y de estimular los mecanismos de defensa de las plantas (11, 12, 13, 14).
Teniendo en cuenta lo antes planteado, se realizó este trabajo con el objetivo de estudiar la actividad antifúngica de cuatro formulados de quitosana en el crecimiento micelial y esporulación de un aislamiento monospórico del hongo Pyricularia grisea Sacc.
MATERIALES Y MÉTODOS
El trabajo fue conducido en el laboratorio de Fitopatología Vegetal de la Unidad Científico Tecnológica de Base Los Palacios, perteneciente al Instituto Nacional de Ciencias Agrícolas (INCA). Se utilizó un aislamiento monospórico del hongo Pyricularia grisea Sacc., obtenido a partir de síntomas típicos de la enfermedad sobre hojas de la variedad de arroz J-104 colectadas en la UEB Agrícola Caribe, perteneciente al Complejo Agroindustrial Arrocero «Los Palacios».
La quitosana (Q-63) se obtuvo a partir de la quitina de langosta, procedente de los laboratorios farmacéuticos «Mario Muñoz» y siguiendo la metodología de obtención propuesta (13, 15). El grado de acetilación fue del 63 % y polimerización de 278 (16, 17, 18, 19). Se utilizó el sulfato de cobre a las mismas concentraciones que la quitosana para comparar su efectividad como antifúngico y también se utilizó la combinación entre quitosana y sulfato de cobre.
Efecto de los formulados de quitosana sobre el crecimiento micelial y la esporulación del hongo Pyricularia grisea
Para el montaje del experimento, se tomaron discos miceliales de 5 mm de diámetro que se sumergieron durante 15 minutos en las disoluciones que aparecen en la Tabla I, colocándose en el centro de cada placa Petri con medio sólido Agar Salvado de Arroz (ASA) (20, 21), pH-6, y se incubaron a temperatura 26.±20C, con alternancia de luz-oscuridad de 12 h.
Posteriormente, se midió el diámetro de las colonias a los cuatro, seis, ocho y diez días con una regla graduada en milímetros, restándole el diámetro del disco sembrado. A los 10 días se hizo el conteo de la esporulación marcando cuatro puntos en el centro y cuatro puntos en la periferia. Luego, con la ayuda del microscopio óptico, con aumento de 400x, se observó el número de conidióforos con conidios presentes en cada punto. Para evaluar la esporulación, se aplicó la escala de cuatro grados (9), en la cual se reemplazaron los signos relativos a los grados por números (3). Se registró además, el color, la forma y textura de la colonia (Tabla II).

Con ayuda de una cámara de conteo SMIEC (XB-K-25), se determinó el número de esporas por tratamiento y se calculó el porcentaje de inhibición por la fórmula:
% de inhibición = (1x tratado/control) x 100
Se utilizó un diseño experimental completamente aleatorizado con seis réplicas. Los datos obtenidos se procesaron mediante un análisis de varianza de clasificación simple, los que fueron transformados según la fórmula 2 arcosen Ö% y las medias obtenidas se docimaron mediante el test de rangos múltiples de Tukey, con un nivel de significación de 5 % de probabilidad de error.
RESULTADOS Y DISCUSIÓN
Debido a que el hongo Pyricularia grisea posee alta diversidad genética (6) es necesario contar con cultivos monospóricos (desarrollados a partir de una sola espora o conidio) que permitan lograr uniformidad genética en la colonia lo que a su vez asegura una alta precisión en los resultados (9).
Efecto de los formulados de quitosana sobre el crecimiento micelial del hongo Pyricularia grisea
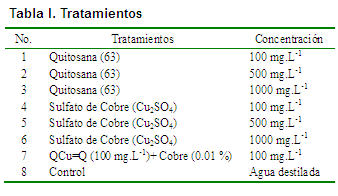
Al observar los tratamientos evaluados en los porcentajes de inhibición se puede apreciar que decrecieron a medida que transcurrió el tiempo (Figura 1). El sulfato de cobre a la concentración de 1000 mg.L-1 tuvo mayor inhibición del crecimiento micelial en todos los días evaluados, con diferencias significativas para el resto de los tratamientos, excepto a los seis días, que no hubo diferencias significativas con QCu 100 mg.L-1. Sin embargo, de los tratamientos con quitosana, solo a la concentración de 1000 mg.L-1 hubo apreciable inhibición del crecimiento micelial, alcanzando el máximo porcentaje a los cuatro días, sin diferencias significativas con QCu 100 mg.L-1 a los cuatro y ocho días, y diferenciándose de los demás tratamientos, que resultaron además muy bajos para ser considerados, de manera general, como antimicrobiano.
En los últimos 10 días, los porcentajes de inhibición diferenciaron entre todos los tratamientos, los que alcanzaron los menores valores. En la literatura consultada al respecto, existen estudios que confirman la actividad antifúngica de la quitosana, a la concentración, 1000 mg.L-1 sobre el hongo P. grisea (14, 21, 22, 23, 26). Sin embargo, las diferencias obtenidas respecto a los mayores porcentajes de inhibición en el crecimiento de este hongo, en comparación con los resultados de este trabajo, podrían ser atribuidas al modo de ensayo, medio de cultivo utilizado y a las características fisiológicas de los aislamientos evaluados, como se refleja en trabajos donde se han utilizado otros formulados de quitosana (16, 22, 23).
Otros estudios demostraron el efecto antimicrobiano de la quitosana, en los 14 hongos fitopatógenos más importantes del cultivo del arroz, dentro de los cuales se encuentra Helminthosporium orysae y Rhizoctonia solani, con porcentajes de inhibición del crecimiento de más de 50 y 80 % respectivamente (9, 21, 24, 25).
Una interpretación de la poca efectividad antimicrobiana en P. grisea, pudiera ser que en el caso de este patógeno, la pared celular está constituida por quitina, b-1,3 glucano y ¶-heteropolisacárido que son polisacáridos complejos y presentan además varios azúcares entre otros constituyentes químicos (14, 26). Teniendo en cuenta esto, es probable que el comportamiento observado en la Figura 1 sea motivado por la composición de la pared celular del hongo P. grisea, ya que sus paredes están quitinizadas y constituyen una barrera natural, que impide o dificulta la penetración de cualquier sustancia (9, 27). Por otro lado, estudios histoquímicos demostraron que en algunos patógenos la actividad antifúngica de la quitosana, es causada por la deposición de las moléculas dentro de la célula fúngica inhibiendo el crecimiento micelial5 (9, 22, 23, 25, 28).
Como los estudios realizados por otros autores mostraron ausencia de correlación entre el crecimiento y esporulación de Pyricularia grisea (9, 29), es necesario confirmar si la quitosana afecta el proceso esporulativo que es, en definitiva, el que reviste mayor importancia desde el punto de vista agrícola, pues la enfermedad se disemina a través de estructuras reproductivas denominadas conidios (6, 9).
Efecto de los formulados de quitosana sobre la esporulación del hongo Pyricularia grisea
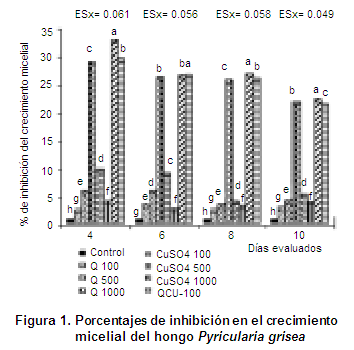
Como se pudo comprobar (Figura 2) algo diferente ocurre cuando se evalúa el efecto de los productos en el porcentaje de inhibición de la esporulación.
Como se observa en la Figura 2, hubo inhibición total en los tratamientos correspondientes a las distintas concentraciones de sulfato de cobre, lo que hace evidente su efecto antifúngico ante el hongo P. grisea (10, 14). En cuanto a los formulados con quitosana, solo la QCu 100 mg.L-1, presentó los valores más elevados de inhibición en la esporulación (100 %) tanto en el centro como en la periferia de la colonia, sin diferencias significativas con el Cu2SO4, indicando realmente mayor toxicidad durante el efecto de este producto en el desarrollo ulterior del hongo, a partir de la inoculación (9, 20). No obstante, las concentraciones de quitosana 100 y 500 presentaron diferencias significativas entre ellas, con valores de inhibición de la esporulación entre 80 y 96 % en el centro y 68 y 85 % en la periferia. En este caso la quitosana 100 fue la que alcanzó el valor más elevado. Resultado que concuerda con estudios realizados (9, 17, 20), donde se obtuvieron los mayores porcentajes de inhibición a esa concentración. Sin embargo, la Q-1000 mg.L-1 desarrolló menor inhibición (inferior a 30 %) que el resto de los tratamientos, lo que se puede atribuir a que a esta concentración la viscosidad de la quitosana dificulta su penetración al interior de las células fúngicas y por tanto su efecto es menor (9, 20).
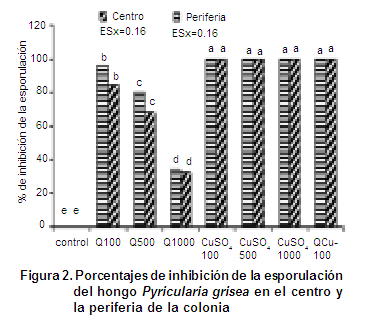
Una presentación de la distribución de la esporulación en los diferentes tratamientos (Tabla III), se pudo establecer que en los tratamientos correspondientes a Q-1000 mg.L-1 y el control (agua), la esporulación fue grado 3, que representa en la escala, mucha esporulación (6-9 conidióforos con conidios), posteriormente la Q-100 mg.L-1 y Q-500 mg.L-1 obtuvieron grado 1 representando poca esporulación en el centro de la colonia (1-2 conidióforos con conidios), mientras que en la periferia esta resultó ser de grado medio (4-5 conidióforos con conidios). Esto se explica probablemente con una de las hipótesis sugeridas en investigaciones citadas (25), donde se plantea que la quitosana a bajas concentraciones es capaz de penetrar en la célula fúngica e interactuar con el ADN, causando desorden en su estructura, así como inhibición en la síntesis de ARNm y proteínas, afectando como consecuencia el proceso esporulativo (9, 27). Las concentraciones de sulfato de cobre (Cu2SO4) no presentaron esporulación.
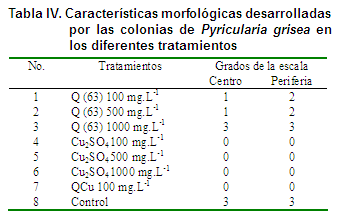
Haciendo una caracterización morfológica de las colonias del hongo, en los diferentes tratamientos, los resultados experimentales demostraron que las características culturales de las colonias de P. grisea varían de acuerdo con el medio de cultivo empleado como son: color, crecimiento de los bordes de la colonia y penetración en el sustrato, además que el hongo necesita medios de cultivo elaborados a partir de infusiones de órganos vegetales del arroz para obtener buen crecimiento y desarrollo, por lo que se plantea que el micelio en cultivo puede ser aéreo o sumergido, hialino, carmelitoso, verde oliváceo o negruzco, ramificado (30).
Por otro lado se comprobó que las quitosanas en sus diferentes concentraciones y además el QCu no indujeron variaciones en la morfología de las colonias de P. grisea crecidas en medios Agar Salvado de arroz (Tabla IV), lo que evidencia que en este estudio el hongo presentó estabilidad en las características culturales propias del aislamiento seleccionado.
CONCLUSIONES
De manera general, atendiendo a los resultados podemos inferir que la quitosana en bajas concentraciones (Q-100 mg.L-1) no causa un efecto letal, en el crecimiento micelial del hongo, resultado que coincide con el de otros autores (9, 27). No comportándose de la misma forma en la esporulación, donde los valores de inhibición estuvieron por encima del 70 %, y teniendo en cuenta que el hongo en el campo se disemina por los conidios, la aplicación de las formulaciones a base de quitosana en bajas concentraciones, pudiera atribuir a la reducción del inóculo inicial de la enfermedad.
Otro tratamiento que tuvo un buen comportamiento en la esporulación, fue el formulado de QCu 100 mg.L-1, por su efecto inhibitorio (100 %), pero teniendo en cuenta que el cobre (Cu2) es un metal pesado, su utilización aumentaría la acumulación del mismo en el suelo y por consiguiente afectaría la productividad del cultivo, no debe ser considerado como otra alternativa de manejo para el control de este patógeno.
REFERENCIAS
1. FAO. Perspectivas de cosechas y situación alimentaria [En línea]. 2009. Consultado diciembre 2010. Disponible en: www.fao.org/docrep/014/al980s/al980s00.pdf
2. FAO. Perspectivas de cosechas y situación alimentaria [En línea]. 2010. Consultado en diciembre 2011. Disponible en: www.fao.org/docrep/013/al972s/al972s00.pdf.
3. Instituto de Investigaciones del Arroz. Normas Técnicas para el consumo del arroz. Sancti Spíritus. Ministerio de la Agricultura. Cuba. 2009.
4. Martínez, B.; Reyes, Y. e Infante, D. Enfermedades Fungosas de importancia [En línea]. 2009. Consultado Diciembre 2010. Disponible en: www.Agrytec.com-Copyright/.
5. Instituto de Investigaciones del Arroz. Instructivo técnico del cultivo de arroz. Ministerio de la Agricultura. Cuba. 2008.
6. Cárdenas, R. M.; Pérez, N.; Cristo, E.; González M. C. y Fabré, L. Monitoreo de la Piriculariosis (Pyricularia grisea Sacc.) en el cultivo del arroz (Oryza sativa Lin). Fitosanidad, 2007, vol. 11, no. 1, p. 41-42.
7. Proyecto de Colaboración Europeo. Obtener arroz más resistente a enfermedades [En línea]. 2009. Consultado diciembre 2010. Disponible en: www.adn.es/local/valencia/20090507/NWS-1789-UPV-enfermedades-resistente-proyecto-colaboración.
8. Rivero, D.; Cruz, A. T.; Martínez, B.; Ramírez, M. A. y Rodríguez, A. T. Actividad antifúngica in vitro de la quitosana Sigma frente a hongos fitopatógenos causantes del manchado del grano en el cultivo de arroz (Oryza sativa L.). Fitosanidad, 2009, vol. 13, no. 2.
9. Cárdenas, R. M.; Ramírez, M. A.; Rodríguez, Aida T. y González, L. M. Efecto de los derivados de quitina y su combinación con sulfato de cobre en el comportamiento del crecimiento micelial y esporulación de un aislamiento monospórico del hongo Pyricularia grisea Sacc. Cultivos Tropicales, 2004, vol. 25, no. 4, p. 89-93.
10. Robinson-Lora, M. A. y Brennan, R. A. Efficient metal removal and neutralization of acid mine drainage by crab-shell chitin under batch and continuous-flow conditions. Bioresource technology, 2009, vol. 100, no. 21, p. 5063-5071.
11. Rodríguez, A. T. Efecto de derivados de quitina en la inducción de mecanismos defensivos y en la protección del arroz contra Pyricularia grisea. [Tesis de maestría] Universidad Agraria de La Habana, 2003. P.75
12. Rodríguez, A. T.; Ramírez, M. A.; Cárdenas, R. M.; Hernández, A. N.; Velásquez, M. G. y Bautista, S. Induction of defense response of Oryza sativa L. against Pyricularia grisea (Cooke) Sacc. by treating seeds with chitosan and hydrolyzed chitosan. Pesticide Biochemistry and Physiology, 2007; vol. 89, no. 3, p. 206-215.
13. Peniche, C. Estudios sobre quitina y quitosana. [Tesis de doctorado]. Universidad de La Habana, 2006. p. 187.
14. Crini, G. y Badot, P. M. Application of chitosan, a natural aminopolysaccharide, for dye removal from aqueous solutions by adsorption processes. Prog Polym Sci., 2008, vol. 33, no. 4, p. 399-447.
15. Ramírez, M. A.; Cabrera, G.; Gutierrez, A. y Rodríguez, T. Metodología para la obtención de quitosana a bajas temperaturas. Cultivos Tropicales, 2000, vol. 21, no. 1, p. 79-82.
16. Pillai, C. K. S.; Paul, W. y Sharma, C. P. Chitin and chitosan polymers: Chemistry, solubility and fiber formation. Progress in Polymer Science, 2009, vol. 34, no. 7, p. 641-678.
17. Gomes, R. C.; Soares, R. M. A.; Nakamura, C. V.; Souto-Padrón, T.; de Souza, R. F.; de Azevedo Soares Semêdo, L. T. /et al./. Streptomyces lunalinharesii spores contain chitin on the outer sheath. FEMS Microbiol. Lett, 2008, vol. 286, no. 1, p. 118-123.
18. Barriada, J. L.; Herrero, R.; Prada-Rodriguez, D. y Sastre de Vicente, M. E. Interaction of mercury with chitin: A physicochemical study of metal binding by a natural biopolymer. Reactive and Functional Polymers, 2008, vol. 68, no. 12, p. 1609-1618.
19. Nitschke, J.; Altenbach, H. J.; Malolepszy, T. y Mölleken, H. A new method for the quantification of chitin and chitosan in edible mushrooms. Carbohydrate Research, 2011, vol. 346, no. 11, p. 1307-1310.
20. Cárdenas, R. M. Selección de variedades de arroz (Oryza sativa L.) resistentes a la Piriculariosis (Pyricularia grisea) usando métodos tradicionales y biotécnológicos. [Informe Final, PTCT 0122]. CITMA, Pinar del Río. 2003. p. 47
21. Fabregat, M. Aspectos bioecológicos y control de Pyricularia grisea en el arroz. [Tesis de grado]. UNAH, 1984.
22. Ramírez, M. A.; Rodríguez, A. T.; Alfonso, L. y Peniche, C. Chitin and its derivatives as biopolymers with potential agricultural applications. Biotecnología Aplicada, 2010, vol. 27, no. 4, p. 270-276.
23. Ramírez, M. A.; Rodríguez, A. T.; Alfonso, L.; Alfonso, J. A.; Azocar, J. A.; Vázquez, Y. Peniche, C. Composición química y elementos trazas en subproductos de exoesqueletos de langosta Panulirus argus con posible uso agrícola. Revista CENIC Ciencias Químicas, 2010, vol. 41, no. 2, p. 99-104.
24. Cruz Triana, A.; Rivero, D.; Martínez, B.; Ramírez, M. A. y Maqueira, L. Efecto de la quitosana sobre el crecimiento y desarrollo in vitro del hongo S. oryzae Sawada y la protección de semillas de arroz (Oryza sativa Lin). Cultivos Tropicales, 2005, vol. 26, no. 3, p. 83-86.
25. Iriti, M.; Sironi, M.; Gomarasca, S.; Casazza, A. P.; Soave, C.; Faoro, F. Cell death-mediated antiviral effect of chitosan in tobacco. Plant Physiology and Biochemistry, 2006, vol. 44, no. 11-12, p. 893-900.
26. Rivero, D.; Cruz, A. T.; Martínez, B.; Ramírez, M. A. y Rodríguez, A. T. Actividad antifúngica in vitro de dos quitosanas frente a Fusarium subglutinans (Wollenwueber & Reinking), patógeno de arroz (Oryza sativa L.). Revista Protección Vegetal, 2006, vol. 21, no. 2, p. 90-94.
27. Bautista-Baños, S.; Hernández-Lauzardo, A. N.; Velásquez del Valle, M. G.; Hernández-López, M.; Ait Barka, E.; Bosquez-Molina, E. y Wilson, C. L. Chitosan a potencial natural compound to control pre-and postharvest diseases of horticultural commodities. Crop Proteccion, 2006, vol. 2, p. 108-118.
28. Echevarría, A. Estudio de la actividad antifúngica de la quitosana en el crecimiento y esporulación in vitro del hongo Pyricularia grisea Sacc. [Tesis de grado]. Universidad Hermanos Saíz Montes de Oca. Pinar de Río. 2003, p. 42.
29. Ktial, J. C. y Randhawa, N. S. Micronutrientes. Boletin FAO Fertilizantes y nutrición vegetal. Organización de las naciones unidas para la agricultura y la alimentación. Roma, 1986.
30. Mellegard, H.; From, C.; Christensen, B. E. y Granum, P. E. Inhibition of Bacillus cereus spore outgrowth and multiplication by chitosan. International Journal of Food Microbiology, 2011, vol. 149, no. 3, p. 218-225.
Recibido: 1 de noviembre de 2010
Aceptado: 2 de mayo de 2012
Anayza Echevarría Hernández, Especialista de La Unidad Científico Tecnológica de Base Los Palacios. Email: aechevarria@inca.edu.cu














