INTRODUCCIÓN
El cafeto (Coffea spp.) juega una importante función en la economía a nivel mundial, ya que representa una fuente mayoritaria de ingresos foráneos en aproximadamente 80 países productores 1. Se estima que el 80 % del volumen exportado de cafeto actualmente es producido en países latinoamericanos como Brasil, Colombia y Costa Rica 2. En Cuba, el cafeto es una prioridad en el sector de la agricultura, ya que a partir de él se obtiene una bebida de consumo habitual por la población, y también constituye un rubro exportable 3.
Aunque la vía más común para producir plántulas de cafeto es la utilización de la semilla botánica, la pérdida de su germinación durante el almacenamiento resulta un problema para la propagación y conservación de sus recursos genéticos 4. A partir de esta realidad, el método de conservación más ampliamente utilizado para las colecciones de especies de cafeto, son los bancos de germoplasma en condiciones de campo. Sin embargo, las amenazas a los recursos fitogenéticos del cafeto son numerosas y su pérdida pudiera ocasionar una erosión genética significativa al germoplasma. Una de las grandes dificultades de las colecciones ex situ en campo de cafeto es que frecuentemente se encuentran localizadas en condiciones ecológicas como la altitud, el sombreado, la humedad relativa, que no resultan adecuadas para la supervivencia de todo el material vegetal. La pérdida de plantas como resultado del envejecimiento, métodos de cultivo inapropiados, así como las plagas y enfermedades, pueden causar erosión genética y el peligro del cambio climático incrementa la urgencia de conservar 1.
Por ello, se estudian otros métodos de conservación ex situ de cafeto que permitan superar estas barreras, por ejemplo, mediante la conservación in vitro, que constituye una de las aplicaciones del cultivo in vitro. Esta resulta una valiosa alternativa para la preservación de germoplasma de especies de semilla botánica de corta viabilidad como el cafeto. También reviste importancia para especies de propagación vegetativa o de materiales que necesitan ser propagados vegetativamente para mantener algún genotipo en particular. La conservación in vitrose puede efectuar a través de los métodos de crecimiento mínimo y crioconservación 5.
Los métodos de crecimiento mínimo consisten en reducir la velocidad de crecimiento de las plantas, basados en la disminución de la división celular y el metabolismo, lo cual se logra mediante la alteración de las condiciones óptimas de cultivo. Se puede variar la composición del medio de cultivo, o bien modificar el ambiente de crecimiento (temperatura, intensidad luminosa, disponibilidad de oxígeno) 6, de esta manera, es posible conservar las plantas a corto o mediano plazos, lo que permite una reducción en la frecuencia de los subcultivos e incrementar la longevidad in vitro de los cultivos; así como minimizar el riesgo de cambios genéticos 5,7.
Los nutrientes minerales se encuentran entre los componentes principales de los medios de cultivo de tejidos vegetales 8, de aquí que en el cultivo del cafeto han sido realizadas diferentes investigaciones referentes a la interacción entre su concentración, la adición de reguladores del crecimiento y reguladores osmóticos y/o la temperatura 9-11. Sin embargo, se carece de estudios acerca del efecto independiente de variaciones en la concentración de estos elementos esenciales, en la conservación a mediano plazo de cafeto.
Por todo ello, en el presente trabajo se propone como objetivo determinar el efecto de la disminución del contenido mineral del medio de cultivo en la respuesta de plantas de cafeto (Coffea arabica L.) conservadas in vitro durante un período comprendido entre dos y seis meses.
MATERIALES Y MÉTODOS
El trabajo se desarrolló en el Laboratorio de Biotecnología del Departamento de Genética y Mejoramiento de Plantas del Instituto Nacional de Ciencias Agrícolas (INCA), ubicado en el municipio San José de Las Lajas, provincia Mayabeque.
Para obtener las plantas in vitro de cafeto (C. arabica), previamente se realizó la desinfección de semillas mediante su inmersión en una solución de hipoclorito de sodio (2,4 % de cloro activo) por 90 min. Las semillas fueron lavadas tres veces con agua destilada estéril y sumergidas en una solución de ácido bórico al 0,5 %, con agitación en zaranda orbital a 150 r.p.m. durante 72 h. Los embriones cigóticos fueron extraídos en las condiciones estériles del flujo laminar y sembrados en medio de cultivo Murashige-Skoog (MS) 12) con sacarosa 30 g L-1, cisteína 25 mg L-1y agar 5 g L-1. Al germinar los embriones, cuando las plántulas contaban con el primer par de hojas verdaderas, fueron subcultivadas a medio de cultivo MS con tiamina 5 mg L-1, inositol 100 mg L-1, sacarosa 30 g L-1, 6-bencil-amino-purina (BAP) 0,5 mg L-1, ácido naftal en-acético (ANA) 0,3 mg L-1, ácido giberélico (AG3) 1 mg L-1 y agar 5 g L-1. Una vez que las plantas tuvieron cuatro pares de hojas, se tomaron como donantes de los brotes apicales dedos pares de hojas, utilizados en el estudio de conservación.
El subcultivo para la conservación in vitro, se realizó en diferentes variantes de medio de cultivo MS 12 suplementado con tiamina 5 mgL-1, inositol 100 mg L-1, cisteína 25 mgL-1, sacarosa 30 g L-1 y agar 5 g L-1. Para retardar el crecimiento de las plantas in vitro de cafeto, las variantes del medio de cultivo consistieron en la disminución de la concentración de las sales de MS, de manera tal que T1 (control) estaba constituido por el 100 % de los macro y microelementos de MS; T2 por el 75 %; T3 por el 50 % y T4 por el 25 %. Para cada variante se sembraron 20 brotes apicales y se realizaron 3 repeticiones por tratamiento. Como recipientes para la siembra, se utilizaron tubos de cultivo (25/100 mm) con 20 mL de medio. Los mismos fueron colocados en el cuarto de crecimiento a una temperatura de 23 ± 2 ºC, bajo iluminación artificial con un fotoperiodo de 16 horas luz e intensidad luminosa de 18,75 µmol m-2 s-1 y humedad relativa del 85 %.
A partir de los dos meses de la siembra y con esta frecuencia hasta los seis meses, se realizaron las evaluaciones del porcentaje de supervivencia, el número de pares de hojas, la abscisión foliar (número de hojas escindidas por planta) y el porcentaje de plantas con formación de raíces. A las variables expresadas en porcentaje se les realizó una prueba de comparación de proporciones utilizando el programa Statgraphics Plus 5.1, y al resto de las variables se les realizó un análisis de varianza de clasificación simple, previa comprobación del cumplimiento de sus premisas, y en caso de diferencias entre las medias se realizó una prueba de comparación de medias (Duncan) utilizando el programa SPSS 10.0 para Windows.
RESULTADOS Y DISCUSIÓN
A los dos meses se alcanzó el 100 % de supervivencia de las plantas, en todos los tratamientos. De manera semejante, a los cuatro meses la supervivencia de las plantas de los tratamientos con las mayores concentraciones de MS mantuvo este valor, sin embargo, a partir de esta etapa comenzó un descenso en la supervivencia de las plantas de los tratamientos T3 y T4, los que contaban con las menores concentraciones de los elementos de MS, obteniéndose diferencias significativas entre ambos y entre estos y los tratamientos T1 (control) y T2, como se observa en la Figura 1.
Al analizar la tercera evaluación, a los seis meses, la supervivencia de las plantas del tratamiento T3 disminuyó al 85 %, valor que se considera elevado para las condiciones de cultivo. En esta etapa, la supervivencia de las plantas del tratamiento T4 disminuyó al 53,33 %, encontrándose diferencias significativas con el resto de los tratamientos (Figura 1). Estos resultados coinciden con los informados por otros autores 13) al realizar la conservación in vitro de clavel español (Dianthus caryophyllus L.), que encontraron diferencias significativas en la supervivencia de las plantas cultivadas en medio con reducción al 25 % de las sales de MS con respecto al resto de los tratamientos, a los tres meses de cultivo.
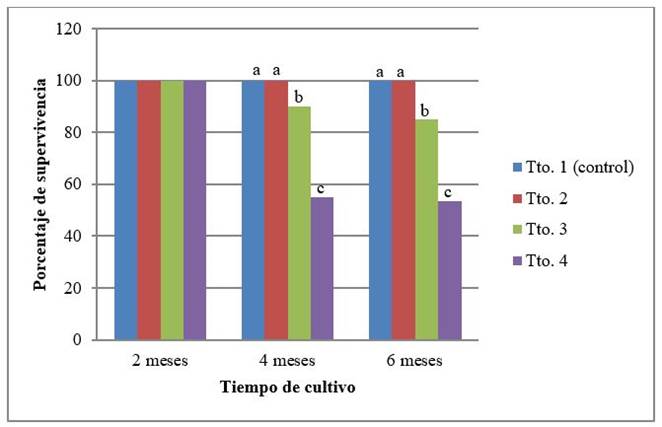 Leyenda: Tto. 1 (control): 100 %; Tto. 2: 75 %; Tto 3: 50 %; Tto. 4: 25 %. Para la misma evaluación, letras comunes no difieren significativamente (Duncan p˂0,05)
Leyenda: Tto. 1 (control): 100 %; Tto. 2: 75 %; Tto 3: 50 %; Tto. 4: 25 %. Para la misma evaluación, letras comunes no difieren significativamente (Duncan p˂0,05)Figura 1 Porcentaje de supervivencia de las plantas de cafeto (C. arabica) subcultivadas en medio de cultivo de conservación, con diferentes concentraciones de los macro y microelementos de MS
A los dos meses, las medias para el número de pares de hojas de las plantas de los tratamientos T1 (control), T2 y T4, no difirieron estadísticamente, sin embargo, las plantas obtenidas en el tratamiento T3 alcanzaron un número de pares de hojas mayoral resto de los tratamientos (Figura 2). A los cuatro meses fue el tratamiento T4 el que difirió del resto, con una media de 2,67 pares de hojas por planta, mientras que en los demás tratamientos la media varió entre 4,60 y 4,87 pares de hojas (tratamientos T3 y T2, respectivamente).
A los seis meses, continuó la tendencia a disminuir el número de pares de hojas de las plantas del tratamiento T4, lo cual se relaciona con un aumento en el número de hojas escindidas. En el resto de los tratamientos, en esta etapa la tendencia fue a un incremento en el número de pares de hojas. No obstante, es de destacar que, aunque el tratamiento T3 (50 % de la concentración de MS) no difirió estadísticamente de los tratamientos con las mayores concentraciones de MS, en este caso el valor de la media fue menor y muy cercano al obtenido en la segunda evaluación, evidenciando una disminución en su ritmo de crecimiento (Figura 2).
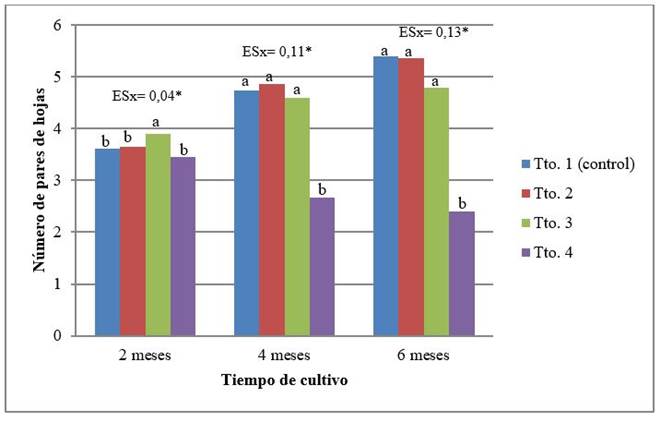 Leyenda: Tto. 1 (control): 100 %; Tto. 2: 75 %; Tto 3: 50 %; Tto. 4: 25 %. Para la misma evaluación, letras comunes no difieren significativamente (Duncan p˂0,05)
Leyenda: Tto. 1 (control): 100 %; Tto. 2: 75 %; Tto 3: 50 %; Tto. 4: 25 %. Para la misma evaluación, letras comunes no difieren significativamente (Duncan p˂0,05)Figura 2 Número de pares de hojas, de las plantas de cafeto (C. arabica) subcultivadas en medio de cultivo de conservación, con diferentes concentraciones de los macro y microelementos de MS
Resultados similares han sido obtenidos al realizar la conservación in vitro de segmentos nodales de cuatro genotipos de boniato (Ipomoea batatas (L.) Lam). En este caso, al evaluar la altura de los brotes sembrados en medio de cultivo con concentraciones de MS al 100 %, 75 % y 50 % y sacarosa 30 g L-1, no se obtuvieron diferencias estadísticas entre estos tratamientos. Teniendo en cuenta los porcentajes de supervivencia, resultó factible la conservación de dos de los genotipos de boniato por un período de seis meses en el tratamiento del 50 % de las sales de MS, mientras el resto fue posible conservarlo en este mismo tratamiento por un período de hasta nueve meses 14. Según algunos autores, en la conservación in vitro bajo condiciones de mínimo crecimiento, no es deseable la elongación excesiva de los explantes porque además de reducir el espacio disponible en el recipiente de cultivo, también causa el agotamiento de los nutrientes del medio y puede provocar la muerte del material vegetal 15.
Con respecto a la abscisión de las hojas, esta variable comenzó a tener incidencia a partir de los cuatro meses, cuando las plantas del tratamiento T4 fueron las más afectadas, perdiendo un promedio de 3,40 hojas, que resultó significativo con las plantas del tratamiento T3, que a su vez perdieron una media de 1,13 hojas (Figura 3). Los menores valores de abscisión foliar fueron obtenidos en las plantas de los tratamientos T1 (control) y T2, en los cuales se utilizaron las mayores concentraciones de los elementos de MS. A los seis meses se incrementó el número de hojas caídas en las plantas de todos los tratamientos, pero se mantuvieron los mismos grupos de significación. De esta forma, se evidencia que la disminución del contenido mineral en los medios de cultivo favorece el retardo en el crecimiento, debido a variaciones que ocurren en el metabolismo celular. El incremento en los valores de abscisión foliar indica que a medida que se disminuyó la concentración de sales minerales en el medio de cultivo, aumentó significativamente el deterioro y necrosis del tejido foliar 13.
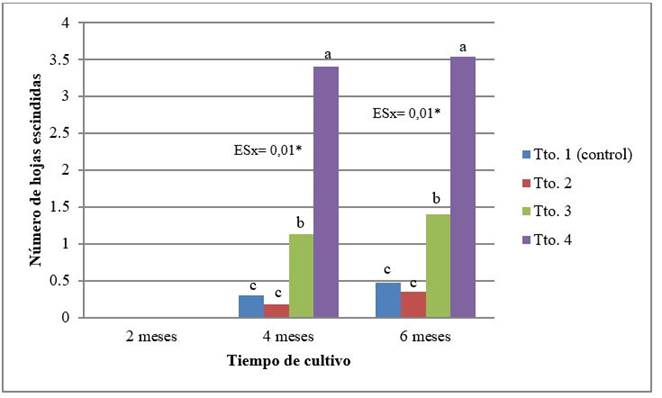 Leyenda: Tto. 1 (control): 100 %; Tto. 2: 75 %; Tto 3: 50 %; Tto. 4: 25 %. Para la misma evaluación, letras comunes no difieren significativamente (Duncan p˂0,05)
Leyenda: Tto. 1 (control): 100 %; Tto. 2: 75 %; Tto 3: 50 %; Tto. 4: 25 %. Para la misma evaluación, letras comunes no difieren significativamente (Duncan p˂0,05)Figura 3 Número de hojas escindidas, de las plantas de cafeto (C. arabica) subcultivadas en medio de cultivo de conservación, con diferentes concentraciones de los macro y microelementos de MS
Desde los cuatro meses, en las plantas de los tratamientos T3 y T4 se observó la formación de raíces (Figura 4), posiblemente como resultado de la escasez de nutrientes que influyó en que las plantas emitieran raíces que facilitaran la obtención de sustancias que se agotaron primeramente en el entorno más cercano al explante. Los porcentajes de formación de raíces fueron del 26 % en el tratamiento T3 y del 21 % en el tratamiento T4 en la segunda evaluación, y del 36 % y 23 % respectivamente, en la tercera evaluación.
En una investigación con el objetivo de preservar germoplasma de C. arabica mediante el cultivo de brotes obtenidos a partir de meristemos apicales de plantas in vitro, se ha realizado la modificación del medio de cultivo mediante la adición de los reguladores del crecimiento 6-benciladenina y zeatina a diferentes concentraciones. Cuando los meristemos del cafeto fueron cultivados en medio Murashige- Skoog (MS) suplementado con 6-benciladenina (BA) o zeatina a las concentraciones de 5 o 10 μM, se obtuvieron múltiples brotes, mientras que a menores niveles de estas hormonas (0,1 o 1 μM), se obtuvieron brotes únicos. La regeneración de las raíces solo fue posible al cultivar los brotes diferenciados en un medio MS al 50 %, libre de sacarosa y suplementado con ácido indol-butírico (AIB) 1μM, lo cual facilitó la preservación de las plantas 9.
Resulta interesante destacar que en el presente estudio, utilizando un único subcultivo en medio al 50 % de los macro y microelementos de MS y en ausencia de reguladores del crecimiento, fue posible lograr tanto el retardo del crecimiento de las plantas de cafeto, como su emisión de raíces, lo cual simplifica la composición y elaboración del medio de cultivo, así como el proceso de conservación.
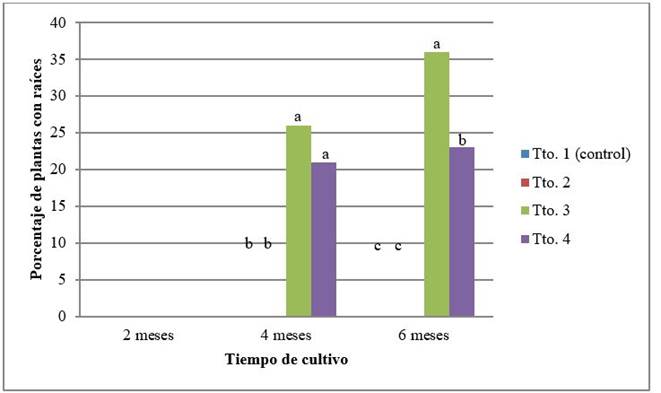 Leyenda: Tto. 1 (control): 100 %; Tto. 2: 75 %; Tto 3: 50 %; Tto. 4: 25 %. Para la misma evaluación, letras comunes no difieren significativamente (Duncan p˂0,05)
Leyenda: Tto. 1 (control): 100 %; Tto. 2: 75 %; Tto 3: 50 %; Tto. 4: 25 %. Para la misma evaluación, letras comunes no difieren significativamente (Duncan p˂0,05)Figura 4 Porcentaje de plantas de cafeto (C. arabica) que formaron raíces al ser subcultivadas en medio de cultivo de conservación, con diferentes concentraciones de los macro y microelementos de MS
A pesar de la respuesta de la emisión de raíces, las plantas del tratamiento T4, que fue el consistente en la menor concentración de los nutrientes de MS, no presentaron elevados porcentajes de supervivencia a los seis meses, ya que al parecer la carencia de macro y microelementos superó los requerimientos nutricionales de las mismas. Además, para dicha etapa, este tratamiento fue en el que se obtuvieron mayores medias de abscisión foliar y menores medias de formación de hojas (Figura 5). Sin embargo, a los dos meses estas plantas conservan valores aceptables para todas las variables evaluadas, por lo que se considera que por este período resulta factible utilizar el tratamiento del 25 % de los macro y microelementos de MS, teniendo en cuenta también que este resulta el tratamiento que permite un mayor ahorro de componentes del medio de cultivo.

Figura 5 Plantas in vitro de cafeto (C. arabica) subcultivadas por seis meses en medio de cultivo de conservación, con la disminución al 25 % de los macro y microelementos de MS (tratamiento T4). Se observa la marchitez foliar, como indicio que generalmente precede a su abscisión
Por otra parte, a los seis meses las plantas del tratamiento T3 lograron sobrevivir en un elevado porcentaje (85 %) y tuvieron menores valores de formación de hojas que los tratamientos T1 (control) y T2 y valores de pérdida de hojas intermedios entre estos dos tratamientos y T4. Adicionalmente, un número significativo de estas plantas formaron raíces, las que posiblemente les brinden mayores posibilidades de supervivencia, debido a una mayor eficiencia ante la absorción de los nutrientes, así como un mejor sostén en el medio de cultivo.
De esta manera, se considera que el tratamiento de la reducción de macro y microelementos de MS al 50 %, resulta el más adecuado para realizar la conservación de las plantas in vitro de cafeto por seis meses (Figura 6). Lo observado con esta concentración de elementos de MS, coincide con la realizada por otros autores 10) al realizar la conservación de germoplasma de cafeto (C. arabica) mediante la encapsulación de yemas apicales. En este caso, se realizó la encapsulación de los explantes en alginato de sodio al 5 % y se les preservó a tres temperaturas en diferentes variantes de medios de cultivo. El que permitió disminuir el crecimiento por un mayor período de tiempo (12 meses), fue el medio de cultivo que contenía las sales de MS al 50 %, con sacarosa 1 % y ácido abscícico (ABA) 10 mgL-1, a una temperatura de 20 ºC.

Figura 6 Plantas in vitro de cafeto (C. arabica) subcultivadas por seis meses en medio de cultivo de conservación con la disminución al 50 % de los macro y microelementos de MS (tratamiento T3)
La reducción de los niveles de macro y microelementos de MS en el medio de cultivo, constituye una de las estrategias más habituales para la conservación in vitro de plantas 14. La conservación de brotes de cafeto mediante este método, resulta una forma simple y accesible a los laboratorios de recursos limitados, que puede facilitar la preservación a corto y mediano plazo de germoplasma e incluso permitir el ahorro de reactivos durante la elaboración de medio de cultivo, así como de tiempo debido a la disminución de la frecuencia de los subcultivos.











 texto en
texto en 


