Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.55 n.3 Ciudad de la Habana sep.-dic. 2003
Instituto Finlay
Caracterización microbiológica de cepas candidatas vacunales de Leptospira interrogans serogrupo Ballum
Dr. Andrés González Rodríguez,1 Lic. Yoandra Rodríguez Jiménez,2 Téc. Niurka Batista Santiesteban,3 Téc. Yolanda Valdés Abreu4 y Lic. Marta González González5
Resumen
Se caracterizaron microbiológicamente 2 cepas candidatas vacunales de Leptospira interrogans serogrupo Ballum, como parte de los trabajos encaminados a la obtención de nuevas formulaciones vacunales antileptospirósicas para uso humano. Se evaluó la cinética de crecimiento de ambas cepas en medio proteico EMJH y en 3 medios libres de proteínas. Se estimó la virulencia en hámsters mediante el cálculo de la dosis letal media. Fueron analizados los perfiles antigénicos celulares y extracelulares mediante SDS-PAGE unidimensional y comparados con aquellos de cepas pertenecientes a los serogrupos Canicola, Icterohaemorrhagiae y Pomona. La homología antigénica entre serogrupos heterólogos se analizó mediante western blotting con suero de hámsters vacunados con vax-SPIRALÒ. Los resultados obtenidos demostraron un crecimiento fastidioso de ambas cepas de Ballum en los medios de cultivo estudiados, una alta virulencia en el modelo animal y una gran homología antigénica, con cepas pertenecientes a otros serogrupos de Leptospira de mayor circulación en Cuba.
DeCS: LEPTOSPIRA INTERROGANS/ aislamiento & purificación; LEPTOSPIROSIS/ inmunología; LEPOSPIROSIS/ prevención & control; MODELOS ANIMALES; VACUNAS BACTERIANAS/ farmacocinética; MESOCRICETUS.
La leptospirosis es una zoonosis bacteriana de amplia distribución mundial, causada por espiroquetas patógenas pertenecientes al género Leptospira. Pequeñas variaciones en las cadenas polisacarídicas del lipopolisacárido (LPS) de este microorganismo determinan la existencia de más de 200 serovariedades (serovares) patógenas, agrupadas en 24 serogrupos.1
Las graves pérdidas económicas y humanas causadas por esta enfermedad justifican el uso de vacunas profilácticas en poblaciones humanas y animales bajo riesgo de infección. Dada la inmunodominancia del LPS las vacunas antileptospirósicas disponibles en la actualidad, constituidas por células enteras inactivadas, confieren una inmunidad serovar específica predominantemente humoral.1,2
La aplicación en Cuba a grupos humanos de riesgo de la vacuna trivalente vax-SPIRALâ, diseñada para establecer protección contra los serogrupos Canicola, Icterohaemorrhagiae y Pomona, ha logrado controlar y disminuir la morbilidad y letalidad de la leptospirosis humana con una elevada efectividad.3,4 Sin embargo, en los últimos años la situación inmunoepidemiológica ha variado y en la actualidad el serogrupo Ballum es el más frecuentemente aislado de pacientes con esta enfermedad en todo el país,5 por lo que son necesarias nuevas formulaciones vacunales como medida profiláctica eficaz.
Previo a la inclusión del serogrupo Ballum en una formulación vacunal para uso en humanos, resulta imprescindible una adecuada selección y caracterización microbiológica de las cepas candidatas vacunales. El presente trabajo se desarrolló con el objetivo de caracterizar el crecimiento, la virulencia y los perfiles antigénicos celulares y extracelulares de 2 cepas candidatas vacunales de Leptospira interrogans serogrupo Ballum.
Métodos
Cepas bacterianas
Se utilizaron en el estudio las cepas candidatas vacunales 12399 y 42600 de Leptospira interrogans serogrupo Ballum (serovar no identificado), las cuales fueron originalmente aisladas por hemocultivo a pacientes con leptospirosis en la provincia de Holguín. Se incluyeron en diferentes ensayos las cepas vacunales 87, 169 y 108, pertenecientes a los serogrupos Canicola (serovar canicola), Icterohaemorrhagiae (serovar copenhageni) y Pomona (serovar mozdok) respectivamente, las cuales fueron originalmente aisladas a partir de muestras animales remitidas al Centro Nacional de Epizootiología y Diagnóstico Veterinario de Ciudad de La Habana. Desde su aislamiento todas las cepas fueron conservadas en medio semisólido de Fletcher.2 La virulencia en todos los casos fue mantenida mediante pases periódicos en hámsters según los métodos descritos.2
Cinética de crecimiento
Se evaluó la cinética de crecimiento de cada cepa candidata vacunal en medio proteico EMJH2 bajo condiciones de cultivo estático (30 ºC) y agitado (130 rpm, 30 ºC) y en las 3 variantes de medio libre de proteínas utilizadas en la planta de producción del Instituto Finlay6 bajo cultivo agitado (130 rpm, 30 ºC). Cada evaluación se realizó por triplicado y se incorporó como control de crecimiento la cepa vacunal perteneciente al serogrupo Canicola. Para el análisis del crecimiento bajo condiciones estáticas se emplearon tubos de cristal con tapón de algodón, que contenían 30 mL de medio fresco inoculado 10 % con un cultivo joven crecido en el mismo medio bajo condiciones estáticas. Para el análisis del crecimiento bajo condiciones de agitación se emplearon erlenmeyers con capacidad de 500 mL y tapón de algodón que contenían 100 mL de medio fresco inoculado; en todos los casos a 10 % con un cultivo joven crecido en medio EMJH bajo condiciones de agitación.
Se determinó la curva de crecimiento obtenida en cada caso tomando muestras de los cultivos cada 24 h durante 7 d. La concentración microbiana de cada muestra fue estimada mediante espectrofotometría (l= 400 nm) y conteo directo de células en cámara de Petroff-Hausser. En cada muestreo se evaluaron características culturales como motilidad y uniformidad celular por observación bajo el microscopio de campo oscuro y se realizaron controles de pureza a los cultivos mediante tinción de Gram y siembra en caldo triptona soya y caldo tioglicolato. Fueron analizados parámetros del crecimiento microbiano como la velocidad específica de crecimiento (m) y el tiempo de duplicación (Td).7
Dosis letal media en hámsters
Se estimó cuantitativamente la virulencia de cada cepa candidata vacunal en el modelo hámster sirio dorado (Mesocricetus aureatus) mediante la determinación de la dosis letal media (DL50) según la metodología propuesta por Fajardo y otros.8 Se utilizaron en el estudio animales de 45-50 g de peso (CENPALAB), mantenidos bajo condiciones adecuadas. El cálculo de la DL50 para cada cepa fue realizado mediante el método de Reed y Muench.9
Perfiles antigénicos celulares y extracelulares
Muestras de 8 ´ 109 células de ambas cepas candidatas vacunales de Ballum y de las cepas vacunales de los serogrupos Canicola, Icterohaemorrhagiae y Pomona, crecidas todas en medio EMJH bajo condiciones de agitación hasta finales de fase exponencial, fueron colectadas por centrifugación a 10 000 rpm durante 20 min, lavadas 3 veces con tampón fosfato salino pH 7,2 (TFS) y solubilizadas con 100 mL de solución de lisis (62,5 mM Tris-HCl pH: 6,8, 10 % glicerol, 5 % 2-mercaptoetanol, 2 % SDS) calentando durante 10 min a 100 ºC. Las muestras así tratadas fueron mantenidas durante toda la noche a 4 ºC y luego separadas mediante SDS-PAGE unidimensional empleando un gel separador 12,5 %.10 Luego de la separación de las proteínas, los geles fueron teñidos convenientemente con azul brillante de Coomassie y analizados mediante analizador de imágenes (ImageMaster VDS, Pharmacia) o transferidos a papel de nitrocelulosa.11 La transferencia se realizó toda la noche utilizando como buffer 48 mM Tris pH 9,2, 39 mM glicina, 1,3 mM SDS y 20 % metanol. Para la detección antigénica la nitrocelulosa fue bloqueada con leche descremada 3 % en Tris-salina y luego incubada a 37 ºC durante 2 h con suero de hámsters inmunizados con vax-SPIRALÒ diluido 1:20 en Tris-salina con 3 % de leche descremada y 0,05 % de Tween 20 (TSLT). Para la visualización de las bandas se incubó 1 h a 37 ºC con conjugado proteína A-peroxidasa (SIGMA) diluido 1:1000 en TSLT y se reveló con 4-cloro-1-naftol y peróxido de hidrógeno.
Sobrenadantes totalmente libres de células de todos los cultivos bacterianos fueron obtenidos por centrifugación al menos 3 veces sucesivas a 15 000 rpm durante 30 min. Muestras de 80 mL de cada sobrenadante fueron tratadas con 20 mL de solución de lisis concentrada 5x, calentadas durante 10 min a 100 ºC y separadas mediante SDS-PAGE unidimensional (12,5 %). Los geles fueron teñidos convenientemente con azul brillante de Coomassie y analizados mediante analizador de imágenes (ImageMaster VDS, Pharmacia). En todas las corridas electroforéticas se incluyó un patrón de peso molecular comercial (LMW Marker Kit, Pharmacia) para el análisis de los geles.
Resultados
Cinética de crecimiento
Partiendo de una misma concentración inicial de 5 ´ 107 células/mL, ambas cepas candidatas vacunales del serogrupo Ballum alcanzaron solo la mitad de los rendimientos logrados por la cepa vacunal de Canicola (1,2 ´ 109 células/mL) en medio EMJH, tras finalizar la fase exponencial de crecimiento bajo condiciones de cultivo estático (fig. 1). Bajo estas condiciones de cultivo las cepas de Ballum mostraron una velocidad específica de crecimiento ligeramente menor (µ12399 = 1,0 ´ 10-2 h-1, µ42600 = 0,9 ´ 10-2 h-1) y un tiempo generacional superior (Td12399 = 69 h, Td42600 = 77 h) a aquellos de la cepa vacunal de Canicola (µ87 = 1,2 ´ 10-2 h-1, Td87 = 58 h).
Resultados similares fueron observados al evaluar la cinética de crecimiento de las 3 cepas en medio EMJH bajo condiciones de cultivo agitado, aunque los rendimientos logrados en todos los casos fueron superiores a los obtenidos bajo cultivo estático. Mientras la cepa vacunal de Canicola logró alcanzar casi 2 ´ 109 células/mL tras 4 d de incubación, ambas cepas de Ballum alcanzaron un rendimiento promedio de 7 ´ 108 células/mL al cabo de este tiempo (fig. 2). Bajo estas condiciones de cultivo las 3 cepas mostraron velocidades de crecimiento específicas (µ12399 = 2,9 ´ 10-2 h-1, µ42600 = 2,9 ´ 10-2 h-1, µ87 = 3,0 ´ 10-2 h-1) y tiempos de duplicación (Td12399= 23,9 h, Td42600= 23,9 h, Td87= 22,8 h) muy similares, aunque la fase de crecimiento exponencial en las cepas de Ballum culminó mucho más rápido.
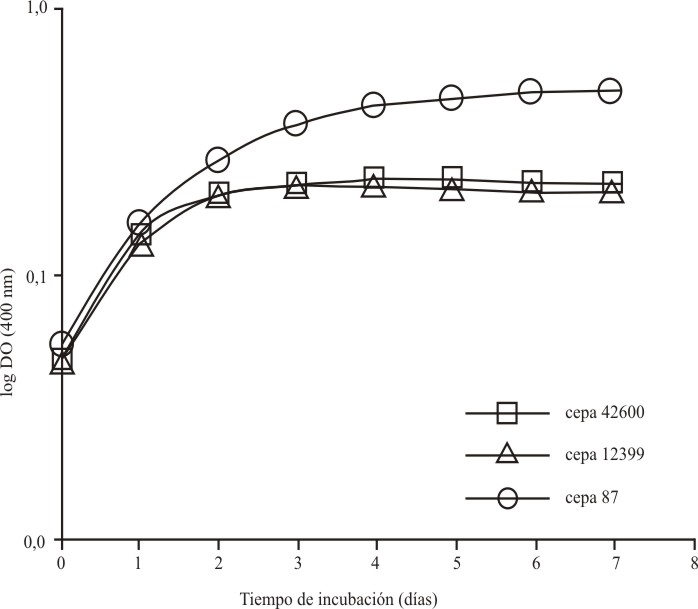
Fig. 2. Curvas de crecimiento seguidas por las cepas candidatas vacunales del serogrupo Ballum (12399 y 42600) y la cepa vacunal del serogrupo Canicola (87) durante el cultivo en medio proteico EMJH bajo condiciones agitadas.
Ninguna de las 3 variantes de medio libre de proteínas analizadas logró sustentar siquiera un discreto crecimiento de alguna de las 2 cepas del serogrupo Ballum. Tras 24 h de incubación los cultivos mostraron un marcado efecto citolítico con una mortalidad generalizada y presencia de abundantes detritos.
Dosis letal media en hámsters
La dosis letal media en hámsters para la cepa 12399 fue de 9 células, mientras que este valor para la cepa 42600 fue de 77 células. Resultados similares fueron obtenidos tras 3 determinaciones sucesivas.
Perfiles antigénicos celulares y extracelulares
El análisis de lisados de células completas permitió identificar la expresión de 19 bandas antigénicas comunes para ambas cepas de Ballum, con pesos moleculares de 12, 13, 15, 16, 19, 25, 29, 32, 36, 39, 45, 48, 54, 64, 71, 82, 89 y 95 kDa. Estas bandas antigénicas fueron igualmente identificadas en las cepas correspondientes a los serogrupos Canicola, Icterohaemorrhagiae y Pomona (fig. 3). La mayoría de estos antígenos celulares altamente conservados fueron reconocidos por el suero de hámsters vacunados con vax-SPIRALÒ (fig. 4).

Fig. 3. Análisis mediante SDS-PAGE unidimensional (gel separador 12,5 % y tinción con azul brillante de Coomassie) de lisado de células completas de las cepas 87 (Canicola), 169 (Icterohaemorrhagiae), 108 (Pomona), 12399 (Ballum) y 42600 (Ballum) crecidas en medio EMJH bajo condiciones controladas (130 rpm, 30 ºC) hasta finales de la fase exponencial.

Fig. 4. Análisis mediante western blotting con suero de hámsters vacunados con vax-SPIRAL® de lisado de células completas de las cepas 87 (Canicola), 169 (Icterohaemorrhagiae), 108 (Pomona), 12399 (Ballum) y 42600 (Ballum).
El análisis de los sobrenadantes libres de células reveló la expresión común de al menos 7 bandas antigénicas definidas con pesos moleculares de 15, 20, 30, 35, 41, 47 y 158 kDa (fig. 5). Una distorsión en el patrón de bandas se observó en todos los casos entre los 60 y 70 kDa, producto de la gran concentración de albúmina sérica bovina del medio presente en los sobrenadantes.
Fig. 5. Análisis mediante SDS-PAGE (gel separador 12,5 % y tinción con azul brillante de Coomassie) de sobrenadantes libres de células de las cepas 87 (Canicola), 169 (Icterohaemorrhagiae), 108 (Pomona), 12399 (Ballum) y 42600 (Ballum) crecidas en medio EMJH bajo condiciones controladas (130 rpm, 30 ºC) hasta finales de la fase exponencial.
Discusión
Uno de los primeros pasos en la confección de una vacuna antileptospirósica es la correcta selección y caracterización de las cepas candidatas vacunales.1,2 Teniendo en cuenta este criterio y dada la necesidad actual de obtención de nuevas formulaciones vacunales eficaces contra la infección por el serogrupo Ballum, fueron caracterizadas microbiológicamente 2 cepas candidatas vacunales pertenecientes a este serogrupo de Leptospira de alta circulación en humanos en Cuba.
Ha sido reconocido que el serogrupo Ballum agrupa cepas de crecimiento fastidioso, con requerimientos nutricionales más exigentes que otras cepas patógenas.2,12 Los bajos rendimientos alcanzados por estas cepas candidatas vacunales en medio proteico EMJH y la ausencia de crecimiento en medios libres de proteínas corroboran esta afirmación. A pesar de ser considerado un medio superior a los tradicionales medios naturales que contienen suero de conejo como constituyente esencial, el medio EMJH resulta en ocasiones insuficiente para el aislamiento y cultivo de serovariedades de crecimiento fastidioso. Estas en muchos casos requieren la adición de factores de crecimiento mayormente proteicos como suero de conejo, suero fetal bovino, hidrolisado de lactoalbúmina o superóxido dismutasa,13 componentes nutricionales poco convenientes para el escalado tecnológico y cultivo de antígenos vacunales para uso humano, dada la conocida reactogenicidad de pequeñas trazas de proteínas séricas en el producto final.
La ausencia de crecimiento en los medios libres de proteínas pudiera esperarse si se tiene en cuenta que estos medios sintéticos contienen niveles aún menores de macronutrientes y factores de crecimiento.6 Sin embargo, los resultados obtenidos indican no solo la carencia de un nutriente esencial para el crecimiento de estas cepas candidatas vacunales de Ballum, sino además la presencia en las 3 variantes de medio evaluadas de al menos un componente con marcado efecto citotóxico, dada la generalizada mortalidad e incluso la apreciación de abundantes detritos celulares tan solo con 24 h de incubación. Para la incorporación del serogrupo Ballum en una nueva formulación vacunal resultará de marcado interés la obtención y optimización de un medio libre de proteínas que sustente un buen crecimiento de estas cepas fastidiosas, sin afectación de otras propiedades importantes como su virulencia, antigenicidad e inmunogenicidad.
Varios estudios demuestran diferencias sustanciales en la expresión de antígenos entre cepas isogénicas virulentas y avirulentas.14 Estas diferencias en la arquitectura antigénica, al parecer, se revierten en una desigual capacidad protectora de unas y otras cepas al ser incluidas en preparados vacunales de células enteras; de ahí la vital importancia de que cepas candidatas vacunales de Leptospira muestren una elevada virulencia en modelos animales. Los hámsters se encuentran entre los animales de laboratorio más susceptibles a la leptospirosis y reproducen con gran fidelidad el proceso clínico patológico de la enfermedad humana, teniendo en cuenta sus características biológicas y el conocimiento acerca de los aspectos sanitarios y genéticos que sobre esta se tienen.15 Ambas cepas candidatas vacunales de Ballum mostraron una elevada virulencia en este modelo animal. Los valores de DL50 obtenidos en ambos casos están en correspondencia con aquellos comúnmente mostrados por cepas de Leptospira altamente virulentas.16
Una gran diversidad de antígenos proteicos ha sido identificada mediante el estudio de los perfiles electroforéticos de células completas de Leptospira.9,16-19 Estos antígenos en su mayoría se ubican entre los 20 y 80 kDa e incluyen proteínas citoplasmáticas, periplasmáticas y de membrana interna y externa. El tratamiento de las muestras con enzimas proteolíticas ha demostrado que el LPS, principal antígeno inmunoprotector de Leptospira, se ubica por debajo de los 20 kDa.17 La conservación antigénica de las proteínas ha sido demostrada mediante immunoblotting; el suero de animales inmunizados con una cepa reconoce comúnmente numerosas proteínas de una gran variedad de serovares.17,19 Muchos de los antígenos proteicos celulares identificados en las cepas de este estudio pudieran corresponderse con algunas de las proteínas descritas y ampliamente caracterizadas en la literatura de la última década, todas altamente conservadas entre cepas patógenas de Leptospira. El reconocimiento de estos antígenos celulares por el suero de hámsters vacunados con la vacuna trivalente vax-SPIRALÒ corrobora no solo la expresión común de estos, sino también su inmunorrelevancia. No fue posible identificar el reconocimiento de antígenos proteicos con pesos moleculares inferiores a 25 kDa dado el gran reconocimiento del LPS en esta zona, por lo que queda enmascarado el reconocimiento de proteínas de bajo peso molecular.
A diferencia del creciente interés en el estudio de componentes estructurales de Leptospira y el gran número de investigaciones realizadas con esta finalidad en la última década, relativamente pocos son los trabajos encaminados al estudio y la caracterización de componentes extracelulares; a pesar de su papel potencial en la patogénesis de la leptospirosis.20 La identificación y neutralización de estas potencialidades pudiera constituir un punto clave en la protección contra la leptospirosis y su evolución clínica, por tal motivo resultó de gran interés la identificación en las cepas de este estudio de antígenos proteicos extracelulares, los cuales pudieran constituir potenciales componentes de una formulación vacunal de nueva generación. Aun cuando no fue objetivo de este trabajo la detección de actividades enzimáticas o citotóxicas en el sobrenadante de los cultivos bacterianos, los resultados obtenidos permiten concluir que de forma similar a lo que ocurre con los antígenos proteicos celulares, existe una gran homología en la expresión de proteínas extracelulares entre los 4 serogrupos de Leptospira de mayor circulación en humanos en Cuba. Estudios futuros deberán ser encaminados a la evaluación de la citotoxicidad de estas proteínas extracelulares altamente conservadas y su posible efecto inmunoprotector.
Como resultado del presente estudio se lograron caracterizar microbiológicamente 2 cepas candidatas vacunales de Leptospira interrogans serogrupo Ballum, las cuales mostraron un crecimiento fastidioso en los medios de cultivo utilizados para el aislamiento, mantenimiento, escalado y producción final de antígenos vacunales, una alta virulencia en el modelo hámster sirio dorado y una gran homología antigénica con las cepas vacunales de los serogrupos Canicola, Icterohaemorrhagiae y Pomona. Estudios adicionales deberán comprobar la capacidad inmunoprotectora de formulaciones vacunales obtenidas a partir de estas cepas.
Agradecimientos
Al doctor Rudy Hartskeerl del Royal Tropical Institute (KIT), Holanda por la clasificación serológica de las cepas candidatas vacunales del serogrupo Ballum.
Summary
Two candidate vaccines of Ballum serogroup Leptospira interrogans were microbiologically characterized as part of the work directed to the obtention of new antileptospirosis vaccine formulations for human use. The growth kynetics of both strains was evaluated in EMJH protein medium and in 3 protein free media. The virulence was estimated in hamsters by the calculation of the mean lethal dose. The cellular and extracellular antigenic profiles were analyzed by unidimensional SDS-PAGE and compared with those from strains of Canicola, Icterohaemorrhaagiaae and Pomona serogroups.The antigenic homology among heterologous groups was analyzed by western blotting with serun from hasterms vaccinated with vax-SPIRALÒ. The results obtained showed a fastidious growth of both strains of Ballum in the studied media, a high virulence in the animal model and a large antigenic homology with strains from other serogroups of Lepstospira prevailing in Cuba.
Subject headings: LEPTOSPIRA INTERROGANS/ isolated & purification; LEPTOSPIROSIS/ immunology; LEPOSPIROSIS/ prevention & control; MODEL, ANIMAL; BACTERIAl VACCINES/ pharmacokinetic; MESOCRICETUS
Referencias bibliográficas
- Levett PN. Leptospirosis. Clin Microbiol Rev 2001;14(2):296-326.
- Faine S, Adler B, Bolin C, Perolat P. Leptospira and leptospirosis, 2nded. Melbourne: MediSci; 1999.
- Bedevia A. Disminuye en grupos de riesgo cifras de morbilidad por Leptospira. Bol Epidemiol Sem IPK 1999;9(32):49.
- Martínez R, Pérez A, Baró M, Álvarez M, Menéndez J, Díaz M, et al. Evaluation of the effectiveness of a new vaccine against human leptospirosis in groupsat risk. Rev Panam Salud Publica 2000; 8 (6): 385-392.
- Rodríguez I, Rodríguez J, Fernández C, Obregón A, Victoria B. Leptospirosis humana en Cuba. Un acercamiento al conocimiento de sus principales reservorios. Bol Epidemiol Sem IPK 2002;12(1).
- Instituto Finlay. Procedimientos Normalizados de Operación (PNO). Preparación del medio libre de proteínas para los serogrupos Pomona, Canicola e Icterohaemorrhagiae (PNO 17-048, 17-049 y 17-050), 2002.
- Brock TD, Madigan MT, Martinko JM, Parker J. Biology of microorganisms, 7thed. New Jersey: Prentice Hall; 1994.
- Fajardo EM, Ortiz B, Chávez A, Gainza N, Izquierdo L, Hernández Y, et al. Estandarización de la dosis letal 50 de las cepas de Leptospira interrogans utilizadas en el control de la vacuna cubana contra la leptospirosis humana. Rev Cubana Med Trop 1998;50(1):22-6.
- Reed LJ, Muench H. A simple method of estimating the fifty percent endpoints. Am J Hyg 1938;27:493-7.
- Brown JA, LeFebvre RB, Pan MJ. Protein and antigen profiles of prevalent serovars of Leptospira interrogans. Infect Immun 1991;59:1772-7.
- Burnette WN. Western blotting: Electrophoretic transfer of protein from Sodium Dodecyl Sulfate Polyacrylamide gel to unmodified nitrocellulose and radiographic detection with antibodies and radioiodinated protein A. Anal Biochem 1980;112:192-200.
- Johnson RC, Walby J, Henry RA, Auran NE. Cultivation of parasitic leptospires: Effect of pyruvate. Appl Microbiol 1973;26(1):118-9.
- Staneck JL, Henneberry RC, Cox CD. Growth requirements of pathogenic leptospires. Infect Immun 1973;7(6):886-97.
- Bernasovskaia EP, Kondratenko VN, Melnitskaia EV. The connection of the antigenic activity of Leptospira to its virulence. Mikrobiol Z 1994;56(6):46-50.
- Infante JF, Sifontes S, Sierra G, Campa C. Los biomodelos aplicados al desarrollo de vacunas y sueros en el Instituto Finlay. Rev Hisp Anim Exp 1998;3(3):30-40.
- Haake DA, Mazel MK, McCoy AM, Milward F, Chao G, Matzunaga J, et al. Leptospiral outer membrane proteins OmpL1 and LipL41 exhibit synergistic immunoprotection. Infect Immun 1999;67:6572-82.
- Guerreiro H, Croda J, Flannery B, Mazel M, Matsunaga J, Galvao Reis M, et al. Leptospiral proteins recognized during the humoral immune response to leptospirosis in humans. Infect Immun 2000;69(8):4958-68.
- Cullen PA, Cordwell SJ, Bulach DM, Haake DA, Adler B. Global analysis of outer membrane proteins from Leptospira interrogans serovar lai. Infect Immun 2002;770: 2311-8.
- Chapman AJ, Everard COR, Faine S, Adler B. Antigens recognized by the human immune response to severe leptospirosis in Barbados. Epidemiol Infect 1991;107:143-55.
- Lee SH, Kim S, Park SC, Kim MJ. Cytotoxic activities of Leptospira interrogans hemolysin SphH as a pore-forming protein on mammalian cells. Infect Immun 2002;70 (1):315-22.
Recibido: 3 de abril de 2003. Aprobado: 2 de julio de 2003.
Dr. Andrés González Rodríguez. Instituto Finlay. Centro de Investigación-Producción de Vacunas. Avenida 27 No. 19805, La Lisa. AP 16017, CP 11600, Ciudad de La Habana, Cuba. Fax: (53-7) 208 6075; Teléfono: (53-7) 202 0986; Correo electrónico: andresglez@finlay.edu.cu
1 Maestro en Microbiología.
2 Licenciada en Bioquímica.
3 Técnico Medio en Química Industrial.
4 Técnico Medio en Veterinaria.
5 Licenciada en Biología.
















