Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.57 n.1 Ciudad de la Habana ene.-abr. 2005
Facultad de Medicina, UNAM – Hospital General de México
Leptospira ¿simulador o causante de leucemia?
Dr. Oscar Velasco-Castrejón,1 MC Beatriz Rivas-Sánchez,2 Dra. Esther Gutiérrez,3 Dra. Laura Chávez,3 Dr. Paulo Duarte,4 Dr. Salvador Chavarria4 y Dr. Héctor Hugo Rivera-Reyes4
Resumen
Se presentaron 2 casos de leptospirosis crónica, en pacientes bicitopénico y pancitopénico respectivamente, con sangrados mucocutáneos y viscerales, diagnosticados de leucemia mieloblástica M3 y leucemia linfoblástica aguda L2, mediante aspirados de médula ósea y tratados como tales por el servicio de Hematología de un Hospital General. Ambos pacientes fallecieron, después de que uno de ellos había mostrado mejoría importante al ser tratado con penicilina sódica cristalina a dosis altas. Los estudios histopatológicos no pudieron demostrar la presencia de células neoplásicas en médula ósea y sí de leptospiras, mediante preparaciones teñidas con plata (Warthin-Starry) e inmunofluorescencia, tanto en este órgano, como en otros tejidos estudiados: riñones, bazo, hígado y pulmones. Los diagnósticos histopatológicos fueron los de leptospirosis generalizada con aplasia medular y leptospirosis generalizada con síndrome mielodisplásico, respectivamente. Se revisó la posibilidad de que Leptospira pueda causar síndromes leucemoides y/o leucemia y basados en los resultados se recomienda a hematólogos, infectólogos, patólogos, y otros, a volver a utilizar las técnicas de impregnación argéntica, inmunohistoquímica e inmunofluorescencia, al estudiar médula ósea y otros tejidos, para detectar la posible presencia de leptospiras y así tratar de forma eficaz al paciente; particularmente en pacientes que como estos tuvieron títulos serológicos considerados como negativos, para evitar la falsa seguridad en las instituciones sanitarias oficiales acerca del mínimo o nulo impacto de la leptospirosis en la salud pública, lo que implica la ausencia de sistemas de control para esta espiroquetosis.
Palabras clave: Leptospirosis crónica, médula ósea, leucemia, aplasia medular, impregnación argéntica, inmunofluorescencia.
La leptospirosis es una zoonosis ampliamente distribuida en el mundo, particularmente en los países tropicales.1-3 Se transmite habitualmente por contacto directo con piel y mucosas por orina y sangre y otros fluidos orgánicos, pero principalmente por la contaminación del agua por la orina de animales infectados.1-5
Clínicamente es una enfermedad polimórfica que se puede confundir con múltiples enfermedades infecciosas o no, como sucedió años antes con la sífilis, a la que se llamó por eso, la gran simuladora.6
Por otro lado, las leucemias agudas son un grupo heterogéneo de padecimientos que suponen proliferación desordenada de una clona de células hematopoyéticas por fallas en los mecanismos de control del desarrollo del clon mutante, debido casi siempre a cambios en los genes reguladores, lo que conduce a una sobrepoblación desordenada de células incapaces de madurar y funcionar normalmente.7,8
Entre las etiologías de las leucemias agudas, se consideran: tóxica, radiaciones ionizantes, medicamentos alquilantes e inclusive una teoría infecciosa (viral), y recuérdese que las leptospiras, por su delgadez, son capaces de atravesar membranas de millipore hasta de 20 milimicras (0,22 mm)9, y por lo tanto, capaces de penetrar al citoplasma e incluso al núcleo de la célula (Velasco, datos por publicar), donde podrían actuar como tales, causando la mutación del ADN genómico.
Aunque tradicionalmente se considera que la leptospirosis en humanos solo posee fase aguda, en animales se reconoce la fase crónica y Ellis, ha demostrado que esta última "es mucho más importante que la aguda en animales de granja",10,11 tal como los autores de este trabajo la han descrito para humanos. Además a diferencia de la aguda, en la fase crónica, los títulos de anticuerpos suelen ser bajos, casi siempre por debajo de 1:100.11,12
Frecuentemente la leptospira produce enfermedad hemorrágica de pulmones y otras vísceras,13-16 así como por múltiples mecanismos, anemias, púrpuras, y hemorragias mucocutáneas17-25 e inclusive parece evolucionar con cuadros mieloproliferativos26 y la sospecha de causar enfermedad autoinmune,27,28 además de poder afectar cualquier órgano.29-34 A pesar de lo antes mencionado, prácticamente nunca se le busca en médula ósea, donde por diversos mecanismos, podría en teoría causar graves problemas hemorrágicos e inclusive neoplasias a sus huéspedes.
Las únicas veces que se ha estudiado la médula ósea en pacientes con leptospirosis fue para conocer su posible repercusión en la producción de anemia, excepto en un caso en que se observó la presencia de leptospiras en la médula ósea en un paciente con síndrome de Weil.35
Métodos
Casos clínicos
- Exámenes de laboratorio de rutina, practicados en los laboratorios del Hospital General de México, SSa.
- Punción de médula ósea, para búsqueda de problemas hematológicos, practicada por médicos del servicio de hematología con tinción de la biopsia por colorantes de Romanovsky.
- Búsqueda de leptospira y sus productos (antigenemia) mediante microscopia de campo oscuro, amplificador de imágenes y videograbación en el laboratorio de medicina tropical.
- Autopsias realizadas por el servicio de anatomía patológica.
- Obtención de tejidos de diversos órganos, fijados con formaldehído, incluidos en parafina y de cortes para su tinción:
- Tinciones de rutina para el estudio histopatológico (hematoxilina-eosina, PAS, Perls).
- Tinción de los tejidos y para búsqueda de hongos (Grocot).
- Tinción de los tejidos y aspirado de médula ósea para la búsqueda de leptospiras por tinción argéntica, mediante la técnica de Warthin-Starry.
- Tinción de los aspirados de médula ósea y los tejidos, para la búsqueda de antígenos de leptospiras por inmunofluorescencia indirecta (IFI), utilizando suero de conejo hiperinmune contra Leptospira sp y anticuerpo anti-Ig totales de conejo marcado con isotiociantato de fluoresceína.
Los exámenes de laboratorio a su ingreso mostraron biometría hemática: hemoglobina 5 g/dL, hematócrito 14%, leucocitos 6 100/dL, plaquetas 7 000/dL.
Al ser hospitalizado en Urgencias, un día y luego a su paso a Terapia Intensiva, se le realizó de nuevo, diagnóstico de leptospirosis crónica, mediante positividad al MAT, observación directa en microscopia de campo oscuro de sangre y orina, videograbación y tinción de plata de las bacterias en sangre y orina (fig. 1); se le administró penicilina sódica cristalina 4 000 000 U cada 6 h, con lo que el paciente inició mejoría importante.
Fig. 1. Leptospira en orina (tinción de Warthin-Starry).
En interconsulta de Hematología al departamento de Terapia Intensiva, por aspirado de médula ósea, diagnosticaron leucemia mieloblástica aguda M3, e iniciaron control con ácido transretinoico (ATRA) y hemoderivados.El paciente con aparente mejoría clínica fue trasladado 3 d después al servicio de hematología para continuar tratamiento específico. Le retiraron penicilina, con lo que la mejoría se detuvo, continuaron con el ATRA y al continuar agravando, 7 d después le administraron idarubicina, muriendo 12 h más tarde.
Caso clínico 2. FCA, masculino, 66 años de edad, taxista, habitante de zona rural. Inició padecimiento actual 30 d antes de su hospitalización, con fatiga intensa, palidez generalizada, disnea de grandes esfuerzos, rápidamente progresiva a pequeños esfuerzos y gingivorragia intensa, además de fiebre elevada vespertina. Se le realizaron exámenes de laboratorio, previos a su hospitalización, que mostraron pancitopenia: hemoglobina 4,3 g/dL, hematócrito 12,8 %, plaquetas 2,000/dL, leucocitos 2 800/dL, linfocitos 84 %, por lo que fue hospitalizado. El paciente ingresó al hospital con diagnósticos de síndromes anémico y febril en estudio.
Los exámenes de laboratorio a su ingreso notificaron la pancitopenia: leucocitos 3 200/dL, neutrófilos 23 %, linfocitos 54 %, monocitos 22,6 %, hemoglobina (Hb) 4,3 g/dL, hematócrito (Hto)12,9 %, plaquetas 15 000/dL, con un tiempo de tromboplastina (TP) 20,1; índice estandarizado de pruebas para medir coagulación sanguínea (INR) 1,66, tiempo de tromboplastina parcial (TPT) 30,3, glucosa 144 mg/dL, urea 48mg/dL, creatinina (Cr) 1,26 mg/dL. Resto normal.
Un día después, el paciente hospitalizado en terapia intensiva, fue valorado por hematología, donde por biopsia de médula ósea, diagnosticaron leucemia linfoblástica aguda L2, iniciando aplicación de hemoderivados. El paciente continuó febril, por lo que se inició antibioticoterapia con ceftazidina y amikacina. Fue trasladado 4 d después a medicina interna para continuar tratamiento; 5 d más tarde continuó febril y evolucionó con oliguria e inició insuficiencia respiratoria aguda, por lo que fue reingresado a la Unidad de Terapia Intensiva, donde se le observaron lesiones equimóticas diseminadas a todo el tegumento. En este sitio se le aplicó oxígeno suplementario por nebulizador y mascarilla facial, hemoderivados y antibióticos. Se realizaron nuevos exámenes de laboratorio presentando leucocitos: 2 900/dL, neutrófilos 500/dL, linfocitos 150/dL, plaquetas 12 000/dL, Hb 9,5 g/dL, Hto 29,2 %, TP 19,8"-50 %, TPT 56", tiempo trombina (TT) 16", nitrógeno ureico en sangre (BUN) 17,9, Cr 0,72, glucosa 140,7. Se envió muestra de sangre y orina a Medicina Tropical, donde se reportó detección de leptospiras en sangre y orina mediante microscopia de campo oscuro, con videograbación y tinción de plata, así como positividad a la serología (MAT) para leptospira, detectando los serovares L. icterohaemorrhagiae a título de 1:80 y L. canicola 1:40. Se le inició tratamiento con penicilina sódica cristalina 6 000 000 U cada 4h.
El paciente falleció 1 d más tarde, después de presentar insuficiencia respiratoria aguda, sangrado de tubo digestivo alto a través de sonda orogástrica, bloqueo AV de tercer grado y posteriormente asistolia.
Resultados
Las observaciones macroscópicas de los pacientes fallecidos realizadas en el servicio de anatomía patológica, reportaron a individuos adultos mayores, del sexo masculino, con lesiones hemorrágicas en piel, mucosas y diversos órganos: encéfalo, pulmón, bazo e hígado, órganos que así mismo estuvieron congestionados y presentaron incremento de peso y tamaño, particularmente pulmones, bazo e hígado.
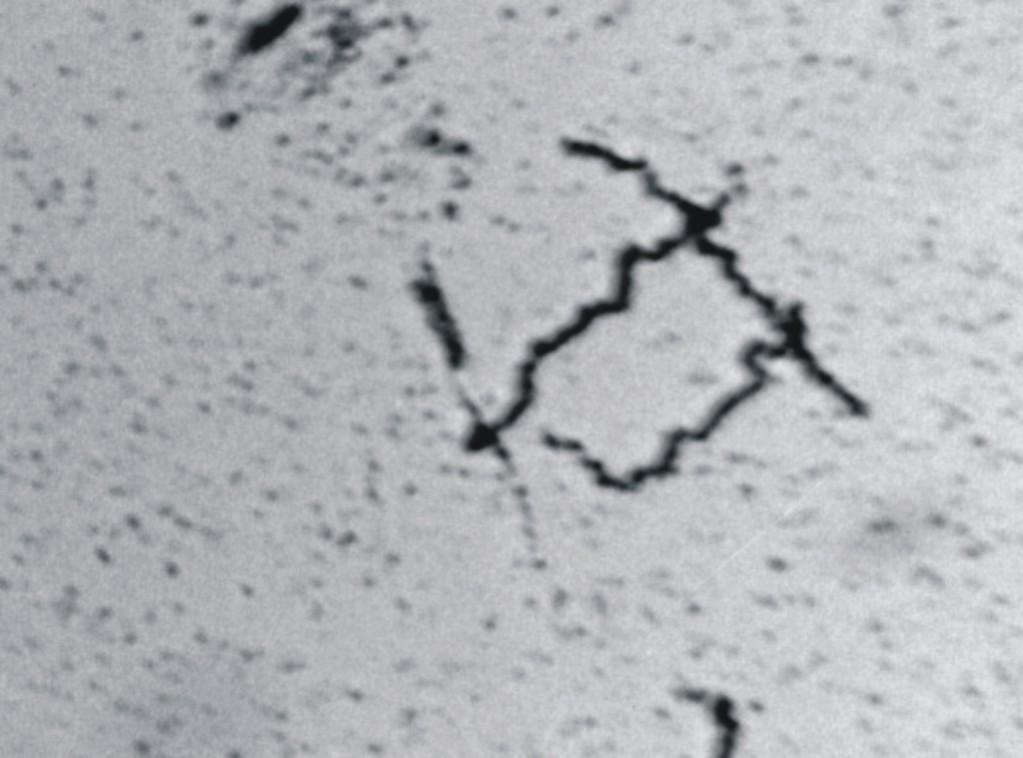
Respecto al estudio microscópico en el caso de JRH, el examen de médula ósea mostró celularidad muy disminuida (aplasia), y las células hematopoyéticas se encontraron sustituidas casi completamente por eritrocitos y macrófagos con hemosiderina. Por el contrario, la médula ósea de FCA mostró hipercelularidad y una gran desorganización displásica de las 3 líneas celulares. No se observaron células neoplásicas en ninguno de los casos. A la tinción de Warthin-Starry se observaron espiroquetas compatibles con Leptospira, observación que fue ratificada por la búsqueda de antígeno de leptospira mediante inmunofluorescencia (figs. 2 y 3).
Fig. 2. Leptospiras en médula ósea (tinción Warthin-Starry).
Fig. 3. Detección de Leptospira en médula ósea por inmunofluorescencia (JRH).
En los órganos de ambos cadáveres, se observaron también espiroquetas, particularmente en los órganos de filtración: ganglios linfáticos, riñón, bazo, hígado y pulmones (figs. 4 y 5). En una porción de los pulmones de JRH, se observó además una zigomicosis tardía con desarrollo de hifas anchas no tabicadas dentro de los vasos y focos de necrosis perivascular.
Fig. 4. Leptospiras en riñón (tinción Warthin-Starry).
Fig. 5. Leptospiras en pulmón (tinción Warthin-Starry).
Discusión
Desde hace 5 años, se observó por primera vez la presencia de espiroquetas compatibles con leptospira, en la médula ósea de un paciente con anemia aplástica grave. Esa vez no se valoró adecuadamente la importancia de este hallazgo y al no encontrar ningún reporte semejante en la literatura mundial sobre este tema, los autores de este trabajo lo consideraron un hallazgo fortuito; 4 años más tarde, volvieron a observar esas formas en la médula ósea de un paciente con leptospirosis crónica y repetidas hospitalizaciones por sospecha de leucemia aguda, que remitieron con antibioticoterapia intravenosa con dosis elevada de penicilina y ceftriaxona.
Esta vez, al ser hospitalizado con síndrome hematológico compatible con leucemia, JRH, un paciente de leptospirosis antigua, conocido y tratado 5 años antes, quien había estado prácticamente asintomático por cerca de 4 años, por lo que dejó de asistir a valoración, recayó y fue hospitalizado. El paciente mejoró de forma importante al aplicársele penicilina intravenosa en dosis elevadas, pero se la retiraron al ser diagnosticado como leucemia mieloblástica M3, mediante biopsia de médula ósea, por el servicio de hematología del hospital y le aplicaron medicación específica para esa enfermedad (ATRA e idarubicina), agravando y muriendo días después.
Poco tiempo más tarde, al fallecer otro paciente (FCA) por leucemia linfoblástica L2, diagnosticado como leptospirosis crónica días antes, mediante los métodos antes descritos, se decidió que era importante estudiar, asociados al servicio de anatomía patológica, la médula ósea y otros órganos de estos pacientes fallecidos, pensando que posiblemente ambos habían sido mal diagnosticados por hematología o que la Leptospira, capaz de producir cuadros tan proteiformes (vasculitis, anemias, púrpuras, plaquetopenia, etc.), involucrando frecuentemente vasos y células sanguíneas, pudiese por diversos mecanismos (ya sea mediante sus factores de virulencia: invasividad, hemolisinas, esfingomielinasas, lipopolisacáridos, glicoproteínas, peptidoglicana, proteínas de shock térmico, flagelina, etc.), destruir células hematopoyéticas; así como producir oncogenes o actuar a la manera de un virus, capaz de infiltrar la médula ósea, penetrar a la célula e integrarse al genoma de la célula huésped y producir mutaciones repetidas, que podrían conducir a la neoplasia y/o desorganizar con sus movimientos el genoma de la célula huésped, con los mismos resultados (recuérdese que Leptospira es capaz de atravesar membranas millipore de 0,22 mm, comportándose como un virus filtrable, como se conoció antiguamente a los microorganismos capaces de atravesar los filtros de porcelana).6
Como se observó en el capítulo de resultados, en histopatología se encontraron diversos órganos de estos individuos con aspecto y lesiones compatibles con leptospirosis,36,37 no se encontraron células neoplásicas en médula ósea y sí abundantes espiroquetas compatibles con leptospira por las tinciones de plata e IFI, lo que sugiere que leptospira, además de invadir médula ósea y destruir células hematopoyéticas que conducen a la anemia, leucopenia y plaquetopenia, con frecuencia es capaz de producir síndromes leucemoides que pueden simular leucemias y agravar e incluso matar al paciente, al ser sustituido el tratamiento antibiótico por los medicamentos contra estas neoplasias, al deprimir aún más el sistema inmune ya deprimido por la infección por Leptospira y dejar de atacar a la bacteria. Sin embargo, es posible que por los mecanismos antes enumerados, pueda también inducir neoplasia.
Lo anterior indica la importancia de que los hematólogos mejoren sus técnicas diagnósticas utilizando también biopsia de hueso y si no observan los cuerpos o bastones de Aüer en médula o sangre periférica (señal inequívoca de leucemia aguda mieloblástica7), utilicen proteínas de fusión o PCR (siglas en inglés de reacción en cadena de la polimerasa), para hacer diagnóstico confirmatorio de leucemia y desde luego, utilizar las técnicas de tinción argéntica, inmunohistoquímica (IHQ) o IFI, o ambas, cuando estudien médula ósea; para así poder detectar la presencia de leptospiras o sus antígenos, que por lo que se ha observado, frecuentemente parasitan este tejido, causando cuadros de anemia, trombocitopenia y a veces leucopenia o leucocitosis, con el consiguiente peligro de muerte del paciente en caso de equivocar el diagnóstico.
Estas recomendaciones también son válidas para los histopatólogos, infectólogos, laboratoristas clínicos y otros especialistas, que abandonaron hace mucho las técnicas de tinción argéntica y prácticamente no usan la IHQ, IFI u otras y confían mucho en la serología, que en este tipo de casos al obtenerse solo títulos bajos es considerada negativa, pensando que las espiroquetas, después del abatimiento de la sífilis, ya no revisten ninguna importancia, con lo que incrementan el subdiagnóstico de leptospirosis y otras espiroquetosis, creando una falsa impresión de seguridad en la población y en los dirigentes de los sistemas de salud, quienes a su vez asumen que la problemática por estas no existe o es mínima, por lo que no la buscan y permiten que la leptospirosis, como se ha observado frecuentemente, produzca brotes epidémicos con elevada morbilidad y letalidad, durante las inundaciones y otros desastres naturales13,38,39 e impacten de forma importante la salud pública, pero que al no ser reconocida su etiología, impidan la creación de sistemas para su control.
Leptospira, does it simulate or cause leukemia?
Summary
Two cases of chronic leptospirosis in bicitopenic and pancitopenic patients. respectively, with mucocutaneous and visceral bleedings were presented. They were diagnosed myeloblastic leukemia M3 and acute lymphoblastic leukemia L2 by bone marrow aspiration and they were treated as such at the hematology department of a general hospital. Both patients died after one of them had considerably improved on being treated with sodium crystalline penicillin at high doses. The histopathological studies could not demonstrate the presence of neoplastic cells in bone marrow but leptospiras were found by means of silver stained preparations (Warthin – Starry) and immunofluorescence, both in this organ and in other tissues studied: kidney., spleen, liver and lungs. The histopathological diagnoses were generalized leptospirosis with medullary aplasia and generalized leptospirosis with myelodisplastic syndrome, respectively. It was reviewed the possibility that leptospira could cause leukemoid syndromes and/or leukemia. Based on these results, it is recommended to hematologists, infectologists, pathologists, and others, to use again the technques of argentic impregnation, immunohystochemistry and immunofluorescence to study the bone marrow and other tissues in order to detect the possible presence of leptospira that would allow to treat the patients more effectively, particularly, patients like these that had serological titres considered negatives so as to avoid the false security existing in the official health institutions about the minimum or null impact that leptospirosis cause in public health, which imply the absence of control systems for this spirochetosis.
Key words: Chronic leptospirosis, bone marrow, leukemia, bone marrow aplasia, argentic impregnation, immunofluorescence.
Referencias bibliográficas
1. Faine S. Adler B, Bolin C, Perolat P. Leptospira and leptospirosis. 2nd ed.
2. Farr RW. Leptospirosis. Clin Infect Dis 1996;21:1-8.
3. Levett PN. Leptospirosis. Clin Microbiol Rev 2001;14(2):296-326.
4. Vinetz JM. Leptospirosis. Curr Open Inf Dis 2001;14:527-38.
5. Barthi AR, Jarlath EN, Ricaldi JN, Matthias MA, Diaz MM, Lovett MA, et al. Leptospirosis. A zoonotic disease a global importance. Lancet Infect Dis 2003;3(12):757-71.
6. Quentin NM, Russel SW. Treponema, Borrelia and Leptospira. En: Fundamentals of medical Bacteriology and Mycology. 2nd ed. 1988. Philadelphia:Lea and Febiger; 1988.p. 424-41.
7. Ruiz Argüelles GJ, Mc Artur JR. Leucemias agudas. En: Ruiz Argüelles GJ. Fundamentos de Hematología. 3a. ed. México:Editorial Médica Panamericana; 2001. p. 225-45.
8. Jones E, Morris A. Lo esencial en célula y genética. Madrid:Ed. Harcourt; 1999.
9. Faine S. Leptospira and Leptospirosis. Boca Ratón:CRC Press; 1994. p.353.
10. Ellis WA, Allen DL. Disease of swine. 7th ed.
11. Ellis WA. Boars as carriers of leptospires of the Australis serogroup on farms with an abortion problem. Vet Rec 1986;118:563.
12. Velasco-Castrejón O, Rivas-Sánchez B, Rivera-Reyes HH. Tratamiento inmunoterapéutico en 50 pacientes con leptospirosis crónica refractaria a antibióticos. Rev Cubana Med Trop 2002;54:74.
13. Trevejo RT, Rigau PJG, Ashford DA, McClure EM, Jarquin GC, Amador JJ, et al. Epidemic leptospirosis associated with pulmonary hemorrage-Nicaragua 1995. J Infect Dis 1998;178:1457-63.
14. Serjo A, Coto H, San Juan J, Videla J, Deodato B, Cernigoi B, et al. Respiratory distress due to pulmonary hemorrhage in leptospirosis. Medicina (B Aires) 2002;62:135-40.
15. O´nail KM, Rickman LS, Lazarus AA. Pulmonary manifestation of leptospirosis. Infec Dis 1991; 13:705-709.
16. Lecour H, Miranda M, Magro C, Rocha A, Goncalves V. Human leptospirosis a review of 50 cases. Infection 1989;17:8-12.
17. Avdeeva MG, Moisova DL, Zentsoya OA, Kostomarov AM. Hematological parameters in characterization of anemia in leptospirosis. Klin Lab Diagn 2001;5:8-12.
18. Shohet SB, Ness PM. Hemolytic anemias. Failure of the red cell membrane. Med Clin North Am 1976;60:913-32.
19. Trowbridge AA, Green JB, Bonnett JD, Shohet SB, Ponnappa BD, McComb WB. Hemolytic anemia associated with leptospirosis. Morphologic and lipid studies. Am J Clin Pathol 1981;76:493-8.
20. Thomspon JC, Manktelow BW. Pathogenesis and red blood destruction in haemoglobinaemic leptospirosis. J Comp Pathol 1986;96:529-40.
21. Avdeeva MG, Moisova DL, Kachanov AV. Bone marrow hematopoiesis in leptospirosis and its role at pathogenesis of anemia. Clin Lab Diag 2003 (1):38-40.
22. Haake DA. Spirochaetal lipoproteins and pathogenesis. Microbiol 2000;146:1491-504.
23. Avdeeva MG, Moisova DL, Gorodin VN, Kostomarov AM, Zotov SV, Cherniavskaia OV. The role of glucosa 6-phosphate dehydrogenase in pathogenesis of anemia in leptospirosis. Klin Med (Mosk) 2002;80:42-4.
24. Seoung HL, Sangduk K, Seung CP, Min JK. Cytotoxic activities of Leptospira interrogans hemolysin SphH as a pore-forming protein on mammalian cells. Inf Immun 2002; 70(1):315.
25. Pumarola ST, Jiménez de ALT. Medicine 2002; 8(69):3688-92.
26. Mateo Balmelli T, Santos-Preciado JI, Pérez-Miravete A, Peña-Alonso R. Leptospirosis ictérica (sindrome de Weil) en un niño con linfoma. Bol Med Hosp Infant Mex 1996;53:411-4.
27. Corona TV. Esclerosis Múltiple. México:Edit. Publ. Cient. Inst Nal Nutrición (INN); 2000. p. 193. 28. Cook
30. De Brito T, Morais DF, Yasuda PH, Lancellotti CP, Hoshino SS, Yamashiro E, et al. Cardiovascular involvement in human and experimental. Ann Trop Med Parasitol 1987; 81:207-14.
31. Seguro AC, Lomar AV, Rocha AS. Acute renal failure of leptospirosis: nonoliguric and hypokalemic forms. Nephron 1990;55:146-51.
32. Edwards CN. Leptospirosis and pancreatitis. [Letters]. Pediatr Infect Dis 1999;18:399-400.
33. Levin N, Nguyen-Khog JL, Charpenter D, Strobel M, Fourne-Amazouz, E, Denis P. Panuveitis with papilitis in leptospirosis. Am J Ophtalmol 1994;118:9.
34. Tenorio G, Rivas-Sánchez B, Velasco-Castrejón O. Utilidad de la determinación serológica de anticuerpos en el diagnóstico diferencial de la toxoplasmosis ocular con la leptospirosis ocular. Rev Med Hosp Gral Mex 2002;65(3):135-43.
35. Wenz M, Gorissen B, Wieshammer S. Weil´s syndrome with bone marrow involvement after collectin walnuts. Dtsch Med Wochenschr 2001;126:1132-5.
36. Arean V. The Pathologic Anatomy and Pathogenesis of fatal human leptospirosis (Weil´s disease). Am J Pathol 1962;40:393-414.
37. Dooley JR, Ishak KG. Leptospirosis. En: Binford CH, Connor DH, eds. Diseases caused by spirochetes. Pathology of Tropical and Extraordinary Diseases. 1976.
38. Vanasco NB, Fusco S, Zanuttini JC, Manattini S, Dalla FML, Pérez J, et al. Outbreak of human leptospirosis after a flood in Reconquista,
39. Ko AI, Galvao RM, Ribeiro DCM,
Recibido: 27 de diciembre de 2004. Aprobado: 10 de marzo de 2005.
Dr. Oscar Velasco Castrejón. Laboratorio de Medicina Tropical. 2do Piso. Medicina Experimental, Fac. Medicina, UNAM – Hospital General de México. Teléfono: (55) 5623-2678 y (55) 5623.2677. FAX: (55) 8596-4600. Correo electrónico: oscarvel1@yahoo.com; oscarvel@terra.com.mx
1 Doctor en Medicina Tropical. Laboratorio de Medicina Tropical. Unidad Medicina Experimental, Facultad de Medicina, UNAM – Hospital General de México.
2 Máster en Ciencias en Inmunoparasitología. Laboratorio de Medicina Tropical. Unidad de Medicina Experimental, Facultad de Medicina, UNAM – Hospital General de México.
3 Doctora en Patología. Estudios Postmortem. Servicio Anatomía Patológica, Hospital General de México.
4 Doctor en Terapia Médica Intensiva. Servicio Terapia Médica Intensiva, Hospital General de México.