Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.59 n.2 Ciudad de la Habana Mayo-ago. 2007
Hospital General Universitario Gustavo Aldereguía Lima. Cienfuegos, Cuba
Impacto de la terapia antirretroviral de alta eficacia en la respuesta clínica e inmunovirológica en enfermos SIDA
Dr. Andrés Reyes Corcho,1 Dr. Miguel A. Mosquera Fernández,2 Dr. Yanelka Bouza Jiménez,3 Dr. Jorge Pérez Avila,4 Dra. Vivian Hernández,5 Dr. Blas Jam Morales,6 Dr. Gustavo Álvarez Amador7 y Dra. Yadira Bouza Jiménez8
Resumen
Se realizó un estudio propectivo y longitudinal con el propósito de evaluar la respuesta clínica, inmunológica y virológica de una cohorte de 34 enfermos de SIDA en la provincia de Cienfuegos tratados con terapia antirretroviral de alta eficacia (TARVAE). Del sexo masculino eran 67,6 % y la media de edad 32 años. La vía de infección sexual se identificó en 91,2 %. Del total de individuos, 79,4 % definieron el SIDA por recuento de LTCD4+ < 200 células. Padecieron de infecciones oportunistas menores 26 enfermos (76,5 %) y 32,4 % enfermó por alguna oportunista mayor antes de la TARVAE. Posterior a esta, las frecuencias se redujeron a 20,6 y 11,8 %, respectivamente. El recuento medio de LTCD4+ al inicio de la TARVAE fue 196 células/mm3, y superó las 400 células en el resto de las mediciones. De una media de CVP de 15 251 copias/mL al año de la terapia, disminuyó a 8 048 copias a los 2 años. Solo 10 casos requirieron hospitalización después de la TARVAE (29,4 %). La adherencia a la terapia superó 80 % y se correlacionó con la restauración inmunológica. La supervivencia al año fue de 100 % y durante los 4 años fallecieron 2 enfermos. Se demostró el impacto positivo de la TARVAE en la frecuencia de infecciones oportunistas, la restauración inmunológica y la supervivencia.
Palabras clave: Infección por el VIH-I, síndrome de inmunodeficiencia adquirida, terapia antirretroviral de alta eficacia, morbilidad, supervivencia.
La infección por el VIH/SIDA afecta alrededor de 40 000 000 de personas, es responsable de alrededor de 3 000 000 de muertes anuales y ha terminado con la vida de más de 20 000 000 de personas en todo el mundo.1,2
Actualmente, más de 90 % de las infecciones por el VIH tienen lugar en países subdesarrollados, y son precisamente estos los de peor situación socioeconómica y de elevada prevalencia de enfermedades como la tuberculosis, la malaria, la esquistosomiosis etc.; muchas de ellas reconocidos cofactores que aceleran de la infección por el VIH y la progresión al síndrome de inmunodeficiencia adquirida (SIDA).3,4 Al término de 2005 las epidemias se agravaron en Asia central, China, Pakistáan y, particularmente, en Sudáfrica no da indicios de disminuir.1
Antes de la existencia de terapia para la infección por el VIH más de 80 % de los enfermos de SIDA en la mayoría de las naciones fallecían severamente inmunodeprimidos, padeciendo múltiples infecciones oportunistas y neoplasias en extremo agresivas.5
El desarrollo de la terapia para la infección por el VIH es sin dudas uno de los sucesos más importantes de la medicina moderna.6 Desde los inicios, con la introducción de la zidovudina, prototipo de un grupo terapéutico general conocido como análogos de los nucleósidos, hasta la generalización de los inhibidores de las proteasas virales a partir de 1995, piedra angular de la terapia antirretroviral de alta eficacia (TARVAE), la actitud de pacientes y médicos pasó de ser una ciega incomprensión a un evidente optimismo.
A pesar de lo controvertido que aún resulta este tema, existen sólidas evidencias de que la TARVAE ha revolucionado los horizontes de estos enfermos. Sistemáticamente se conoce de mejoras notables en el pronóstico y la calidad de la vida de ellos, también de importantes reducciones en la morbilidad y mortalidad relacionada con el SIDA sobre todo en Norteamérica y Europa.7-9 Estudios basados en necropsias destacan que las muertes secundarias a infecciones oportunistas, neoplasias y estadios finales del SIDA han decrecido, y los enfermos muestran cierta preservación de la función inmune.10,11
Contrastando con estos beneficios, 3 situaciones clínicas constituyen puntos álgidos de la terapia para el SIDA a escala mundial: las complicaciones metabólicas asociadas a la TARVAE; las interacciones farmacológicas entre los medicamentos antirretrovirales y los tratamientos para las infecciones oportunistas y la inmumodulación, secundarias a los complejos mecanismos farmacocinéticos y farmacodinámicos que comparten estos; y por último, la emergente resistencia a los antirretrovirales que de manera importante obedece a supresiones incompletas de la replicación del VIH-1, que conduce a la aparición de variantes resistentes del virus. Se estima que 5,8 % del total de nuevos pacientes infectados por el VIH en los EE. UU. y Canadá tienen cepas resistentes a 2 clases de drogas antirretrovirales, comparado con 0,4 % de 6 años atrás; en Europa algunos investigadores han reportado hasta 21 %.12.
Cuba tiene una de las epidemias más pequeñas de la región con una prevalencia de 0,06 %. Al cierre de diciembre de 2005, 6 833 individuos vivían con el VIH en la isla y 1 407 habían fallecido.13 A mediados de 2001 la TARVAE se generalizó a toda la población SIDA del país. Durante este período se han observado importantes resultados con fármacos genéricos de producción nacional, inherentes a reducciones significativas en la morbilidad, la mortalidad y las hospitalizaciones. Un estudio previo identificó excelentes respuestas clínica e inmunológica a la TARVAE en enfermos de 2 provincias cubanas.14 El presente trabajo tiene como propósito evaluar el impacto de la TARVAE en la respuesta clínica e inmunovirológica de enfermos SIDA de la provincia de Cienfuegos.
Métodos
Se estudió una cohorte de 34 enfermos SIDA tratados con TARVAE, mediante un diseño descriptivo y longitudinal. Los 34 pacientes se derivaron de la provincia de Cienfuegos y constituyeron 37,7 % del total de seropositivos para el VIH de la provincia y 100 % de los enfermos de SIDA. Los casos fueron sistemáticamente evaluados en consulta médica sanatorial desde el inicio del tratamiento en mayo de 2001 hasta el cierre del estudio el 30 de junio de 2005. También fueron consideradas las hospitalizaciones en el Hospital General Universitario Gustavo Aldereguía Lima y el Instituto de Medicina Tropical Pedro Kourí de Ciudad de La Habana.
Variables: edad, sexo, vía de infección, definición de SIDA, tiempo entre el diagnóstico de la infección por el VIH y el inicio de la terapia (años), síndrome retroviral agudo, complejo relacionado con el SIDA, infecciones oportunistas padecidas antes y después de la terapia, hospitalizaciones antes y después de la terapia, recuento de LTCD4+ (células por mm3) antes y durante el tratamiento, CVP (copias de virus por mL) al año del tratamiento, peso en kilogramo, hemoglobina en g/L, efectos adversos de la TARVAE, supervivencia en meses.
Definiciones operacionales
TARVAE: incluyó al menos 3 fármacos, fundamentalmente 2 inhibidores de la retrotranscriptasa y un inhibidor de las proteasas. A los efectos de este trabajo y como parte de los protocolos cubanos para el tratamiento de la infección por el VIH, los enfermos fueron tratados con: AZT (zidovudina: tabletas de 100 mg) 600 mg/d o d4T (estavudina: tabletas de 40 mg) 80 mg/d, más 3TC (lamivudina: tabletas de 150 mg) 300 mg/d e indinavir (tabletas de 200 mg) 1 800 mg/d. Varios individuos recibieron modificaciones en los esquemas terapéuticos durante el seguimiento.
Tiempo entre el diagnóstico de la infección por el VIH y el desarrollo del síndrome de inmunodeficiencia adquirida (SIDA): dependió del tiempo entre el diagnóstico serológico de la infección y el diagnóstico de SIDA acorde con los criterios de los CDC de 1993 utilizados a los largo de la investigación.15
Síndrome retroviral agudo: se utilizó la definición clínica de Cooper AD y otros.16
Enfermedad sintomática precoz (complejo relacionado con el SIDA, ARC): se incluyeron las entidades clínicas siguientes: adenopatías generalizadas, muguet, leucoplasia vellosa oral, herpes zoster, trombocitopenia, molusco contagioso, herpes simple recidivante, condilomas acuminados, úlceras aftosas.15
Adherencia a la TARVAE: se identificó adherencia cuando no se presentaron inestabilidades, abandono o dosis subóptimas de los fármacos, incluso en presencia de toxicidad farmacológica. De no cumplirse lo anterior se entendió ausencia de adherencia. Restauración inmunológica: se consideró a un recuento de LTCD4+ mayor que 200 células por mm3 realizado por citometría de flujo en cualquiera de las mediciones periódicas establecidas.
La carga viral plasmática (CVP) se determinó por la técnica de amplificación de ácidos nucleicos (NASBA, Biomeriux), con un límite de detección de 50 copias/mL. Se consideró CVP no detectable a todo registro inferior a 50 copias/mL y como criterio de respuesta virológica una CVP menor que 1 000 copias/mL. A los efectos de este trabajo se utilizó la medición realizada al año del tratamiento.
Efectos adversos de la terapia: se registraron los efectos adversos de clase, inherentes a los 3 grupos esenciales de fármacos.17
Análisis estadístico
Los datos se registraron y procesaron utilizando el Statistical Package for Social Sciences (SPSS 9.0, Chicago, IL, USA). Se calculó la frecuencia de las variables categóricas y la prueba no paramétrica de chi cuadrado se utilizó para comparar las proporciones. Se determinó la media aritmética de las mediciones numéricas y se compararon usando los tests de Kruskal Wallis o ANOVA, según correspondió. Mediante el método de Kaplan – Meier se obtuvo la función de supervivencia. El nivel de significación fue a= 0,05.
Resultados
En la tabla 1 se muestran las características generales de los 34 pacientes, el sexo masculino predominó con 67,6 % y la vía de infección fue sexual en 31 enfermos (91,2 %), solo en 3 casos se registró la autoinoculación del virus (8,8 %). Respecto a los criterios por los cuales definieron el SIDA se vio que en 27 individuos (79,4 %) dependió de un recuento de LTCD4+ menor que 200 células; en 5 (14,7 %) del padecimiento de alguna enfemedad indicadora y en 2 casos, ambas condiciones. La media de edad resultó de 32 ± 6 años con una mediana de 30. El tiempo promedio entre el diganóstico serológico de la infección por el VIH y el inicio de la TARVAE fue 4,85 ± 3,87 años.
Tabla 1. Características generales de los pacientes. 34 enfermos de SIDA. Cienfuegos. 2001-2005
| Variable | Categoría | No. | % |
| n= 34 | |||
| Sexo | Masculino | 23 | 67,6 |
| Femenino | 11 | 32,4 | |
| Vía de infección | Sexual | 31 | 91,2 |
| Autoinoculado | 3 | 8,8 | |
| Definición de SIDA | Recuento de LTCD4+ < 200 células | 27 | 79,4 |
| Enfermedades indicadoras de SIDA | 5 | 14,7 | |
| Ambos criterios | 2 | 5,9 | |
| Edad (años) | Media | DE | Mediana |
| 32 | 6,65 | 30 | |
| Tiempo entre el diagnóstico de la infección por el VIH y el inicio de la terapia (años) | Media | DE | Mediana |
| 4,85 | 3.87 | 4,50 |
La situación clínica de los casos previos a iniciar la TARVAE aparece reflejada en la tabla 2. De los enfermos, 44,1 % tuvo manifestacines clínicas de síndrome retroviral agudo durante la primoinfección por el VIH, y 26 casos (76,5 %) habían desarrollado la enfermedad sintomática precoz antes de iniciar la TARVAE. La frecuencia de infecciones oportunistas menores fue de 76,5 % y 32,4 % enfermó antes de la terapia por alguna infección oportunista mayor. La candidiasis oral (73,5 %), el herpes zoster (50,0 %), el herpes simple (45,9 %) y los condilomas acuminados (11,8 %), resultaron las infecciones menores más frecuentes. La neumonía por Pneumocystis jiroveci (14,7 %), la neurotoxoplasmosis (11,8 %), la candidiasis esofágica (8,8 %) y la criptosporidiasis sintomática (14,7 %), resultaron las infecciones oportunistas mayores más registradas (datos no mostrados).
Tabla 2. Situación clínica de los enfermos antes del inicio de la TARVAE. 34 enfermos de SIDA. Cienfuegos. 2001-2005
| Variable | No. | % | |
| n= 34 | |||
| Síndrome retroviral agudo | 15 | 44,1 | |
| Complejo relacionado con el SIDA (ARC) | 26 | 76,5 | |
| Infecciones oportunistas menores | 26 | 76,5 | |
| Infecciones oportunistas mayores | 11 | 32,4 | |
| Hospitalizaciones | 29 | 85,3 | |
| Recuento de LTCD4+ | Media | Mediana | |
| 196 | DE= 134 | 186 | |
Antes de comenzar la TARVAE, 29 individuos habían requerido al menos una hospitalización por enfermedades relacionadas con el SIDA (85,3 %). La media del recuento de LTCD4+ previo a la terapia fue 196 células por mm3 ± 134 y la mediana 186 células por mm3.
En la tabla 3 se muestra una comparación de la frecuencia de las variables clínicas seleccionadas antes y después de iniciada la TARVAE. Así, se puede apreciar la significativa reducción de las infecciones oportunistas menores y mayores luego de la TARVAE hasta 20,6 y 11,8 %, respectivamente; también el porcentaje de individuos que requirieron hospitalización se redujo de 85,3 a 29,4 %. La proporción de enfermos con hemoglobina inferior a 110 g/L pasó de 32,4 a 3,0 %. El peso corporal al año del tratamiento también tuvo redución en el porcentaje de casos con menos de 60 kg de 35,3 hasta 26,5 %.
Tabla 3. Características clínicas de los enfermos antes y después de la TARVAE. 34 enfermos de SIDA. Cienfuegos. 2001-2005
| Variables clínicas | Antes de TARVAE | Después de TARVAE | |
| % | % | ||
| Infecciones oportunistas | Menores* | 76,5 | 20,6 |
| Mayores** | 32,4 | 11,8 | |
| % de enfermos que ha requerido hospitalizaciones* | 85,3 | 29,4 | |
| + % de enfermos con Hb < 110 g/L** | 32,4 | 3,0 | |
| + % de enfermos con peso < 60 kg*** | 35,3 | 26,5 | |
+ Para las variables hemoglobina y peso corporal se consideró la medición al año de tratamiento.
*p< 0,001, ** p< 0,05, *** p> 0,05.
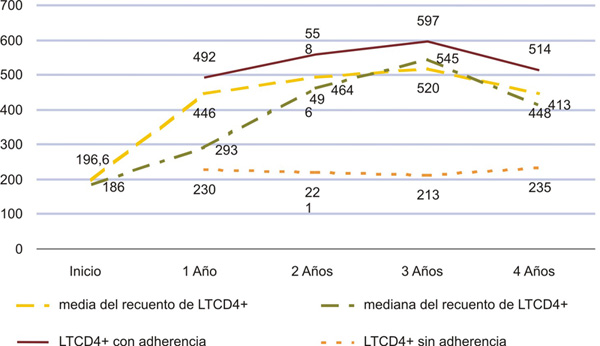
En la figura 1 se señala la evolución del recuento de LTCD4+ durante los años de estudio, es evidente que se partió de un recuento medio inferior a 200 células (186) y se logró una significativa restauración inmunológica de los casos con recuentos medios superiores a las 400 células por mm3. También fue evidente la significativa diferencia de esta variable respecto a la adherencia a la TARVAE, en los enfermos con adherencia el recuento medio de LTCD4+ fue superior a las 400 células en todos los momentos de la medición, mientras que en el resto estuvo alrededor de 200 células.
p< 0,05 para la diferencia entre las medias por años y según la variable adherencia.
Fig. 1. Evaluación del recuento de LTCD4+ antes y durante la TARVAE. Correlación con la adherencia a la terapia. 34 enfermos de SIDA. Cienfuegos. 2001-2005.
En la tabla 4 se correlacionaron las variables clínicas e inmunológicas antes de la TARVAE con la restauración inmunológica de los pacientes al año del tratamiento. Fue significativa la diferencia en el recuento de LTCD4+ respecto al variable complejo relacionado con el SIDA (ARC), en los casos que presentaron esta situación clínica el recuento de LTCD4+ al año de la TARVAE fue significativamente inferior 351/752 células por mm3. Esta observación no ocurrió con el resto de las variables tabuladas. Además, se comparó la media de tiempo entre el diagnóstico de la infección y el comienzo de la terapia, y resultó superior, 6 vs. 4 años en los individuos sin recuperación inmunológica al año (p> 0,05).
Tabla 4. Correlación de las variables clínicas e inmunológicas pre-TARVAE con la restauración inmunológica de los casos al año de la TARVAE. 34 enfermos de SIDA. Cienfuegos. 2001-2005
| Variables (previo a la TARVAE) | Recuento de LTCD4+ al año de la TARVAE | ||||
| Defición de SIDA | Recuento de LTCD4+ | Media | DS | Mediana | p |
| 485 | 444 | 328 | 0,556 | ||
| Enfermedades indicadoras | 289 | 146 | 242 | ||
| Ambos | 308 | 89 | 308 | ||
| ARC | Sí | 351 | 245 | 262 | 0,012 |
| No | 752 | 649 | 577 | ||
| Enfermedades oportunistas mayores | Sí | 552 | 619 | 245 | 0,300 |
| No | 395 | 254 | 328 | ||
| Hospitalizaciones | Sí | 441 | 432 | 267 | 0,879 |
| No | 472 | 227 | 442 | ||
| Recuento de LTCD4+ | < 200 células | 415 | 471 | 251 | 0,601 |
| ≥ 200 células | 490 | 299 | 437 | ||
|
| Estratos de recuento de LTCD4+ al año de la TARVAE | ||||
| < 200 células | ≥ 200 células | ||||
| 6,57* DE= 4,47 | 4,41* DE= 3,66 | ||||
*p= 0,192. ANOVA.
En la tabla 5 se destaca la evaluación de la CVP al año de la TARVAE según variables clínicas e inmunológicas de interés. De los enfermos, 29,4 % tuvo la CVP indetectable al año de tratamiento, sin diferencia entre los tiempos diagnóstico/TARVAE y los estratos de la viremia. El recuento de LTCD4+ en el inicio del tratamiento no se asoció con significativas diferencias en las medias de carga viral plasmática 48 758/ 24 486. De forma semejante sucedió con la adherencia a la TARVAE, la media de la CVP en los casos con adherencia resultó inferior a su contraparte 25 663/ 99 900 (p> 0,05). El recuento de LTCD4+ agrupado al año del tratamiento se relacionó con obstensible reducción de la viremia en aquellos pacientes con restauración inmunológica (200 LTCD4+ o más), respecto al grupo de menos de 200 células (5 729 / 166 181) p< 0,001.
Tabla 5. Evaluación de la carga viral plasmática al año de la TARVAE en relación con la adherencia al tratamiento y el recuento de LTCD4+ antes y después de la terapia. 34 enfermos de SIDA. Cienfuegos. 2001-2005
| Variable | Carga viral plasmática copias/ml al año | ||||
| Media | DE | Mediana | p | ||
| Recuento de LTCD4+ antes de TARVAE | < 200 células | 48 758 | 130 062 | 2900 | 0,545 |
| ≥ 200 células | 24 486 | 85 084 | 370 | ||
| Adherencia a TARVAE | Sí | 25 663 | 107 855 | 470 | 0,146 |
| No | 99 900 | 125 737 | 66 800 | ||
| Recuento de LTCD4+ 1 año de TARVAE | < 200 células | 166 181 | 212 326 | 130 000 | 0,000 |
| ≥ 200 células | 5 729 | 16 127 | 530 | ||
| No y % de enfermos con carga viral no detectable (< 50 copias/mL) | 10 | 29,4% | |||
|
| Estratos de carga viral plasmática copias/mL | ||||
| ≥ 1 000 | < 1 000 | ||||
| 5,00* | 4,69* | ||||
| DE= 3,93 | DE= 3,93 | ||||
* p= 0,818. ANOVA.
En la tabla 6 se puede ver que 71,4 % de los enfermos que no restauraron su inmunidad luego de 1 año de TARVAE, tuvieron una viremia igual o superior a las 1 000 copias/mL; mientras que los porcentajes fueron semejantes (48,1 y 51,9 %) en el grupo con recuentos de LTCD4+ de 200 células o más (p= 0,405). Significativamente 100 % de los casos sin adherencia a la terapia mantuvo una viremia plasmática igual o superior a las 1 000 copias/mL luego de 1 año de TARVAE (p= 0,020).
Tabla 6. Correlación entre el recuento de LTCD4+ y la carga viral plasmática al año de la terapia en relación a la adherencia a la TARVAE. 34 enfermos de SIDA. Cienfuegos. 2001-2005
| Recuento de LTCD4+ al año de TARVAE * | Carga viral (copias/ml) al año de TARVAE | |||
| ≥ 1 000 | <1 000 | |||
| No. | % | No. | % | |
| < 200 células | 5 | 71,4 | 2 | 28,6 |
| ≥ 200 células | 13 | 48,1 | 14 | 51,9 |
| Adherencia a TARVAE ** | 12 | 42,9 | 16 | 57,1 |
| Sí | ||||
| No | 6 | 100,0 | 0 | 0 |
| Total estratos de carga viral copias/mL | 18 | 52,9 | 16 | 47,1 |
* p= 0,405, ** p= 0,020.
En este estudio la adherencia a la TARVAE fue 82,4 % y en semejente porcentaje se reportaron efectos adversos a los fármacos utilizados; en 38,2 % de los enfermos fue necesario cambiar el régimen terapéutico. Los efectos adversos más importantes fueron digestivos: náuseas y vómitos 61,8 %; diarreas 26,5 %, pérdida del apetito 26,5 %. Se observó redistribución de la grasa corporal en 11,8 % y 32,4 % tuvo evidencias humorales de síndrome metabólico, caracterizado básicamente por hipertrigliciridemia (datos no mostrados).
En la figura 2 se muestra la función de supervivencia de Kaplan-Meier durante 4 años de seguimiento. En este período ocurrieron 2 fallecimientos, ambos por enfermedades clínicas relaciondas con el SIDA.
Fig. 2. Curva de supervivencia de Kaplan-Meier al término de 4 años de estudio. 34 enfermos de SIDA de Cienfuegos. 2001-2005.
Discusión
Predominó el sexo masculino acorde con el comportamiento de la epidemia de VIH/SIDA en Cuba y el mundo.14,18 De forma global fueron adultos jóvenes, en relación precisamente con las edades de riesgo de la infección por el virus. Varios estudios cubanos y las series internacionales consultadas coinciden con estas observaciones.14,18
Predominó la vía de infección sexual en la cohorte, acorde con el comportamiento epidemiológico de los países en desarrollo, donde las relaciones heterosexuales y homosexuales/bisexuales son las fundamentales para adquirir la infección; contrariamente, en los países desarrollados de occidente y Europa predominan la adicción a drogas endovenosas y los hombres que tienen sexo con otros hombres.1,19,20
La media del recuento de linfocitos T CD4+ fue inferior a 200 células por mm3, lo que indica una insuficiencia celular avanzada, asociada con el deterioro clínico de los pacientes. Esta observación coincide con la situación en Cuba y en el resto del mundo en la era previa a la generalización de la TARVAE.19,21,22
De forma semejante se comportó la frecuencia de hospitalizaciones antes de la terapia, superior a 85 %; así como la presentación en los enfermos de la enfermedad sintomática precoz, también denominado complejo relacionado con el SIDA, resultantes del progresivo declinar de la inmunidad de los individuos infectados por el VIH secundado por la aparición de enfermedades oportunistas menores como la candidiosis oral, el herpes zoster, herpes simple recidivante, etc. Estas características indican que los enfermos estudiados desarrollaron la historia natural de la infección por el VIH y se presentaron en el estudio como pacientes polimórbidos, con grados variables de compromiso de la inmunidad celular, inherentes a la destrucción millonaria de linfocitos TCD4+ y a la replicación exagerada del virus en el sistema mononuclear-fagocítico.
También, la presentación de las infecciones oportunistas indicadoras SIDA tuvo una frecuencia de 32,4 %, destacándose la neurotoxoplasmosis y la neumonía por P. jiroveci junto a la criptosporidiosis sintomática como las más prevalentes. La literatura clásica documenta que las infecciones oportunistas mayores marcaban el panorama clínico de los pacientes luego de 10 años de evolución de la infección por el VIH, y que su aparición iba acompañada de elevada letalidad y pobre supervivencia.22,23
La adherencia a la TARVAE superó 80 %, esto refleja un elevado porcentaje de sostenibilidad en el tratamiento. Varios informes fuera de la isla han obtenido similares resultados; sin embargo, la mayoría aceptan que la información sobre la adherencia es incompleta y referida por el enfermo, lo que limita su confiabilidad.20 Sin dudas, la mayor relevancia en relación con la adherencia al tratamiento obedeció a la significativa diferencia de la restauración inmunológica entre los enfermos con adherencia y sin esta; en estos últimos el recuento medio de linfocitos T CD4+ osciló sobre 200 células por mm3 en la totalidad de las mediciones, mientras que en los casos con adherencia esta sobrepasó las 500 células, indicador de recuperación inmunológica sostenida. La literatura consultada atribuye a la adherencia terapéutica un papel decisivo en la respuesta al tratamiento y ha encontrado asociación entre esta variable y la posibilidad de enfermar y morir por entidades clínicas dependientes de la severa inmunodepresión.20,24,25 En varias series la adherencia subóptima se ha identificado como una de las explicaciones más importantes para la falta de control de la viremia; esto ha inducido a considerar lo que se ha llamado DAART (terapia antirretroviral directamente administrada), como una estrategia para promover la adherencia, sin embargo, los resultados no han sido del todo alentadores.26
La frecuencia de las infecciones oportunistas posteriores a la terapia constituyó un indicador de respuesta clínica a la TARVAE, resultó sorprendente la disminución en su ocurrencia luego de 4 años de estudio, 20,6 % de los casos desarrolló alguna infección menor y solo 11,8 % presentó alguna oportunista mayor durante el seguimiento. De manera proporcional, se redujo el número de pacientes que necesitaron hospitalización en este período y hubo significativa mejoría en las cifras de hemoglobina y el peso corporal. Inumerables publicaciones revisadas coinciden absolutamente con el análisis presentado, y describen la mejoría clínica de los casos con TARVAE no solo en lo concerniente al desarrollo de dolencias oportunistas y neoplasias, sino a la calidad de vida y la función física y mental de los enfermos.14,27,28 Desde los países de escasos recursos hasta los desarrollados de occidente los beneficios de la TARVAE han sido una realidad irrebatible;2,29 particularmente en los EE. UU. el impacto se ha calculado en 3 000 000 de años de vida salvados desde 1989.29 El éxito de la TARVAE es comparable con el de varias intervenciones para enfermedades crónicas como el cáncer y las complicaciones de las enfermedades de las arterias coronarias.2,30
La recuperación inmunológica de los enfermos fue evidente desde el primer año de tratamiento. Curiosamente, a pesar de que los individuos iniciaron el tratamiento inmersos en grados severos de compromiso inmunológico, aspecto que pudiera ser negativo para la respuesta terapéutica, se evidenció un ascenso sostenido del recuento de las células dianas de la infección por el VIH, el que tampoco se vio limitado por condiciones clínicas adversas como: las infecciones previas, el síndrome retroviral agudo, las hospitalizaciones y el propio estado inmunológico antes de iniciar la TARVAE. Como han destacado otros investigadores, el antecedente de enfermedad sintomática precoz se asoció con menor ascenso en el recuento de LTCD4+ después de la TARVAE.31
La cinética de la restauración inmunológica es un proceso complejo, en el cual interactúan varios factores entre los que se señalan: la replicación viral residual, el tiempo de infección, la alteración de la función tímica, el estado de los linfonodos, la edad, la activación de células T, la apoptosis y, quizás, la coinfección por otros virus.31,32 Recientemente, investigadores foráneos han propuesto la hipótesis de que la inmunodeficiencia avanzada limita la recuperación de los LTCD4+, y que la cinética de estas células antes de iniciar la TARVAE puede predecir esta recuperación.32 Sin embargo, esta tendencia no se observó en la serie presentada, pues la restauración del recuento de LTCD4+ fue sostenida y no dependiente del estado inmunológico al inicio de la terapia. El limitado número de casos, y el período de observación menoscaban la posibilidad de aceveraciones más concluyentes.
Al año del tratamiento 29,4 % de los casos tuvo carga viral indetectable. Se identificaron diferencias porcentuales significativas entre la adherencia a la terapia y la respuesta virológica, porque 100 % de los enfermos sin adherencia no tuvo respuesta; de otra parte la media de la viremia resultó significativamente inferior en los casos con recuento de LTCD4+ igual o superior a 200 células luego de 1 año de TARVAE. La asociación entre restauración inmunológica y respuesta virológica ha sido planteada por otros autores;31 también se ha demostrado que la elevada viremia durante el tratamiento pueden tener impacto negativo sobre la restauración inmunológica.26,32
Los efectos adversos de la medicación antirretroviral están paralelos con sus bondades, y muchas veces resulta la causa del abandono del tratamiento. Más de 80 % de los enfermos presentó toxicidad por los antirretrovirales, que motivó la mayor parte de los cambios de los regímenes terapéuticos. Estos fueron reacciones gastrointestinales transitorias inherentes a los inhibidores de la proteasa viral, particularmente el indinavir. Se encontró escasa frecuencia del resto de las manifestaciones de toxicidad, con excepción de los elementos clínicos y humorales del síndrome metabólico registrados en 32,4 % de los casos, porcentaje superior a lo reportado por Bouza Y y otros en una primera observación.14 Esta complicación atribuible a los inhibidores de las proteasas, cursa con dislipidemia, obesidad centrípeta, hiperglicemia y resistencia a la insulina; y parece ser la resultante de la interacción entre factores genéticos y ambientales que en presencia de estos fármacos, inducen daño del DNA mitocondrial y la estimulación de moléculas pro-apoptóticas que generan alteraciones endoteliales y de la lipogénesis.33
En series internacionales la prevalencia de esta entidad alcanzó entre 25 y 50 % de los enfermos con TARVAE.34,35 Las conclusiones del estudio SMART demostraron que las complicaciones cardiovasculares, renales y hepáticas relacionadas con la TARVAE fueron más frecuentes con la terapia episódica, que con la modalidad continuada basada en la supresión mantenida de la viremia.36
Un elemento importante en este estudio fue la supervivencia, pues ocurrieron 2 fallecimientos en los 4 años. La curva de Kaplan-Meier describe la función de supervivencia y demostró el impacto de la TARVAE en la mortalidad por enfermedades relacionadas con la inmunodeficiencia, aspecto visible en todos los escenarios donde la TARVAE es una práctica habitual.2,29,30 El estudio presentado demostró en el contexto cubano, que la TARVAE con fármacos genéricos ha facilitado un mejor desenlace para los enfermos de SIDA.
Impact of highly active antiretroviral therapy in the clinical, immunological and virological response from AIDS patients
Summary
A longitudinal prospective study was made to evaluate the clinical, immunological and virological response of a cohort of 34 AIDS patients in Cienfuegos provinces, who had been treated with highly active antiretroviral therapy (HAART). Males comprised 67.6% of the total number and average age was 32 years. Sexual infection path was identified in 91.2 % of cases. The CD4+ T counting under 200 cells defined AIDS in 79.4 % of individuals. Twenty six patients suffered minor opportunistic infections (76.5 %) whereas 32.4 % got sick due to some major opportunistic disease prior to the therapy. After this therapy, these frequencies lowered to 20.6 % and 11.8 % respectively. Average CD4+ counting at the starting of HAART was 196 cell/mm3 and exceeded 400 cells in the rest of further countings. From a PVC average of 15 251 copies/ml one year after therapy, this figure reduced to 8 048 copies at 2 years. Only 10 cases required hospitalization after a HAART (29.4%). Treatment adherence reached over 80% and was correlated to immunological restoration. Survival after one year was 100 % and only 2 patients died in the following 4 years. The positive impact of HAART on the frequency of opportunistic infections, immunological restoration and survival was proved.
Key words: HIV-1 infection, acquired immunodeficiency syndrome, highly active antiretroviral therapy, morbidity, survival.
Referencias bibliográficas
1. UNAIDS/WHO. Report on the global HIV/AIDS epidemic 2006. Accesible en http:// www.unaids.org/en/HIV_data/2006Global Report/default.asp
2. Walensky RP, Paltiel AD, Losina E, Mercincavage LM, Schackman BR, Sax PE, et al. The survival benefits of AIDS treatment in the
3. The global HIV and AIDS epidemic, 2001. MMWR 2001;50(21):434-9.
4. Bentwich Z, Maartens G, Torten D, Lal AA, Lal RB. Concurrent infections and HIV pathogenesis. AIDS 2000;14:2071-81.
5. Morgan D, Mahe C, Mayanja B, Okongo JM, Lubega R, Whitworth JA. HIV-1 infection in rural Africa: is there a difference in median time to AIDS and survival compared with that in industrialized countries? AIDS 2002;16(4):597-603.
6. Wolfe PR. Practical approaaches to HIV therapy: Recommendation for the year 2000. Postgrad Med 2000;107(4):127-38.
7. Montaner JSG, Mellors JW. Antiretroviral therapy for previously treated patients (editorial). N Engl J Med 2001;345(6):452.
8. Sax PE. Opportunistic infections in HIV disease: down but not out. Infect Dis Clin North Am 2001;15(2):433-55.
9. Powles T, Imami L, Nelson M, Gazzard BG, Bower M. Effects of combination chemotherapy anh highly active antiretroviral therapy on immune parameters in HIV-1 associated lymphoma. AIDS 2002;16(4):531-6.
10. Valdez H, Chowdhry TK, Asaad R, Woolley IJ, Davis T, Davidson R, et al. Changing spectrum of mortality due to human immunodeficiency virus: analysis of 260 deaths during 1995-1999. Clin Infect Dis 2001;32:101-8.
11. Huang L, Quartin A, Jones D, Havlir DV. Intensive care of patients with HIV infection. N Engl J Med 2006;355:173-81.
12. Stephenson J. 20 years after AIDS emerges, HIVs complexitis still loom large. JAMA 2001;285:1279-81.
13. MINSAP. Cuadro Epidemiológico Nacional. Cuba: Dirección Nacional de Estadísticas; 2005.
14. Bouza JY, Reyes CA, Pentón L, León SC, Bouza JY. Evaluación de la respuesta clínica e inmunológica a la TARGA en enfermos SIDA de dos provincias cubanas. Rev Cubana Med Trop 2006;58(1):73-84.
15. Center for Disease Control. 1993. Revised classification system for HIV infection and expanded case definition for AIDS among adolescents and adults. MMWR 1992;(RR-17):1-19.
16. Cooper DA, Maclean P, Finlayson R. Acute AIDS retrovirus infection. Definition of a clinical illness associated with seroconversion. Lancet 1985;1:537-40.
17. Guidelines for the use of antiretroviral agents in HIV- infected adults and adolescents. Panel on clinical practices for the treatment of HIV infections. DHHS and HJ Kaiser Fundations; 2000.
18. Scaling up antiretroviral therapy in resource-limited settings: guidelines for a public health approach. Geneva: World Health Organization; 2002.
19. Del Rio C, Sepúlveda J. AIDS in México: lessons learned and implications for developing countries. AIDS 2002;16:1445-57.
20. Jain MK, Skiest DJ, Cloud JW, Jain CL, Burns D. Changes in mortality related to Human Immunodeficiency Virus infection: comparative analysis of inpatients deaths in 1995 and in 1999-2000. Clin Infect Dis 2003;36:1030-8.
21. Reyes Corcho A, Díaz Jidy M, Pérez Rodríguez A, Bouza Jiménez Y, Bouza Jiménez Y. Factores asociados con la presencia de tuberculosis en pacientes con el síndrome de inmunodeficiencia adquirida en Cuba. Rev Panam Salud Pública 2004;15(5):341-7.
22. Petruckevitch A, Del Amo J, Phillips AN, Johnson AM, Stephenson J, Desmond N, et al. Disease progression and survival following specific AIDS-defining conditions: a retrospective cohort study of 2048 HIV-infected persons in London. AIDS 1998;12:1007-13.
23. Masliah E, de Teresa RM, Mallory ME, Hansen LA. Changes in pathological findings at autopsy in AIDS cases for the last 15 years. AIDS 2000;14(1):69-74.
24. The Avanti Study Group. AVANTI 2: randomized, double-blind trial to evaluated the efficacy and safety of zidovudine plus lamivudine versus zidovudine plus lamividine plus indinavir in HIV- infected antiretroviral - naive patients. AIDS 2000;14:367-74.
25. Wood E, Hogg RS, Yip B, Moore D, Harrigan PR, Montaner JSG. Impact of baseline viral load and adherence on survival of HIV-infected adults with baseline CD4 cell counts ≥ 200 cells/µl. AIDS 2006;20:1117-23.
26. Wohl AR, Garland WH,
27. Nieuwkerk PT, Gisolf EH, Reijers MHE, Lange JMA, Danner SA. Long- term quality of life outcomes in three antiretroviral treatment strategies for HIV-1 infection. AIDS 2001;15:1985-91.
28. Báez-Feliciano D, Thomas JC, Gómez MA, Miranda S, Fernández DM, Velázquez M, et al. Changes in the AIDS epidemiologic situation in Puerto Rico following health care reform and the introduction of HAART. Pan Am J Public Health 2005;17(2):92-101.
29. Vermund SH. Millions of life-years saved with potent antiretroviral drugs in the
30. Kim JY, Farmer P. AIDS in 2006: moving toward One World, One Hope? N Engl J Med 2006;355(7):645-7.
31. Kaufmann GR, Furrer H, Ledergerber B, Perrin L, Opravil M. Characteristics, determinans, and clinical relevance of CD4 T cell recovery to < 500 cells/ul in HIV type 1- infected individuals receiving potent antiretroviral therapy. Clin Infect Dis 2005;41:361-72.
32. Sasson SC, Kelleher AD, Cooper DA. The modern ART of HIV infection management: towards a tailored approach to maximize CD4 T cell reconstitution. Clin Infect Dis 2005;41:373-5.
33. Savés M, Raffi F, Capeau Y, Rozenbaum W, Ragnaud JM. Factors related to lipodystrophy and metabolic alterations in patients with Human Immunodeficiency Virus infection receiving higly activa antiretroviral therapy. Clin Infect Dis 2002;34:1396-404.
34. Miller JE, Emery S, French M, Baker D, Cooper DA. The Australian Prevalence Survey of Lipodystrophy. San Francisco:Seventh Conference on Retroviruses and Opportunistic Infections; 2000.
35. Saint-Marc T, Partisani M, Poizot-Martin I. Fat distribution evaluated by computed tomography and metabolic abnormalities in patients undergoing antiretroviral therapy: preliminary results of the LIPOCO study. AIDS 2000;14:37-49.
36. Clinical Alert: international HIV/AIDS trial finds continuous antiretroviral therapy superior to episodic therapy. Bethesta: National Institute of Allergy and Infectious Diseases (NIAID), National Institute of Health 2006. Visitado: January 18, 2006. Accessible en http://www.niaid.nih.gov/default.htm
Recibido: 16 de noviembre de 2006. Aprobado: 31 de enero de 2007.
Dr. Andrés Reyes Corcho. Calle Lombart no. 9 entre Vila y Cienfuegos, Cumanayagua, Cienfuegos, Cuba. Correo electrónico: rcorcho@ucf.edu.cu; anitasrb2000@yahoo.es
1 Doctor en Medicina. Máster en Ciencias. Especialista de II Grado en Medicina Interna. Hospital General Universitario Gustavo Aldereguía Lima. Cienfuegos, Cuba.
2 Especialista de I Grado en Medicina Interna. Hospital Municipal Aguada de Pasajeros, Cienfuegos.
3 Especialista de I Grado en Medicina Interna. Hospital General Universitario Gustavo Aldereguía Lima. Cienfuegos, Cuba.
4 Doctor en Medicina. Máster en Ciencias. Especialista de segundo grado en Farmacología. Hospital. Instituto de Medicina Tropical Pedro Kourí. La Habana, Cuba.
5 Especialista de I Grado en Medicina General Integral. Sanatorio de SIDA, Cienfuegos.
6 Especialista de I Grado en Medicina Interna. Hospital General Universitario Gustavo Aldereguía Lima. Cienfuegos, Cuba.
7 Especialista de I Grado en Medicina Interna. Hospital Municipal Aguada de Pasajeros, Cienfuegos.
8 Especialista de I Grado en Medicina General Integral y Pediatría. Hospital General Universitario Gustavo Aldereguía Lima. Cienfuegos, Cuba.