Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.61 n.2 Ciudad de la Habana Mayo-ago. 2009
ARTÍCULO ORIGINAL
Validación del método de titulación del virus de la inmunodeficiencia humana tipo 1
Validation of the titration method for the human immunodeficiency virus type 1
Giselle Álvarez SeguíI; Marta Dubed EchevarríaII; Enrique Noa RomeroIII; Leonor M. Navea LeyvaIV; María T. Pérez GuevaraV; Antonio RodríguezVI
I Máster en Ciencias. Licenciada en Biología. Investigadora Agregada. Laboratorio de Investigaciones del SIDA (LISIDA). Ciudad de La Habana, Cuba.
II Máster en Ciencias. Licenciada en Biología. Investigadora Auxiliar. LISIDA. Ciudad de La Habana, Cuba.
III Máster en Ciencias. Licenciado en Biología. Investigador Auxiliar. LISIDA. Ciudad de La Habana, Cuba.
IV Doctora en Ciencias Médicas. Máster en Ciencias. Especialista de II Grado en Microbiología. LISIDA. Ciudad de La Habana, Cuba.
V Máster en Ciencias. Licenciada en Bioquímica. Investigadora Auxiliar. LISIDA. Ciudad de La Habana, Cuba.
VI Máster en Ciencias. Licenciado en Biología. Instructor. Facultad de Biología. Universidad de La Habana. Ciudad de La Habana, Cuba.
RESUMEN
INTRODUCCIÓN: en la validación de los procesos de producción de productos biológicos, la cuantificación viral es esencial para demostrar su seguridad.
OBJETIVO: en este trabajo se evaluó el método de titulación del virus de la inmunodeficiencia humana tipo 1, para ello se determinó la exactitud, precisión, linealidad y límite de detección.
MÉTODOS: la titulación se realizó por el método del cálculo de la dilución punto final, mediante la visualización del efecto citopático y la determinación de la producción de antígeno p24 por medio de un ensayo inmunoenzimático, la dosis infectiva media en cultivo de células por mililitro se calculó según el método de Reed y Muench.
RESULTADOS: la exactitud del método coincidió con el título de referencia, los valores del coeficiente de variación de la precisión (repetibilidad y precisión intermedia) fueron menores que 5 y 10 %, respectivamente; la linealidad mostró un adecuado coeficiente de correlación y el límite de detección se determinó en la dilución 10-12.
CONCLUSIONES: el método evaluado demostró un adecuado desempeño para la cuantificación viral.
Palabras clave: titulación viral, validación, virus de la inmunodeficiencia humana tipo 1.
ABSTRACT
BACKGROUND: viral quantification is essential to demonstrate biological product safety during the validation of the production process.
OBJECTIVE: to evaluate the accuracy, linearity and detection limit of a titration method for the human immunodeficiency virus type 1.
METHODS: the titration was performed by calculating the end-point dilution method, through the cytopathic effect assay and the determination of Ag p24 production by an enzyme immunoassay. Mean infective dose in cultured cells per milimeter was estimated by Reed and Muench´s method.
RESULTS: the accuracy of the method was similar to that of the reference titration, the variation coefficient figures for accuracy (repeatability and intermediate accuracy) were lower than 5 % and 10 %, respectively, the linearity showed adequate correlation coefficient and the detection limit was determined in the 10-12 dilution
CONCLUSIONS: the evaluated method was suitable for viral quantification
Key words: viral titration, validation, human immunodeficiency virus type 1.
INTRODUCCIÓN
En los estudios de validación de los procesos de producción de productos biológicos que emplean materia prima de origen humano, los retrovirus son contaminantes potenciales y, por esta razón, es necesario realizar estudios de validación que demuestren que el proceso de producción es capaz de eliminarlos e inactivarlos. El virus de la inmunodeficiencia humana tipo 1 (VIH-1) es considerado como un contaminante relevante y se emplea como modelo para otros retrovirus humanos.1,2
Los dos principales métodos de ensayos usados en la cuantificación de virus infecciosos en estudios de clarificación viral, son el ensayo de formación de placas y el método del cálculo de la dilución punto final o cálculo de la dosis infectiva de 50 % en cultivo de células (DICC50), mediante la visualización del efecto citopático (ECP); este último es utilizado en estudios de validación de procesos de productos biológicos.3 Ambos tipos de ensayos se han empleado para la determinación cuantitativa de la titulación viral y los factores de reducción de los procesos,1 aunque están disponibles nuevos ensayos para determinar títulos virales en los procesos de validación por cuantificación de componentes de los virus, como son los ácidos nucleicos genómicos o enzimas como la trascriptasa reversa, que resultan más fácilmente medibles que la infectividad.4
La variación en los ensayos de titulación viral se debe a diferencias en los sustratos celulares, entre modelos virales, suplementos proteicos adicionados a los cultivos de células y a diferencias entre operadores y entre ensayos,1 aun cuando en el laboratorio se seleccione el método más adecuado para un ensayo, se necesita de una evidencia documentada para confirmar que se han cumplido los requisitos para una aplicación especifica, por lo tanto es necesario la evaluación de sus parámetros analíticos críticos como son: exactitud, precisión (repetibilidad, precisión intermedia), linealidad y límite de detección (LOD).5
En este trabajo se evaluó el método de titulación viral para el VIH-1 teniendo en cuenta los parámetros antes mencionados, los cuales permiten asegurar que el método es capaz de lograr resultados confiables en la cuantificación viral.
MÉTODOS
Condiciones experimentales
Cepa viral: BRU (VIH-1). Donada gentilmente por Centralised facility for AIDS Reagents (CFAR).
Referencia: ADP104
Título referencia: 6.413 DICC50/mL (log del título)
Sustrato celular: CEM (500 x 103 células/mL). Donada gentilmente por CFAR.
Referencia: ARP005.
Medio de cultivo: RPMI 1640 suplementado con 10 % de suero fetal bovino (Terracell), 2 mM de L-glutamina (Flow Laboratories) y 40 µg/mL de gentamicina (Sigma).
Método de titulación (procedimiento)
La titulación del inóculo viral se realizó mediante diluciones seriadas de base cuatro (4-1 a 4-16) de la cepa viral (6 réplicas) en placas de 96 pozos,6,7 posteriormente, se añadió el sustrato celular y las placas se incubaron a 37 ºC en atmósfera húmeda con 5 % de CO2. En cada título se incluyó un control celular sin virus. El título viral se determinó por ECP y por cálculo de Ag p24 en el sobrenadante del cultivo libre de células, mediante el sistema inmunoenzimático DAVIH Ag p24 (DAVIHLAB, Cuba). El cálculo de la dosis infecciosa media en cultivo de células por mililitro (DICC50/mL), en ambos casos se determinó por el método de Reed y Muench.8
Parámetros evaluados
Exactitud: se compararon los resultados obtenidos de 5 títulos en 3 tiempos de incubación independientes: 4, 7 y 11 d, con el valor de referencia conocido. Estos experimentos se realizaron por una misma persona en iguales condiciones de trabajo (N= 15).
Análisis de la precisión
Repetibilidad: se calcularon los valores de desviación estándar relativa (% RSD) o coeficiente de variación (CV), de 5 títulos realizados por una misma persona, en 3 ensayos diferentes para los 3 períodos de incubación antes mencionados.
Precisión intermedia: se realizó una validación retrospectiva para verificar que el ensayo es capaz de producir resultados similares en períodos largos de tiempo (1 año). Se tuvo en cuenta la variabilidad, interdía, interoperador (2 operadores) (N= 9) y entre los datos de lectura de ECP y el ELISA (N= 18). Se calcularon los valores de CV a partir de 3 títulos de la preparación viral realizados por cada operador.
Linealidad: se evaluó por un análisis de regresión lineal donde se utilizaron los datos obtenidos a partir de la lectura del ECP y los resultados del ELISA de 10 títulos (10 determinaciones por dilución).
Límite de detección (LOD): se determinó por evaluación visual del ECP y datos obtenidos del ELISA de 10 títulos (10 determinaciones por dilución).
Análisis estadístico: se realizó una prueba t de Student, un análisis de varianza de clasificación simple y una prueba de Student- Newman-Keuls para el análisis de exactitud, precisión (repetibilidad y precisión intermedia o interensayo). Para el cálculo de los CV se tuvieron en cuenta las medias y desviaciones estándar de los datos obtenidos. Para la linealidad se aplicó una prueba de normalidad y una correlación de Pearson. Todos los datos se procesaron con un intervalo de confianza de 95 % utilizando el programa Statistica versión 6.0.
RESULTADOS
Exactitud
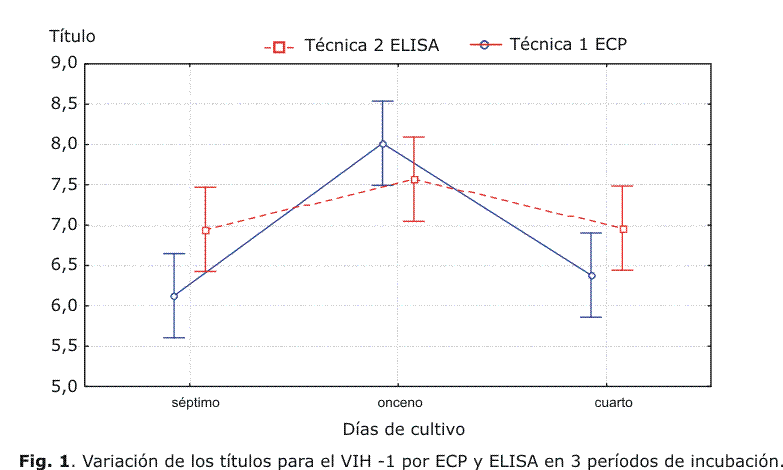
El valor promedio del log del título para el ECP fue de 6,38 ± 0,6 para cuarto día de incubación, 6,13 ± 0,35 para el séptimo y 8,02 ± 1,03 para el onceno día, mientras que por el ELISA fue de 6,96 ± 0,26 para el cuarto día, 6,95 ± 0,33 para el séptimo y 7,57 ± 0,45 para el onceno día de incubación, por lo que se diferenciaron en ± 0,5 log del título respecto a la preparación viral inicial en los dos primeros períodos de incubación en ambas técnicas.
En la figura 1 se muestran los resultados del análisis estadístico para la exactitud, el cual demostró que no hubo diferencias significativas entre el cuarto y séptimo día de incubación, pero sí entre estos y el onceno día, con una p< 0,4473, tanto en el análisis del ECP como en los resultados del ELISA.
Repetibilidad y precisión intermedia o interensayo
Los CV en 3 períodos de incubación para mostrar el comportamiento de la repetibilidad se muestran en la tabla 1, donde fueron menores que 10 % al cuarto y séptimo día de incubación, pero mayor al onceno día, al analizar el ECP, sin embargo, fueron adecuados para el ELISA. Los resultados de la precisión intermedia o interensayo se muestran en la tabla 2, donde los CV obtenidos son óptimos porque se comportaron inferiores a 10 %. El análisis estadístico de la precisión intermedia no mostró diferencias entre operadores ni entre días, con p= 0,978, pero al comparar los datos de los resultados de la lectura por ECP y ELISA hubo diferencias significativas entre las técnicas con p= 0,034.
Linealidad
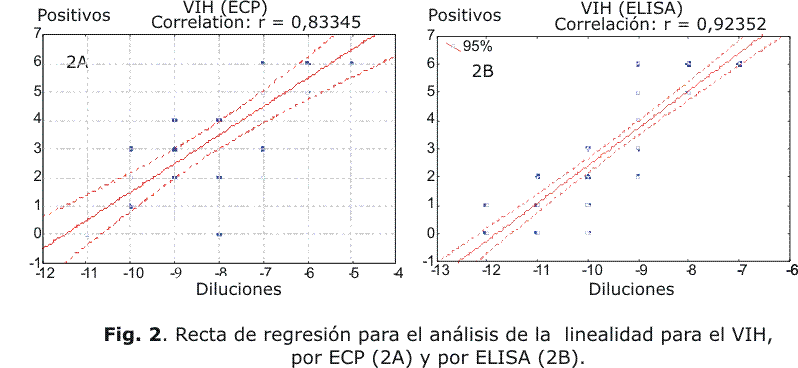
La recta de regresión para mostrar los resultados de la linealidad se muestra en la figura 2 tanto para el ECP (2A) como el ELISA (2B), con valores del coeficiente de correlación (r) de 0,833 y 0,923, respectivamente.
Límite de detección
El límite de detección (LOD) fue determinado por evaluación visual,9 y la mayor dilución después de la cual una identificación de respuesta positiva no fue confiable resultó 10-12. El LOD se puede observar también, si se analiza la recta de regresión obtenida para el estudio de la linealidad con los datos obtenidos en el ELISA, donde las concentraciones más bajas del analito pueden ser determinadas por extrapolación de la recta a 0.5
DISCUSIÓN
En la exactitud los títulos alcanzaron un valor máximo en el último período de incubación y se diferenciaron en ± 0,5 log del título respecto a la preparación inicial en los 2 primeros períodos de incubación; los datos obtenidos al cuarto y séptimo día tanto por ECP como por ELISA resultaron los de mayor concordancia con el valor del título inicial de la cepa viral y este parámetro es esencial para medir la exactitud.1
El método de ANOVA que se empleó para la comparación de los períodos de incubación que muestra la figura 1, demostró que no existen diferencias significativas entre el cuarto y séptimo día de incubación, pero fueron significativas con p< 0,04473 para el onceno día de incubación, al comparar los resultados por ECP como por el ELISA.
Esta diferencia debe estar influenciada por el período de incubación prolongado que provoca un sobrecrecimiento del sustrato celular, lo que implica una mayor infectividad de estas. Por otra parte, el ensayo que se evalúa posee las dificultades inherentes a todos los métodos para la cuantificación del VIH-1, dadas por lo laborioso de la técnica y se reporta que los títulos pueden variar en ± un log a pesar de proceder de una misma preparación viral.7
Para el análisis de la precisión, en la tabla 1 se muestran los resultados de la repetibilidad calculados a partir del ECP, donde los CV fueron menores que 10 % al cuarto y séptimo día de incubación, pero mayor al onceno día. Esto debe estar dado por varios factores como son la sobre estimación de la lectura del efecto citopático, tropismo celular o evaporación del medio de cultivo en las placas al incubarlas por largos períodos de tiempo;7 no obstante, al aplicar la técnica ELISA, los valores de CV fueron adecuados, inferiores a 10 % en el onceno día y óptimos para el cuarto y séptimo día con valores menores que 5 %, como establece la norma cubana para la validación de métodos de ensayo.5
Los resultados de la precisión intermedia o interensayo se muestran en la tabla 2, donde los valores obtenidos de los CV fueron menores que 20 % y no exceden de 10 %, por lo que se consideran óptimos porque se comportan inferiores a 10 %.5 Por otra parte, el análisis estadístico de la precisión intermedia no mostró diferencias entre operadores, ni entre días con p= 0,978 (N= 9), lo que demuestra la habilidad del ensayo de producir resultados similares en largos períodos de tiempo e incluir variaciones (interoperador e interdías), así como que la reproducibilidad del método aumenta gradualmente con una práctica consistente,7 sin embargo, al comparar los datos de los resultados de la lectura por ECP y ELISA hubo diferencias significativas entre las técnicas con p= 0,034 (N= 18). Esta diferencia se debe a que la lectura del ECP es un método cualitativo, basado en la evaluación visual;7 mientras que el inmunoensayo enzimático basado en la detección y captura de antígeno p24 del VIH, es mucho más sensible y específico para la detección de la replicación viral en sobrenadantes de cultivo.10
La linealidad es la capacidad de un ensayo para obtener resultados directamente proporcionales a la concentración del analito en una muestra. Se prefiere hablar de comportamiento lineal porque para ensayos biológicos, a diferencia de los químicos, se emplean métodos para linealizarla, como por ejemplo un análisis de regresión.9,11
Los resultados de la regresión para analizar la linealidad mostraron valores altos y significativos del coeficiente de correlación (r), por ambos métodos (ECP y ELISA) con valores de 0,833 y 0,923, respectivamente. Esto implica altos valores del coeficiente de determinación, por encima de 0,60 y cercano a 1, que demuestra la calidad del ajuste en los análisis de regresión,12 por lo tanto, el modelo puede ser empleado de forma efectiva en la determinación del título de las preparaciones virales.
El límite de detección en determinaciones cualitativas es la concentración umbral por debajo de la cual una identificación positiva (respuesta) no es confiable,5 y puede ser determinado en este tipo de ensayo por evaluación visual.9 La mayor dilución en la cual después de esta una identificación no resultó confiable fue en 10-12. En el estudio de la linealidad con los datos obtenidos en el ELISA, las concentraciones más bajas del analito o LOD también pueden ser determinadas por extrapolación de la recta a 0.5
Los parámetros utilizados, así como el análisis estadístico realizado para evaluar el método de titulación por ambas vías, demostraron una adecuada precisión de este en la cuantificación viral, por lo que en los estudios de evaluación de eliminación del VIH-1 ofrece una estimación real de los factores de reducción en los procesos de producción de productos biológicos, donde la efectividad en la remoción de este retrovirus como contaminación potencial debe ser demostrada; también representa el primer resultado en Cuba sobre esta temática.
AGRADECIMIENTOS
Al profesor L. Montaigner, doctor G. Farrar y al NIBS Centralised Facility for AIDS Reagents supported by EU Programmed EVA and the UK Medical Research Council por la donación de los reactivos que facilitaron la realización de este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Darling AJ. Validation of biopharmaceutical purification processes for virus clearance evaluation. Mol Biotechnol. 2002;21:57-83.
2. Ruibal I, Noa E, Ramírez A, Hernñandez A, Paez R, Valdez R, et al. El VIH como modelo en la validación viral de productos biológicos. Rev Latinoam Microbiol. 2002;44(4).
3. Aleman MR, Noa E, Tamayo A, Dubed M, Padilla S, Álvarez G, et al. A revalidation study of viral clearance in the purification of monoclonal antibody CB.Hep-1. Biopharm Int. 2007;20(1):46-55.
4. Brorson K. Process scale bioseparations for the biopharmaceutical industry. CRC Press. 2007;449-62.
5. NC-TS-368:2004. Guía para la validación de métodos de ensayo químico para alimento. Anexo A, A-1. La HAbana: Oficina Nacional de Normalización;2004.
6. Dulbecco R. Endpoint Method-Measurement of the infections titer of viral sample, chapter The Nature of Viruses. In; Virology. 2nd ed. Philadelphia: J.P. Lippincott; 1988. p. 22-5.
7. Johnson VA, Brington RE. Infectivity assay (virus yield assay). In: Aldovani A, Walker BD, editores. Techniques in HIV research. New York: Stockton Press; 1990. p. 71-6.
8. Reed LJ, Muench H. A simple method of estimating fifty percent end point. Am J Hyg. 1938;27:493-7.
9. Martinez L, García L, Pérez N, Chang A. Determinación de trazas de lidocaína y epinefrina en el proceso de limpieza posterior a la fabricación de carpules. Rev Cubana Farm. 2001;35(2):100-3.
10. Rayfield MA. HIV culture: AIDS TESTING. 2nd ed. New York: Springer-Verlag; 1994. p. 129.
11. Álvarez G, Dubed M, Noa E, Navea L, Pérez MT, González A, et al. Evaluación de la utilidad del método de titulación viral empleado para validar procesos de producción de biológicos. Misc.-47. ISBN 959-283-31-8 [CD-ROM]. La Habana: Biotecnología Habana; 2006.
12. Ochoa R, Martínez JC, Ferrio lX, Margarita A, Estrada E, Blanco R, et al. Sensibilización de placas para ensayos inmunoenzimáticos con antígenos vacunales. VacciMonitor. 2001;10(4):14-7.
Recibido: 17 de octubre de 2008.
Aprobado: 19 de enero de 2009.
Lic. Giselle Álvarez Seguí. Carretera de Tapaste y Autopista Nacional. CP 32 700. San José de las Lajas. La Habana, Cuba. Correo electrónico: cicdc@infomed.sld.cu; lisida@infomed.sld.cu














